Механизмы парасимпатических влияний на сердце в развитии противоишемического эффекта дистантного кондиционирования миокарда
Автор: Мрочек Александр Геннадьевич, Булгак Александр Григорьевич, Басалай Марина Васильевна, Барсукевич Вероника Чеславовна, Гурин Андрей Валерьевич
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2014 года.
Бесплатный доступ
Цель исследования: изучить вовлечение отдельных парасимпатических и симпатических бета-адренергических механизмoв в развитие противоишемического эффекта дистантного ишемического кондиционирования. Материал и методы. Эксперименты проводились на белых нелинейных крысах-самцах. Дистантное ишемическое кондиционирование представляло собой 15-минутную окклюзию обеих бедренных артерий, осуществляемую до начала ишемии миокарда (ДИПК), на 10-й минуте ишемии (ДИПерК) или на 10-й минуте реперфузии (ДИПостК10'). Для изучения роли блуждающих нервов в развитии дистантного ишемического кондиционирования окклюзия бедренных артерий выполнялась в условиях двухсторонней ваготомии (Ваготомия+ДИПК, Ваготомия+ДИПерК, Ваготомия+ДИПостК10'). С целью блокады М-холинорецепторов животным вводился атропин (группы Атропин+ДИПК и Атропин+ДИПостК10'). Блокада бета-адренорецепторов осуществлялась введением метопролола или атенолола на 1-й минуте реперфузии животным с интактными блуждающими нервами (группы МетR+ДИПостК10' и АтенR+ДИПостК10') или в условиях двухсторонней ваготомии (группы Ваготомия+МетR+ДИПостК10' и Ваготомия+АтенR+ДИПостК10'). Результаты. ДИПК, ДИПерК и ДИПостК10' ограничивали зону некроза на 56%, 58% и 49%, соответственно, (p0,05 в сравнении с контрольной группой, p
Дистантное ишемическое кондиционирование миокарда, парасимпатическая иннервация сердца, ишемия и реперфузия миокарда
Короткий адрес: https://sciup.org/14342754
IDR: 14342754
Текст научной статьи Механизмы парасимпатических влияний на сердце в развитии противоишемического эффекта дистантного кондиционирования миокарда
K настоящему времени накоплено большое количество данных, подчеркивающих важную роль парасимпатической иннервации сердца в механизмах защиты миокарда от повреждения, вызванного его ишемией и реперфузией [1, 2, 3, 4, 5]. Известно также, что парасимпатическая иннервация сердца (блуждающие нервы) принимает непосредственное участие в развитии противоишемического эффекта дистантного ишемического прекондиционирования миокарда [6, 7, 8, 9]. Вместе с тем, результаты ранее проведенного нами исследования свидетельствуют о том, что двухсторонняя ваготомия, выполненная до начала 30-минутной ишемии миокарда, не предупреждает противоишемический эффект дистантного ишемического посткондиционирования на 10-й минуте реперфузии [7]. При этом роль парасимпатической иннервации сердца в механизмах дистантного ишемического перкондиционирова-ния – кратковременной дистантной ишемии, осуществляемой во время продолжающейся острой коронарной окклюзии, – до настоящего времени не изучалась.
В свете возрастающего в последние годы интереса к проведению исследований, направленных на изучение эффективности дистантного кондиционирования в клинической практике [10, 11], а также развития новой многообещающей методики кардиопротекции – стимуляции блуждающих не- рвов [5], – нам представляется важным выяснить значимость блуждающих нервов в ограничении зоны некроза миокарда путем дистантного ишемического перкондиционирования, а также изучить отдельные механизмы участия парасимпатической иннервации в развитии кардиопротекторного эффекта кратковременной ишемии анатомически удаленного от сердца органа.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование было выполнено на 119 белых нелинейных крысах-самцах массой 200-250 гр. Для анестезии использовался этаминал натрия в дозе 50 мг/кг внутрибрюшинно с последующей внутривенной инфузией поддерживающей дозы 10 мг/кг/час. Животных переводили на искусственное дыхание атмосферным воздухом через трахеостому при помощи аппарата ИВЛ. При этом дыхательный объем поддерживался на уровне 8-10 мл/кг массы, частота дыхания – 5660 в минуту. Температура тела измерялась в прямой кишке и поддерживалась на уровне 37,0±0,5°C. В ходе экспериментов осуществлялась непрерывная регистрация артериального давления (АД) в правой общей сонной артерии, а также ЭКГ во II стандартном отведении. Животные контрольной группы (n=8) подвергались только 30-минутной ишемии и 120-минутной реперфузии миокарда. Дистантное ишемическое пре-
Рисунок 1. Влияние двухсторонней ваготомии на выраженность противоишемического эффекта дистантного ишемического пре- (ДИПК), пер- (ДИПерК) и посткондиционирования миокарда на 10-й минуте реперфузии (ДИПостК10')
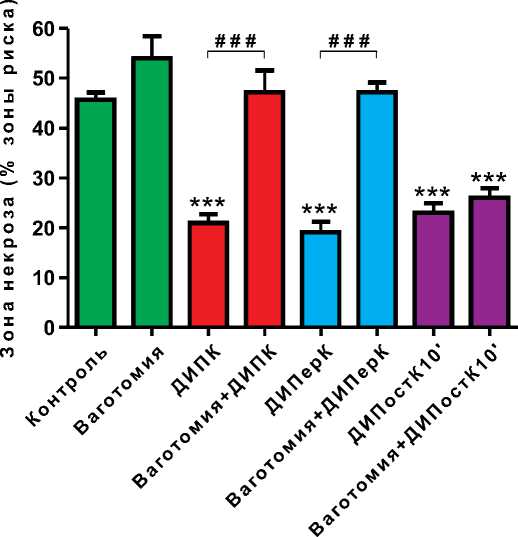
Примечание: *** – p<0,001 – различия между контрольной и опытными группами достоверны; # # # – p<0,001 – различия между опытными группами достоверны.
(ДИПК, n=8), пер- (ДИПерК, n=8) и посткондиционирование (ДИПостК10', n=8) представляло собой 15-минутную окклюзию обеих бедренных артерий, осуществляемую до начала ишемии миокарда, на 10-й минуте ишемии или на 10-й минуте реперфузии.
В первой серии экспериментов животные опытных групп подвергались двухсторонней ваготомии, осуществляемой за 15 минут до начала ишемии миокарда (Ваготомия, n=8); ДИПК (n=8), ДИПерК (n=8), ДИПостК10' (n=8) в условиях интактной парасимпатической иннервации; ДИПК, ДИПерК, ДИПостК10' в условиях двухсторонней ваготомии, выполненной до начала ДИПК или до начала коронарной окклюзии (группы Ваготомия+ДИПК, n=8; Ваготомия+ДИПерК, n=7; Ваготомия+ДИПостК10', n=8).
Во второй серии экспериментов животные опытных групп подвергались ДИПК, ДИПостК10' или этим же воздействиям, но выполняемым на фоне внутривенного введения атропина в дозе 1 мг/кг болюсно с последующим введением поддерживающей дозы 1 мг/кг/час (группы Атропин+ДИПК, n=10, и Атропин+ДИПостК10', n=6).
В третьей серии экспериментов крысы опытных групп подвергались только воздействию ДИПостК10'; ДИПостК10' в условиях двухсторонней ваготомии, выполненной до начала ишемии миокарда (Ваготомия+ДИПостК10'); ДИПостК10' на фоне внутривенного введения метопролола или атенолола (группы МетR+ДИПостК10', n=10, и АтенR+ДИПостК10', n=10); ДИПостК10' в условиях двухсторонней ваготомии и на фоне внутривенного введения метопролола или атенолола (группы Ваготомия+МетR+ДИПостК10', n=10, и Ваготомия+АтенR+ДИПостК10', n=10).
Показатели гемодинамики – среднее АД (АД ср.) и часто- та сердечных сокращений (ЧСС) – выражались в мм рт. ст. и ударах в минуту, соответственно, и оценивались в начале 30-минутной окклюзии ПНКА, в начале реперфузии, а также на 60-й и 120-й минутах реперфузии. Исходными, или базальными, значениями изучаемых показателей гемодинамики считались значения в конце 15-минутного периода стабилизации после вскрытия грудной клетки. Критериями исключения животных из исследования являлись среднее АД (АД ср.) менее 60 мм рт. ст., ЧСС менее 300 ударов в минуту и наличие желудочковых экстрасистол до начала эксперимента.
С целью определения зоны ишемии, или зоны риска, в конце реперфузии производили повторную окклюзию ПНКА, а затем вводили 0,5 мл 5% раствора синьки Эванса в левую общую яремную вену. Жизнеспособный миокард зоны риска идентифицировали визуально после 15-минутного инкубирования срезов миокарда в 1% растворе 2,3,5-трифенилтетра-золия хлорида при температуре 37°C, как окрашенный в кирпично-красный цвет. Зону некроза рассчитывали в % массы зоны риска.
Все количественные параметры оценивались на нормальность их распределения с помощью теста Колмогорова-Смирнова. Статистическую значимость различий полученных данных – зон риска, зон некроза, показателей гемодинамики – между группами животных оценивали при помощи однофакторного дисперсионного анализа с использованием тестов множественных сравнений Данна и Бонферрони. Результаты представлялись в виде: среднее ± стандартное отклонение. Значения p<0,05 рассматривались как достоверные.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Значения показателей гемодинамики у животных в ходе
Рисунок 2. Влияние введения атропина на выраженность противоишемического эффекта пре- (ДИПК) и посткондиционирования миокарда на 10-й минуте реперфузии (ДИПостК10')
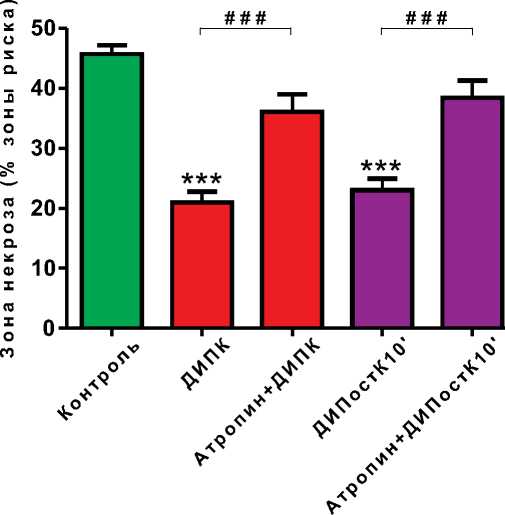
Примечание: *** – p<0,001 – различия между контрольной и опытными группами достоверны; # # # – p<0,001 – различия между опытными группами достоверны.
Рисунок 3. Влияние введения атенолола
(АтенR) и метопролола (МетR) на выраженность противоишемического эффекта дистантного ишемического посткондиционирования миокарда на 10-й минуте реперфузии (ДИПостК10') в условиях интактной парасимпатической иннервации и двухсторонней ваготомии
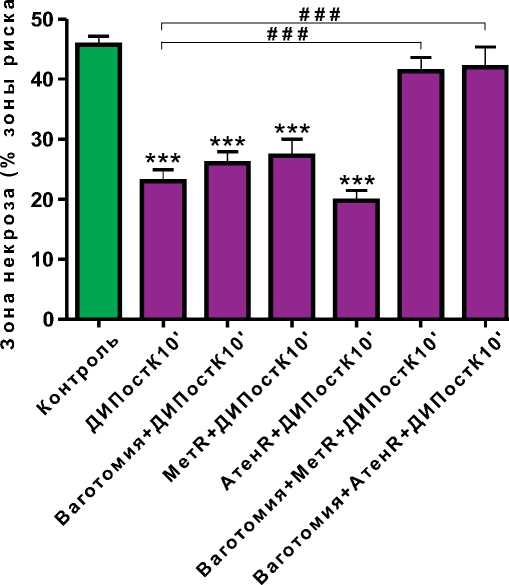
Примечание: *** – p<0,001 – различия между контрольной и опытными группами достоверны; # # # – p<0,001 – различия между опытными группами достоверны.
экспериментов представлены в таблице 1. Значимые отличия ЧСС от их первоначальных значений отмечались в группах, где животные подвергались воздействию ДИПК после двухсторонней ваготомии либо введения атропина, а также у крыс, которым осуществлялось введение метопролола. При этом у животных, подвергшихся ДИПК в условиях двухсторонней ваготомии, повышение ЧСС наблюдалось только в начале ишемии миокарда (p<0,05). У крыс, которым выполнялось ДИПК на фоне введения атропина, повышение данного показателя отмечалось в начале реперфузии (p<0,05), на 60-й и 120-й минутах реперфузии (p<0,01). Снижение ЧСС, вызванное введением метопролола, у животных с интактными блуждающими нервами сохранялось на протяжении всего наблюдаемого периода реперфузии (p<0,01), тогда как у ваготомизированных крыс значения ЧСС к 120-й минуте реперфузии были сравнимы с регистрируемыми до начала экспериментов.
Размеры зон риска во всех группах животных были сопоставимы (p>0,05). На рисунках 1-3 представлены значения зон некроза в экспериментальных группах. Зона некроза в контрольной группе составила 45±4%, в группе Ваготомия – 53±12% (p>0,05 в сравнении с контролем). 15-минутная окклюзия бедренных артерий, осуществляемая до начала ишемии миокарда, во время коронарной окклюзии или на 10-й минуте реперфузии, ограничивала зону некроза на 56%, 58% и 49%, соответственно, (p<0,001 в сравнении с группой Контроль).
Двухсторонняя ваготомия, осуществляемая до начала острой ишемии миокарда, предупреждала развитие проти-воишемического эффекта ДИПК и ДИПерК (зоны некроза 47±12% и 47±1%, соответственно, p<0,001% в сравнении с группами ДИПК и ДИПерК, p>0,05 в сравнении с контролем), но не оказывала влияния на выраженность кардиопротек-торного эффекта ДИПостК10' (зона некроза 26±5%, p<0,001 в сравнении с контролем, p>0,05 в сравнении с группой ДИ-ПостК10') (рисунок 1).
Результаты данной серии экспериментов могут быть обусловлены тем, что выраженность кардиопротекторно-го эффекта дистантного кондиционирования в условиях двухсторонней ваготомии зависит от интервала времени между перерезкой блуждающих нервов и окончанием дистантной ишемии. Эта закономерность может быть объяснима особенностями парасимпатической иннервации левого желудочка. Как известно, парасимпатическая эфферентная иннервация сердца представлена правым и левым блуждающими нервами, волокна которых заканчиваются в правом предсердии и атриовентрикулярном узле, соответственно. Результаты исследований, проведенных Ekstr o m J. [12], Kakinuma Y. et al. [13], а также Rana O. et al. [14], свидетельствуют о том, что на уровне кардиомиоцитов желудочков сердца существует собственная система синтеза ацетилхолина, поддерживаемая механизмом положительной обратной связи. Эта система активизирует свою работу в ответ на активацию М-холинорецепторов или введение ингибитора ацетилхолинэстеразы. То есть, поступающие к сердцу через блуждающие нервы импульсы обеспечивают поддержание надлежащей функциональной активности локальной системы синтеза ацетилхолина [12, 13, 14]. Таким образом, учитывая, что высвобождающийся из окончаний парасимпатических нервов ацетилхолин подвергается быстрому разрушению ацетилхолинэстеразой, двухсторонняя ваготомия должна сопровождаться быстрым снижением содержания ацетилхолина в миокарде. Вместе с тем, как было показано Slav i kov a J. & Tucek S. в экспериментах на крысах, через длительный интервал времени после двухсторонней ваготомии в миокарде желудочков наблюдается высокое содержание ацетилхолинтрансферазы, сравнимое с содержанием данного фермента до перерезки блуждающих нервов [15]. Jo S. et al. продемонстрировали прогрессирующее увеличение количества М-холинорецепторов в миокарде птиц, подвергшихся перерезке блуждающих нервов, прямо пропорционально времени, прошедшему после ваготомии [16]. Таким образом, результаты приведенных исследований свидетельствуют о возможности компенсаторного восстановления синтеза ацетилхолина в кардиомиоцитах после парасимпатической денервации. Данный факт может объяснять воспроизводимость противоишемического эффекта ДИПостК10' в условиях перерезки обоих блуждающих нервов, выполняемой за 15 минут до начала ишемии миокарда. При этом предупреждение кардиопротекторного эффекта ДИПерК в условиях двухсторонней ваготомии согласуется с результатами исследований, проведенных на животных, показавшими возможность ограничивать ишемическое и реперфузионное повреждение миокарда путем стимуляции блуждающих нервов [1, 2, 4]. Полученные нами данные свидетельствуют о целесообразности проведения дальнейших исследований, направленных на оценку влияния стимуляции блуждающих нервов на размер некроза и прогноз у пациентов с острым коронарным синдромом. Безопасность данной
Таблица 1. Показатели гемодинамики в ходе экспериментов у животных, подвергшихся дистантному ишемическому пре- (ДИПК), пер- (ДИПерК) и посткондиционированию миокарда на 10-й минуте реперфузии (ДИПостК10')
|
До начала ОИМ |
Начало ОИМ |
Реперфузия, минуты |
||||
|
0 |
60 |
120 |
||||
|
Контроль (n=8) |
АД ср. |
82±16 |
74±17 |
78±16 |
87±19 |
88±14 |
|
ЧСС |
390±54 |
413±54 |
425±70 |
424±71 |
439±50 |
|
|
Ваготомия (n=8) |
АД ср. |
88±18 |
90±9 |
94±20 |
101±23 |
93±19 |
|
ЧСС |
456±62 |
473±32 |
462±38 |
453±42 |
454±27 |
|
|
ДИПК (n=8) |
АД ср. |
83±21 |
85±23 |
81±23 |
90±22 |
80±18 |
|
ЧСС |
418±34 |
429±45 |
437±42 |
420±46 |
418±36 |
|
|
Ваготомия+ |
АД ср. |
79±10 |
103±25 |
103±29 |
96±21 |
96±12 |
|
ДИПК (n=8) |
ЧСС |
441±21 |
472±18* |
462±20 |
456±16 |
458±11 |
|
ДИПерК (n=8) |
АД ср. |
84±15 |
76±14 |
81±21 |
83±17 |
81±13 |
|
ЧСС |
420±30 |
428±35 |
420±39 |
442±39 |
443±42 |
|
|
Ваготомия+ |
АД ср. |
70±8 |
72±10 |
83±12 |
83±19 |
84±21 |
|
ДИПерК (n=7) |
ЧСС |
417±41 |
438±46 |
462±45 |
468±47 |
456±26 |
|
ДИПостК10' (n=8) |
АД ср. |
76±8 |
78±10 |
81±15 |
89±17 |
89±11 |
|
ЧСС |
402±45 |
421±23 |
415±54 |
422±49 |
434±36 |
|
|
Ваготомия+ |
АД ср. |
84±16 |
95±22 |
92±26 |
98±22 |
89±18 |
|
ДИПостК10' (n=8) |
ЧСС |
399±46 |
429±48 |
415±58 |
418±50 |
420±47 |
|
Атропин+ |
АД ср. |
89±18 |
83±18 |
82±11 |
86±16 |
85±15 |
|
ДИПК (n=10) |
ЧСС |
388±27 |
410±28 |
435±13* |
441±20** |
445±20** |
|
Атропин+ |
АД ср. |
84±13 |
82±15 |
73±12 |
75±10 |
80±11 |
|
ДИПостК10' (n=6) |
ЧСС |
427±47 |
445±90 |
407±52 |
405±61 |
433±35 |
|
МетR+ |
АД ср. |
84±16 |
73±11 |
74±11 |
73±9 |
81±12 |
|
ДИПостК10' (n=10) |
ЧСС |
436±39 |
451±43 |
425±59 |
355±33*** |
383±31** |
|
АтенR+ |
АД ср. |
74±13 |
78±16 |
65±5 |
63±2 |
74±4 |
|
ДИПостК10' (n=10) |
ЧСС |
390±37 |
403±40 |
390±41 |
340±43 |
361±37 |
|
Ваготомия+МетR+ |
АД ср. |
95±16 |
91±18 |
83±16 |
79±15 |
82±19 |
|
ДИПостК10' (n=10) |
ЧСС |
426±44 |
455±47 |
421±66 |
372±38* |
404±37 |
|
Ваготомия+АтенR+ |
АД ср. |
97±23 |
96±13 |
100±18 |
90±17 |
87±21 |
|
ДИПостК10' (n=10) |
ЧСС |
453±35 |
468±33 |
466±20 |
390±28 |
388±49 |
Примечание: животным опытных групп дополнительно выполнялись: двухсторонняя ваготомия до начала ишемии миокарда, введение атропина в/в до начала дистантной ишемии либо введение метопролола или атенолола на 1-й минуте реперфузии (МетR и АтенR соответственно). * – p<0,05, ** – p<0,01, *** – p<0,001 – значимые отличия показателей гемодинамики от первоначальных значений.
методики в настоящее время не вызывает сомнений: использование стимуляторов блуждающих нервов было одобрено FDA США в 1997 г. у пациентов, страдающих эпилепсией, а в 2005 г. – у пациентов, страдающих депрессией.
В настоящее время известно, что парасимпатическая холинергическая регуляция оказывает кардиопротекторное действие при ишемии миокарда за счет снижения скорости использования макроэргических субстратов и уменьшения интенсивности потребления кислорода кардиомиоцитами [17]. В исследовании, проведенном Donato M. et al. на кроликах, было показано, что введение атропина предупреждает развитие противоишемического эффекта ДИПК в той же степени, что и перерезка блуждающих нервов либо спинного мозга в шейном отделе [18]. Введение атропина внутривенно крысам в нашем исследовании предупреждало, подобно двухсторонней перерезке блуждающих нервов, развитие кардиопротекторного эффекта как ДИПК (зона некроза 36±9%, p<0,001, в сравнении с группой ДИПК, p>0,05, в сравнении с контрольной группой), так и ДИПостК10' (зона некроза 38±7%, p<0,001 в сравнении с группой ДИПостК10', p>0,05 в сравнении с контрольной группой) (рисунок 2). Это подтверждает правомерность описанного выше механизма участия блуждающих нервов в развитии дистантного кондиционирования миокарда посредством возбуждения М-холинорецепторов и активации синтеза ацетилхолина.
Исследование, проведенное Rona O. et al. на крысах, показало сниженную экспрессию ацетихолинтрансферазы в кардиомиоцитах пожилых животных по сравнению с кардиомиоцитами молодых взрослых особей [19]. Этот факт может объяснять снижение эффективности дистантного ишемического прекондиционирования, наблюдаемое в клинической практике у пожилых пациентов [20].
Как известно, симпатический и парасимпатический отделы нервной системы находятся в постоянном динамическом антагонистическом либо синергичном взаимодействии [21]. В противовес кардиопротекторным эффектам повышения парасимпатического тонуса [1, 2, 3, 4, 5] симпатическая нервная система, согласно распространенным представлениям, оказывает деструктивное действие, как при острой коронарной недостаточности, так и при развитии хронической сердечной недостаточности ишемической этиологии [22].
Основным доказательством повреждающего действия симпатической нервной системы при хронической сердечной недостаточности являются данные многоцентровых исследований с использованием бета-адреноблокаторов [23, 24, 25, 26]. Хорошо контролируемые клинические исследования, посвященные изучению эффектов бета-блокаторов у пациентов острым коронарным синдромом, в настоящее время практически отсутствуют [27]. Нерандомизированное проспективное исследование, проведенное в Австрии на 664 пациентах острым инфарктом миокарда с подъемом сегмента ST, завершенное в 2013 году, показало, что максимально раннее использование бета-адреноблокатора (бисопролола) у данной категории пациентов сопровождается снижением общей и сердечно-сосудистой смертности [28, 29]. Подобные результаты, свидетельствующие о способности бета-блокаторов (в большей степени карведилола, в меньшей – бисопролола) снижать смертность и частоту сердечно-сосудистых событий при остром инфаркте миокарда, были получены и ранее в ретроспективном нерандомизированном одноцентровом исследовании, проведенном в Японии на 251 последовательно взятом пациенте [30].
Данные, свидетельствующие об эффективности бета-блокаторов в плане ограничения размера инфаркта миокарда в эксперименте, крайне противоречивы. Исследование Ibanez B. et al. (2011 г.) продемонстрировало ограничение зоны некроза в миокарде, подвергшегося ишемии и реперфузии, у свиней при внутривенном введении метопролола до момента окончания коронарной окклюзии [31]. Следует принимать во внимание, что бета-блокаторы взаимодействуют только с β -адренорецепторами, не влияя на α -адренорецепторы, стимуляция которых может также сопровождаться различными эффектами на сердечно-сосудистую систему. Так, в исследовании, проведенном Гуриным А.В. и соавт. (1999 г.), было показано, что альфа-адреноблокатор празозин в дозе 0,5-1 мг/ кг при введении за 5 мин до 30-минутной коронарной окклюзии у крыс увеличивает частоту возникновения фибрилляции желудочков и смертность животных [32]. В этой связи необходимо отметить также, что в настоящее время существует несколько исследований, показавших кардиопротекторное действие фармакологической стимуляции α -адренорецепторов при острой ишемии миокарда [33, 34].
Учитывая широкое использование бета-адреноблокаторов в клинической практике, нам представлялось важным оценить влияние этой группы препаратов на выраженность противоишемического эффекта дистатного ишемического посткондиционирования. Как известно, все бета-адреноблокаторы, оказывающие благоприятный эффект при хронической сердечной недостаточности ишемической этиологии являются в той или иной степени липофильными, то есть, обладают способностью проникать через гематоэнцефалический барьер [35, 36]. Gourine A. et al. в экспериментах на крысах показали, что непрерывная инфузия метопролола непосредственно в желудочки мозга замедляет развитие ремоделирования левого желудочка сердца, вызванного окклюзией коронарной артерии [37]. То есть, можно предположить, что липофильные и гидрофильные бета-адреноблокаторы могут оказывать разное влияние на ишемию и реперфузию миокарда.
В нашем исследовании внутривенное введение метопролола или атенолола крысам с интактными блуждающими нервами не оказывало влияния на выраженность противо-ишемического эффекта ДИПостК10' (зоны некроза 27±8% и 19±4%, соответственно, p<0,001, в сравнении с контрольной группой, p>0,05, в сравнении с группой ДИПостК10') (рисунок 4). При этом у ваготомизированных животных введение этих препаратов предупреждало развитие кардиопротектор-ного эффекта дистантной ишемии (зоны некроза 41±7% и 42±8%, соответственно, p>0,05, в сравнении с контрольной группой, p<0,001%, в сравнении с группой ДИПостК10'). Результаты данной серии экспериментов свидетельствуют о том, что бета-адренорецепторы принимают участие в развитии дистантного ишемического посткондиционирования в условиях ваготомии, но не играют ключевой роли в развитии противоишемического эффекта ДИПостК10' у животных с интактными блуждающими нервами. Полученные данные согласуются с результатами исследования G ó rny D. et al., показавшими, что стимуляция бета-адренорецепторов адреналином является необходимой для поддержания синтеза ацетилхолина в клетках коры головного мозга крыс как in vitro, так и in vivo [38]. Lewis M. et al. в 2001г. продемонстрировали предупреждение снижения сократительной функции левого желудочка, вызываемого стимуляцией левого блуждающего нерва у свиней при введении бета-адреноблокатора эсмолола [39]. Таким образом, полученные нами данные, в совокупности с литературными, свидетельствуют о том, что симпатическая нервная система играет, по-видимому, двойственную роль при острой коронарной недостаточности, оказывая в какой-то степени кардиопротекторный эффект. Подобные рассуждения согласуются с теорией стресса Selye H. (1961 г.), суть которой сводится к тому, что при различных видах стресса (в том числе и при ишемическом) важная роль в процессах адаптации отводится симпатической нервной системе [40].
Существование наблюдаемого в представленном исследовании взаимодействия симпатической и парасимпатической иннервации сердца, относящегося к механизму развития дистантного ишемического посткондиционирования миокарда, может обусловливать слабую выраженность противоише-мического эффекта дистантного посткондиционирования у пациентов с полинейропатиями, принимающих бета-адреноблокаторы.
ВЫВОДЫ
-
1. Парасимпатическая иннервация сердца (блуждающие нервы) принимает непосредственное участие в развитии противоишемического эффекта дистантного ишемического пре- и перкондиционирования миокарда. Двух-
- сторонняя ваготомия, осуществляемая до начала острой коронарной окклюзии, не оказывает влияния на выраженность противоишемического эффекта дистантного ишемического посткондиционирования, воспроизводимого с 10-й по 25-ю минуту реперфузии миокарда.
-
2. Введение атропина предупреждает развитие кардиопро-текторного эффекта как дистантного ишемического прекондиционирования, так и дистантного посткондиционирования миокарда на 10-й минуте реперфузии.
-
3. Введение липофильных или гидрофильных бета-адреноблокаторов не влияет на выраженность кардиопротек-торного эффекта дистантного ишемического посткондиционирования на 10-й минуте реперфузии. Вместе с тем, введение атенолола или метопролола крысам, подвергшимся острой коронарной окклюзии в условиях двухсторонней ваготомии, предупреждает развитие противоише-мического эффекта данного феномена.
Список литературы Механизмы парасимпатических влияний на сердце в развитии противоишемического эффекта дистантного кондиционирования миокарда
- Vagal stimulation suppresses ischemia-induced myocardial interstitial myoglobin release/T. Kawada [et al.]//Life Sci. -2008. -Vol. 83, № 13-14. -P. 490-495.
- Vagal nerve stimulation prevents reperfusion injury through inhibition of opening of mitochondrial permeability transition pore independent of the bradycardiac effect/R.G. Katare [et al.]//J. Thorac. Cardiovasc. Surg. -2009. -Vol. 137, №1. -P. 223-231.
- Cholinergic anti-inflammatory pathway: a possible approach to protect against myocardial ischemia reperfusion injury/J. Xiong [et al.]//Chin. Med. J. (Engl). -2010. -Vol. 123, №19. -P. 2720-2726.
- Vagal stimulation, through its nicotinic action, limits infarct size and the inflammatory response to myocardial ischemia and reperfusion/L. Calvillo [et al.]//J. Cardiovasc. Pharmacol. -2011. -Vol. 58, №5. -P. 500-507.
- De Ferrari, G.M Vagus nerve stimulation: from pre-clinical to clinical application: challenges and future directions/G.M. De Ferrari, P.J. Schwartz//Heart Fail. Rev. -2011. -Vol. 16, №2. -P. 195-203.
- Роль парасимпатической нервной системы в развитии кардиопротекторных эффектов дистантного ишемического прекондиционирования миокарда/М.В. Басалай, В.Ч. Барсукевич, А.Г. Булгак, А.Г. Мрочек//Известия Национальной академии наук Беларуси. Серия медицинских наук. -2012. -№ 1. -С. 20-26.
- Remote ischaemic pre-and delayed postconditioning -similar degree of cardioprotection but distinct mechanisms/M. Basalay, V. Barsukevich, S. Mastitskaya, A. Mrochek, J. Pernow, P.Q. Sjöquist, G.L. Ackland,A.V. Gourine,A. Gourine//Exp. Physiol. -2012. -Vol. 97, №8. -P. 908-917.
- Cardioprotection evoked by remote ischaemic preconditioning is critically dependent on the activity of vagal pre-ganglionic neurones/S. Mastitskaya [et al.]//Cardiovasc. Res. -2012. -Vol. 95, №4. -P. 487-494.
- Roleoftheparasympatheticnervoussystemincardioprotection by remote hindlimb ischaemic preconditioning/M. Donato [et al.]//Exp. Physiol. -2013. -Vol. 98, №2. -P. 425-434.
- Remote ischaemic conditioning before hospital admission, as a complement to angioplasty, and effect on myocardial salvage in patients with acute myocardial infarction: a randomised trial/H.E. B0tker [et al.]//Lancet. -2010. -Vol. 375(9716). -P. 727-734.
- Remote ischemic preconditioning: the surgeon's perspective/M. Thielmann [et al.]//Exp. Physiol. -2013. -Vol. 14, №3. -P. 187-192.
- Ekström, J. Fall in choline acetyltransferase activity in the ventricles of the rat heart after treatment with a ganglion blocking drug/J. Ekström//Acta Physiol. Scand. -1978. -Vol. 102, №1. -P. 116-119.
- Kakinuma, Y. Cholinoceptive and cholinergic properties of cardiomyocytes involving an amplification mechanism for vagal efferent effects in sparsely innervated ventricular myocardium/Y. Kakinuma, T. Akiyama, T. Sato//FEBS J. -2009. -Vol. 276, №18. -P. 5111-5125.
- Acetylcholine as an age-dependent non-neuronal source in the heart/O.R. Rana [et al.]//Auton. Neurosci. -2010. -Vol. 156, №1-2. -P. 82-89.
- Slavikovà, J. Choline acetyltransferase activity and distribution in rat hearts after bilateral cervical vagotomy/J. Slavikovd, S. Tucek//Physiol. Bohemoslov. -1985. -Vol. 34, №3. -P. 217-223.
- Jo, S.A. Regulation of acetylcholinesterase in avian heart. Studies on ontogeny and the influence of vagotomy./S.A. Jo, D.M. Higgins, H.A. Berman//Circ. Res. -1992. -Vol. 70, №4. -P. 633-643.
- A non-neuronal cardiac cholinergic system plays a protective role in myocardium salvage during ischemic insults/Y. Kakinuma [et al.]//PLoS One. -2012. -Vol. 7, №11. -P. 50761.
- Roleoftheparasympatheticnervoussystemincardioprotection by remote hindlimb ischaemic preconditioning/M. Donato [et al.]//Exp. Physiol. -2013. -Vol. 98, №2. -P. 425-434.
- Acetylcholine as an age-dependent non-neuronal source in the heart/O.R. Rana [et al.]//Auton. Neurosci. -2010. -Vol. 156, №1-2. -P. 82-89.
- Effect of local and remote schemic preconditioning on endothelial function in young people and healthy or hypertensive elderly people/L. Moro [et al.]//Atherosclerosis. -2011. -Vol. 219, №2. -P. 750-752.
- Шмидт, Р. Физиология человека. В 3-х томах. Т. 2. Пер. с англ./Под ред. Р. Шмидта и Г. Тевса. -М.: Мир, 1996. -313 с.
- Schömig, A. Catecholamines in myocardial ischemia. Systemic and cardiac release./A. Schömig//Circulation. -1990. -Vol. 82, №3. -P. 13-22.
- Randomized study on the efficacy and safety of landiolol, an ultra-short-acting ß1-adrenergic blocker, in patients with acute myocardial infarction undergoing primary percutaneous coronary intervention/K. Hanada [et al.]//Circ. J. -2012. -Vol. 76, №2. -P. 439-445.
- Beta blockers therapy is associated with improved left ventricular systolic function and sustained exercise capacity in elderly patients with heart failure. CIBIS-ELD sub-study/M. Dekleva [et al.]//Aging Clin. Exp. Res. -2012. -Vol. 24, №6. -P. 675-681.
- Trend of clinical outcome and surrogate markers during titration of β-blocker in heart failure patients with reduced ejection fraction: relevance of achieved heart rate and β-blocker dose/N. Kato [et al.]//Circ. J. -2013. -Vol. 77, №4. -P. 1001-1008.
- Effect of metoprolol versus carvedilol on outcomes in MADIT-CRT (multicenter automatic defibrillator implantation trial with cardiac resynchronization therapy)/M. Ruwald [et al.]//J. Am. Coll. Cardiol. -2013. -Vol. 61, №14. -P. 1518-1526.
- Impact of beta blockade therapy on long-term mortality after ST-segment elevation acute myocardial infarction in the percutaneous coronary intervention era/D. Nakatani [et al.]//Am. J. Cardiol. -2013. -Vol. 111, №4. -P. 457-464.
- Benefit of immediate beta-blocker therapy on mortality in patients with ST-segment elevation myocardial infarction/M.M. Hirschl [et al.]//Crit. Care Med. -2013. -Vol. 41, №6. -P. 1396-1404.
- Roolvink, V. The sooner, the better: early beta-blocker administration in patients with ST-elevation myocardial infarction/V. Roolvink, A.W. Van'tHof, I.C. Horst//Crit. Care Med. -2013. -Vol. 41, №6. -P. 1566-1568.
- Additive effects of β-blockers on renin-angiotensin system inhibitors for patients after acute myocardial infarction treated with primary coronary revascularization/M. Konishi [et al.]//Circ. J. -2011. -Vol. 75, №8. -P. 1982-1991.
- The cardioprotection granted by metoprolol is restricted to its administration prior to coronary reperfusion/B. Ibanez [et al.]//Int. J. Cardiol. -2011. -Vol. 147, №3. -P. 428-432.
- Изучение кардиопротекторного действия лекарственных средств в условиях прерывистой ишемии [Текст]: отчет о НИР (заключ.): РНПЦ “Кардиология“; рук. д.м.н. А.В. Гурин; исполн.: М.Г. Колядко, В.Л. Недорезов, Ф.И. Молош. -Минск, 1999.
- Kitakaze, M. Role of adenosine and its interaction with alpha adrenoceptor activity in ischaemic and reperfusion injury of the myocardium/M. Kitakaze, M. Hori, T. Kamada//Cardiovasc. Res. -1993. -Vol. 27, №1. -P. 18-27.
- Alpha 1-adrenergic agonists precondition rabbit ischemic myocardium independent of adenosine by direct activation of protein kinase C/A. Tsuchida [et al.]//Circ. Res. -1994. -Vol. 75, №3. -P. 576-585.
- Metoprolol reverses left ventricular remodeling in patients with asymptomatic systolic dysfunction: the REversalof VEntricular Remodeling with Toprol-XL (REVERT) trial/W.S. Colucci [et al.]//Circulation. -2007. -Vol. 116, №1. -P. 49-56.
- Carvedilol in the treatment of chronic heart failure: lessons from the Carvedilol Or Metoprolol European Trial/W.S. Colucci [et al.]//Vasc. Health Risk Manag. -2007. -Vol. 3, №1. -P. 31-37.
- Beneficial effect of the central nervous system beta-adrenoceptor blockade on the failing heart/A. Gourine, S.I. Bondar, K.M. Spyer, A.V. Gourine//Circ. Res. -2008. -Vol. 102, №6. -P. 633-636.
- The effect of adrenaline on acetylcholine synthesis after blockade of alpha-and beta-adrenergic receptors in vitro/D. Górny [et al.]//Acta Physiol. Pol. -1977. -Vol. 28, №4. -P. 313-320.
- Vagus nerve stimulation decreases left venrticular contractility in vivo in the human and pig heart/M.E. Lewis [et al.]//J. Physiol. -2001. -Vol. 534, №2. -P. 547-552.
- Selye, H. Stress and cardiovascular disease/H. Selye//World Wide Abstr. Gen. Med. -1961. -Vol. 4. -P. 8-13.


