Механизмы резистентности к иммунотерапии при MSI фенотипе
Автор: Федянин М.Ю.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S1 т.15, 2025 года.
Бесплатный доступ
Цель: Обобщить современные представления о механизмах первичной и приобретённой резистентности к ингибиторам контрольных точек (ИКТ) при колоректальном раке (КРР) с dMMR / MSI. Материалы и методы: Нарративный обзор рецензируемой литературы и результатов клинических исследований ИКТ, включающий молекулярно-генетические, иммунологические, морфологические и микробиотические маркеры резистентности. Результаты: Резистентность при КРР с dMMR / MSI имеет многофакторную природу, к которой можно отнести дефекты антигенной презентации (β2‑микроглобулин, компоненты APM, HLA), нарушения сигнального пути IFN-γ / JAKSTAT, гиперактивность WNT / β-катенина, TGF-β-опосредованный сигналинг и ремоделирование стромы, а также особенности транскриптомных подтипов. Вклад микроокружения включает накопление Treg, MDSC, нейтрофилов и М2‑макрофагов, активацию фибробластов, ангиогенез и особенности метаболизма опухолевых клеток, а также экспансию дополнительных иммунных контрольных точек (LAG-3, TIM-3, TIGIT, IDO1), снижающих эффективность PD-1‑блокады. На уровне биомаркеров значимы: вариабельность TMB и степень выраженности MSI, результаты Immunoscore, морфологические признаки (например, наличие муцинозного компонента в опухоли), а также генетических причин развития MSI. Микробиота (в том числе F. nucleatum) ассоциирована с особенностями микрокружения опухоли и чувствительностью к ИКТ. Перспективные пути преодоления резистентности включают ко-блокаду PD-1 с CTLA-4 или LAG-3, сочетание с анти-VEGF-терапией и ингибиторами TGF-β, воздействие на миелоидные клетки, модуляцию микробиоты и новые таргетные подходы (например, ингибирование WRN). Заключение: Несмотря на высокую иммуногенность MSI-ассоциированного КРР, резистентность остаётся существенной клинической проблемой и требует стратификации по совокупности геномных, транскриптомных и иммунных признаков. Наиболее перспективной видится персонализированная комбинационная иммунотерапия на основе интегральной оценки антигенпрезентирующей функции, интерферонового сигналинга, микроокружения, морфологии, микробиоты и клинических признаков.
MSI, dMMR, колоректальный рак, иммунотерапия, ингибиторы контрольных точек, резистентность, микроокружение опухоли
Короткий адрес: https://sciup.org/140312890
IDR: 140312890 | DOI: 10.18027/2224-5057-2025-15-3s1-11-30
Текст научной статьи Механизмы резистентности к иммунотерапии при MSI фенотипе
Микросателлитная нестабильность (MSI) является отражением наличия нарушений в системе репараций по типу неспаренных оснований (MMR). Данные нарушения встречаются у 15% пациентов с резектабельными стадиями [1] и только от 3 % до 5% случаев метастатического колоректального рака (мКРР) [2]. Микросател-литная нестабильность может возникать как вследствие спорадических изменений, так и наследственных причин.
Один из восьми случаев КРР со спорадическим dMMR/MSI развивается в результате гиперметилирования промотора гена гомолога 1 (MLH1) MutL [3]. Наследственные случаи в основном связаны с синдромом Линча (СЛ) и являются результатом герминальных мутаций в одном из генов MMR, таких как MLH1, PMS1, PMS2, MSH2 и MSH6 или мутации гена EPCAM. КРР с dMMR /MSI обычно демонстрируют специфические опухолевые характеристики: женский пол, склонность к локализации первичной опухоли в правых отделах толстой кишки, чаще наблюдается поражение брюшины, муцинозный характер опухоли, высокая степень злокачественности, низкая дифференцировка, высокая частота мутаций гена BRAF [4].
Генетически при нарушениях в системе MMR развивается гипермутированный фенотип опухолей, приводящий к высокой мутационной нагрузке (TMB), образованию высокоиммунных неоантигенов как следствие накопления в процессе репликации клеток большого количества делеций, вставок и мутаций со сдвигом рамки считывания. Накопление опухоль-ассоциированных неоантигенов способствует идентификации опухолевых клеток иммунной системой [5,6]. Эта гипотеза была подтверждена в контролируемой мышиной сингенной модели КРР. Путем генетической инактивации репарации неспаренных оснований в клеточной линии pMMR, исследователи показали, что потеря MMR вызывает гипермутированный статус опухоли, связанный с повышенной нагрузкой опухолевых неоантигенов. В свою очередь, это запускало долгосрочный иммунный ответ [7]. Кроме этого, экспрессия нестабильных промежуточных продуктов ДНК в опухолевых клетках с dMMR/MSI активирует передачу сигналов cGAS-cGAMP-STING, индуцируя выработку интерферонов I типа, IL-6 и TNF. Они, в свою очередь, активируют врожденный и приобретенный иммунитет за счет рекрутирования Т-клеток и антигенпрезентирующих клеток (АПК) в микроокружение, усиления поглощения и презентации неоантигенов, а также активации Т-клеток в дренирующих лимфатических узлах [8].
Процесс канцерогенеза данного подтипа опухолей можно изучать у пациентов с синдромом Линча. Следует отметить, что полипы, ассоциированные с СЛ, и нормальный эпителий толстой кишки обычно характеризуются низкой мутационной нагрузкой и соответственно низкой представленностью неоантигенов, однако демонстрируют иммунный характер микроокружения, включающий инфильтрацию CD4 + Т-клетками, экспрессию провоспали-тельных цитокинов (TNF, IL-12) и иммунных контрольных точек LAG3 и PD-L1, что указывает на раннюю иммунную реакцию. Если же в клетках полипа при СЛ также выявляется и dMMR, то в таких клетках определялась и высокая частота мутаций и неоантигенов, сравнимая с гипермутированными злокачественными опухолями, и также детектировалась экспрессия CTLA-4 [9]. Эти данные свидетельствуют о том, что презентация неоантигенов, иммунная активация и последующий иммунный надзор или уклонение от него могут происходить уже на ранних стадиях канцерогенеза. Дополнительным подтверждением ранней иммунной активации при СЛ служит высокая инфильтрация неизмененной слизистой толстой кишки пациентов без опухоли иммунными клетками, включая CD45 + , CD8 + , естественные киллеры (NK), дендритные, тучные и В-клетки, зачастую в более высоких количествах, чем в удалённых от опухоли участках слизистой у пациентов с КРР без СЛ [10]. Примечательно, что плотность CD3 + Т-клеток у пациентов с СЛ без опухолей коррели- ровала с удлиненным временем до развития заболевания, что предполагает роль Т-клеток в модуляции в неизмененной слизистой риска возникновения злокачественных новообразований. Кроме того, наблюдалось увеличение количества FOXP3-положительных регуляторных Т-клеток (Tregs), обладающих иммуносупрессивными свойствами и выявленных в нормальной слизистой СЛ пациентов как с КРР, так и без него, по сравнению с контрольными образцами без СЛ. Также CD8 + Т-клетки в нормальной слизистой у пациентов с СЛ демонстрировали фенотип истощения, что вместе свидетельствует о раннем формировании иммунных регуляторных механизмов, потенциально способствующих прогрессированию опухоли [10].
Появление ингибиторов иммунных контрольных точек (ИКТ) изменило лечение метастатического КРР с dMMR/MSI. В клиническом исследовании III фазы KEYNOTE-177 и исследовании III фазы CHECKMATE-8HW показатели контроля заболевания составили 65% при использовании пембролизумаба и 84% при комбинированном лечении ниволумабом и ипилимумабом. Однако, несмотря на такую эффективность, около 30–40% пациентов с dMMR/MSI прогрессируют в процессе терапии ИКТ, а около 20–25% проявляют первичную резистентность к данному классу препаратов [11,12]. Причины отсутствия ответа у некоторых пациентов остаются неясными, при этом одним из соображений является возможная лабораторная ошибка трактовки статуса dMMR/MSI [13]. В качестве примера — в исследование CHECKMATE-142 разрешали включать пациентов по результатам тестирования локальной лаборатории. В дальнейшем при перепроверке результатов тестирования в центральной лаборатории практически у 18% пациентов выявлен MSS фенотип. При этом следует отметить, что гетерогенность статуса MSI между первичной опухолью и метастазами КРР наблюдается редко [14].
Тем не менее, даже принимая во внимание ошибки в тестировании вопросы наличия первичной и вторичной резистентности к ИКТ при КРР с dMMR/MSI остаются. Данный обзор литературы направлен на понимание механизмов потенциальной резистентности или, другими словами, механизмам уклонения от иммунного ответа при применении ИКТ при dMMR/MSI КРР.
КОМПОНЕНТЫ МИКРООКРУЖЕНИЯ ОПУХОЛИ, УЧАСТВУЮЩИЕ В УКЛОНЕНИИ ОТ ИММУННОГО ОТВЕТА
Опухолевое микроокружение содержит различные иммунные клетки, такие как CD4 + и CD8 + Т-клетки, натуральные киллеры, регуляторные Т-клетки (Tregs) и миелоидные супрессорные клетки (МДСК). Т-лимфоциты, особенно CD8 + цитотоксические Т-клетки и CD4 + хел-перные Т-клетки, играют решающую роль в формировании противоопухолевого ответа. Тем не менее, активация этих
Т-клеток может негативно регулироваться молекулами иммунных контрольных точек, такими как цитотоксический антиген Т-лимфоцитов 4 (CTLA-4), белок запрограммированной клеточной смерти 1 (PD-1), иммуноглобулин Т-клеток и домен, содержащий муцин 3 (TIM-3), а также ген активации лимфоцитов 3 (LAG-3) [15]. Это негативное регулирование может привести к иммунной толерантности и истощению Т-клеток, снижая эффективность иммунного противоопухолевого ответа.
Сравнение КРР с dMMR/MSI и с нормальной функцией этой системы (pMMR) показало, что основное отличие в иммунном составе опухолей заключается в количестве и состоянии Т-клеток [16]. В соответствии с большей иммуногенностью dMMR опухолей, эти Т-клетки характеризовались активностью цитотоксических функций (экспрессия гранулизина, гранзима B, перфорина). При этом в некоторых dMMR опухолях были обнаружены участки, в которых Т-клетки, продуцирующие интерферон-γ, формировали очаги вместе с миелоидными клетками, экспрессирующими интерферон-индуцируемые гены (ISG) и рецепторы CXCR3L, создавая среду, способствующую привлечению лимфоцитов. Это приводило к инфильтрации опухолей c dMMR CXCL13 + Т-клетками — маркер Т-клеток, которые реактивны к опухолевым антигенам [10,17,18], — а также PDCD1 (PD-1) + γδ-подобными Т-клетками, что потенциально должно усиливать противоопухолевый ответ. Следовательно, присутствие таких воспалительных иммуногенных очагов, вероятно, играет роль в регуляции Т-клеточного ответа и общей противоопухолевой иммунной активности в опухолях с dMMR.
Однако персистирующая воспалительная сигнализация в таких опухолях может способствовать и развитию иммуносупрессии — через индуцированное IFN-γ повышение экспрессии иммунных контрольных точек и привлечение иммуносупрессивных стромальных клеток и миелоидных клеток (фибробластов, нейтрофилов, макрофагов) по градиентам цитокинов (CCL2, CCL7, VEGF, IL-10, TGFB, IL-17, G-CSF, GM–CSF, IL1B, CCL20) [19,20]. Особенно в опухолях с dMMR наблюдалась пространственная корреляция ISG-сигнатур с молекулами тормозного действия — IDO1, PD-1, PD-L1, Tim3. Кроме того, такие опухоли были обогащены воспалительными фенотипами фибробластов, экспрессирующих металлопротеиназы (MMPs), известные своей ролью в ангиогенезе и ремоделировании тканей. Активированные фибробласты могут продуцировать IL-17, стимулирующий дальнейший рост опухоли [21,22].
В целом, эти данные показывают, что в MSI-ассоциированных опухолях может формироваться мощный противоопухолевый иммунный ответ, но при этом появляются иммуносупрессивные воспалительные очаги, которые ослабляют иммунный ответ против опухоли. Вопрос о точном времени появления этих механизмов иммунного уклонения остается открытым. Ниже рассмотрено более подробно влияние компонентов микроокружения на резистентность к ИКТ.
Регуляторные Т-клетки
Tregs играют ключевую роль в поддержании иммунного гомеостаза, ограничивая цитотоксическое воздействие эффекторных Т-клеток [23]. Они достигают этого за счет высвобождения ингибирующих цитокинов, таких как интерлейкин (IL) 10 и трансформирующий фактор роста β (TGF-β), или за счет модуляции антигенпрезентирующих клеток посредством экспрессии CTLA-4 или LAG-3 [24]. Тем не менее, их роль при КРР до сих пор неясна из-за противоречивых выводов об их прогностической значимости. Например, Vlad с соавторами обнаружили, что присутствие Tregs в опухолях толстой кишки было связано с улучшением выживаемости [25]. Напротив, Waniczek с соавторами опубликовали данные, что высокая инфильтрация опухоли Treg была связана с низкой выживаемостью без признаков болезни и общей выживаемостью [26]. Хотя эти результаты были получены в основном при анализе пациентов опухолях с MSS фенотипом, эти данные говорят о разнообразии Tregs, которые включают как активированные, так и несупрессивные подтипы.
Эти подтипы состоят из CD45RA+ /FOXP3- Treg-клеток и провоспалительных CD45RA-FOXP3+ Treg-клеток [27]. Saito с соавторами обнаружили, что высокая экспрессия FOXP3 была связана с худшим прогнозом у пациентов с КРР, при этом инфильтрирующие опухоль Tregs, в первую очередь, относились к группе CD45RA-FOXP3+ [28]. С другой стороны, в опухолях толстой кишки с dMMR/MSI фенотипом отмечается увеличение инфильтрации опухолей FOXP3-положительными клетками [29], что с одной стороны может говорить об ускользании от иммунного воздействия, но может является не критичным для действия ИКТ. Тем не менее, полученные результаты легли в основу попыток воздействия на данный класс клеток с целью преодоления резистентности к ИКТ. Например, было показано, что антитела против IL-10 увеличивают присутствие инфильтрирующих опухоль лимфоцитов (TILs) и способствуют гибели опухолевых клеток in vitro [30].
Клетки-супрессоры миелоидного происхождения
Миелоидные клетки супрессоры (МДСК) представляют собой гетерогенную популяцию иммунных клеток миелоидной линии и могут подавлять противоопухолевый иммунитет с помощью различных механизмов [31]. В частности, МДСК производят ферменты, такие как синтаза оксида азота и аргиназа-1, которые истощают содержание L-аргинина в клетках, аминокислоту, необходимую для нормального функционирования Т-клеток и Т-клеточного рецептора [32,33]. Это истощение ухудшает иммунный ответ против опухолей. Колониестимулирующие факторы роста (G-CSF и GM–CSF) индуцируют повышенный гликолиз, активность в пентозофосфатном пути и цикле Кребса, а также повышенный уровень холестерина. Поскольку холестерин необходим для дифференцировки воспали- тельных макрофагов и дендритных клеток и способствует антигенпрезентирующей функции, можно предположить, что метаболическое перепрограммирование и дифференцировка эффекторных миелоидных клеток могут быть одним из ключевым механизмом противоопухолевого иммунитета, опосредованного применением ИКТ [19]. Также есть основания полагать, что МДСК могут стимулировать активацию Tregs за счет высвобождения цитокина IL-10 [34], что приводит к иммуносупрессии.
Несмотря на более высокую распространенность вну-триопухолевых Tregs и МДСК в опухолях толстой кишки с MSS фенотипом [35], опухоли с dMMR/MSI могут быть более восприимчивы к эффектам этих иммуносупрессивных клеток. Примечательно, что по сравнению с pMMR, опухоли dMMR отличались большей экспрессией хемо-кинов, привлекающих моноциты и нейтрофилы, а также аларминов S100A8 и S100A9 , которые могут опосредовать иммуносупрессию за счет усиления накопления МДСК со способностью ингибировать Т-клетки [36] и секретировать супрессивные цитокины IL-10 и TGF-β [37].
В тех участках опухолей, в которых Tregs и тучные клетки колокализовались друг с другом отмечается сниженная экспрессия MHC–I и плохая инфильтрация CD8 + , Granzyme B + Т-лимфоцитами, что ассоциировалось с резистентностью к лечению анти-PD-1. Исследования 2D и 3D моделей кокультур показали, что тучные клетки человека способствуют росту КРР за счет увеличения продукции цитокинов (CCL15 или SCF) и стимуляции TLR2 [38].
Эти данные демонстрируют, что миелоидные программы изменяются в опухолях с dMMR/MSI, что, вероятно, способствует ускользанию от иммунитета во время прогрессирования опухоли. Истощение иммуносупрессивных опухоль-ассоциированных миелоидных клеток является привлекательным терапевтическим подходом для стимулирования противоопухолевого иммунного ответа. Однако, такие ингибиторы проявили минимальные терапевтические возможности, и остается неясным, могут ли эти методы лечения восстановить чувствительность к ИКТ.
Нейтрофилы
Воспалительная реакция также ассоциирована с наличием нейтрофилов в микроокружении. В исследовании Sui Q с соавторами показано, что при КРР с dMMR/MSI как местные воспалительные изменения, так и признаки системной воспалительной реакции (отношение нейтрофилов к лимфоцитам — NLR > 3) связаны с иммуносупрессивным микроокружением и низким ответом опухоли на ИКТ [39]. Хотя нейтрофилы могут активироваться при воспалении, исследования показывают, что нейтрофилы в опухолях функционально отличаются от своих периферических аналогов в кровотоке [40]. Кроме того, несколько типов клеток в опухолевом микроокружении могут вносить свой вклад в пул цитокинов, включая G-CSF, GM–CSF, CXCR2 лиганды и IL17, которые активируют нейтрофилы
-
[41] . Таким образом, считается, что инфильтрирующие опухоль нейтрофилы вносят больший вклад в иммуносупрессию, чем периферические нейтрофилы.
В ответ на гипоксию и специфические цитокины миелоидные клетки экспрессируют повышенные уровни лигандов CTLA-4 и других ингибиторов иммунных контрольных точек. Лиганды CTLA-4, такие как молекулы B7, также высоко экспрессируются в дендритных клетках. В Т-клетках CTLA-4 (ингибитор) и CD28 (активатор) существуют как гомодимеры, способные связываться с CD80/CD86 через один и тот же внеклеточный мотив. Ряд исследователей утверждают, что активация CD80 в нейтрофилах может способствовать активации Т-клеток путем взаимодействия с CD28 [42], в то время как другие предполагают, что CTLA-4 обладает значительно более высоким сродством и авид-ностью с CD80/CD86, тем самым вытесняя CD28 и просто не позволяя ему оказывать свой стимулирующий сигналинг [43]. В совокупности эти результаты свидетельствуют о том, что взаимодействие CTLA-4 и CD80/CD86 в наибольшей степени способствует истощению Т-клеток в воспалительных условиях. А эксперименты in vitro показывает, что нейтрализация CD80 и CD86 может снижать ингибиторную функцию нейтрофилов в отношении Т-клеток.
Опухоль-ассоциированные макрофаги
Опухоль-ассоциированные макрофаги (ТАМ) обычно обнаруживаются в микроокружении солидных опухолей и могут быть классифицированы на подтипы М1 (провос-палительные) и М2 (противовоспалительные) [44]. Макрофаги М1, обычно активируемые интерфероном-γ (ИФН-γ) или фактором некроза опухоли, обладают цитотоксическим действием в отношении опухолевых клеток. IL-4 является одним из нескольких цитокинов, ответственных за активацию макрофагов M2, которые проявляют противовоспалительные и проопухолевые характеристики [45]. В отношении микроокружения опухоли TAM М2 способны ингибировать миграцию и цитотоксичность CD8+ Т-лимфоцитов за счет повышения экспрессии PD-L1/PD-L2, активности ферментов аргиназы (ARG1) и синтазы оксида азота 2 (NOS2), а также за счет привлечения регуляторных Т-клеток (Tregs). Это состояние поляризации не является постоянным, что позволяет макрофагам переключаться между фенотипами M1 и M2 [46].
Роль макрофагов в развитии КРР обсуждается, при этом некоторые исследования связывают высокую плотность ТАМ с улучшением исходов болезни [47], а другие показывают противоположные результаты [48]. Исследования опухолей с dMMR/MSI показали более высокое содержание в микроокружении TAM M1 фенотипа и повышенные уровни экспрессии PD-L1 на макрофагах M2 во фронте инвазии по сравнению с опухолями MSS [49]. В настоящий момент изучаются следующие стратегии воздействия на ТАМ: ингибирование рекрутинга ТАМ, перепрограммирование проопухолевых макрофагов
М.Ю. Федянин
М2 на противоопухолевый фенотип М1 или комбинация того и другого [51]. Однако пока эти работы не увенчались клиническим успехом.
Опухоль ассоциированные фибробласты
Опухолевая строма, включающая опухоль-ассоцииро-ванные фибробласты (CAFs) и внеклеточный матрикс (ECM), играет одну из ключевых ролей в инициации, прогрессии, метастазировании и резистентности к терапии при КРР [52]. CAFs влияют на привлечение иммунных клеток и регулируют врожденный и адаптивный иммунитет посредством продукции цитокинов и хемокинов, включая TGF-β [53], активация которого в микроокружении опухоли оказывает выраженное иммуносупрессивное действие. CAFs также препятствуют миграции CD8 + Т-клеток в опухоль [54,55], что способствует резистентности к ИКТ. Аналогично, ECM способствует привлечению иммуносупрессивных клеток (Tregs, TAMs) и блокирует рекрутирование противоопухолевых иммунных клеток.
Влияние метаболизма опухолевых клеток на микроокружение
Метаболизм опухоли также важен для иммунного уклонения. Лактат, ключевой продукт эффекта Варбурга, является сильным ингибитором CD8 + Т-лимфоцитов [55]. Лактат способствует поляризации макрофагов в иммуносупрессивный M2 фенотип и изменяет метаболизм Tregs, позволяя им сохранять активность при низком уровне глюкозы [56]. У пациентов с MSI-ассоциированным КРР наблюдается выраженный эффект Варбурга и обратная связь между гликолизом и инфильтрацией CD8 + Т-клет-ками. Гипоксия индуцирует экспрессию эктонуклеотидаз CD39 и CD73, катализирующие превращение АТФ в аденозин, который также является сильным иммуносупрессан-том [57,58]. Эти данные подчеркивают роль метаболизма опухоли в механизмах иммунного уклонения.
МЕХАНИЗМЫ УКЛОНЕНИЯ ОТ ИММУННОГО ОТВЕТА И РЕЗИСТЕНТНОСТЬ К ИКТ
Первоначальный иммунный ответ врожденной и адаптивной иммунной системы на опухолевые антигены называется фазой элиминации. За этим следует фаза равновесия, которая описывает состояние равновесия между персистенцией опухолевых клеток и их разрушением иммунной системой [59]. Возможные механизмы иммунологического ускользания могут быть на любом из этапов и включают, как изменения в антигенпрезентирующем механизме (АПМ), развитии иммунотолерантного опухолевого микроокружения, так и повышение экспрессии молекул иммунных контрольных точек.
Процесс презентации антигенов
В АПМ ключевую роль играют молекулы главного комплекса гистосовместимости (MHC) I типа, поскольку они способствуют распознаванию антигена Т-лимфоцитами. Они экспрессированы на поверхности почти всех ядросодержащих клеток [60]. Белок MHC–I типа состоит из тяжелой цепи, кодируемой генами человеческого лейкоцитарного антигена (HLA) A, B или C на хромосоме 6, и неполиморфной легкой цепи, кодируемой геном бе-та2-микроглобулина (β2M), расположенного на хромосоме 15 [61]. Генетические изменения, включая мутации и потерю гетерозиготности, а также нарушения в сборке или распаде комплекса МНС, могут приводить к снижению его экспрессии на поверхности клетки [62]. Это может позволить опухолевым клеткам уклоняться от обнаружения иммунной системой (рис. 1). При dMMR/MSI в 11% образцах первичной опухоли выявляется потеря гена β2M , а в 55% наблюдаются изменения внутри АПМ [63]. В случаях dMMR/MSI около 20% опухолей имеют мутации в HLA-A, — B или -C [64]. В случаях синдрома Линча этот процент возрастает до 50% [65]. Тем не менее, повышенная частота мутаций в этих генах может быть связана лишь с гипермутантным статусом, присущим опухолям с dMMR/MSI, но не оказывать влияние на чувствительность к ИКТ [66].
Изменения или потеря гетерозиготности β2М были описаны как возможные механизмы (приобретенной) резистентности к ИКТ при меланоме [67] и раке легкого [68]. Тем не менее, доказательства в отношении КРР с dMMR/MSI фенотипом более неоднозначны. Несмотря на то, чтоустойчивость к ИКТ в некоторых исследованиях была связана с изменениями в β2M [69], мутации β2M или отсутствие экспрессии β2M не обязательно исключают ответ на ИКТ при данном типе опухолей. Несмотря на ожидаемый дефицит антигенной презентации, большинство β2M-дефицитных опухолей толстой кишки с dMMR/MSI достигают клинической пользы от терапии ИКТ [70]. Одно из объяснений заключается в том, что β2M может быть получен из других клеток при межклеточных взаимодействиях. Другое — участие иммунных эффекторных клеток, отличных от CD8 + Т-лимфоцитов в ответе на лечение. Так, в исследовании de Vries с соавторами было продемонстрировано, что ключевыми эффекторами иммунотерапии при опухолях с dMMR с дефектами MHC–I являются γδ Т-клетки [71]. При действии ингибиторов ИКТ существенно увеличивалась инфильтрация γδ Т-клетками именно при β2M-дефицитных опухолях с dMMR, при этом увеличивалась экспрессия PD-1, цитотоксических молекул и иммуноглобулиноподобных рецепторов клеток-киллеров. Кроме того, NK и CD4 + Т-клетки также могут играть важную роль в противоопухолевом действии при dMMR и дефиците MHC–I. Так в мышиных моделях опухолей с β2M -/- и dMMR фенотипом эксперименты по истощению субпопуляции Т-клеток показали, что CD4 + , но не CD8 + , Т-лимфоциты необходимы для эффективности блокады контрольных
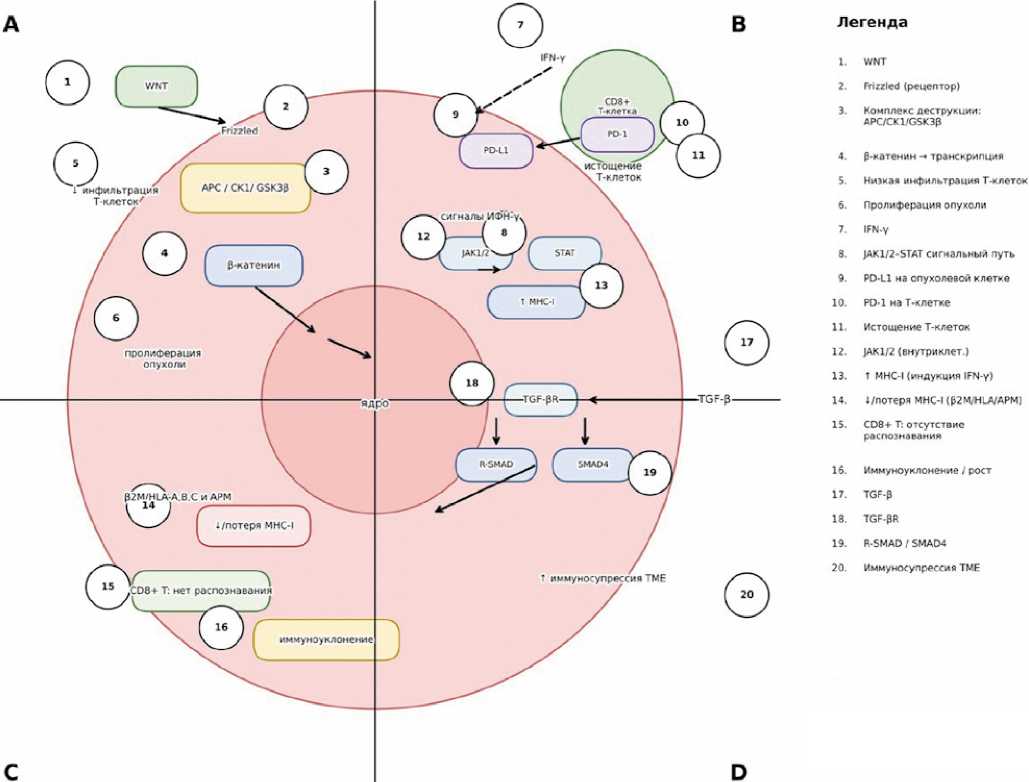
Рисунок 1. Факторы, связанные с резистентностью к ИКТ. (A) Сигнальный путь WNT/β-катенина: потеря гена аденоматозного полипоза кишки (APC) приводит к повышению уровня β-катенина и активации сигнального пути WNT, что впоследствии приводит к изменению Т-клеточного ответа, значительному снижению инфильтрирующих опухоль лимфоцитов и пролиферации опухоли; (B) Передача сигналов интерферона-γ (ИФН-γ): ИФН-γ способствует апоптозу опухолевых клеток и усиливает экспрессию основного комплекса гистосовместимости класса I (MHC–I) и лиганда запрограммированной клеточной смерти 1 (PD-L1) за счет действия JAK киназ; (C) Антигенпрезентирующий механизм (АПМ): (1) внутриопухолевые механизмы, такие как мутации, потеря гетерозиготности (LOS) или делеции в гене β2M, а также в генах HLA-A, -B и -C, запускают потерю MHC-I; (D) Трансформирующий фактор роста бета (TGF-β): Мутации либо в рецепторе TGF-β, либо в его нижележащей мишени, SMAD4, могут привести к резкому повышению уровня TGF-β. Повышенный уровень TGF-β может привести к истощению Т-клеток и вызвать резистентность к ИКТ (создано ChatGPT 5.0).
точек (анти-PD-1 + анти-CTLA-4) [72]. Тем не менее, механизмы противоопухолевого иммунитета, вызванного CD4 + Т-клетками, в ответ на применение ИКТ при опухолях с dMMR и с дефицитом MHC–I еще предстоит исследовать.
В исследовании KEYNOTE 177 пациенты dMMR/MSI и комутациями в генах RAS, в группе с пембролизумабом имели более короткую выживаемость без прогрессирования (ВБП) по сравнению с пациентами диким типом генов RAS [11]. Это наблюдение согласуется с исследованием Salem с соавторами, которое показало, что КРР с dMMR/MSI и мутациями RAS ослабляют иммунный надзор и делают опухолевое микроокружение более иммунотолерантным [73]. Доклинические исследования показывают, что мутация KRAS может подавлять экспрессию HLA-A, -B или -C путем ингибирования регуляторного фактора интерферона 2. Это приводит к увеличению экспрессии хемокинового лиганда 3 (CXCL3), побуждая иммуносупрессивные МДСК проникать в опухоль [74]. Кроме того, мутации KRAS могут способствовать созданию иммуносупрессивной среды за счет активации сигнального пути MAPK (RAF/MEK/ERK)
М.Ю. Федянин
-
[75] . Интересно, что на эффективность комбинированной иммунотерапии с использованием анти-PD-1 антитела ниволумаба и анти-CTLA-4 антитела ипилимумаба статус генов RAS не оказывал влияния [76].
Интерферон-γ (IFN-γ), преимущественно продуцируемый эффекторными Т-клетками, активирует путь JAK/STAT в опухолевых клетках, что усиливает противоопухолевый эффект за счет индукции MHC–I класса и хемокинов для привлечения Т-клеток, но одновременно способствует иммунному уклонению через индукцию экспрессии PD-L1. Активация JAK1/JAK2 при связывании IFN-γ с его рецепторами является критическим этапом. Выявлены мутации в генах JAK2 сигналинга (например, гомозиготная мутация в JAK1 W690*) в клетках КРР с dMMR/MSI, которые приводят к потере экспрессии антигенов из-за нарушений интерфе-ронового пути, что клинически реализовалось в устойчивость к ИКТ [77]. Однако роль мутацийJAK противоречива. Например, гетерозиготные мутации этого пути, напротив, связаны с активацией сигнальной системы IFN-γ и увеличением экспрессии MHC-I и PD-L [78], а ингибиторы JAK (например, итакитиниб) усиливают противоопухолевый ответ пембролизумаба у пациентов с немелкоклеточным раком легкого [79].
Передача сигналов интерферона-γ
ИФН-γ, как описывалось выше, играет ключевую роль в противоопухолевом иммунитете, способствуя апоптозу опухолевых клеток и усиливая экспрессию антигенпрезентирующих молекул, таких как MHC–I [80]. Передача сигналов ИФН может повышать регуляцию классических и неклассических молекул MHC. Апрегуляция опухоли классического MHC–I ингибирует естественные клетки-киллеры. Поскольку опухоли с dMMR/MSI содержат воспалительные инфильтраты, ИФН-опосредованная активация классических и неклассических ингибиторных контрольных точек MHC–I в этих опухолях может способствовать иммунному ускользанию [16].
Но эффекты ИНФ связаны не только с АПМ. С одной стороны, ИФНγ-индуцированная сигнатура, включая экспрессию CXCL9/CXCL13, была ассоциирована с благоприятным ответом при применении ИКТ при различных опухолях [81]. С другой стороны, персистирующая активность генов, стимулированных интерфероном (ISG) может в конечном итоге приводить к иммуносупрессии из-за отрицательной обратной связи, которая повышает экспрессию иммунных контрольных точек и сопутствующих ингибирующих факторов, таких как PD-1/PD-L1, Lag3/MHC-II, Tim3/LGALS9 и IDO1 [16]. В исследовании Boukhaled с соавторами, подтверждающем негативную регуляторную роль передачи сигналов ИФН, сообщалось, что эпигенетически закодированная высокая чувствительность на ИНФ I типа в периферической иммунной системе до начала терапии, определяет негативный исход применения ИКТ [82]. Поскольку накопление повреждений ДНК в клетках с dMMR может хронически стимулировать сигналинг ИФН по пути cGAS-STING, видится перспективным изучение роли передачи сигналов ИФН в формировании ответа на применение ИКТ.
Цитолитическая активность микроокружения
Снижение экспрессии маркеров цитолитической активности ассоциировано с резистентностью к анти-PD-1 терапии при ряде злокачественных опухолей, включая КРР [83,84]. Анализ секвенирования РНК единичных клеток показал, что в КРР с dMMR/MSI субпопуляции Т- и NK-клеток приобретают цитолитические свойства (гранулизин (GNLY), гранзим B (GZMB) и PRF1) в большей степени, чем в опухоли с pMMR [16]. Это было дополнительно подтверждено на уровне ИГХ [85]. Подтверждая роль цитолитической активности в ответе на ИКТ, было показано, что ответ на терапию ассоциирован с экспрессией цитолитических маркеров, например, GZMA и PRF1 в опухолях с dMMR/MSI [86]. Несмотря на то, что было доказано, что CD8 + Т-лимфоциты вносят основной вклад в реализацию противоопухолевого ответа при применении ИКТ, экспрессия GZMA и PRF1 в опухолях с dMMR/MSI также была связана с высокими уровнями активированных CD4 + Т-кле-ток, γδ Т-клеток и макрофагов [84]. Это указывает на то, что для оптимального контроля опухоли и длительной выживаемости, наблюдаемой у этих пациентов, необходим скоординированный цитолитический иммунный ответ нескольких клеточных элементов.
Дополнительные иммунные контрольные точки
Дополнительные иммунные контрольные точки на Т-лимфоцитах могут нейтрализовать эффект терапии антителами к PD-1/PD-L1. Было показано, что иммунное микроокружение при КРР с dMMR/MSI может подавляться экспрессией не только известных ингибирующих контрольных точек, таких как PD-1, CTLA-4, но геном активации лимфоцитов 3 (LAG-3) и индуоламин 2,3-диоксигена-зой 1 (IDO-1) [29]. Это объясняет, почему некоторые формы КРР с dMMR/MSI ускользают от иммунного ответа человека и прогрессируют до 4 стадии и имеют первичную резистентность к мишеням анти-PD-1/PD-L1. Это также объясняет и эффективность применения комбинации ниволумаба и анти-LAG3 антитела релатлимаба при местнораспространенном раке ободочной кишки, что позволило достичь полных патоморфозов у 68% пациентов [87], аналогичный показатель достигается и при применении комбинации ниволумаба и анти-CTLA-4 антитела ипилимумаба [88].
Трансформирующий фактор роста бета (TGF-β)
TGF-β — сильный индуктор эпителиально-мезенхимального перехода, который ограничивает подвижность Т-клеток, увеличивает фиброз ткани, за счет стимуляции роста стромальных клеточных компонентов опухолевого микроокружения. Кроме того, высокие концентрации TGF-β в опухолевом микроокружении могут вызывать истощение Т-клеток (рис. 1) [89], что коррелирует с негативным прогнозом [90] и резистентностью к лечению ИКТ при КРР и dMMR/MSI фенотипом [91] в клинических исследованиях. Мутации в гене рецептора TGF-β II типа или его нижележащей мишени, SMAD4, могут нарушить механизм отрицательной обратной связи, тем самым приводя к повышению уровня TGF-β. Мутации и инактивация компонентов пути TGF-β чаще встречаются при MSI ассоциированном КРР, а активация его чаще наблюдается при MSS фенотипе, что частично объясняет связь этих опухолей с воспалением, не вовлекающим Т-клетки [89]. Изменения в передаче сигналов стромального TGF-β в доклинических исследованиях были связаны со снижением эффективности ИКТ [52]. Мутации гена SMAD4 являются неблагоприятным прогностическим признаком при КРР в целом [93], а снижение экспрессии белка SMAD4 как проявление мутации SMAD4 выявляется в 6–14 % случаев КРР с dMMR / MSI [94]. В настоящее время проводятся клинические исследования I/II фазы, направленные на таргетирование TGF-β с целью усиления ответа на терапию ИКТ.
Сигнальный путь WNT
Ген аденоматозного полипоза (APC), который относится к онкосупрессорам, играет ключевую роль в регуляции сигнального пути WNT/β-катенина. Одним из ключевых действий белка APC является образование комплекса с другими белками для разрушения β-катенина, что снижает его концентрацию в клетке (рис. 1). При биаллельной потере гена APC , которая наблюдается в 62% случаев КРР с MSS и 20% случаев заболевания dMMR/MSI [95], наблюдается накопление β-катенина и последующая активация сигнального пути WNT. Такое повышение уровня β-катенина связано с изменением Т-клеточного ответа и заметным снижением числа TILs независимо от микросателлитного статуса опухоли [95]. Таким образом, повышение активности WNT/β-катенин сигнального пути может приводить к снижению чувствительности опухоли к ИКТ в том числе и при dMMR/MSI.
КЛИНИЧЕСКИЕ, ПАТОМОРФОЛОГИЧЕСКИЕ И МОЛЕКУЛЯРНЫЕ ИЗМЕНЕНИЯ ПРИ КРР С dMMR/MSI, АССОЦИИРОВАННЫЕ
С РЕЗИСТЕНТНОСТЬЮ К ИКТ
Опухоли толстой кишки с dMMR/MSI обладают уникальным клиническим, патологическим и молекулярным профилем. Они часто связаны с правосторонней локализацией, муцинозным гистотипом, низкой степенью дифференцировки и высокой частотой встречаемости мутаций гена BRAF. При метастатическом заболевании, такие опухоли склонны к метастазированию в отдаленные лимфатические узлы и по брюшине [96]. Транскриптомно, большинство опухолей с dMMR/MSI относятся к категории CMS1-иммунному подтипу консенсусного субтипирования КРР, и характеризуются высокой мутационной нагрузкой, иммуногенной опухолевой сигнатурой, наличием специфических TILs (например, CD8 + цитотоксических Т-лимфоцитов, CD4 + Т-хелперов 1 и естественных киллеров) и благоприятным прогнозом на ранних стадиях КРР. Реже опухоли с dMMR/MSI могут попадать в категорию CMS3-метаболический подтип (16%), — который чаще встречается в опухолях с комутациями KRAS. В этой категории реже встречаются случаи с высокой мутационной нагрузкой и гиперметилированием генов и менее выражена инфильтрации опухоли иммунными клетками в сравнении с CMS1 подтипом. Еще меньший процент опухолей с MSI могут быть классифицированы как CMS4 мезенхимальный подтип, известный самым неблагоприятным прогнозом и активностью TGF-β сигнального пути, иммуносупрессивным микроокружением [97]. Это разнообразие экспрес-сионных профилей опухолей с dMMR/MSI также может объяснять резистентность к ИКТ.
Транскриптом опухоли
М.Ю. Федянин
A отмечалось большее число пациентов с первичной резистентностью к ИКТ (30% против 12% в кластере B и 8,1% в кластере C). Выживаемость без прогрессирования была значительно короче у пациентов из кластера A по сравнению с кластерами B и C (р < 0,001), (2-годичная ВБП — 33,5%, 80,5% и 78,3 % соответственно) [99].
В исследовании Esposito A. с соавторами провели дифференциальный анализ экспрессии генов между органоидами от пациентов, которые отвечали и не отвечали на ИКТ и выявили, что экспрессия гена REG4 обратно коррелирует с инфильтрацией и активацией CD8 + T-клетками. Также исследователи отметили, что экспрессия MUC1 и MUC5AC повышается при экспрессии REG4, а их белки формируют иммуносупрессивное опухолевое микроокружение. При этом аномальное гликозилирование муцинов на мембранах опухолевых клеток ведет к экспрессии атипичных эпитопов, способных индуцировать апоптоз специфических T-лимфоцитов. Нокаут REG4 приводил к снижению экспрессии MUC1 и галектинов — молекул с иммуносупрессивными свойствами, что указывает на активацию секреторной толерогенной программы как возможного механизма иммунного уклонения, опосредованного REG4. Требуется валидация данного биомаркера на большем клиническом материале.
Мутационные характеристики опухоли
Анализ уровня мутационной нагрузки (TMB) с помощью платформы Foundation Medicine в когорте из 22 пациентов с КРР и dMMR/MSI, получавших иммунотерапию, выявил пороговое значение между 37–41 мутаций/Мб для выявления ответивших и не ответивших (стабилизация или прогрессирование) на терапию ИКТ [101]. Авторы также пришли к выводу, что TMB 61,8 мут/Мб является 75-м процентилем для КРР с dMMR/MSI, после обследования более 800 опухолей с этим фенотипом в базе данных Foundation Medicine. Однако не во всех исследованиях данная закономерность была выявлена [102]. В связи с чем дальнейшие исследовании сконцентрировались на оценки влияния мутаций конкретных генов на эффективность ИКТ.
Так, из выборки из 16 пациентов были сформированы две группы — группа с ВБП более 6 месяцев (n = 9) и группа с резистентностью с ВБП менее 6 месяцев (n = 7). Мультимодальный анализ, включавший геномику опухоли (панель NGS на 431 ген) и иммунное микроокружение (маркеры CD3, CD8 + , FOXP3, PD-L1), выявил, что мутации гена CTNNB1 были обнаружены у 2 из 7 резистентных и отсутствовали у ответчиков. Напротив, биаллельные мутации ARID1A обнаруживались только в группе пациентов с ВБП более 6 месяцев (4 из 9 пациентов). Авторы исследования также показали, что опухоли с мутацией ARID1A обладают наибольшей плотностью инфильтрации иммунными клетками и экспрессией PD-L1, в то время как опухоли с мутацией CTNNB1 -низкой [102]. ARID1A относится к комплексу ремоделирования хроматина SWItch/Sucrose
Non-Fermentable (SWI/SNF). Описано белок-белковое взаимодействие между ARID1A и MSH2, и подавление экспрессии ARID1A приводит к снижению функциональной активности системы MMR [103]. Поскольку биаллельные мутации приводят к отсутствию экспрессии белка ARID1A, как следствие более выраженное нарушение в системе MMR с точки зрения репарации ДНК приведет к более высокому уровню неоантигенов, что может определять более высокую эффективность анти-PD-1/PD-L1 антител. Кроме того, опухоли с биаллельными мутациями ARID1A показали высокий уровень экспрессии PD-L1 и высокую плотность субпопуляций Т-клеток. В предыдущих исследованиях также описывалась такая иммунная контекстура для опухолей с мутацией ARID1A, без указания гетерозиготности [104].
Терапевтические неудачи при лечении ИКТ также могут быть связаны и с эпигенетическими изменениями, такими как модификация гистонов (например, фосфорилирование и деацетиляция) в промоторной области гена PD-L1, метилирование ДНК и сигнатуры микроРНК, которые приводят к формированию специфического иммунотолерантного микроокуржения — присутствие Т-клеток в строме, но их отсутствие в опухолевом компоненте [109].
Патоморфологические характеристики
Одной из патоморфологических особенностей опухолей с dMMR/MSI является зачастую наличие муцинозного компонента. В исследовании Kim с соавторами было показано, что наличие муцинозного компонента при КРР с MSI может быть ассоциировано с меньшим шансом достижения ответа на ИКТ [110]. Одним из объяснений может быть формирование перитуморального слизистого пула, который действует как природный физический барьер, затрудняющий инфильтрацию эффекторными Т-клет-ками и проникновение противоопухолевых препаратов.
Получается, что для пациентов с MSI необходимо дополнительная стратификация не только на основе степени инфильтрации иммунными клетками, но и по содержанию муцинозного компонента. Учитывая, что данный подтип опухолей часто экспрессирует COX-2 [111], предлагается изучать эффективность комбинированных подходов, включающих антитела к PD-1, антиангиогенные препараты и ингибиторы COX-2 [112].
Среди патоморфологических признаков, ассоциированных с эффективность ИКТ при КРР с dMMR/MSI также уделяется внимание утрате экспрессии белка CDX-2. Данная картина связана с повышенным риском прогрессирования заболевания, инвазией сосудов, метастазированием и агрессивным клиническим поведением при MSS [113,114]. Было показано, что CDX-2 усиливает экспрессию хемокина CXCL14 путем активации соответствующего энхансера, что способствует привлечению и активации NK-клеток, дендритных и Т-клеток, усиливая их миграцию и цитотоксическую активность [115]. Несмотря на ограниченный размер выборки пациентов с КРР и dMMR/MSI, в исследовании Ziranu P с соавторами отмечено, что в случае с отрицательной экспрессией CDX-2 выявлялось быстрое прогрессирование заболевания при терапии пембролизу-мабом. Перспективными видится исследования, включающие анализ опухолево-инфильтрирующих лимфоцитов и экспрессии CXCL14 в микроокружении опухоли, а также оценку экспрессии PD-L1 у пациентов с различным статусом CDX-2. Особенностью CDX-2 является возможность использовать его как доступный и экономичный прогностический маркер с помощью иммуногистохимического анализа. [116].
Учитывая важность качества мутаций для ответа на ИКТ и высокую иммуногенность dMMR/MSI-ассоцииро-ванных мутаций со сдвигом рамки считывая, может быть полезна оценка степени выраженности MSI с помощью MSIsensor score, который количественно оценивает число нестабильных микросателлитов [117]. Так мультиплексный геномный MSI-сигнатурный профиль с мутациями в 19 генах, содержащих микросателлиты, ассоциируется с ответом на ИКТ у пациентов при КРР [118].
Микробиота толстой кишки
Связь между микробиотой толстой кишки и возникновением, прогрессированием и клиническим прогнозом при различных ЗНО и КРР, в частности, хорошо известна. При КРР большинство данных говорят о взаимосвязи канцерогенеза с Fusobacterium nucleatum [119], которая чаще встречается в случаях с MSI или мутациях гена BRAF [120]. При этом пациенты с КРР, микробиом которых обогащен Fusobacterium nucleatum, с большей вероятностью получают пользу от терапии ИКТ. Механизм заключается в том, что F. nucleatum повышает чувствительность опухоли за счет индуцирования экспрессии PD-L1 и увеличения инфильтрации CD8 + Т-лимфоцитов. Хотя не во всех опухолях с MSI при наличии F. nucleatum отмечается увеличение TILs [121]. Среди других бактерий выделяют Bifidobacterium pseudolongum, — важный комменсальный микроорганизм, который стимулирует активацию T-хелперов 1 типа, что значительно повышает чувствительность моделей КРР у мышей к терапии ИКТ [122]. Кроме того, штаммы Bacteroides_sp. _CAG:927, Bacteroidales_S24–7, Akkermansi muciniphila, Bacteroides acidifacins и лизаты Lactobacillus acidophilus также усиливают чувствительность КРР к ИКТ в доклинических моделях [123,124].
В клинических исследованиях среди микроорганизмов, вероятно способствующих резистентности, выделяют род Bifidobacterium. При этом B. adolescentis, B. pseudocatenulatum демонстрировали ассоциацию с первичной резистентностью, тогда как B. breve — со вторичной резистентностью к ИКТ. Эти находки говорят о вариабельности воздействия разных видов, что связано с их биологическими различиями по метаболизму и специфичности к хозяину. Кроме того, различия в составе микробиоты также наблюдались у пациентов, не реагирующих на ИКТ, и с приобретенной резистентностью, в частности, такие таксоны как Barnesiella и Parabacteroides были более представлены на старте и сохранялись на высоком уровне во время терапии, что коррелирует с их известными иммуно-модуляторными функциями [125]. В этой же работе авторы провели дополнительный мультиомикс-ный анализ влияния микрофлоры кишки и активностью ИКТ при КРР с dMMR/MSI. Выявлено повышение уровня некоторых короткоцепочечных жирных кислот (КЦЖК) у пациентов с ответом на ИКТ, включая бутират. Бутират, как наиболее изученная КЦЖК, нарушает цикл Кребса в CD8 + T-клетках, отвлекая его от гликолитического пути, что ведет к усилению памяти активированных CD8 + T-клеток. При этом воздействие бутиратом напрямую усиливает противоопухолевую цитотоксическую активность CD8 + T-клеток in vitro и in vivo через IL-12 сигнальный путь. Помимо бутиратa, также было выявлено значительное обогащение каприновой кислоты и изобутирата в когорте с dMMR/MSI с ответом на ИКТ. В то время как механизмы влияния каприновой кислоты и изобутирата на иммунитет еще недостаточно изучены, обнаружение бактерий рода Porphyromonadaceae, продуцирующих эти КЦЖК, может служить дополнительным доказательством их роли в позитивном влиянии микробиоты на иммунотерапию. Авторы дополнительно разработали модели машинного обучения для оценки пригодности микробиомных биомаркеров в качестве предикторов ответа на ИКТ, которые продемонстрировали высокую точность при валидации на независимом наборе данных [125].
Трансплантация фекальной микробиоты от пациентов с меланомой, ответивших на ИКТ, пациентам с первичной резистентностью к ИКТ способна индуцировать ответ и/или долгосрочную стабилизацию заболевания при повторном назначении ИКТ [126]. Последний терапевтический подход в настоящее время исследуется у паци-
М.Ю. Федянин ентов с мКРР и dMMR/MSI с первичной резистентностью к терапии ИКТ в клиническом исследовании II фазы. Тем не менее, все еще необходимо определить, играет ли аномальная микробиота кишечника ключевую роль в иммунном ускользании dMMR/MSI-ассоциированном КРР.
Immunoscore
Опухолевые клетки, иммунные клетки и опухолевая строма, взаимодействуя друг с другом, создают различимую иммунную сигнатуру при различных злокачественных новообразованиях [127]. Как упоминалось ранее, КРР с dMMR/MSI содержит большое количество инфильтрирующих опухоль лимфоцитов (TILs), в частности, состоящих из CD8 + цитотоксических Т-клеток с потенциальной противоопухолевой активностью и Т-хелперов с секрецией ИФН-γ. Высокая плотность цитотоксических Т-лимфоцитов в КРР связана с лучшей безрецидивной и общей выживаемостью [128]. Это привело к разработке теста под названием Immunosore (IS), который количественно оценивает плотность CD3 + и CD8 + лимфоцитов в опухолевом центре и на его инвазивном крае (диапазон: 0–4). Данные IS являются независимым прогностическим фактором в отношении безрецидивной выживаемости и общей выживаемости [129]. При MSI-ассоциированном КРР в 56% случаев отмечается очень высокий уровень TILs по IS, в отличие от 26% случаев MSS подтипа [130]. Исследование с участием пациентов с dMMR/MSI показало, что более высокий IS ассоциирован с лучшим ответом на терапию ИКТ пембролизумабом [131].
Другая группа исследователей, исходя из предположения, что независимо от того, есть или нет dMRR/MSI, реализация ответа при применении ИКТ не будет проявляться при недостаточной инфильтрации опухоли активными CD8 + Т лимфоцитами. Это легло в основу разработки универсального алгоритма определения степени инфильтрации CD8 + клетками опухоли и их функциональной активности. В данной работе разработан вычислительный метод TMEPRE, который измеряет два фактора микроокружения опухоли, TME1. TcellInfiltration — степень инфильтрации CD8 + Т-клетками, и TME2. TcellResponse — способность инфильтрирующих CD8 + Т-клеток отвечать на анти-PD-1 антитела. TMEPRE разрабатывался без использования данных об ответе на ИКТ или выживаемости и отражает биологию микроокружения опухоли КРР. Метод был валидирован на трёх наборах данных пациентов, получавших ИКТ. Примерно у половины пациентов с КРР и MSI, которые не ответили на терапию ИКТ показатели TME1. TcellInfiltration были снижены. Авторы рекомендуют для таких пациентов — комбинированные варианты иммунотерапии [132]. Генетические маркеры компоненты TME2. TcellResponse экспрессируются как на CD8 + Т-клетках, так и других иммунных клетках микроокружения. Среди них CCL5, CD2, CD48, CD84, FAM78A, HCST и IL21R — высоко-экспрессируемые в CD8 + Т-клетках. Высокая экспрессия
HAVCR2 и PDCD1 у пациентов с прогрессированием на ИКТ связана с терминальным истощением CD8 + Т-лимфоцитов. Другие маркеры TME2. TcellResponse (CIQB, CIQC, KMO, FCGR1A, FCGR1B, FCER1G) также гиперэкспрессированы у пациентов с прогрессированием и свидетельствуют о наличии миелоидных супрессорных клеток в микроокружении, подавляющих иммунный ответ. Примерно у 50% пациентов с КРР и MSI без ответа на ТКИ высокий TME1. TcellInfiltration сочетается с низким TME2. TcellResponse. Для этих пациентов возможна комбинированная терапия анти-PD1 с препаратами, нацеленными на миелоидные супрессорные клетки, или с препаратами, воздействующими на коэкспрессируемые ингибиторные рецепторы. Таким образом, метод TMEPRE помогает персонализировать иммунотерапию у пациентов с колоректальным раком и dMMR/MSI, учитывая разнообразие микроокружения опухоли [132].
Ангиогенез
Предклинические исследования показали тесную связь между ангиогенезом опухоли и иммуносупрессией: аномальная сосудистая сеть способствует уклонению опухоли от иммунного надзора, затрудняя транспорт иммунных клеток в опухолевую среду. Антиангиогенная терапия способна нормализовать сосудистую структуру, улучшить оксигенацию, увеличить инфильтрацию иммунных клеток и преобразовать иммуносупрессивное микроокружение опухоли в иммуноподдерживающее, что может благоприятно влиять на эффективность иммунотерапии [134,135]. Многочисленные клинические исследования подтвердили эффективность и безопасность комбинации ингибиторов контрольных точек с антиангиогенными препаратами при различных солидных опухолях. Аналогичные положительные результаты наблюдаются и у пациентов с КРР и dMMR/MSI. Ретроспективное исследование показало, что пациенты с прогрессированием после лечения ИКТ демонстрировали ответы при терапии, включающей как ИКТ, так и антиангиогенные препараты [136]. Более того описаны наблюдения, при которых данная опция может приводить к эффектам в случае сочетания КРР с dMMR/MSI и мутацией KRAS [137,138], в отличие от монотерапии ан-ти-PD-1 антителами.
Синдром Линча в сравнении со спорадической MSI
Синдром Линча или наследственный неполипозный колоректальный рак (HNPCC) — это аутосомно-доминантное наследственное заболевание, вызванное герминальной мутацией в одном из вышеупомянутых генов системы MMR или мутацией гена EPCAM, на долю которого приходится примерно 3% всех КРР [139]. Возможным объяснением преимущества выживаемости при применении ИКТ, помимо более молодого возраста пациентов с СЛ в сравнении со спорадическим КРР, может быть более высокий уровень соматических мутаций и неоантигенов, что, как предполагается впоследствии, вызывает более частые иммунные ответы. И если Le с соавторами не выявил существенных различий в частоте ответов на ИКТ при КРР на фоне СЛ или спорадическим dMMR/MSI [140], то в исследовании CHECKMATE-142 частота ответов при синдроме Линча составила 71% против 48% при спорадическом КРР с dMMR/MSI [141]. Также и в исследовании Chalabi с соавторами неоадъювантная иммунотерапиия при КРР с dMMR/MSI приводила к лучшим показателям полного патоморфологического ответа у пациентов с СЛ (78%) в сравнении со спорадическим dMMR/MSI-ассоции-рованном КРР (58%) [142].
Анализ базы данных США пациентов с КРР, ассоциированных с СЛ, выявил, что среди умерших 46% пациентов погибли от опухолей с dMMR/MSI, из них 70% пациентов имели прогрессирование заболевания на фоне иммунотерапии, 10% умерли от токсичности иммунотерапии, а 15% от других осложнений лечения [143]. В большинстве работ, посвященных СЛ, показана различная чувствительность опухолей к ИКТ в зависимости от локализации мутации в генах MMR. Так наихудшие результаты применения ИКТ были у пациентов с локализацией герминальных мутаций в генах MSH6 и PMS2. Поражение данных генов было ассоциировано с меньшим уровнем MSI score по данным NGS, а при PMS2 и меньшим уровнем мутационной нагрузки [144]. Интересно, что при спорадических опухолях может наблюдаться обратная ситуация — в относительно большой когорте пациентов с КРР и dMMR/MSI, которым проводилась терапия ИКТ, была выявлена более короткая общая выживаемость при потере компонентов комплекса MutL (потеря экспрессии MLH1 и PMS2) по сравнению с потерей MutS (потеря экспрессии PMS2 и MSH6) медиана 36 месяцев против не достигнута, р = 0,011) [145]. Изолированная потеря PMS2 и MSH6 относится к необычным фенотипам, которые, согласно ретроспективному исследованию пациентов с опухолями ЖКТ и dMMR/MSI, требуютусиления иммунотерапевтических подходов [146].
Данные находки привели к мысли, что если в основе dMMR/MSI лежат мутации в генах репарации, то эффект на ИКТ лучше, в сравнении с эпигенетическим выключением генов. Данная гипотеза была проверена в крупном ретроспективном исследовании из США. Авторы работы создали 2 выборки пациентов — из MSK (2014–2025): n = 2001 (на ИКТ n = 779), и выборка Caris для валидации находок: n = 13043 (на ИКТ n = 4 070). По данным анализа в группе MSK: у 63% пациентов в опухоли выпадала экспрессия MLH1/PMS2 (из них 82% эпигенетическое выключение MLH1), 21 % MSH2/MSH6, 6% MSH6, 5% PMS2. В выборке Caris: 75% MLH1/PMS2 (85% эпигенетически), 11 % MSH2 / MSH6, 5 % MSH6, 7 % PMS2. При одиночной потере экспрессии PMS2 или MSH6 часто, по данным NGS, отмечались низкий уровень MSI, меньшее число неоанти- генов, слабее T-клеточный ответ и снижение чувствительности к ИКТ [147]. При эпигенетическом выключении MLH1 развивается иной мутагенез/динамика антигенности, чем при мутациях в гене MLH1, что отражается на ответе при применении ИКТ. В другом исследовании, уже при раке эндометрия с dMMR, связанного с СЛ частота ответов при применении пембролизумаба составлял 100% и только 44% у пациенток с эпигенетическим dMMR. Соотношения 3-летних ВБП и ОВ составили 100% против 30% и 100% против 43% соответственно [148]. То есть, некоторые неоантигены, на которые нацелены CD8 + Т-лимфоциты, могут отсутствовать при опухолях с эпигенетическим dMMR. Это также может быть связано с временным эпигенетическим подавлением гена MLH1, когда опухолевые клетки могут сохранять экспрессию белка MMR. Кроме того, микроокружение и активность провоспалительных сигнальных путей могут различаться между опухолями, связанными с СЛ и эпигенетическими перестройками генов MMR. Так, при раке эндометрия степень инфильтрации эффекторных CD8 + Т-клеток коррелировала с ответами на ИКТ при СЛ, в то время при эпигенетическом dMRR такая корреляция обнаружена только для активированных CD16 + NK-клеток [149]. Следует отметить, что при опухолях синдрома Линча различий в эффективности между монотерапией анти-PD-1 антител и комбинированной с анти-CTLA-4 иммунотерапией не отмечено, хотя при спорадическом раке с dMMR/MSI комбинация более эффективна.
Таким образом, механизмы, которые опосредуют ускользание от иммунитета и устойчивость к иммунотерапии при опухолях dMMR, являются многофакторными. Полное понимание этих механизмов в экологическом контексте их микроокружения на протяжении всего развития и прогрессирования опухоли имеет важное значение для разработки новых методов лечения, которые улучшат результаты клинических вмешательств при КРР с dMMR/MSI.
ПОДХОДЫ К ПРЕОДОЛЕНИЮ РЕЗИСТЕНТНОСТИ К ИКТ
Из клинически изученных терапевтических подходов, а таких было немного при КРР с dMMR/MSI с прогрессированием при применении ИКТ, сконцентрируемся только на ключевых вариантах. В литературе представлены клинические наблюдения по возможному достижению ответа при назначении комбинации анти-PD-1 и анти-CTLA-4 антител в случае прогрессирования на монотерапии анти-PD-1 [150].
Также предклинические эксперименты показали, что для опухолей с dMMR/MSI одним из ключевых ферментов, которые поддерживают стабильность генома при высоком уровне накопления мутаций и формирования динуклео-тидных повторов, является хеликаза Вернера (WRN). Если накаутировать WRN, то клетки гибнут— феномен синтети-
М.Ю. Федянин ческой летальности [151]. На конференции AACR 2025 представили результаты I фазы применения ингибитора WRN (RO7589831) при прогрессировании MSI-ассоциированных опухолей на ИКТ. Дозолимитирующая токсичность не достигнута. Несмотря на то, что у практически половины пациентов отмечался метаболический эффект по данным ПЭТ, рентгенологические ответы зарегистрированы лишь у 14,3%, контроль болезни — у 65,7%, при медиане длительности терапии 19 недель [152]. На ESMO 2025 представлены результаты исследования I/Ib фазы с препаратом HRO761 аналогичного действия при MSI/dMMR солидных опухолях при прогрессировании на иммунотерапии. Всего включено 47 пациентов, большинство — 27-с опухолями толстой кишки. Частота ответов невысокая — 8,6% (при КРР 10,5%), частота контроля болезни 68,6% (при КРР 84,2%), медиана ВБП 5,6 мес (КРР — не достигнута, вне КРР — всего 2,1 мес) [153].
ВЫВОДЫ
Внедрение ИКТ изменило терапевтический ландшафт лечения метастатического и резектабельного КРР с dMMR/MSI. Тем не менее, гетерогенность ответов, когда у подгруппы пациентов наблюдается резистентность или прогрессирование, подчеркивает необходимость более глубокого понимания основных механизмов развития иммунного ответ на ИКТ при данном подтипе опухолей. Геномная и транскриптомная характеристика показали, что КРР с dMMR/MSI иммунологически неоднородны, несмотря на наличие сопоставимого уровня TMB. Большинство из них сильно инфильтрированы иммунными клетками, но существуют также опухоли с низкой инфильтрацией иммунными клетками, которые связаны с муцинозным гистотипом, мутациями гена KRAS и активацией Wnt/Notch сигнального пути, большим размером опухоли, отдаленным метастазированием или ранним рецидивом и низкой чувствительностью к ИКТ. Кроме этого, такие факторы, как микроокружение опухоли, роль различных иммунных клеток, генетические изменения и влияние микробиоты кишки, играют роль в модуляции ответа на ИКТ и развитии приобретенной резистентности опухоли. Нельзя забывать и о потенциальной ошибочной диагностике статуса dMMR/MSI, внутриопухолевой гетерогенности, а также различии между синдромом Линча и спорадическим MSI, что также может компрометировать эффективность иммунотерапии и создает проблемы в клиническом ведении таких пациентов.


