Меланизация полиаминофенолов в процессе биотрансформации парацетамола клетками Rhodococcus ruber ИЭГМ 77
Автор: Коротаев М.Ю., Вихарева Е.В., Ившина И.Б.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2016 года.
Бесплатный доступ
Методами C ЯМР -спектроскопии и хромато-масс-спектрометрии установлено, что в составе нерастворимых в воде продуктов, образующихся в процессе биотрансформации парацетамола клетками Rhodococcus ruber ИЭГМ 77, присутствуют производные индола и бензофурана. Предложен механизм образования сопряженных индольных и бензофурановых циклических систем в результате последовательной ферментативной окислительной поликонденсации аминофенольных соединений. Образующиеся полиаминофенолы преобразуются в меланиноподобные соединения. По нашим данным, молекулы по-лиаминофенолов, а также индольные и бензофурановые фрагменты в химической структуре меланино-подобных соединений содержат симметричные ("Sym") и асимметрические ("Asym") участки, включающие ароматические и хиноидные кольца с эквивалентными заместителями в пара- и мета-положении соответственно. Впервые обоснованная возможность ферментативной меланизации поли-аминофенолов клетками R. ruber ИЭГМ 77 рассматривается с позиции гипотезы гумификации.
Парацетамол, биотрансформация, актинобактерии рода rhodococcus, хромато-масс-спектрометрия, 13c ямр-спектроскопия
Короткий адрес: https://sciup.org/147204765
IDR: 147204765 | УДК: 579.695
Текст научной статьи Меланизация полиаминофенолов в процессе биотрансформации парацетамола клетками Rhodococcus ruber ИЭГМ 77
Биологическая деструкция лежит в основе биотехнологических способов утилизации органических, в том числе фармацевтических, отходов [Wu, Zhang, Chen, 2012]. В качестве биодеструкторов широко ис пользуются почвенные микроорганизмы, выделяемые из природных сред [De Gusseme et al., 2011; Zhang et al., 2013]. Наряду с этим биодеструкция органических соединений является естественным процессом, протекающим в природе при трансформации растительных остатков в гуминовые вещества. Последние представляют собой смесь высокомолекулярных азотсодер-
жащих соединений ароматической и алифатической природы.
Согласно данным, представленным в работе F.J. Stevenson [1994], одним из механизмов образования гуминовых веществ является ферментативная окислительная поликонденсация хиноидных соединений с аминокислотами. Наличие азо-метиновых связей в химической структуре гумусовых кислот подтверждает данный механизм [Орлов, 1990]. Однако процессы гумусообразования не исчерпываются одними только химическими взаимодействиями карбонильных и аминогрупп реагирующих соединений, иначе в качестве продуктов реакции идентифицировались бы только производные полиаминофенолов и полифеноксазинов, последние из которых присутствуют в молекулах гуминовых кислот [Орлов, 1990; Thorn, Mikita, 1992]. Отличительной особенностью гумификации является образование как азот-углеродных, так и углерод-углеродных полимеробразую-щих связей [Орлов, 1990]. Следовательно, биохимическое взаимодействие хинонов с соединениями, содержащими аминогруппу, гипотетически может привести к синтезу индольного кольца, представленного в молекулах гуминовых кислот и родственных им меланинов [Орлов, 1990; Thorn, Mikita, 1992; Bosetto et al. 1997; Subianto, 2006]. Последние являются продуктами полимеризации индол-5,6-хинона и 5,6-дигидроксииндол-2-карбо-новой кислоты, образующихся при окислении тирозина и триптофана.
В ранее проведенных нами исследованиях показано, что биодеструкция парацетамола клетками Rhodococcus ruber ИЭГМ 77 сопровождается образованием черного аморфного осадка полимерной природы [Коротаев и др., 2015]. В соответствии с данными элементного анализа, спектрофотометрии, ИК- и 'Н ЯМР-спектроскопии продукты, содержащиеся в полученном осадке, представляют собой полиаминофенолы, структурные единицы которых включают остатки 2,5-диаминобензол-1,4-диола, 4,6-диаминобензо л-1,3-диола, 2,5-дигидрокси- 1,4-бензохинондиимина, 2-амино-5 -гидрокси-1,4-бензохинонимина [Коротаев и др., 2016]. Однако данные методы не позволили получить информацию о характере углерод-углеродных связей в образующихся нерастворимых продуктах (НП) биотрансформации парацетамола. Для установления в структуре НП полимеробразующих углерод-углеродных химических связей и более детального выяснения механизмов биотрансформации парацетамола родококками с позиций общей теории гумификации целесообразно исследование данного осадка методами 13С ЯМР спектроскопии и хромато-масс-спектрометрии. Целью настоящей работы является оценка возможности биосинтеза меланин-родственных соединений (меланизации образующихся полиаминофенолов) при биотрансформации парацетамола клетками R. ruber ИЭГМ 77.
Материалы и методы исследований
Для биодеструкции парацетамола (Аныцо Лу-ань Фармасьютикал Ко., Лтд., Китай) использовали штамм R. ruber ИЭГМ 77 из Региональной профилированной коллекции алканотрофных микроорганизмов (официальный акроним коллекции ИЭГМ, номер во Всемирной федерации коллекций культур WDCM 768, . Выделение осадка из постферментационной среды осуществляли в соответствии с условиями, описанными в работе [Ivshina et al., 2006].
Спектроскопия ЯМР 13С
Спектры 13С ЯМР НП записывали в ДМСО-б6 на спектрометре ЯМР Broker DRX-500 (Broker BioSpin GmbH, Германия) с рабочей частотой 125.8 МГц. Химические сдвиги представляли относительно Me4Si.
Хромато-масс-спектрометрия
Для анализа использовали пробы, представляющие собой (1:12,78)=1/(1+12.78) = 7.3% (масс.) растворы НП в этилацетате. Хроматограммы и масс-спектры НП снимали на газовом хроматографе Agilent 7890А с масс-спектрометрическим детектором Agilent 5975С на капиллярной неполярной колонке HP-5ms (Agilent Technologies, США). Условия анализа: ионизация методом электронного удара (70 eV); объём вводимой пробы - 1 мкл; скорость потока газа-носителя (гелий) - 1 мл/мин.; без деления потока; температура испарителя - 280°С; температура колонки программируемая (в течение первых 5 мин 70°С, затем повышение до 310°С со скоростью 18°С в 1 мин. и выдерживание на данном уровне 10 мин.); диапазон анализируемых масс - 40-400 m/z; задержка работы детектора на выход растворителя -3.5 мин.
Результаты исследования и их обсуждение
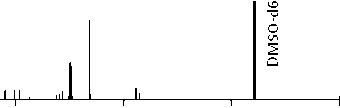
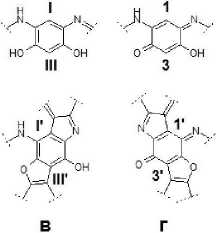
Полученные спектры 13С ЯМР НП подтверждают наличие в НП полиаминофенольных и феноксазиновых фрагментов и свидетельствуют о присутствии индольных и бензофураноидных циклических систем (рис. 1, 2): 92.98 (Сь СЦ; 93.92 (Сп, С2); 94.53 (Сш, С3); 115.61 (Сп,2), 115.64 (Сг.гж.з); 124.63, 125.02, 125.41 (C-N); 150.75, 154.63, 154.86, 155.39 (С-О); 148.37, 161.47 (C=N); 177.34 (С=О).
Результаты хромато-масс-спектрометрического исследования растворов НП в этилацетате пред- ставлены на рис. 3 и 4.
На хроматограмме (рис. 3) отмечается выраженный пик со временем удерживания 22.60 мин с масс-спектром (рис. 4). включающим следующие характеристические ионы, т г (%): 41.00 (23.03); 55. 00 (9.56); 57.20 (100.00); 91.00 (10.31); 117.00 (5.10); 131.20 (5.93); 147.20 (10.69); 191.20 (12.37); 316.40 (33.94). Идентифицировать по библиотеке масс-спектров данное соединение не удалось. Тем не менее, гипотетические структурные фрагменты, установленные методом 13С ЯМР-спектроскопии (см. рис. 2), объясняют механизм фрагментации компонента НП со временем удерживания 22.60 мин. (рис. 5).
150 100 50 0
Химический сдвиг, м.д.
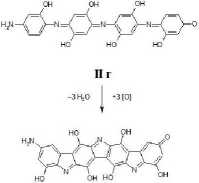
Как видно из рис. 5, характеристические ионы в масс-спектре компонента НП со временем удерживания 22.60 мин. являются продуктами фрагментации конденсированной системы, состоящей из индольных колец. В соответствии с данными, представленными в работах [Коротаев и др., 2016; Ivshina et al., 2006], биотрансформация парацетамола родококками осуществляется по пути I и II, при реализации которых образуются асимметричные (‘Msym”) и симметричные (“Sym”) участки молекул полиаминофенолов 1г и Пг соответственно (рис. 6).
Abundance
200000 0
57,2
41,0 э1 с д
191,2
„^1.0 147,2
5Ъл 1Э12
117,0
m/z—> 30,00 130,00 230,00 330,00 430,00
Рис. 4. Масс-спектр компонента НП со временем удерживания 22.60 мин.
Рис. 1. Спектр 13С ЯМР НП (ДМСО-а6, 125.8 МГц):
39.64,39.80, 92.98, 93.92, 94.53, 115.35, 115.40, 115.61, 115.64, 122.78, 124.12, 124.63, 124.87, 125.02, 125.41, 125.76, 128.64, 129.81, 131.12, 143.80, 148.37, 150.75, 154.63, 154.86, 155.39, 161.47, 177.34, 178.89
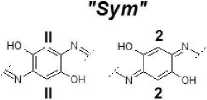
"Asym"
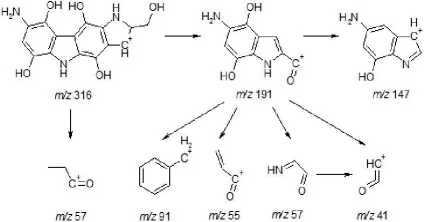
Рис. 5. Фрагментация и характеристические ионы компонента НП со временем удерживания 22.60 мин.
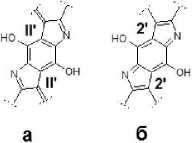
Рис. 2. Структурные фрагменты молекул НП, представленные остатками:
а - 2,5-диаминобензол-1,4-диола; б - 2,5-дигидрокси-1,4-безохинондиимина; в - 4,6-диаминобензол-1,3-диола; г - 2-амино-5-гидрокси-1,4-бензохинонимина

Abundance
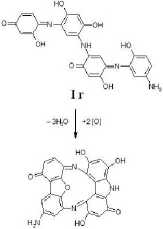
Рис. 6. Предполагаемая схема меланизации полиаминофенолов (путь I и II)
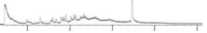
3,50 7.00 10,5014,0017,5021.00 24,502.6,00
Рис. 3. Хроматограмма раствора НП в
этилацетате
Вероятно, в процессе дальнейшей биотрансформации родококками уАкупГ и “Sym" участки молекул полиаминофенолов подвергаются меланизации с образованием полииндолобензофурановых
и полииндольных циклических конденсированных систем соответственно.
Впервые обоснованную нами возможность ферментативной меланизации полиаминофенолов клетками R. ruber ИЭГМ 77, по-видимому, можно рассматривать с позиции образования гуминопо-добных веществ (гумификации).
Заключение
Молекулы продуктов, получаемых при биологической трансформации парацетамола клетками Rhodococcus ruber ИЭГМ 77, включают аминофе-нольные и феноксазиновые, а также индольные и бензофурановые фрагменты. Таким образом, данные продукты имеют гуминоподобную природу и образуются в результате ферментативной меланизации полиаминофенолов.
Работа выполнена при частичной поддержке Комплексной программы Уральского отделения РАН (проект 15-12-4-10) и гранта Российского научного фонда (14-14-00643).
Список литературы Меланизация полиаминофенолов в процессе биотрансформации парацетамола клетками Rhodococcus ruber ИЭГМ 77
- Коротаев М.Ю. и др. Химическая структура осадка, образующегося в процессе биотрансформации парацетамола клетками Rhodococcus ruber ИЭГМ 77//Биофармацевтический журнал. 2016. Т. 8, № 1. С. 13-19
- Коротаев М.Ю. и др. Определение средней молекулярной массы нерастворимых продуктов биодеструкции парацетамола клетками Rhodococcus ruber ИЭГМ 77//Фундаментальные исследования. 2015. № 2, Ч. 26. С. 58505854
- Орлов Д. С. Гумусовые кислоты почв и общая теория гумификации. М.: Изд-во МГУ, 1990. 325 с
- Bosetto M. et al. Study of the humic-like compounds formed from L-tyrosine on homoionic clays//Clays Minerals. 1997. Vol. 32. P. 341-349
- De Gusseme B. et al. Degradation of acetaminophen by Delftia tsuruhatensis and Pseudomonas aeruginosa in a membrane bioreactor//Water Research. 2011. Vol. 45. P. 1829-1837
- Ivshina I.B. et al. Catalysis of the biodegradation of unusable medicines by alkanotrophic rhodococci//Applied Biochemistry and Microbiology. 2006. Vol. 42, № 4. P. 392-395
- Stevenson F.J. Humus Chemistry: Genesis, Composition, Reactions. New York: John Wiley & Sons, 1994. 512 p
- Subianto S. Electrochemical Synthesis of Melanin-Like Polyindolequinone. Thesis of dissertation. -Brisbane St Lucia: The University of Queensland, 2006. 197 p
- Thorn K.A., Mikita M.A. Ammonia fixation by humic substances: a nitrogen-15 and carbon-13 NMR study//The Science of the Total Environment. 1992. Vol. 113. P. 67-87
- Wu S., Zhang L., Chen J. Paracetamol in the environment and its degradation by microorganisms Applied Microbiology Biotechnology. 2012. Vol. 96. P. 875-884
- Zhang L. et al. Degradation of paracetamol by pure bacterial cultures and their microbial consortium//Applied Microbiology and Biotechnology. 2013. Vol. 97, № 8. P. 3687-3698


