Мелатонин как перспективный фактор коррекции кишечного микробиома при воспалительных заболеваниях кишечника
Автор: Осиков М.В., Гречишкин М.В., Шишкова Ю.С., Ильиных М.А.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Иммунология
Статья в выпуске: 3, 2023 года.
Бесплатный доступ
Воспалительные заболевания кишечника (ВЗК) включают язвенный колит и болезнь Крона. Этиология и патогенез ВЗК остаются до конца не ясными, наиболее распространенная гипотеза заключается в том, что аномальный иммунный ответ против микробиома кишечника запускается факторами окружающей среды у генетически предрасположенных людей. Недостатком препаратов первой линии терапии при ВЗК является возникновение побочных эффектов более чем у 30% пациентов. В связи с этим актуальна разработка новых безопасных лекарственных средств, действующих преимущественно локально. Цель работы - проанализировать современные данные о механизмах и эффектах воздействия на микробиом кишечника мелатонина в контексте возможного применения при ВЗК. Мелатонин (МТ) - биологически активное вещество, синтезируется в организме из триптофана, реализует свои эффекты через МТ-зависимые и МТ-независимые рецепторы, которые находятся в клеточной мембране и ядре. МТ участвует в регуляции циркадных ритмов, обладает антиоксидантным и иммуномодулирующим действием. При экспериментальном моделировании ВЗК и в клинических условиях МТ уменьшает выраженность воспалительного процесса в стенке толстой кишки за счет прерывания процессов перекисного окисления липидов и инактивации свободных радикалов, а также за счет действия через специфические рецепторы на функцию клеток крови лимфоидных органов. МТ при ВЗК приводит к качественному и количественному изменению кишечного микробиома, устранению признаков дисбиоза, увеличению количества продуцентов короткоцепочечных жирных кислот - Actinomycetota (Actinobacteria) и уменьшению количества бактерий, которые повышают проницаемость кишечного барьера - Bacteroidota (Bacteroidetes). Предположительно МТ оказывает бактериостатический эффект, связывая свободное железо и действуя на сигнальные пути NF-kB и STAT1, что может быть фактором коррекции дисбиоза толстой кишки при ВЗК. Данные о влиянии МТ на состав кишечного микробиома являются предпосылкой для проведения дальнейших доклинических исследований и возможного применения мелатонина при ВЗК в клинической практике.
Воспалительные заболевания кишечника, мелатонин, кишечный микробиом, коррекция
Короткий адрес: https://sciup.org/147241927
IDR: 147241927 | УДК: 616.34-002.2:612.017./.062:612.438 | DOI: 10.17072/1994-9952-2023-3-287-296
Текст обзорной статьи Мелатонин как перспективный фактор коррекции кишечного микробиома при воспалительных заболеваниях кишечника
Воспалительные заболевания кишечника (ВЗК) включают язвенный колит (ЯК) и болезнь Крона (БК) и представляют собой хронические заболевания желудочно-кишечного тракта (ЖКТ), возникающие в результате неконтролируемых реакций слизистой оболочки, связанных с генетической предрасположенностью, факторами окружающей среды и кишечным микробиомом [Guan, 201 9]. У пациентов с ВЗК наблюдаются вариации содержания бактерий, грибов, вирусов и других популяций микроорганизмов в микробиоме кишечника, а также регистрируется дисбаланс между комменсальными и условнопатогенными микроорганизмами [Lee et al., 2021]. В результате нарушения иммунологической толерантности и формирования дисбиоза в стенке кишки накапливаются клетки воспалительного ответа и усугубляются реакции, связанные с цитокинами, такими как фактор некроза опухоли (TNF-α), интерлейкин (IL)-1β, IL-17, интерферон (IFN)-γ и др., которые приводят к активации лейкоцитов, разрушению стенки кишечника [Lee et al., 2021; Marié et al., 2021; Vakadaris et al., 2023]. При ВЗК хорошо изучены изменения количественного и качественного состава микробиома кишечника, видовое разнообразие варьирует в зависимости от варианта ВЗК: у пациентов с ЯК на фоне уменьшения Bacteroidota ( Bacteroidetes ) и Bacillota ( Firmicutes ) возрастает количество грамотрицательных Enterobacteriaceae ( Klebsiella pneumoniae , Escherichia coli , Clostridium difficile ), в то время как при БК сокращается представительство Clostridium spp., а повышение Escherichia coli выражено в большей степени, чем при ЯК [Jeon et al., 2022]. Bacteroi-dota ( Bacteroidetes ) составляют около 30% всех кишечных бактерий и могут рассматриваться как одна из основных биот грамотрицательных бактерий в кишечнике [Ortiz et al., 2023]. Они выделяют токсины, включая поверхностный липополисахарид (LPS), токсичные протеолитические пептиды и бета-амилоид (Aβ). Эти бактериальные токсины могут изменять проницаемость гематоэнцефалического барьера или повышают проницаемость стенки кишечника. Присутствие LPS из Bacteroides fragilis в сыворотке крови вносит вклад в воспаление при ВЗК [da Silva et al., 2023]. Недостатками препаратов первой линии терапии при ВЗК, включая производные 5-аминосалициловой кислоты, глюкокортикостероиды, иммуносупрессоры, генно-инженерные биологические препараты, являются побочные эффекты, в том числе системная иммуносупрессия, индивидуальная непереносимость, рефрактерность более чем у 30% пациентов [Kim et al., 2022]. В связи с этим, востребованной становится разработка новых, обоснованных с патогенетических позиций и безопасных лекарственных средств преимущественно локального действия с активными веществами эндогенного или растительного происхождения. Ранее нами в доклинических условиях по данным клинико-морфологических, иммунологических и биохимических исследований продемонстрировано успешное применение оригинальных ректальных суппозиториев с витамином Д3, куркумином, ректальным и системным применением озона при экспериментальном моделировании ВЗК [Осиков, Симонян, Бакеева, 2020, Осиков и др., 2021, 2022; Осиков, Кайгородцева, 2022]. Среди биологически активных веществ может быть использован мелатонин (МТ), обладающий плейотропными свойствами. Его действие связано с регуляцией циркадных ритмов, предотвращением окислительного стресса, а также с уменьшением воспалительной инфильтрации тканей [Ma et al., 2020; da Silva et al., 2023]. Секреция МТ в желудочно-кишечном тракте, на которую может влиять циркадный ритм, связана с потреблением пищи. МТ участвует в регуляции моторной, секреторной и пищеварительной функции ЖКТ через мембранные рецепторы, включая рецептор мелатонина, серотонина (5-HT), а также путем ингибирования активности синтазы оксида азота (NOS) и никотиновых каналов [Liu, Wang, 2019]. У больных с
ВЗК часто встречаются нарушения сна, в том числе из-за ночных позывов к дефекации, тем самым нарушается синтез МТ. Это можно рассматривать как локальный десинхроноз, изолированный или протекающий на фоне общего десинхроноза. МТ может оказывать двойное действие — улучшать сон и способствовать лечению заболеваний ЖКТ [Vaccaro et al., 2023]. Некоторые исследования на животных показали, что лишение сна и нарушение циркадного ритма усиливают воспаление в толстой кишке у мышей, вызванное декстраном сульфата натрия (DSS) или 2,4,6-тринитробензолсульфоновой кислотой (TNBS), в то время как МТ значительно ослабляет проявление колита [Liu et al., 2017]. МТ изучается как средство для лечения ВЗК в исследованиях на животных и клинических условиях, при этом роль МТ в регуляции воспалительного процесса и микробиома при ВЗК не до конца изучены [da Silva et al., 2023].
Цель работы – провести критический анализ данных о механизмах действия, влиянии на микробиом кишечника в контексте возможного применения мелатонина при ВЗК, представленных в рецензируемых источниках, индексированных в базах данных Pubmed и Российского индекса научного цитирования за период 2019–2023 гг.
Мелатонин: общая характеристика
МТ – это индоламин, синтезируемый из триптофана, который вырабатывается шишковидной железой, слизистой оболочкой кишечника, естественными клетками-киллерами, энтерохромаффинными клетками (ЭК) и др. [Ma et al., 2020]. МТ синтезируется пинеалоцитами из триптофана, поступающего в организм с пищей. Попав с кровотоком в эпифиз, триптофан превращается в серотонин в два этапа, с участием ферментов триптофангидроксилазы и 5-окситриптофандекарбоксилазы. Затем, в две стадии, с помощью ферментов N-ацетилтрансферазы и оксииндол-О-метилтрансферазы из серотонина образуется МТ, который не накапливается в эпифизе, а немедленно выбрасывается в кровяное русло и ликвор. Концентрация МТ в ЖКТ может превосходить концентрацию в шишковидной железе в 400 раз, а в крови в 10–100 раз [Ma et al., 2020].
Рецепторы МТ присутствуют в клеточной мембране и в ядре, делятся на МТ-зависимые и МТ-независимые рецепторы [Reiter et al., 2017; Ma et al., 2020]. Мембранные рецепторы МТ1 и МТ2 относятся к семейству рецепторов, связанных с G-белком. Рецептор МТ1 часто связан с репродуктивной, метаболической и сосудосуживающей функциями, в то время как рецептор МТ2 участвует в контроле высвобождения дофамина и циркадного ритма в сетчатке глаза, а также в вазодилатации. Рецептор MT3, расположенный в цитозоле, был идентифицирован как хинон-редуктаза-2, которая связана с метаболизмом ксенобиотиков в клетках. Ядерные рецепторы МТ представляют собой родственное ретиноидам подсемейство орфанных ядерных рецепторов (RORs) и ретиноидные Z-рецепторы (RZRs). RORs включают три подтипа (α, β и γ) и четыре варианта сплайсинга в α-подтипе [Ma et al., 2020]. Только сплайс-вариант подтипа RORα и подтип RORγ связаны с действием МТ в ядре. ROR-γt (вторая изоформа RORγ) – орфанный ядерный рецептор, который служит ключевым регулятором иммунного баланса и выступает в качестве терапевтической мишени при воспалительных заболеваниях. ROR-γt индуцирует экспрессию IL-6 и трансформирующего фактора роста β (TGF-β), эти связанные цитокины способны индуцировать транскрипцию генов, кодирующих IL-17 в Т-хелперных клетках (Th)17 [Reiter et al., 2017].
Рецепторы МТ активируют различные сигнальные пути через гетеротримерные гуанозиндифосфат (GDP)/гуанозинтрифосфат (GTP)-связанные белки. Активация рецепторов вызывает диссоциацию гете-ротримерных G-белков, в результате чего субъединица Gα и комплекс Gβγ взаимодействуют с различными эффекторными молекулами, участвующими в клеточной передаче сигналов. К числу эффекторных систем, которые активируются МТ, относятся аденилатциклаза (АЦ), фосфолипаза С (PLC), фосфолипаза А2, калиевые каналы, гуанилатциклаза, кальциевые каналы [Nikolaev, Robeva, Konakchieva, 2021]. При активации рецепторов МТ1 и МТ2 аденилатциклаза ингибируется РТХ (коклюшный токсин)-чувствительными Gi-белками (изоформы Gαi2 и Gαi3), что приводит к снижению концентрации циклического аденозинмонофосфата (цАМФ). Снижение цАМФ впоследствии ингибирует активность проте-инкиназы А и фосфорилирование ядерного фактора CREB (белок, связывающий чувствительный к цАМФ элемент) [Gao et al., 2022]. МТ играет роль в регуляции ритмической экспрессии так называемых «часовых генов» посредством передачи сигналов AЦ/цАМФ. Фосфорилированный CREB может связываться с промоторами этих генов и увеличивать их экспрессию. Индуцированный МТ сигнальный каскад в супрахиазматическом ядре модулирует циркадные ритмы, противодействуя эффекту PACAP (пептида, активирующего АЦ гипофиза), который индуцирует фосфорилирование CREB. При связывании МТ1 с белками Gq или через димеры Gi-Gβγ МТ стимулирует активность фосфолипазы С (PLC), которая превращает фосфатидилинозитол (PIP2) в диацилглицерин (DAG) и инозитол-1,4,5-трифосфат (IP3). Повышенные уровни DAG и IP3 активируют протеинкиназу C (PKC), передачу сигналов кальция с помощью кальмодулинкиназ (CaMK), стимулируют митоген-активируемые протеинкиназы (MAPK), включая внеклеточную сигнал-регулируемую киназу (ERK), c-Jun N-терминальные киназы (JNK) и p38 [Nikolaev, Robeva, Konakchieva, 2021].
Через рецепторы MT1 и MT2 МТ регулирует циркадные ритмы. MT1 опосредуют Gi-зависимую активацию экспрессии «часовых» генов, калиевых каналов, связанных с G-белков [Nikolaev, Robeva, Kona-kchieva, 2021]. Хотя точный механизм влияния МТ на «часовые» гены не ясен, показано, что нокаутирование гена рецептора МТ1 приводит к снижению экспрессии гена PER1, CFOS и иных, участвующих в регуляции циркадных ритмов, а сам эффект опосредован активностью нейронов стриатума. МТ контролирует светочувствительность сетчатки через гетеродимерный рецептор MT1/MT2 и активацию Gq-связанного сигнального пути Akt/FOXO1 [Liu et al., 2016].
МТ оказывает физиологическое воздействие на репродукцию и половое созревание у млекопитающих, подавляя экспрессию гонадотропин-высвобождающего гормона (ГнРГ) циклически в течение 24часового периода [Tordjman et al., 2017]. Ритмичный выброс ГнРГ контролирует секрецию лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона. Суточный профиль секреции МТ передает внутреннюю информацию, используемую как для циркадной, так и для сезонной временной организации. Ритмический паттерн МТ увлекает за собой репродуктивный ритм через влияние фотопериода на пульсирующую секрецию ЛГ и, следовательно, опосредует сезонные колебания репродукции, отчетливо наблюдаемые у животных и умеренно – у человека [Kauppila et al., 1987].
МТ обладает антиоксидантным действием, реализуемым его способностью нейтрализовать свободные радикалы, в том числе образующиеся при перекисном окислении липидов, а также за счет активации в его присутствии глутатионпероксидазы – мощного эндогенного фактора ферментативной защиты от свободного радикального окисления [Qin et al., 2022].
Через рецептор-зависимые и независимые пути МТ участвует в иммуномодуляции. В рецептор-зависимом пути участвуют три типа рецепторов, включая мембранные рецепторы МТ, ROR и RZR. В рецептор-независимом пути МТ защищает организм от ионизирующего излучения, ультрафиолетового излучения, ишемии/реперфузии, токсичности тяжелых металлов, алкоголя и лекарств [Esteban-Zubero et al., 2017].
В макрофагах МТ может изменять экспрессию генов, кодирующих TNF-α и IL-6 [Flemer et al., 2018]. Недавние исследования с использованием макрофагов показали, что МТ преимущественно подавляет сигнальные преобразователи и активаторы транскрипции (STAT) и регуляторные факторы интерферона (IFN), связанные с передачей сигналов [Ma et al., 2020]. МТ во время воспалительного ответа при участии арилалкиламин-N-ацетилтрансферазы, активированного ядерный фактор «каппа-би» (NF-κB) пути опосредует выработку тучными клетками провоспалительных цитокинов, таких как TNF-α и IL-6 [Sibila-no, Frossi, Pucillo, 2014].
МТ контролирует активацию, дифференцировку и пролиферацию Т-клеток. Регуляторное действие МТ на рецепторы в Т-клетках включает снижение продукции IFN-γ для подавления дифференцировки Th1, повышение продукции IL-4 и IL-10 для усиления дифференцировки Th2, ингибирование дифференцировки Th17 клеток, активизацию дифференцировки Treg клеток 1 типа, продуцирующих IL-10 [Lar-done et al., 2010; Raphael et al., 2015]. МТ стимулирует фолликулярные вспомогательные Т-клетки памяти к выходу из фазы G0/G1 и стимулирует экспрессию мРНК CD28. В физиологических условиях МТ подавляет высвобождение NO, который является ингибирующим фактором пролиферации лимфоцитов, таким образом влияя на пролиферацию B-лимфоцитов [Ma et al., 2020].
В экспериментальных моделях колита МТ улучшает состояние толстой кишки при DSS-индуцированном колите путем уменьшения окислительного стресса [Jochum et al., 2023]. Улучшает состояние толстой кишки при TNBS-индуцированном колите через сигнальный путь TLR4/MyD88/NF-κB у крыс, а также повышает уровень экспрессии генов IL-5 и IL-13 [Barnes et al., 2022]. В модели колита, индуцированного оксазолоном, МТ ингибирует выработку IL-5, IL-13 и их мРНК в Th2 [Zhao et al., 2022].
МТ способен отменять увеличение проницаемости кишечника и приток бактериальных эндотоксинов, снижать активность миелопероксидазы (MPO) и TNF-α в толстой кишке [Бурчаков, Успенская, 2017]. Способность МТ модулировать воспалительный каскад, нейтрализовать свободные радикалы кислорода послужили убедительным основанием для изучения его эффективности при ВЗК и в клинических условиях [Zhao et al., 2022].
Мелатонин и микробиом толстой кишки
Циркадные часы, управляющие биоритмами, существуют у большинства эукариотических организмов, однако наличие таких часов у прокариот ограничено цианобактериями. В последнее время было обнаружено, что Klebsiella aerogenes реагирует на действие МТ путем повышенной активности роения [Paulose et al., 2016].
Prevotella intermedia (P. intermedia) стимулирует макрофаги к производству медиаторов воспаления, таких как оксид азота и IL-6 в иммунных клетках, и служит основной причиной воспалительных заболеваний. МТ эффективно блокирует NF-κB сигнализацию, индуцированную P. intermedia, уменьшая ядер- ную транслокацию и подавляя ДНК-связывающую активность p50 субъединицы NF-κB [Zhao et al., 2022].
S.W. Kim с соавторами показали, что введение МТ мышам улучшает состояние толстой кишки при DSS-индуцированном колите [Kim et al., 2020]. МТ ингибирует экспрессию провоспалительных медиаторов, таких как IL-1β и IL-17α, и корректирует дисбиоз кишечника [Kim et al., 2020]. Кроме того, МТ увеличивает количество бокаловидных клеток в кишечнике, которые продуцируют муцин и антимикробные пептиды, служащие защитой от патогенов, поддерживая таким образом гомеостаз слизистой оболочки кишечника и комменсальных бактерий, а также сегрегацию кишечных бактерий и эпителия. МТ повышает соотношение Bacillota ( Firmicutes ) и Bacteroidota ( Bacteroidetes ) при DSS-индуцированном колите , что расходится с данными других авторов о повышении численности Bacillota ( Firmicutes ) и снижении количества Bacteroidota ( Bacteroidetes ) и, вероятно, связано с различными бактериальными нишами в ЖКТ при взятии проб [Kim et al., 2020].
Результаты исследования J.L. da Silva et al. указывают на прямое или косвенное влияние МТ на состав фекального микробиома: увеличение Actinomycetota ( Actinobacteria ) и уменьшение Bacteroidota ( Bacteroidetes ), в то время как в популяции Bacillota ( Firmicutes ) или Pseudomonadota ( Proteobacteria ) различий не было [da Silva et al., 2023]. Z.X. Zhao et al. показывают, что МТ снижает количество в толстой кишке Desulfovibrio , Peptococcaceae и Lachnospiraceae , которые участвуют в воспалении при ВЗК, и увеличивает количество Bifidobacterium , в результате чего Bifidobacterium колонизируют слизистый слой кишечника и модулируют выработку слизи бокаловидными клетками, прикрепляясь к кишечной слизи, выделяют метаболиты, которые повышают уровень основного муцина для поддержания целостности кишечника [Zhao et al., 2022].
Изучение роли МТ в патогенезе ВЗК только начинается. В клиническом исследовании обнаружено, что после терапии МТ в слизистой толстой кишки оказались менее выраженными воспалительные изменения, отсутствовали участки некрозов и язвенные изменения, наблюдалось восстановление ультраструктуры клеток эпителия и их количества [Бурчаков, Успенская, 2017].
Снижение уровня эндогенного МТ в толстой кишке вызывает дисбиоз микробиоты кишечника, сопровождающийся воспалением кишечника и повышением его проницаемости, и как следствие, микроорганизмы и токсины попадают в кровоток, увеличивается уровень провоспалительных факторов в крови (TNF-α и MCP-1), что приводит к хроническому системному воспалению, изменяет плотные контакты и повреждает клетки, составляющие гематоэнцефалический барьер, способствуя активному переносу про-воспалительных факторов из крови в мозг, что в конечном итоге приводит к болезни Альцгеймера, активации микроглии и отложению белка Aβ [Zhang et al., 2022].
Обнаружено, что микробиом толстой кишки и МТ могут взаимодействовать при регуляции липидного обмена [Pan et al., 2022]. МТ уменьшает качественный и количественный состав микробиома толстой кишки у мышей с ожирением, вызванным диетой с высоким содержанием жиров, в то же время МТ значительно увеличивает относительную численность Akkermansia , которые играют роль в снижении веса у людей с ожирением [Pan et al., 2022].
Сообщается, что МТ обладает высокой способностью связывать металлы, включая железо. J. Limson at al. заметили, что МТ и его предшественники проявляют способность связывать металлы in situ . I. Gul-cin at al. также отметили, что МТ является эффективным хелатирующим агентом металлов [Limson, Nyokong, Daya, 1998; Gulcin, Buyukokuroglu, Kufrevioglu, 2003]. Обычно считается, что эта особенность МТ связана с антиоксидантными свойствами, делая переходные металлы недоступными для реакции Фентона. В случае бактериального роста большое значение имеет агент, связывающий свободное железо в цитоплазме. Поскольку МТ легко преодолевает все биологические барьеры, включая клеточную стенку бактерий, он может связывать свободное железо в цитоплазме и с помощью этого механизма ограничивать рост бактерий. МТ оказывает антибактериальное действие in vitro на S. aureus, S. pneumoniae, E. coli, H. Pylori, K. pneumoniae [He et al., 2021]. Способность МТ связывать свободные металлы может являться предпосылкой изменения микробиоты толстой кишки в условиях его применения.
В работе Y. Wu at al. продемонстрирован терапевтический эффект МТ на остеолиз, индуцированный частицами титана, кроме того, впервые был полностью раскрыт механизм, благодаря которому введение МТ устраняло дисбиоз, вызванный остеолизом, увеличивало относительное количество микробов, продуцирующих короткоцепочечные жирные кислоты, усиливало экспрессию ферментов синтеза бутирата и повышало концентрацию бутирата в кале [Wu et al., 2021].
Заключение
Таким образом, МТ – это биологически активное вещество, синтезируемое из триптофана шишковидной железой, также продуцируется слизистой оболочкой кишечника, естественными клетками-киллерами, энтерохромаффинными клетками и эндотелиальными клетками. МТ реализует свои эффекты через мелатонин-зависимые и независимые рецепторы, которые находятся в клеточной мембране и ядре. Функции МТ разнообразны: он регулирует циркадные ритмы, обладает антиоксидантными и иммуномодулирующими свойствами, регулирует репродукцию и половое созревание у млекопитающих.
При экспериментальном моделировании ВЗК МТ улучшает состояние толстой кишки, воздействуя на бокаловидные и стволовые клетки, влияя на микробиом кишечника и иммунный ответ, уменьшая окислительный стресс. МТ может устранять микробный дисбиоз в толстой кишке при ВЗК, способствует увеличению количества бактерий-продуцентов короткоцепочечных жирных кислот, например Actinomy-cetota ( Actinobacteria ), к которым относится Bifidobacterium и уменьшению количества бактерий, повышающих проницаемость кишечного барьера, и вносят вклад в воспаление при ВЗК, например Bacteroi-dota ( Bacteroidetes ); также MT может оказывать бактериостатический эффект путем связывания свободного железа в цитоплазме бактерий.
Представленные данные позволяют предположить, что МТ можно рассматривать как фактор коррекции дисбиоза толстой кишки при ВЗК, что может быть сопряжено с изменениями локального иммунного статуса, воспалительного процесса в стенке толстой кишки, с уменьшением окислительного стресса и в конечном итоге приводить к улучшению клинико-морфологической картины при ВЗК (рисунок).
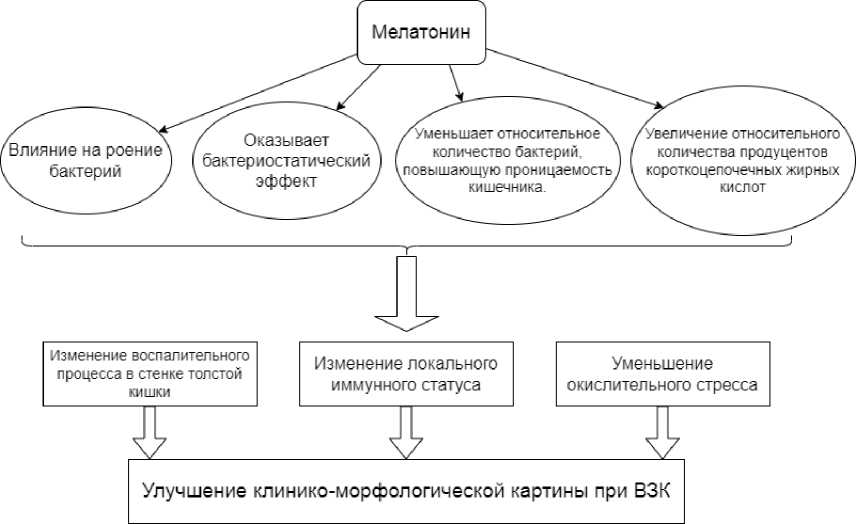
Предполагаемые механизмы влияния мелатонина на микробиом кишечника и патогенетические факторы при ВЗК
[Proposed mechanisms of melatonin influence on the intestinal microbiome and pathogenetic factors in IBD]
С учетом действия МТ и его доступности, МТ является привлекательным терапевтическим средством для лечения ВЗК у пациентов. В связи с этим, необходимо дальнейшее изучение состояния факторов локального иммунитета и его связи с динамикой качественного и количественного состава микробиома кишечника при ВЗК в условиях применения МТ.
Список литературы Мелатонин как перспективный фактор коррекции кишечного микробиома при воспалительных заболеваниях кишечника
- Бурчаков Д.И., Успенская Ю.Б. Антиоксидантный, противовоспалительный и седативный эффекты мелатонина: результаты клинических исследований // Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2017. № 4(2). С. 67–73. https://doi.org/10.17116/jnevro20171174267-73.
- Осиков М.В., Кайгородцева Н. Сравнительный анализ противовоспалительного действия озона и 5-аминосалициловой кислоты при экспериментальном колите // Патологическая физиология и экспериментальная терапия. 2022. Т. 66, № 3. С. 91–100.
- Осиков М.В., Симонян Е.В., Бакеева А.Е. Влияние экстракта корневищ куркумы длинной в составе ректальных суппозиториев на показатели перекисного окисления липидов в толстом кишечнике при экспериментальной болезни Крона // Экспериментальная и клиническая гастроэнтерология. 2020. Т. 175(3). С. 80–86. DOI: 10.31146/1682-8658-ecg-175-3-80-86.
- Осиков М.В. и др. Морфологические аспекты протекторного действия оригинальных ректальных суппозиториев с экстрактом куркумы при экспериментальной болезни Крона // Патологическая физиология и экспериментальная терапия. 2021. Т. 65, № 2. С. 67–77.
- Осиков М.В. и др. Влияние витамина D3 в составе оригинальных ректальных суппозиториев на показатели окислительной модификации белков в толстом кишечнике при экспериментальном язвенном колите // Бюллетень экспериментальной биологии и медицины. 2020. Т. 170, №. 11. С. 563–568.
- Barnes A. et al. Systematic review and meta-analysis of sleep quality in inactive inflammatory bowel dis-ease // JGH Open. 2022. Vol. 6, № 11. P. 738–744. doi: 10.1002/jgh3.12817.
- da Silva J.L. et al. The Microbiota-Dependent Worsening Effects of Melatonin on Gut Inflammation // Mi-croorganisms. 2023. Vol. 11, № 2. P. 460. doi: 10.3390/microorganisms11020460.
- Esteban-Zubero E. et al. Melatonin's role as a co-adjuvant treatment in colonic diseases: A review // Life Sci. 2017. Vol. 170. P. 72–81. doi: 10.1016/j.lfs.2016.11.031.
- Flemer B. et al. Tumour-associated and non-tumour-associated microbiota: Addendum // Gut Microbes. 2018. Jul 4; 9(4). Р. 369–373. doi: 10.1080/19490976.2018.1435246.
- Gao Y. et al. Melatonin Receptors: A Key Mediator in Animal Reproduction // Vet. Sci. 2022. Vol. 9, № 7. P. 10. doi: 10.3390/vetsci9070309.
- Guan Q. A Comprehensive Review and Update on the Pathogenesis of Inflammatory Bowel Disease // Journal of Immunology Research. 2019. Vol. 2019. Article number. 7247238. P. 16. doi: 10.1155/2019/7247238.
- Gulcin I., Buyukokuroglu M.E., Kufrevioglu O.I. Metal chelating and hydrogen peroxide scavenging ef-fects of melatonin // J. Pineal. Res. 2003. May; 34(4). Р. 278–281. doi: 10.1034/j.1600-079x.2003.00042.x.
- He F. et al. Bacteriostatic Potential of Melatonin: Therapeutic Standing and Mechanistic Insights // Front Immunol. 2021. May. 31, 12. Р. 683879. doi: 10.3389/fimmu.2021.683879.
- Jeon H. et al. TDAG51 deficiency attenuates dextran sulfate sodium-induced colitis in mice // Sci Rep. 2022. Vol. 12, № 1. P. 13. doi: 10.1038/s41598-022-24873-4.
- Jochum S.B. et al. Colonic Epithelial Circadian Disruption Worsens Dextran Sulfate Sodium-Induced Colitis // Inflamm. Bowel. Dis. 2023. Vol. 29, № 3. P. 444–457. doi: 10.1093/ibd/izac219.
- Kauppila A. et al. Inverse seasonal relationship between melatonin and ovarian activity in humans in a region with a strong seasonal contrast in luminosity // J. Clin. Endocrinol. Metab. 1987. Vol. 65, № 5. P. 823–828. doi: 10.1210/jcem-65-5-823.
- Kim S. et al. Sirtuin 7 Inhibitor Attenuates Colonic Mucosal Immune Activation in Mice-Potential Ther-apeutic Target in Inflammatory Bowel Disease // Biomedicines. 2022. Vol. 10, № 11. P. 10. doi: 10.3390/biomedicines10112693.
- Kim S.W. et al. Melatonin controls microbiota in colitis by goblet cell differentiation and antimicrobial peptide production through Toll-like receptor 4 signalling // Sci. Rep. 2020. Vol. 10, № 1. P. 9. doi: 10.1038/s41598-020-59314-7.
- Lardone P.J. et al. Blocking of melatonin synthesis and MT(1) receptor impairs the activation of Jurkat T cells // Cell Mol. Life Sci. 2010. Vol. 67, № 18. P. 3163–3172. doi: 10.1007/s00018-010-0374-y.
- Lee J.W.J. et al. Multi-omics reveal microbial determinants impacting responses to biologic therapies in inflammatory bowel disease // Cell Host Microbe. 2021. Vol. 29, № 8. P. 1294–1304. doi: 10.1016/j.chom.2021.06.019.
- Limson J., Nyokong T., Daya S. The interaction of melatonin and its precursors with aluminium, cadmi-um, copper, iron, lead, and zinc: an adsorptive voltammetric study // J. Pineal. Res. 1998. Jan; 24(1). Р. 15–21. doi: 10.1111/j.1600-079x.1998.tb00361.x.
- Liu G. et al. Melatonin alters amino acid metabolism and inflammatory responses in colitis mice // Ami-no Acids. 2017. Vol. 49, № 12. P. 2065–2071. doi: 10.1007/s00726-017-2489-z.
- Liu J. et al. MT1 and MT2 Melatonin Receptors: A Therapeutic Perspective // Annu Rev. Pharmacol. Toxicol. 2016. Vol. 56. P. 361–383. doi: 10.1146/annurev-pharmtox-010814-124742.
- Liu X.W., Wang C.D. Melatonin alleviates circadian rhythm disruption exacerbating DSS-induced colitis by inhibiting the distribution of HMGB1 in intestinal tissues // Int. Immunopharmacol. 2019. Vol. 73. P. 108–117. doi: 10.1016/j.intimp.2019.05.005.
- Ma N. et al. Melatonin mediates mucosal immune cells, microbial metabolism, and rhythm crosstalk: A therapeutic target to reduce intestinal inflammation // Med. Res. Rev. 2020. Vol. 40, № 2. P. 606–632. doi: 10.1002/med.21628.
- Marié I.J. et al. Tonic interferon restricts pathogenic IL-17-driven inflammatory disease via balancing the microbiome // eLife. 2021. Vol. 10. Article number e68371. P. 20. doi: 10.7554/eLife.68371.
- Nikolaev G., Robeva R., Konakchieva R. Membrane Melatonin Receptors Activated Cell Signaling in Physiology and Disease // Int. J. Mol. Sci. 2021. Vol. 23, № 1. P. 23. doi: 10.3390/ijms23010471.
- Qin T. et al. Melatonin Suppresses LPS-Induced Oxidative Stress in Dendritic Cells for Inflammatory Regulation via the Nrf2/HO-1 Axis // Antioxidants (Basel). 2022. Vol. 11, № 10. P. 12. doi: 10.3390/antiox11102012.
- Ortiz A.M. et al. Experimental bacterial dysbiosis with consequent immune alterations increase in-trarectal SIV acquisition susceptibility // Cell Rep. 2023. Vol. 42, № 1. P. 15. doi: 10.1016/j.celrep.2023.112020.
- Pan S. et al. Therapeutic potential of melatonin in colorectal cancer: Focus on lipid metabolism and gut microbiota // Biochim. Biophys. Acta Mol. Basis. Dis. 2022. Jan 1. 1868(1). Р. 166281. doi: 10.1016/j.bbadis.2021.166281.
- Paulose J.K. et al. Human Gut Bacteria Are Sensitive to Melatonin and Express Endogenous Circadian Rhythmicity // PLoS One. 2016. Vol. 11, № 1. P. 9. doi: 10.1371/journal.pone.0146643.
- Raphael I. et al. T cell subsets and their signature cytokines in autoimmune and inflammatory diseases // Cytokine. 2015. Vol. 74, № 1. P. 5–17. doi: 10.1016/j.cyto.2014.09.011.
- Reiter R.J. et al. Melatonin as a mitochondria-targeted antioxidant: one of evolution's best ideas // Cell Mol Life Sci. 2017. Vol. 74, № 21. P. 3863–3881. doi: 10.1007/s00018-017-2609-7.
- Sibilano R., Frossi B., Pucillo C.E. Mast cell activation: a complex interplay of positive and negative sig-naling pathways. Eur J Immunol. 2014. Vol. 44, № 9. P. 2558–2566. doi: 10.1002/eji.201444546.
- Tordjman S. et al. Melatonin: Pharmacology, Functions and Therapeutic Benefits // Curr. Neuropharma-col. 2017. Vol. 15, № 3. P. 434–443. doi: 10.2174/1570159X14666161228122115.
- Vaccaro R. et al. Serotonin and Melatonin in Human Lower Gastrointestinal Tract // Diagnostics (Basel). 2023. Vol. 13, № 2. P. 9. doi: 10.3390/diagnostics13020204.
- Vakadaris G. et al. The Role of Probiotics in Inducing and Maintaining Remission in Crohn's Disease and Ulcerative Colitis: A // Systematic Review of the Literature. Biomedicines. 2023. Vol. 11, № 2. P. 494. doi: 10.3390/biomedicines11020494.
- Wu Y. et al. Melatonin alleviates titanium nanoparticles induced osteolysis via activation of butyr-ate/GPR109A signaling pathway // J. Nanobiotechnology. 2021. Jun. 6. 19(1). Р. 170. doi: 10.1186/s12951-021-00915-3.
- Zhang B. et al. Gut Microbiota Dysbiosis Induced by Decreasing Endogenous Melatonin Mediates the Pathogenesis of Alzheimer's Disease and Obesity // Front Immunol. 2022. May 10. 13. 900132. doi: 10.3389/fimmu.2022.900132.
- Zhao Z.X. et al. Melatonin Mitigates Oxazolone-Induced Colitis in Microbiota-Dependent Manner // Front Immunol. 2022. Vol. 12. Article number 783806. P. 11. doi: 10.3389/fimmu.2021.783806.


