Мешковидные клетки в эпидермисе атлантической трески Gadus morhua L
Автор: Журавлева Нонна Георгиевна, Ишкова Екатерина Александровна, Оттесен Оддвар
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Краткое сообщение
Статья в выпуске: 2 т.22, 2019 года.
Бесплатный доступ
Инфекционные заболевания являются фактором, негативно влияющим на искусственное разведение трески. Эпидермис рыб представляет собой барьер, осуществляющий первичное взаимодействие между хозяином и патогенными организмами. Изучение эпидермиса атлантической трески Gadus morhua L. проведено с использованием экспериментальной базы Нoрд Университета (г. Буде, Норвегия). Изготовление ультратонких срезов эпидермиса трески осуществлено при участии отдела электронной микроскопии Университета г. Тромсе (Норвегия). Для светооптического и электронно-микроскопического исследования были отобраны эмбрионы, предличинки (от момента вылупления) и личинки (до 3 недель после вылупления), а также молодь трески (в возрасте 5 месяцев, 1 года и 1,5 лет). Материал для светооптического микроскопирования фиксировали 10%-м нейтральным формалином. Электронно-микроскопические исследования включали фиксацию 25%-м глютаральдегидом в солевом растворе какодиловой кислоты (какодилат натрия, pH = 7,2). Мешковидные клетки были обнаружены в эпидермисе трески всех исследованных возрастных групп; они имели круглую или преимущественно овальную форму и обладали характерной вакуолью; вакуоли были заполнены электронно-прозрачным материалом, связанным с мембраной, но большинство клеток не имели секреторного содержимого...
Мешковидные клетки, эпидермис, атлантическая треска, секреторный материал
Короткий адрес: https://sciup.org/142220019
IDR: 142220019 | УДК: 591.3; | DOI: 10.21443/1560-9278-2019-22-2-282-287
Текст научной статьи Мешковидные клетки в эпидермисе атлантической трески Gadus morhua L
*Мурманский морской биологический институт, г. Мурманск, Россия; ORCID: , e-mail: ^
В настоящее время разведение атлантической трески Gadus morhua L. представляет собой динамично развивающуюся отрасль в странах Северной Атлантики 1 . Основным фактором, негативно влияющим на процесс выращивания трески, являются инфекционные заболевания. Эпидермис кожи рыб – барьер, осуществляющий первичное взаимодействие между хозяином и патогенными организмами, поэтому изучение строения эпидермиса кожи представляется крайне важным для эффективного развития аквакультуры трески.
В эпидермисе трески имеются три основных типа клеток: эпителиальные, слизистые и мешковидные (Bullock et al., 1974).
В иностранной литературе авторы никогда не объединяли мешковидные и слизистые клетки, а четко подразделяли их 2 (Mittal et al., 1981; Pickering et al., 1987; Whitear, 1986), а также высказывали предположения о возможных функциях данного вида клеток. Следует отметить, что значение и роль мешковидных клеток для организма до сих пор не определены. Актуальность изучения этих клеток обусловлена необходимостью оценки жизнестойкости молоди трески при разведении и воздействии на нее негативных факторов окружающей среды.
Целью настоящего исследования является изучение особенностей строения, распределения и химического состава мешковидных клеток в эпидермисе атлантической трески на разных стадиях онтогенеза, а также определение (на основе полученных данных) их роли в функционировании организма.
Материалы и методы
Изучение эпидермиса атлантической трески Gadus morhua L. проводили с использованием экспериментальной базы Нoрд Университета (г. Буде, Норвегия). Изготовление ультратонких срезов эпидермиса трески осуществляли при участии отдела электронной микроскопии Университета г. Тромсе (Норвегия).
Для светооптического и электронно-микроскопического исследования были отобраны эмбрионы, предличинки (от момента вылупления) и личинки (до 3 недель после вылупления), а также молодь трески (в возрасте 5 месяцев, 1 года и 1,5 лет).
Материал для светооптических исследований фиксировали 10%-м нейтральным формалином. Фиксацию материала для электронно-микроскопических исследований осуществляли 25%-м глютаральдегидом в солевом растворе какодиловой кислоты (какодилат натрия, pH = 7,2).
Тонкие (3 мкм) срезы для светооптической микроскопии были сделаны с помощью микротома Shandon Finesse ME (США), полутонкие (250–300 нм) и ультратонкие (70–75 нм) – микротома Leica EM UC6 (США). Препараты окрашивали в ходе исследований: светооптических – гематоксилином с докраской эозином, бисмарком коричневым, проводили ШИК-реакцию (реакцию с применением Шифф-йодной кислоты); электронно-микроскопических – нитратом свинца (Culling, 1974). Фотографии полутонких и тонких срезов произведены с использованием цифровой фотокамеры Olympus DP71 (Япония), соединенной с микроскопом Olympus BX51 (Япония). Анализ ультратонких срезов и их фотографий осуществлен с помощью трансмиссионного электронного микроскопа JEOL JEM-1010 (США).
Результаты и обсуждение
Мешковидная клетка имеет периферийно расположенное ядро и большую вакуоль, прикрепленную к мембране, которая, как правило, окружена маленькими вакуолями или каналами, осуществляющими процесс секреции (Mittal et al., 1981; Pickering et al., 1987). У многих видов рыб периферийные вакуоли мешковидных клеток предположительно возникают из цистерн шероховатого эндоплазматического ретикулюма (ЭПР), но некоторые вместо этого имеют периферийную цитоплазму, богатую гладким ЭПР (Whitear, 1986).
Содержимое вакуолей мешковидных клеток может быть электронно-прозрачным, волокнистым или иметь плотные массы, похожие на гранулы, но не прикрепленные к мембране. Иногда секреты мешковидных клеток обладают гелеобразной структурой (Mittal et al., 1981).
Мешковидные клетки были обнаружены нами в эпидермисе трески всех исследованных возрастных групп. Клетки имели круглую или преимущественно овальную форму и обладали характерной вакуолью. Вакуоли были заполнены электронно-прозрачным материалом, связанным с мембраной, но большинство клеток не имели секреторного содержимого (рис. 1, а, б). В ходе электронно-микроскопических исследований было установлено, что секреторный материал в основном отсутствовал в вакуолях открытых на поверхность клеток, где имелись образования, напоминающие пузырьки или трубочки (рис. 1, б).
В эпидермисе личинок трески (с первого дня после вылупления) были выявлены поверхностно расположенные мешковидные клетки, открывающиеся на поверхность и выделяющие свое содержимое (рис. 2).
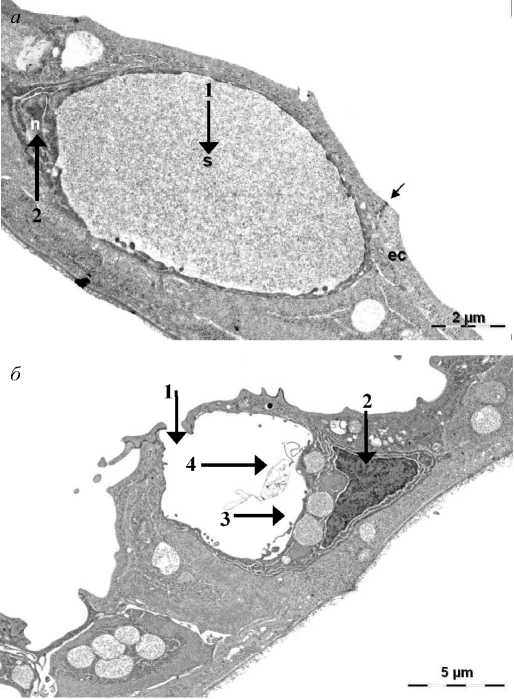
Рис. 1. Мешковидные клетки в эпидермисе личинки атлантической трески в возрасте до 3 недель после вылупления (трансмиссионная электронная микроскопия): закрытая клетка (a): 1 – вакуоль с секреторным материалом внутри, смещающим органеллы и ядро на периферию клетки; 2 – ядро; открытая клетка с оставшимся после секреции содержимым (б): 1 – разорвавшаяся в результате секреции оболочка клетки; 2 – ядро; 3 – митохондрии; 4 – трубочки и пузырьки, оставшиеся после секреции Fig. 1. Saccular cells in the epidermis of Atlantic cod larva, age 3 wph. (TEM): closed cell (a):
1 – an vacuole with secretory material inside pressing the organelles including nucleus to the periphery of the cell; 2 – nucleus; an open cell with remaining contents after secretion (б): 1 – destroyed shell of the cell after secretion; 2 – nucleus; 3 – mitochondria; 4 – tubules and bubbles remaining after secretion
У молоди трески в возрасте 5 месяцев мешковидные клетки в эпидермисе располагались более вентрально, занимая ⅔ эпидермиса кожи. Эпидермис трески в возрасте 1 года и 1,5 лет содержал мешковидные клетки, расположенные в несколько слоев. Меньшие по размеру поверхностно расположенные мешковидные клетки иногда были открыты на поверхность (рис. 2, а–в).
Данная закономерность может свидетельствовать о бактерицидных свойствах секрета мешковидных клеток. Поскольку на личиночных стадиях иммунная система трески слабо развита, мешковидные клетки выделяют на поверхность вещества, усиливающие защитные реакции кожи относительно неблагоприятных факторов окружающей среды (Ellis, 2001). С развитием иммунной системы синтез большого количества секрета становится нецелесообразным, и мешковидные клетки располагаются ближе к базальной мембране. У трески старшего возраста снова появляется необходимость в большом количестве секрета на поверхности кожи, так как взрослые особи начинают обитать в более агрессивной среде (в придонном слое), поэтому более взрослые рыбы имеют мешковидные клетки, расположенные у поверхности эпидермиса. Количество мешковидных клеток в эпидермисе трески увеличивается с возрастом рыб.
Кроме того, было установлено, что в передней части тела молоди атлантической трески количество данного типа клеток преобладало по сравнению с хвостовым отделом. Такое распределение косвенно подтверждает секреторную функцию мешковидных клеток, так как проксимально образованный секрет распределяется дистально за счет движения рыбы (Pickering et al., 1987). Благодаря этому рыбы могут экономить собственную энергию, поскольку нет необходимости в секреторной деятельности клеток, находящихся в районе хвостового отдела.
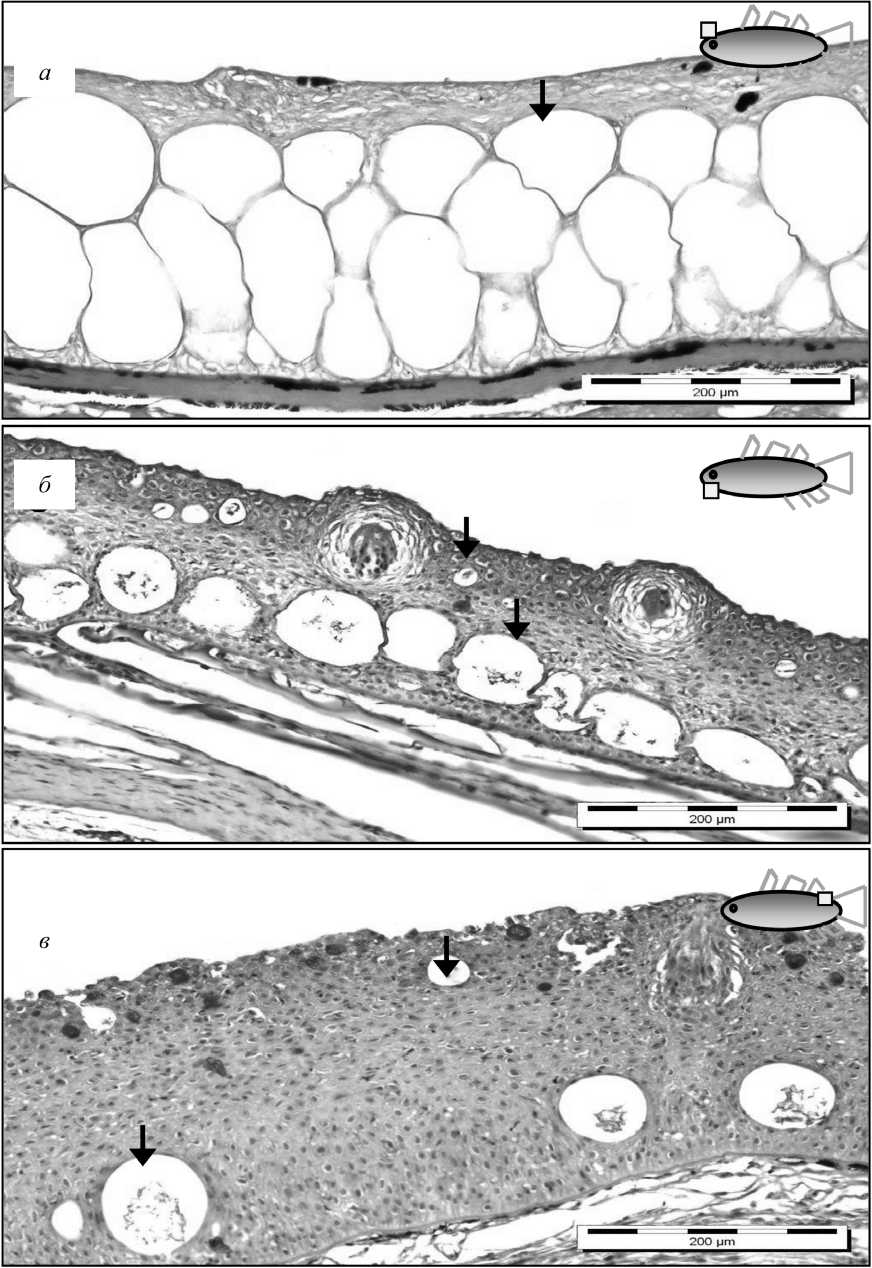
Рис. 2. Эпидермис молоди атлантической трески (ШИК-реакция): a – головной отдел (возраст 5 месяцев); б – головной отдел (1 год); в – хвостовой отдел (1,5 года).
Стрелками обозначены мешковидные клетки в разных частях эпидермиса Fig. 2. Epidermis of Atlantic cod juveniles of different ages (PAS): a – head (age: 5 months); б – head (age: 1 year); в – tail (age: 1.5 years).
Arrows indicate saccular cells in different parts of the epidermis
Мешковидные клетки в эпидермисе более молодых рыб в возрасте 5 месяцев и 1 года имели положительную реакцию при использовании ШИК-реакции и окрашивании альциановым синим (AС) (pH = 2,5) и бисмарком коричневым; окрашивание же только с помощью AС (при pH, равном 0,5 и 1,0) отсутствовало, что свидетельствует о наличии в секрете данного вида клеток нейтральных и кислых мукополисахаридов и/или гликогена. Мешковидные клетки рыб в возрасте 1,5 лет проявили положительное окрашивание ко всем вышеперечисленным красителям, свидетельствуя о наличии нейтральных, кислых и кислых сульфатированных гликопротеинов и/или гликогена. Наличие сульфатированных муцинов в эпидермисе кожи старших рыб вполне обоснованно: мукополисахариды обладают бактерицидной функцией, необходимость которой обусловлена агрессивностью среды эпибентали (Smith, 2007).
Заключение
В эпидермисе трески имеются три основных типа клеток: эпителиальные, слизистые (Козыренко и др., 2010) и мешковидные (Bullock et al., 1974). Распределение и количество мешковидных клеток зависит от анатомо-топографических особенностей эпидермиса кожи трески на разных стадиях онтогенеза.
В процессе исследования выявлены бактерицидные свойства секрета и защитные функции мешковидных клеток на ранних стадиях онтогенеза трески, характеризующейся слабым развитием иммунной системы, и на поздних стадиях развития, обусловленных обитанием в придонных слоях моря. Бактерицидные свойства секрета мешковидных клеток обеспечиваются наличием в его составе кислых сульфатированных мукополисаридов.
Передние отделы тела молоди атлантической трески содержат большее число мешковидных клеток по сравнению с хвостовым отделом, что косвенно также подтверждает их секреторную функцию. При проведении экспериментов впервые сделана попытка установления взаимосвязи между распределением, количеством и химическим составом мешковидных клеток в зависимости от возраста рыб. Полученные результаты свидетельствуют о секреторных, бактерицидных, защитных функциях мешковидных клеток в эпидермисе атлантической трески и отражают ее экологические особенности как эпибентосно-пелагического вида.
Список литературы Мешковидные клетки в эпидермисе атлантической трески Gadus morhua L
- Козыренко Е. А., Оттесен О., Амин А. Особенности распределения и химического состава слизистых клеток в эпидермисе атлантической трески Gadus morhua L.//Вестник МГТУ. 2010. Т. 13, № 4/1. С. 655-660.
- Bullock A. M., Roberts R. J. The dermatology of marine teleost fish. I. The normal integument//Oceanography and marine biology: An annual review/ed. H. Barnes. London, 1974. Vol. 13. P. 383-411.
- Culling C. F. A. Handbook of histopathological and histochemical techniques. 3rd edition. Butterworth-Heinemann, 1974.
- Ellis A. E. Innate host defense mechanisms of fish against viruses and bacteria//Developmental & Comparative Immunology. 2001. Vol. 25, Iss. 8-9. P. 827-839. DOI: https://doi.org/10.1016/S0145-305X(01)00038-6.
- Mittal A. K., Whitear M., Bullock A. M. Sacciform cells in the skin of teleost fish//Zeitschrift für Mikroskopisch-Anatomische Forschung. 1981. Vol. 95, Iss. 4 P. 559-585.
- Pickering A. D., Fletcher J. M. Sacciform cells in the epidermis of the brown trout, Salmo trutta, and the Arctic char, Salvetinus alpinus//Cell and Tissue Research. 1987. Vol. 247, Iss. 2. P. 259-265 DOI: https://doi.org/10.1007/BF00218307
- Smith B. E., Ligenza T. J., Almeida F. P., Link J. S. The trophic ecology of Atlantic cod: Insights from tri-monthly, localized scales of sampling//Journal of Fish Biology. 2007. Vol. 71, Iss. 3. P. 749-762.
- Whitear M. The skin of the fishes including cyclostomes. Chap. 2. Epidermis//Biology of the Integument. 2 Vertebrates/eds.: J. Bereiter-Hahn, A. G. Matoltsy, K. S. Richards. Springer-Verlag Berlin Heidelberg, 1986. P. 8-38 DOI: 10.1007/978-3-662-00989-5


