Местная инфильтрационная анестезия при тотальном эндопротезировании коленного сустава
Автор: Тарасов Д.А., Лычагин А.В., Кожевников В.А., Захаров Г.Г., Рукин Я.А., Тарабарко И.Н.
Журнал: Кафедра травматологии и ортопедии @jkto
Статья в выпуске: 2 (32), 2018 года.
Бесплатный доступ
Введение: Неудовлетворенность качеством послеоперационного обезболивания при проведении тотального эндопротезирования коленного суста- ва требует поиска новых схем и методик. В последние годы все более популярным становится использование местной инфильтрационной анесте- зии, хотя ее эффективность еще недостаточно изучена.цель исследования: изучить роль местной инфильтрационной анестезии в сочетании с ирригацией раны раствором местного анестетика в послео- перационном периоде для послеоперационного обезболивания больных, перенесших тотальное эндопротезирование коленного сустава. Материалы и методы: 40 пациентов с гонартрозом III степени, которым было выполнено первичное тотальное эндопротезирование коленного су- става, были распределены в две группы, используя метод конвертов. В основную группу (n=20) вошли пациенты, которым интраоперационно про- водилась инфильтрационная пери- и интраартикулярная инфильтрационная анестезия (МИА) с ирригацией раны раствором местного анестетика через катетер 16G через 4-6 часов и в первые сутки после операции после операции...
Тотальное протезирование коленного сустава, местная инфильтрационная анестезия, послеоперационное обезболивание
Короткий адрес: https://sciup.org/142215943
IDR: 142215943 | УДК: 617.3 | DOI: 10.17238/issn2226-2016.2018.2.74-79
Текст научной статьи Местная инфильтрационная анестезия при тотальном эндопротезировании коленного сустава
Проблема послеоперационного обезболивания в ортопедии в целом и при протезировании коленного сустава в частности остается до сих пор актуальной. Это обусловлено несколькими факторами. Во-первых, количество эндопротезирований коленного сустава растет из года в год [1-5]. Во-вторых, особенности иннервации коленного сустава и травматичность самого оперативного вмешательства сопровождаются выраженной ноцицептивной импульсацией, что приводит к развитию значительного болевого синдрома, трудно поддающегося коррекции, ограничивает раннюю активизацию пациентов и создает предпосылки к формированию хронической боли [6]. В-третьих, традиционные схемы системной мультимодальной послеоперационной аналгезии, в том числе в комбинации с опиоидами, не обеспечивают приемлемый уровень обезболивания, а использование эпидуральной аналгезии (ЭДА) и блокад периферических нервов часто сопровождается различным побочными эффектами. Задержка мочеиспускания, гипотензия, мышечная слабость отмечаются при применении ЭДА. Потеря чувствительности нижней конечности, нежелательные падения являются побочным эффектом при использовании блокады бедренного нерва. Применение опиоидов для обезболивания может сопровождаться избыточной седацией, тошнотой и рвотой, задержкой мочи, а использование неселективных нестероидных противовоспалительных средств увеличивает риск развития геморрагических осложнений и почечной недостаточности, в особенности при совместном использовании с антикоагулянтной терапией с целью профилактики тромбоэмболических осложнений [7; 8].
В 2008 году Kerr D.R. и Kohan L. одними из первых предложили модифицированную стратегию при эндопротезировании коленного и тазобедренного суставов, основанную на применении местной инфильтрационной аналгезии, которая заключалась в интраоперационном использовании смеси ропивакаина, кеторолака и адреналина для инфильтрации периартикулярных тканей с целью улучшения качества послеоперационного обезболивания, ранней активизации пациентов и сокращения длительности послеоперационной госпитализации [9]. Кроме самой инфильтрационной аналгезии они также использовали катетер для обеспечения продленного обезболивания раны в послеоперационном периоде и практически отказались от использования системных опиоидов.
Методика, предложенная более 10 лет назад, до сих пор не используется широко, уступая по частоте применения ЭДА и бло- кадам периферических нервов. Доступные в литературе, в особенности в отечественной, данные малочисленны [8;9;10], а клиническая эффективность самой методики требует дальнейшего изучения. Целью данного исследования стало изучение роли местной инфильтрационной аналгезии в послеоперационном обезболивании у пациентов после тотального эндопротезирования коленного сустава.
Материалы и методы
В период с августа 2017 по март 2018 гг. в клинике травматологии и ортопедии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский университет) проведено рандомизированное сравнительное исследование клинической эффективности и безопасности применения местной инфильтрационной аналгезии (МИА) и «традиционного» системного мультимодального послеоперационного обезболивания. В исследование были включены 40 пациентов, которым было выполнено первичное одностороннее эндопротезирование сустава при гонартрозе III cте-пени.
После получения письменного и устного информированного согласия на участие в исследовании в предоперационном периоде пациенты путем рандомизации с использованием метода «конвертов» были распределены на 2 группы: в основную группу были включены пациенты, которым интраоперационно проводилась инфильтрация пери- и интраартикулярных тканей раствором анестетика с установкой микрокатетера в рану (МИА, n=20), в группу сравнения – пациенты, послеоперационное обезболивание которых осуществляли с использованием стандартной мультимодальной системной аналгезии (ММА, n=20). Основные демографические и клинические характеристики пациентов представлены в таблице 1.
Все вмешательства были выполнены в условиях субарахноидальной анестезии с внутривенной седацией. Накануне вечером пациенту назначали феназепам 1 мг per os, в день операции за 30 минут до транспортировки в операционную – 1 мл раствора феназепама внутримышечно с целью премедикации. Всем больным проводили стандартный интраоперационный мониторинг. За 30 минут до кожного разреза для профилактики послеоперационных инфекционных осложнений внутривенно использовали 1 г цефтриаксона. Перед пункцией субарахноидального пространства пациенту вводили диазепам в дозе 2,5-5 мг и дексаметазон 8 мг внутривенно. Пункцию субарахноидального пространства осуществляли на уровне L3-L4 иглой 25-27G в положении пациента сидя. После получения тока ликвора ин- тратекально вводили изобарический 0,5% раствор бупивакаина, максимально 2,5-3 мл. Интраоперационная седация обеспечивалась внутривенной инфузией пропофола. В послеоперационном периоде назначали низкомолекулярные гепарины в стандартных дозировках и продолжали в течение 3 дней после операции с последующим переходом на пероральные антикоагулянты. Операцию проводили без наложения турникета. Объем инфузионной терапии интраоперационно составлял 1500-2000 мл кристаллоидных и коллоидных растворов.
Пациентам основной группы после установки эндопротеза до и после ушивания суставной капсулы осуществляли пери-артикулярную инфильтрацию тканей на глубину максимально 3 см раствором, содержащим 100 мл 0,2% раствора ропивакаина и 0,5 мл адреналина (0,1 мг/мл) по 30-50 мл в суммарном объеме 120-150 мл. С целью продленного послеоперационного обезболивания данным пациентам перед ушиванием раны дополнительно устанавливали применяемый для эпидуральной анестезии катетер размером 16G. Кончик катетера позиционировали в верхней части раны, а его противоположный конец выводили на кожу на 5 см ниже угла раны (рисунок 1). К катетеру присоединяли бактериальный фильтр и фиксировали. Первое введение в катетер проводили через 4-6 часов после операции после разрешения моторного блока в объеме 40 мл 0,5% раствора ропивакаина с адреналином (0,01 мг) при пережатом дренаже. При необходимости введение раствора анестетика повторяли через 8 часов, а также утром в первые послеоперационные сутки за 30 минут до удаления дренажа и катетера.
Пациентам обеих групп проводили системную мультимодальную аналгезию, которая включала комбинацию глюкокортикостероидов (дексаметазон 8 мг интраоперационно), нестероидных противовоспалительных средств (кетопрофен 100 мг 3 раза в сутки), трамадола (100 мг 1 раз в сутки) и парацетамола (1г 2-3 раза в сутки) в течение 1-х суток после операции с последующей коррекцией кратности и доз указанных препаратов в зависимости от выраженности послеоперационного болевого синдрома.
Активизацию пациентов начинали в 1-е послеоперационные сутки после удаления катетера, дренажа и рентгенологического контроля положения эндопротеза с участием специалиста по реабилитации.
Выраженность болевого синдрома в покое и при движении (сгибание в коленном суставе) оценивали с использованием 10-бальной визуально-аналоговой шкалы до операции, через 4-6 часов (при разрешении моторного блока) и в первые сутки после операции.
Регистрировали частоту инфекционных осложнений и побочные реакции (ортостатическая гипотензия, тошнота и рвота, местные реакции в зоне операции).
Статистическую обработку материала проводили с помощью пакета Microsoft Exсel и программы SPSS 25.0.0.0 (IBM). Данные с нормальным распределением представляли в виде среднего (М) со стандартным отклонением оценивали с использованием t-критерия Стьюдента, для непараметрических данных – в виде Ме (25;75) с использованием критерия Манн-Уитни. Для достоверности различий номинальных данных применяли критерий Фишера. Различия считали достоверным при р < 0,05.
Результаты
Группы были сопоставимы по полу, возрасту, функциональному и физическому статусу. Следует отметить, что в обеих группах преобладали женщины (95% в основной группе и 90% в группе сравнения), что подтверждает данные регистра эндопротезирования коленного сустава РНИИТО им. Р.Р. Вредена [1]. Средний вес и ИМТ в контрольной группе были достоверно выше, чем в основной, р = 0,03 и р = 0,04 соответственно (таблица 1).
Таблица 1
Демографические и клинические характеристики пациентов в группах
|
Показатель |
МИА (n=20) |
ММА (n=20) |
р |
|
Возраст, годы |
64,4±8,3 |
64,1±6,5 |
0,08* |
|
Мужчины : женщины |
1:19 |
2:18 |
0,548** |
|
Рост, см |
161,2±7 |
167,6±7 |
0,583* |
|
Вес, кг |
84,9±16,9 |
100±8,1 |
0,04* |
|
ИМТ, кг/м2 |
32,7±6,4 |
35,8±2,5 |
0,03* |
Примечание: ИМТ – индекс массы тела. * – р рассчитан с применение критерия Стьюдента; ** – р рассчитан с применением критерия Фишера
По данным Сараева А.В. и соавт. выраженность болевого синдрома не зависит от ИМТ и веса, но в большей степени определяется полом, длительностью оперативного вмешательства и уровнем предоперационной тревожности [11], что позволило нам признать имеющиеся различия незначимыми в оценке послеоперационного болевого синдрома.
Выраженность болевого синдрома до операции в покое составила в среднем 1 (0,25;2) балл в группе МИА и 0 (0;1) баллов в группе ММА, р = 0,001. При движении (сгибание в коленном суставе) выраженность боли в группах статистически не отличалась (6 (4;6,75) и 6 (5;6) баллов соответственно, р = 0,693). Через 4-6 часов (при разрешении моторного блока) и в первые сутки после операции боль при движении была статистические достоверно менее выражена в группе МИА при сравнении с ММА, р = 0,006 и р = 0,016. Динамика болевого синдрома в группах представлена в таблице 2.
Таблица 2
Выраженность болевого синдрома по визуально-аналоговой шкале в группах
|
Показатель |
МИА (n=20) |
ММА (n=20) |
р |
|
ВАШ в покое, баллы |
|||
|
ДО |
1 (0,25;2) |
0 (0;1) |
0,001 |
|
4-6 ч ПО |
0 (0;1) |
2 (2;2) |
0,707 |
|
ПОД1 |
1 (0;1) |
1 (1;2) |
0,314 |
|
ВАШ при движении, баллы |
|||
|
ДО |
6 (4;6,75) |
6 (5;6) |
0,693 |
|
4-6 ч ПО |
2 (1;3) |
6 (4;6) |
0,006 |
|
ПОД1 |
2 (1;3) |
5 (2;5) |
0,016 |
Примечании: ВАШ – визуально-аналоговая шкала боли в баллах; ДО – до операции; ПО – после операции; ПОД1 – 1-ый послеоперационный койко-день.
Сильная боль, резистентная к проводимой терапии и потребовавшая введения наркотических аналгетиков (морфин 1,0 мг), была отмечена у 2 пациентов в основной группе и у 5 в группе сравнения, р = 0,376.
Побочных реакций (ортостатическая гипотензия, тошнота и рвота, местные реакции в зоне операции) на фоне проведения МИА, как и внутрисуставных инфекционных осложнений, зафиксировано не было.
Обсуждение
В последние годы применение местной инфильтрационной аналгезии в комплексном обезболивании при эндопротезировании коленного сустава привлекает все больше исследователей. Это может быть объяснено как необходимостью проведения ранней активизации и реабилитации пациентов в рамках «fast track» хирургии, так и неудовлетворенностью традиционными подходами к обезболиванию пациентов после ортопедических вмешательств [6;8;12;13;14].
Современная стратегия послеоперационного обезболивания в ортопедии основана на принципе мультимодальной аналгезии, под которой в настоящее время понимают не только сочетание различных классов препаратов и способов их введения, но и обязательное включение в схемы послеоперационного ведения различных методик обезболивания, не системного, а регионарного воздействия (блокада периферических нервов, периартику-лярная инфильтрация, эпидуральная анестезия) [8;15].
Если преимущество субарахноидальной анестезии перед общей при проведении оперативных вмешательств на нижних конечностях не вызывает сомнений, то в вопросах послеоперационного обезболивания единства подходов в настоящее время нет. Послеоперационный болевой синдром отличается высокой интенсивностью, в связи с чем пациенты, перенесшие тотальное эндопротезирование коленного сустава, в послеоперационном периоде нуждаются в назначении значительных доз опиоидных аналгетиков или, что предпочтительнее, эпидуральной инфузии местного анестетика [16, С.579]. Изолированное применение системной аналгезии многими авторами признается нецелесообразным в виду плохого контроля над послеоперационной болью [8]. Именно неудовлетворенность качеством обезболивания системными препаратами, в т.ч. опиоидами, подтолкнула исследователей к поиску новых схем аналгезии [9]. Включение МИА в схему послеоперационного обезболивания позволяет уменьшить выраженность болевого синдрома у пациентов, улучшает их самочувствие, что способствует более ранней их активизации по сравнению со «стандартным» обезболиванием [17]. Эти данные подтверждены и в нашем исследовании. По нашим данным, выраженность болевого синдрома через 4-6 часов и в первые сутки после операции при движении на фоне применения МИА была значимо меньше, чем в группе мультимодальной системной аналгезии (р = 0,006 и р = 0,016). что позволило проводить активизацию пациентов с первых суток после операции без выраженного для них дискомфорта.
Длительное время стандартом обезболивания при тотальном эндопротезировании коленного сустава считалась ЭДА [18]. В то же время известно, что, хотя частота осложнений при при- менении нейроаксиальных блокад не превышает 0,03%, спектр этих осложнений включает формирование эпидуральной гематомы, абсцедирование, повреждение спинного мозга и развитие менингита. Побочными эффектами ЭДА также являются развитие гипотензии, задержка мочи, мышечная слабость [19]. В отличие от ЭДА, МИА не сопровождается системными реакциями, даже на фоне применения достаточно больших доз местных анестетиков (средний объем 0,2% раствора ропивакаина, который используется при инфильтрационной анестезии, обычно составляет 120-150 мл с суммарной дозой ропивакаина 300 мг). Безопасность введения таких объемом анестетика подтверждена в нескольких исследованиях [10;20]. В нашем исследовании не зафиксировано ни одного случая побочных нежелательных реакций на фоне применения МИА с продленным введением препаратов, а также инфекционных осложнений, что подтверждает опубликованные ранее данные [21; 22; 23].
Следует отметить, что при использовании нами «традиционной» методики, предложенной Kerr D.R и Kohan L. [9], мы были неудовлетворены распределением анестетика после его болюсного введения в рану, так как возникала мозаичность анестезии (преимущественно в области надколенника и нижнего угла раны). В связи с чем методика установки катетера была нами модифицирована: катетер устанавливали в рану не сверху вниз, а снизу вверх таким образом, чтобы его кончик располагался в верхнем углу раны, тем самым обеспечивая более равномерное распределение анестетика под действием гравитации (рисунок 1).
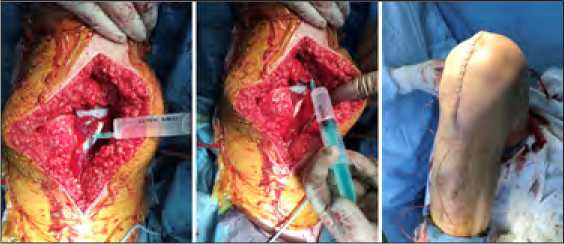
Рис. 1. Модифицированная методика проведения местной инфильтрационной анестезии при тотальном эндопротезировании коленного сустава
Кроме того, мы отказались от добавления кеторолака к первичному раствору для инфильтрационной анестезии, поскольку в применяемую мультимодальную схему обезболивания уже были включены нестероидные противовоспалительные средства. Мы поддерживаем мнение [8], что кеторолак в качестве адьюванта обеспечивает в большей степени системный противовоспалительный эффект, который не зависит от места его введения.
Выводы
Местная инфильтрационная анестезия в сочетании с системным мультимодальным обезболиванием позволяет уменьшить выраженность болевого синдрома в первые часы после тотального протезирования коленного сустава, в особенности при движении, что повышает качество лечения пациентов и способствует их ранней активизации.
Применение «катетера в ране» с дополнительным введением раствора анестетика дает возможность пролонгировать эффекты местной аналгезии, обеспечивая достаточный уровень обезболивания в течение суток после операции.
Местная инфильтрационная анестезия не сопровождается значимыми системными и местными побочными эффектами, что подтверждает безопасность и эффективность данной методики.
Заключение
Несмотря на то, что применение МИА только набирает популярность, в настоящее время уже не вызывает сомнений эффективность данной методики в комплексном обезболивании пациентов в травматологии и ортопедии. Но в то же время доказательная база применения МИА еще не сформирована. Это обусловлено не только различиями в методике проведения инфильтрационной анестезии, в объемах вводимого раствора, различных схемах применения адъювантов (кеторолок, адреналин, гидрокортизон и т.д.), в режимах послеоперационного ведения (с установкой катетера и без, введение препаратов через катетер в непрерывном или дискретном режиме), но и дизайном проводимых исследований.
Таким образом, мы полагаем, что местная инфильтрационная анестезия повышает качество послеоперационного обезболивания пациентов, способствует их более ранней активизации и реабилитации, а простота, безопасность и эффективность методики позволяют рекомендовать ее для включения в схему мультимодальной аналгезии при проведении тотального эндопротезирования коленного сустава.
Список литературы Местная инфильтрационная анестезия при тотальном эндопротезировании коленного сустава
- Корнилов Н.Н., Куляба Т.А., Филь А.С., Муравьёва Ю.В. Данные регистра эндопротезирования коленного сустава РНИИТО им. Р.Р. Вредена за 2011-2013 год//Травматология и ортопедия России. 2015. №1 (75), С. 136-151.. 2015, Vol. 1 (75), pp. 136-151. In Russ]
- Carr A.J., Robertsson O., Graves S., Price A.J., Arden N.K., Judge A., Beard, D.J. Knee replacement. The Lancet, 2012, Vol. 379(9823), pp. 1331-1340 DOI: 10.1016/S0140-6736(11)60752-6
- Кавалерский Г.М., Лычагин А.В., Сметанин С.М., Грицюк А.А., Ченский А.Д. Историческое развитие концепции эндопротезирования коленного сустава//Кафедра травматологии и ортопедии. 2016. №19. C. 16-19. , 2016, No. 19, pp. 16-19. In Russ]
- Кавалерский Г.М., Грицюк А.А., Лычагин А.В., Сметанин С.М., жи-диляев А.В. Эндопротезирование коленного сустава при ревматоидном артрите//Кафедра травматологии и ортопедии. 2013. №4(8), C. 8-12. , 2013, No. 4(8), pp. 8-12. In Russ]
- Иванов П.П., Корнилов Н.Н., Куляба Т.А. Ревизионные хирургические вмешательства при перипротезной инфекции коленного (обзор литературы)//Кафедра травматологии и ортопедии. 2017. №1(21), C. 35-43. , 2017, No. 1(21), pp. 35-43. In Russ]
- De Neumann L., Clairoux A., Brulotte V., McCartney C.J. In Search of the Perfect Balance: a Narrative Review of Analgesic Techniques for Total Knee Arthroplasty. Current Anesthesiology Reports, 2017, Vol. 7(2), pp. 201-211 DOI: 10.1007/s40140-017-0218-5
- Afzal A., Hawkins F., Rosenquist R.W. epidural hematoma in a patient receiving epidural analgesia and LMwH after total-knee arthroplasty. Regional anesthesia and pain medicine, 2006, Vol. 31(5), p. 480
- Moucha C.S., Weiser M.C., Levin E.J. Current strategies in anesthesia and analgesia for total knee arthroplasty. JAAOS-Journal of the American Academy of Orthopaedic Surgeons, 2016, Vol. 24(2), pp. 60-73 DOI: 10.5435/JAAOS-D-14-00259
- Kerr D.R., Kohan L. Local infiltration analgesia: a technique for the control of acute postoperative pain following knee and hip surgery: a case study of 325 patients. Acta Orthopaedica, 2008, Vol. 79(2), pp. 174-183 DOI: 10.1080/17453670710014950
- Корячкин В.А.,Чуприс В.Г.,Черный А.Ж.,Казарин В.С.,Лиськов М.А., Малевич Г.М.,Мальцев,М.П.Системнаятоксичностьместныханес-тетиков при регионарной анестезии в ортопедии и травматологии//Травматология и ортопедия России. 2015. №1(75), C. 129-135. , 2015, No. 1(75), pp. 129-135. In Russ]
- Сараев А.В. Линдберг М.Ф., Гэй К., Росселэнд Л.А., Лердал А., Корнилов Н.Н., Куляба Т.А. Факторы, влияющие на интенсивность болевого синдрома в раннем послеоперационном периоде после тотальной артропластики коленного сустава//Травматология и ортопедия России. 2017. №23(1), C. 45-58. , 2017, Vol. 23(1), pp. 45-58. In Russ] 2905-2017-23-1-45-58 DOI: 10.21823/2311-
- Currall V.A., Butt U., Greenwood R., Robinson S., Harries W.J. Multi-modal Analgesia In Total Knee Arthroplasty. Orthopaedic Proceedings, 2010, Vol. 92 (supp. III), pp. 417-417
- Perlas A., Kirkham K.R., Billing R., Tse C., Brull R., Gandhi R., Chan V.W. The impact of analgesic modality on early ambulation following total knee arthroplasty. Regional anesthesia and pain medicine, 2013, Vol. 38(4), pp. 334-339 DOI: 10.1097/AAP.0b013e318296b6a0
- Soffin E.M., YaDeau J.T. enhanced recovery after surgery for primary hip and knee arthroplasty: a review of the evidence. British journal of anaesthesia. 2016; 117: iii62-iii72 DOI: 10.1093/bja/aew362
- Andersen L., Husted H., Otte K.S., Kristensen B.B., Kehlet H. High-volume infiltration analgesia in total knee arthroplasty: a random-ized, double-blind, placebo-controlled trial. Acta Anaesthesiologica Scandinavica, 2008, Vol. 52(10), pp. 1331-1335. 6576.2008.01777.x DOI: 10.1111/j.1399-
- Бунятян А.А. Рациональная фармакоанестезиология: Рук. для практикующих врачей. Под общ. ред. А.А. Бунятяна, В.М. Мизикова. М.: Литтерра, 2006. 579 c.
- Lamplot J.D., Wagner E.R., Manning D.W. Multimodal pain management in total knee arthroplasty: a prospective randomized controlled trial. The Journal of arthroplasty, 2014, Vol. 29 (2), pp. 329-334 DOI: 10.1016/j.arth.2013.06.005
- Davies A.F., Segar E.P., Murdoch J., Wright D.E., Wilson, I.H. epidural infusion or combined femoral and sciatic nerve blocks as perioperative analgesia for knee arthroplasty. British journal of anaesthesia, 2004, Vol. 93(3), pp. 368-374 DOI: 10.1093/bja/aeh224
- Horlocker T.T. Complications of regional anesthesia and acute pain management. Anesthesiology clinics, 2011, Vol. 29(2), pp. 257-278 DOI: 10.1016/j.anclin.2011.04.006
- Affas F., Stiller C.O., Nygårds E.B., Stephanson N., Wretenberg P., Olofs-son C. A randomized study comparing plasma concentration of ropivacaine after local infiltration analgesia and femoral block in primary total knee arthroplasty. Scandinavian Journal of Pain. 2012;3(1):46-51 DOI: 10.1016/j.sjpain.2011.09.001
- Bianconi M., Ferraro L., Traina G.C., Zanoli G., Antonelli T., Guberti A., Massari L. Pharmacokinetics and efficacy of ropivacaine continuous wound instillation after joint replacement surgery. British Journal of Anaesthesia, 2003, Vol. 91(6), pp. 830-835 DOI: 10.1093/bja/aeg277
- Toftdahl K., Nikolajsen L., Haraldsted V., Madsen F., Tønnesen E.K., Søbal-le K. Comparison of peri-and intraarticular analgesia with femoral nerve block after total knee arthroplasty: a randomized clinical trial. Acta ortho-paedica, 2007, Vol. 78(2), pp. 72-179 DOI: 10.1080/17453670710013645
- Essving P., Axelsson K., Kjellberg J., Wallgren Ö., Gupta A., Lundin A. Reduced hospital stay, morphine consumption, and pain intensity with local infiltration analgesia after unicompartmental knee arthroplasty: A randomized double-blind study of 40 patients. Acta orthopaedica, 2009, Vol. 80(2), pp. 213-219 DOI: 10.3109/17453670902930008


