Местные лучевые повреждения после лучевого и комбинированного лечения злокачественных новообразований области головы и шеи
Автор: Исаев П.А., Медведев В.С., Пасов В.В., Семин Д.Ю., Дербугов Д.Н., Полькин В.В.
Рубрика: Научные статьи
Статья в выпуске: 4 т.19, 2010 года.
Бесплатный доступ
Рассмотрены причины местных лучевых повреждений (ЛП), развивающихся после лучевого и комбинированного лечения злокачественных новообразований области головы и шеи. Все 1192 пациента были разделены на четыре клинические группы. 486 (40,8 %) больным первой группы была проведена дистанционная лучевая терапия (ДЛТ) в режиме традиционного фракционирования по 1,8-2,3 Гр 5 раз в неделю до суммарной очаговой дозы (СОД) 60 Гр. 244 (20,5 %) больным второй группы лучевое лечение сочетали с локальной ультравысокочастотной терапией-гипертермией (УВЧ-гипертермией), с регионарной внутриартериальной химиотерапией (ХТ), гипергликемией и последовательно проведенными сеансами регионарной внутриартериальной ХТ, гипергликемией и локальной УВЧ-гипертермией. 204 (17,1 %) больным третьей группы была проведена лучевая терапия (ЛТ) в режиме ускоренного суперфракционирования с неравномерным дроблением разовой очаговой дозы (РОД) 1 + 1,5/2 Гр до СОД 60 Гр и неоадъювантная полихимиотерапия (ПХТ): цисплатин (100 мг на 1 м2 площади поверхности тела), 5-фторурацил (3000 мг непрерывно в течение 72 ч). Нейтроны в сочетанной ЛТ применялись 258 (21,6 %) больным четвертой группы: 36 (3 %) - проводилась дистанционная нейтронная терапия, 222 (18,6 %) - сочетанная гамма-нейтронная терапия источниками 252Cf. В 285 (23,9 %) случаях выявления у больных остаточной опухоли и 184 (15,4 %) с неполной регрессией регионарных метастазов прибегали к хирургическим вмешательствам. Среди факторов риска развития поздних осложнений наибольшее значение имели: локализация первичного очага; лучевая нагрузка; операция в составе комбинированного метода лечения. Общая частота поздних лучевых повреждений составила 252 (21,1 %) наблюдения. Максимальная частота осложнений отмечена у больных, которым проводили курс конвенциональной лучевой терапии - 115 (23,7 %) наблюдений; минимальная - 35 (15,7 %) - при использовании сочетанной нейтронной терапии источниками 252Cf, р=0,00963. Следовательно, внутритканевая брахитерапия - это наиболее щадящий и чрезвычайно эффективный метод лечения, позволяющий обеспечить равномерное облучение и вызывающий наименьшее число осложнений со стороны окружающих нормальных тканей в условиях реализации максимальной суммарной очаговой дозы в первичном очаге.
Злокачественные новообразования головы и шеи, местные лучевые повреждения
Короткий адрес: https://sciup.org/170170014
IDR: 170170014
Текст научной статьи Местные лучевые повреждения после лучевого и комбинированного лечения злокачественных новообразований области головы и шеи
рошие результаты лечения основного заболевания, отдаляют возможность проведения дальнейших этапов комбинированного лечения. Они существенно снижают качество жизни пациентов, могут стать причиной страданий, глубокой инвалидности и смерти больного [8]. Очевидно, что причины развития таких повреждений многообразны по формам и степени выраженности [7]. Однако, до сих пор, нет полного понимания и четкого представления о том, какова роль каждого из компонентов лучевого и комбинированного лечения в формировании комплекса функциональных и органических нарушений.
Материалы и методы
В данной работе проведен ретроспективный анализ частоты развития местных ЛП в когорте из 1192 пациентов, которые перенесли радикальное лечение по поводу злокачественных новообразований области головы и шеи, а также выяснены причины их развития в зависимости от метода операции и условий проведения лучевой терапии. Лучевая нагрузка оценивалась в единицах время-доза-фракция (ВДФ) с использованием таблиц, предложенных А.С. Павловым и соавторами [2].
В соответствии с проведенными методами лечения все больные были разделены на четыре клинические группы.
486 (40,8 %) больным первой группы была проведена ДЛТ в режиме традиционного фракционирования по 1,8-2,3 Гр 5 раз в неделю до СОД 60 Гр. Лечение осуществляли на гамма-терапевтических установках «РОКУС» и «АГАТ Р». Облучение в 441 (37 %) случае проводили с противолежащих полей размерами от 6 x 6 см до 10 x 12 см, с включением в облучаемый объем одновременно опухолевого очага и верхнего барьера регионарного лимфатического оттока. 98 (8,2 %) больным I группы ЛТ была проведена в комбинации с полихимиотерапией (ПХТ). Режим ПХТ включал два препарата – цисплатин и 5-фторурацил. В первый день лечения, одновременно с ЛТ, на фоне гипергидратации внутривенно вводили цисплатин из расчета 100 мг на 1 м2 площади поверхности тела. Затем пациенту начинали внутривенное введение 5-фторурацила в дозе 3000 мг непрерывно в течение 72 ч при помощи инфузионного шприцевого насоса. Повторный цикл ПХТ повторяли на 21-28 день лечения.
116 (23,9 %) пациентам с неполной регрессией регионарных метастазов выполняли плановое иссечение лимфатических узлов через 4-6 недель после завершения лечения. В 91 (18,7 %) случае выявления у больных остаточной опухоли либо локального рецидива прибегали к хирургическим вмешательствам. Расширенная операция Крайля с иссечением обширных участков покровных тканей, денудацией общей или внутренней сонной артерии, резекцией наружной сонной артерии, иссечением блуждающего, подъязычного нервов, симпатического ствола выполнена нами в 31 (6,3 %) наблюдении, в 38 (7,8 %) – произведены расширенные и модифицированные варианты фасциально-футлярного иссечения клетчатки шеи. Для радикального удаления новообразований у 51 (5,3 %) пациента осуществлена электрорезекция языка, дна полости рта, щеки с резекцией или экзартикуляцией половины нижней челюсти, еще у 7 (0,6 %) – тотально или субтотально иссечены ткани нижней губы, подбородка, выполнена краевая или сегментарная резекция нижней челюсти.
Из 244 (20,5 %) больных второй группы у 97 (8,2 %) ЛТ сочетали с локальной УВЧ-гипертермией, у 62 (5,2 %) – с регионарной внутриартериальной ХТ, гипергликемией и у 85 (7,1 %) – с последовательно проведенными сеансами регионарной внутриартериальной ХТ, гипергликемии и локальной УВЧ-гипертермии.
Сеансы локальной УВЧ-гипертермии проводили в специально оборудованном кабинете, оснащенном всем необходимым для оказания неотложной медицинской помощи, расположенном в одном здании с гамма-терапевтическими установками. Локальное нагревание опухоли осуществляли с помощью гипертермического комплекса «Супертерм ЭП-40» (40,68 МГц) с помощью электродных устройств различных диаметров, которые позволяют выдерживать температурные режимы от 41,5 °С до 43 °С. Контроль за уровнем температуры осуществляли способом внутритканевой термометрии. Использовали прибор дистанционного измерения температуры с игольчатым термодатчиком, который вводили параллельно электродным пластинам со стороны, противоположной генератору. Сеансы гипертермии сочетались с укрупненными фракциями ЛТ по 5 Гр. Интервал между воздействиями при этом не превышал 5-10 минут. Всего проводили 4 сеанса терморадиотерапии, 2 раза в неделю с интервалами между сеансами 3-4 дня. Остальную дозу ЛТ подводили в режиме традиционного фракционирования по 2 Гр 5 раз в неделю до СОД 56 Гр. 62 (5,2 %) больным ЛТ методом условно-динамического фракционирования сочетали с сеансами регионарной внутриартериальной химиотерапии и гипергликемии. Непосредственно перед инфузией раствора глюкозы внутриартериально капельно вводили 5 мг блеоцина, растворенного в 100 мл 0,9 % раствора хлорида натрия. После чего проводили инфузию 450 мл 10 % раствора глюкозы в течение 3 часов. Сеансы внутриартериальной ХТ и гипергликемии сочетали с облучением РОД 4 Гр и проводили сразу после лучевой терапии. Всего проводили 3 сеанса регионарных инфузий с перерывами между сеансами 2-3 дня. Далее проводились еще 2 сеанса облучения РОД 4 Гр с теми же интервалами до СОД 20 Гр. В последующем ЛТ проводили в традиционном режиме фракционирования по 2 Гр 5 раз в неделю до СОД 54 Гр. Лечение 85 (7,1 %) больных заключалось в сочетании ДЛТ, осуществляемой в режиме условно-динамического фракционирования дозы, с последовательно проведенными сеансами регионарной внутриартериальной ХТ, гипергликемии и локальной УВЧ-гипертермии по вышеописанным методикам.
70 (28,7 %) пациентам II группы с неполной регрессией регионарных метастазов выполняли плановую лимфодиссекцию через 5-6 недель после завершения ЛТ. В 52 (21,3 %) наблюдениях у больных выявлена остаточная опухоль либо локальный рецидив, что привело к хирургическим вмешательствам. При этом расширенные и модифицированные варианты иссечения клетчатки шеи выполнены нами у 36 (14,7 %) больных. Для радикального удаления новообразований 33 (13,5 %) пациентам выполнена резекция языка, дна полости рта с резекцией нижней челюсти, еще у 3 (1,2 %) тотально или субтотально иссечены ткани нижней губы, проведена сегментарная резекция нижней челюсти.
Все 204 (17,1 %) пациента третьей группы получили комбинированное лечение: неоадъювантную ПХТ и ЛТ в самостоятельном варианте. Использовался радикальный курс ДЛТ в режиме ускоренного суперфракционирования с неравномерным дроблением дневной дозы – в 137 (11,5 %) наблюдениях в РОД 1 и 1,5 Гр, еще в 67 (5,6 %) наблюдениях в РОД 1 и 2 Гр с интервалом 4-6 часов до СОД 60 Гр. В схеме ПХТ применяли два препарата – цисплатин и 5-фторурацил. В первый день лечения, одновременно с ЛТ, на фоне гипергидратации внутривенно вводили цисплатин из расчета 100 мг на 1 м2 площади поверхности тела. Затем пациенту начинали внутривенное введение 5-фторурацила в дозе 3000 мг непрерывно в течение 72 ч при помощи инфузионного шприцевого насоса. Повторный цикл ПХТ повторяли на 21-28 день лечения.
52 (4,3 %) больным III группы при отсутствии объективных данных за резорбцию метастазов в лимфатических узлах шеи выполняли хирургическое вмешательство через 4-6 недель после окончания лечения. У 10 (0,8 %) человек при контрольном обследовании был выявлен продолженный рост или рецидив заболевания. Во всех этих наблюдениях прибегали к удалению опухоли с резекцией ½ нижней челюсти, тканей языка, дна полости рта, щеки, удалением шейной клетчатки.
Нейтроны в сочетанной гамма-нейтронной терапии применяли 258 (21,6 %) больным четвертой группы. У 36 (3 %) из них в начале курса лечения проводилась дистанционная нейтронная терапия РОД 1 Гр через день до СОД 3-4 Гр. Относительная биологическая эффективность (ОБЭ) нейтронов равнялась 4,0. В качестве источника быстрых нейтронов использовался пучок канала Б-3 исследовательского центра БР-10 ГНЦ РФ – Физико-энергетический институт, на котором был создан специальный медицинский блок. Далее проводилась ДЛТ по 2 Гр 5 раз в неделю до СОД, эквивалентной 60 Гр. Еще у 222 (18,6 %) больных при проведении сочетанной гамма-нейтронной терапии были использованы источники 252Cf. Суммарная масса радиоактивного вещества в них колебалась от 2,4 до 13,53 мкг при мощности дозы от 3,43 до 25,2 сГр/ч. СОД от внутритканевого этапа, при проведении сочетанной лучевой терапии по традиционной методике, составляла 4,0-6,0 Гр, при нетрадиционных – 3,5-5,0 Гр. Облучаемые объёмы в своем сечении имели форму квадрата, прямоугольника или эллипса. Продолжительность внутритканевой терапии источниками 252Cf в зависимости от величины и мощности дозы колебалась от 24 до 120 часов.
В 64 (5,4 %) наблюдениях был проведен традиционный курс сочетанной ЛТ. На первом этапе – ДЛТ после соответствующей подготовки, полной топометрической информации о характере опухолевого процесса. На основании данных рентгенологического исследования всем больным изготавливали индивидуальные топометрические карты поперечного среза черепа с точным нанесением контуров опухолевого очага на уровне его центра и всех окружающих анатомических структур. Кроме этого, изготовляли топограмму на уровне середины шеи. Дозиметрическое планирование дистанционного облучения осуществляли с использованием систем планирования «Selectron» и «Teroplan». При этом опухоль и окружающие ее ткани на расстоянии 2-3 см получали максимальную поглощенную дозу. Поглощенные дозы в окружающих опухоль критических органах и тканях не превышали уровней толерантности. Размеры полей варьировали от 6 x 9 см до 8 x 10 см. Облучение проводили в режиме традиционного фракционирования РОД 2 Гр до СОД 40 Гр. Второй этап – внутритканевую нейтронную терапию – проводили через 2-3 дня после исчезновения лучевой реакции со стороны слизистой ротоглотки.
Лучевое лечение 44 (3,7 %) пациентам начинали с подведения двух крупных фракций, 5 Гр и 3 Гр, через день на первичный очаг и зоны первого барьера регионарного метастазирования. На следующий день после окончания первого этапа проводили внутритканевое облучение первичного очага.
Еще у 114 (9,6 %) больных на первом этапе лечения проводили внутритканевую терапию с использованием штырьковых источников 252Cf, а на втором этапе – через 5-7 суток после нейтронного облучения – дистанционную лучевую терапию на первичный очаг и зоны регионарного лимфатического оттока в режиме стандартного фракционирования до СОД 40 Гр.
47 (18,2 %) пациентам с неполной регрессией регионарных метастазов выполняли плановую лимфодиссекцию через 5-6 недель после завершения ЛТ.
В 31 (12 %) наблюдении, в случае выявления остаточной опухоли, прибегали к хирургическим вмешательствам, при этом расширенные и модифицированные варианты иссечения клетчатки шеи выполнены нами у 14 (5,4 %) больных.
Для радикального удаления новообразований у 15 (5,8 %) пациентов выполнена резекция тканей полости рта, нижней губы с удалением надкостницы и резекцией нижней челюсти.
Выраженность лучевых повреждений нормальных тканей в зоне облучения оценивалась по классификатору RTOG [6]. Статистическая обработка результатов проводилась с помощью компьютерной программы «STATISTICA for Windows» фирмы Stat Sofort, версия 6.0, статистически значимыми считались отличия p<0,05. Вычислялся критерий соответствия χ 2 Пирсона, t-критерий Стьюдента.
Результаты
Местные лучевые повреждения были выявлены у 252 (21,1 %) из 1192 больных в сроки от 3 до 110 мес. (в среднем 22,7 ± 6,4 мес.). Распределение пациентов по группам в зависимости от сроков возникновения ЛП представлено в таблице 1.
Таблица 1
Распределение пациентов по группам в зависимости от сроков возникновения лучевых повреждений
В таблице 1 видно, что у 129 (51,2 %) больных лучевые осложнения появились в первый год после окончания лечения, у 72 (28,6 %) они развились в течение 12-24 мес. и у 51 (20,2 %) – через 24 мес. Достоверных различий в сроках возникновения ЛП в зависимости от методики лечения выявлено не было, р=0,7523. Необходимо подчеркнуть, что данная закономерность сохраняется также и во всех подгруппах. Таким образом, в нашем исследовании показано, что используемые методики лучевого и комбинированного лечения злокачественных опухолей головы и шеи не оказывали существенного влияния на сроки возникновения ЛП.
Дальнейший анализ частоты развития поздних осложнений показал, что наибольшее их количество было выявлено при традиционном фракционировании дозы – у 115 (23,7 %) из 486 больных. Причем у 99 (25,5 %) из 388 пациентов, получивших курс конвенциональной лучевой терапии в самостоятельном варианте, и у 16 (16,3 %) из 98 больных, где наряду с лучевой терапией использовалась адъювантная полихимиотерапия, р=0,0626. Очевидно, что последняя не влияла на прогноз заболевания.
Среди 244 больных с опухолями области головы и шеи, которым проводился радикальный курс ДЛТ в режиме условно-динамического фракционирования дозы, у 54 (22,1 %) были выявлены местные лучевые осложнения. При использовании терморадиотерапии поздние повреждения развились у 21 (21,6 %) из 97 пациентов, при облучении с регионарной внутриартериальной гипергликемией и химиотерапией – у 14 (22,6 %) из 62 больных, при лучевом лечении с комплексной радиомодификацией – у 19 (22,4 %) из 85 человек. Различия не были значимыми как внутри этой группы (р=1,0000), так и в сравнении с группой, где применялась традиционная методика (р=0,7100). Следовательно, включение в схему комбинированного лечения средств, усиливающих биологическое действие ионизирующего излучения, в сроки от 3 мес. и более, не повышает риск развития ЛП.
Применение ДЛТ в режиме ускоренного суперфракционирования с неравномерным дроблением дневной дозы позволило снизить частоту ЛП на четверть. Так у 38 (18,6 %) из 204 больных сформировались осложнения в виде лучевых язв и остеорадионекрозов. При использовании методики неравномерного дробления дневной дозы на две фракции: 1+1,5 Гр и 1+2 Гр, лучевые повреждения развились соответственно в 17 (19,7 %) из 137 и в 11 (16,4 %) из 67 наблюдений, р=0,5163. Сравнительная оценка частоты развития поздних лучевых осложнений у пациентов при традиционном и нетрадиционном фракционировании дозы не продемонстрировала существенных межгрупповых различий, р=0,2699. Кроме того, имела место тенденция к существенному сокращению возникновения ЛП при суточном дроблении дозы и одновременного обеспечения адекватного терапевтического эффекта, который при использовании традиционных способов достигается радикальными дозами. Следовательно, методика двукратного дробления дневной дозы не снижает восстановительные способности облученных тканей и уменьшает отдаленную токсичность, вносимую лучевым компонентом.
При сочетанной гамма-нейтронной терапии больных опухолями головы и шеи частота поздних осложнений составляла 17,4 % (45 из 258 наблюдений). При более детальном изучении было выявлено, что лучевые повреждения чаще встречались после дистанционной гамма-нейтронной терапии, в 27,8 % (10 из 36), и в 15,7 % (35 из 222) наблюдений – после контактной нейтронной терапии источниками 252Cf в сочетании с дистанционной лучевой терапией, р=0,0963.
Частота поздних ЛП при использовании разработанной в клинике МРНЦ методики сочетанной гамма-нейтронной терапии, включающей быстрые нейтроны реактора, не превышала величин, наблюдаемых при реализации современных методик дистанционной гамма-терапии, р=0,1026. А при использовании внутритканевой нейтронной терапии источниками 252Cf и вовсе приблизило их к минимальным показателям, р=0,0290. Таким образом, сочетанная внутритканевая нейтронная терапия источниками 252Cf по сравнению с дистанционными методами облучения снижает риск возникновения лучевых повреждений в условиях сложной топографической анатомии и близкого расположения жизненно важных структур челюстно-лицевой области с 22,4 до 15,7 %.
Несомненный интерес представляют сведения о влиянии методики лечения на частоту возникновения различных форм ЛП. Данный анализ был проведен с целью определения общих тенденций при образовании отдаленных осложнений комплексного лечения злокачественных опухолей головы и шеи. Формирование фиброзных изменений тканей в границах полей облучения той или иной степени выраженности наблюдалось у всех пациентов, в сроки от 3 до 62 мес. (в среднем 16,3 ± 1,7 мес., таблица 2).
В таблице 2 видно, что большинство фиброзных изменений – 63,4 % – появились в течение первого года после облучения, а в течение последующего года – у 92,3 % больных. Сроки замещения нормальной ткани на фиброзную в I группе колебались от 3 до 62 мес. (16,2 ± 1,7 мес.), во II – от 5 до 37 мес. (13,1 ± 2,2 мес.), в III – от 3 до 21 мес. (9,4 ± 5,1 мес.) и в IV – от 3 до 18 мес. (9,7 ± 4,8 мес.).
Таблица 2 Частота проявлений местных лучевых повреждений в зависимости от продолжительности латентного периода
|
Вид лучевого повреждения |
Продолжительность латентного периода, мес. |
|||||
|
< 6 |
6-9 |
9-12 |
12-18 |
18-24 |
> 24 |
|
|
Фиброз |
298 (25 %) |
242 (20,3 %) |
216 (18,1 %) |
183 (15,4 %) |
161 (13,5 %) |
92 (7,7 %) |
|
Язва |
29 (14,2 %) |
31 (15,2 %) |
38 (18,6 %) |
38 (18,6 %) |
39 (19,1 %) |
29 (14,2 %) |
|
ОРН |
- |
14 (13,1 %) |
17 (15,9 %) |
26 (24,3 %) |
28 (26,1 %) |
22 (20,6 %) |
ОРН – остеорадионекроз.
Длительность латентного периода постлучевого фиброза в исследуемых группах существенно не различалась, р=0,0668. Вместе с тем, имеет место тенденция к сокращению сроков фиброзной трансформации облученных тканей при нетрадиционных режимах фракционирования, дозы ДЛТ и брахитерапии.
В группе больных, страдающих местными лучевыми повреждениями, фиброзные изменения, как правило, предшествовали развитию патологических проявлений со стороны мягких тканей и костных структур челюстно-лицевой области и шеи. В частности, поздние лучевые язвы и ОРН нижней челюсти во всех наблюдениях сформировались на фоне имеющихся фиброзных изменений кожи и слизистых оболочек. Лучевые язвы образовались в сроки от 5 до 110 мес. (19,7 ± 2,1 мес.):
-
• в I группе – от 6 до 92 мес. (21,9 ± 2,8 мес.);
-
• во II – от 5 до 110 мес. (18,9 ± 1,9 мес.);
-
• в III – от 6 до 62 мес. (17,9 ± 2,4 мес.);
-
• в IV – от 5 до 60 мес. (16,9 ± 2,2 мес.), р=0,7546.
В течение первых 6 месяцев ни у одного больного не было отмечено каких-либо осложнений со стороны костных структур области головы и шеи. ОРН нижней челюсти развился в сроки от 6 до 102 мес. (23,6 ± 1,2 мес.):
-
• в I группе – от 6 до 102 мес. (26,3 ± 3,5 мес.);
-
• во II – от 7 до 62 мес. (23,1 ± 2,7 мес.);
-
• в III – от 6 до 96 мес. (23,2 ± 2,8 мес.);
-
• в IV – от 7 до 68 мес. (19,4 ± 3,5 мес.), р=0,9514.
На основе рассчитанных доверительных интервалов можно утверждать, что фиброз, как первичный элемент, является причиной развития других местных лучевых повреждений, р=0,0119. То есть на момент формирования фиброзных изменений кожи и подкожной клетчатки можно прогнозировать появление других местных лучевых повреждений в будущем. В частности, на фоне фиброза челюстно-лицевой области и шеи в будущем развитие лучевой язвы, ОРН нижней челюсти и их сочетание можно ожидать в 12,2; 4 и 4,9 % случаев соответственно, таблица 3.
Таблица 3
Частота развития поздних лучевых повреждений в зависимости от методики облучения
|
Группа больных |
Вид лучевого повреждения |
||
|
Лучевая язва |
ОРН |
Лучевая язва+ОРН |
|
Всего, n=1192 |
69 (14,2 %) 32 (13,1 %) 23 (11,3 %) 21 (8,1 %) 145 (12,2 %) |
20 (4,1 %) 11 (4,5 %) 7 (3,4 %) 10 (3,9 %) 48 (4 %) |
26 (5,3 %) 11 (4,5 %) 8 (3,9 %) 14 (5,4 %) 59 (4,9 %) |
Прослеживается приблизительно одинаковая частота возникновения в изучаемых группах таких осложнений как лучевая язва, ОРН и комбинация язвы и ОРН. Наряду с этим отсутствует достоверная зависимость между различными ЛП и методикой проведенного лечения, р=0,0579.
В нашей работе мы попытались определить вероятность развития различных форм лучевых повреждений в зависимости от методики облучения и локализации опухоли. Так, из 252 больных поздние осложнения развились у 78 (28,8 %) пациентов после лучевого или комбинированного лечения рака дна полости рта, 64 (19,2 %) – ротоглотки, 41 (17,9 %) – языка, 32 (17,3 %) – мягких тканей головы и шеи, 21 (20,4 %) – нижней губы, 9 (26,4 %) – десны, 7 (18,4 %) – щеки. Эти данные представлены в таблице 4.
В таблице 4 видно, что риск возникновения ЛП у больных с локализацией опухоли в области дна полости рта и десны оказался выше, чем у пациентов, страдающих злокачественными новообразованиями нижней губы, щеки, языка, ротоглотки и мягких тканей головы и шеи.
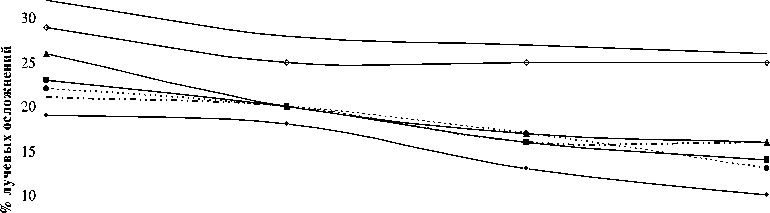
Эти показатели представлены на рисунке 1, на котором отражено процентное соотношение частоты возникновения осложнений в зависимости от локализации опухоли и их распределение в группах.
Частота лучевых повреждений в зависимости от локализации опухоли и методики облучения
Таблица 4
|
Группа больных |
Локализация опухоли |
||||||
|
нижняя губа |
десна |
дно полости рта |
язык |
щека |
ротоглотка |
мягкие ткани головы и шеи |
|
|
I, n=486 |
11/43 (25,5 %) |
4/14 (28,6 %) |
30/92 (32,6 %) |
13/56 (23,2 %) |
4/18 (22,2 %) |
30/143 (20,9 %) |
23/120 (19,2 %) |
|
II, n=244 |
1/5 (20 %) |
2/8 (25 %) |
17/60 (28,3 %) |
9/44 (20,5 %) |
1/5 (20 %) |
19/94 (20,2 %) |
5/28 (17,9 %) |
|
III, n=204 |
1/6 (16,7 %) |
2/8 (25 %) |
12/45 (26,7 %) |
8/50 (16 %) |
1/6 (16,7 %) |
12/73 (16,4 %) |
2/16 (12,5 %) |
|
IV, n=258 |
8/49 (16,3 %) |
1/4 (25 %) |
16/61 (26,2 %) |
11/78 (14,1 %) |
1/8 (12,5 %) |
6/37 (16,2 %) |
2/21 (9,5 %) |
|
Всего, n=1192 |
21/103 (20,4 %) |
9/34 (26,4 %) |
75/258 (29,1 %) |
41/228 (17,9 %) |
7/37 (18,9 %) |
67/347 (19,3 %) |
32/185 (17,3 %) |
Примечание: в числителе – абсолютное число осложнений, в знаменателе – абсолютное число леченых больных.
I группа
II группа
III группа
IV группа
нижняя губа десна дно полости рта язык щека ротоглотка мягки е ткани головы и шеи
Рис . 1. Процентное соотношение частоты возникновения осложнений в зависимости от локализации опухоли и их распределение в группах.
При более детальном анализе частоты возникновения поздних осложнений в зависимости от локализации опухоли и методики облучения отмечены некоторые особенности. Например, лучевые повреждения у больных, получивших сочетанную внутритканевую нейтронную терапию с использованием источников 252Cf, при раке дна полости рта возникали чаще (25,5 %), чем при раке языка (14,1 %). Вероятно, это связано с травмой слизистой оболочки альвеолярного отростка нижней челюсти направляющей пластиной. Кроме того, кровоснабжение тканей дна полости рта значительно уступает хорошо оксигенированным тканям языка. Проведение комплексной оценки формы ЛП в зависимости от применяемых методик гамма-нейтронной терапии не представляется целесообразным ввиду малочисленности данных. ЛП при раке дна полости рта и раке десны возникали чаще (28,5 %), чем при раке нижней губы, щеки, языка, ротоглотки и мягких тканей головы и шеи (18,6 %), р=0,0003. Такое значимое различие можно объяснить, прежде всего, близостью расположения опухоли к нижнечелюстной кости и существенной лучевой нагрузкой на последнюю.
На рисунке 1 видно, что частота возникновения осложнений у больных раком дна полости рта и десны во всех группах превышает таковые при других локализациях опухоли. Тем не менее, наибольшее сближение кривых во II группе говорит о нивелировании этого различия у больных злокачественными новообразованиями вышеперечисленных локализаций при использовании локальной УВЧ-гипертермии, регионарной внутриартериальной химиотерапии и гипергликемии. Следовательно, включение в схему лучевого лечения радиомодификаторов приводит к некоторому повышению частоты осложнений среди больных раком нижней губы, щеки, языка, ротоглотки и мягких тканей головы и шеи.
Анализ частоты развития местных повреждений в зависимости от лучевой нагрузки показал, что в группах больных, которым была проведена дистанционная гамма-терапия, при ВДФ менее 75 ед. осложнения развивались в 52 (33,3 %) наблюдениях. Радикальный курс ДГТ и сочетанной гамма-нейтронной терапии с лучевой нагрузкой до 100 ед. ВДФ явился причиной поздних осложнений у 133 (15,4 %) пациентов, а более 100 ед. – у 67 (38,1 %) больных (таблица 5).
Таблица 5
Частота развития местных лучевых повреждений в изучаемых группах в зависимости от показателя ВДФ
|
Группа больных |
Показатель ВДФ, ед. |
||
|
< 75 |
75-100 |
> 100 |
|
|
I, n=486 |
34/109 |
35/251 |
46/126 |
|
(31,2 %) |
(14 %) |
(36,5 %) |
|
|
II, n=244 |
15/37 (40,5 %) |
32/191 (16,8 %) |
7/16 (43,8 % ) |
|
III, n=204 |
3/10 |
27/175 |
8/19 |
|
(30 %) |
(15,4 %) |
(42,1 %) |
|
|
IV, n=258 |
- |
39/243 (16 %) |
6/15 (40 %) |
|
Всего, n=1192 |
52/156 |
133/860 |
67/176 |
|
(33,3 %) |
(15,4 %) |
(38,1 %) |
|
Примечание: в числителе – абсолютное число осложнений, в знаменателе – абсолютное число леченых больных.
В таблице 5 видно, что при ВДФ до 75 ед. поздние осложнения ЛТ в виде язв и ОРН развивались через 31,2 ± 15,4 мес. (15-110 мес.), а при суммарной дозе, превышающей 100 ед. ВДФ, – через 10,7 ± 2,8 мес. (6-14 мес.), р=0,0029.
Таким образом, применение радикального курса ЛТ в самостоятельном или сочетанном варианте, при показателях ВДФ, не превышающих 100 ед., вызывает развитие местных ЛП реже, чем в наблюдениях, где лучевая нагрузка превышает показатель ВДФ 100 ед., р<0,0001.
В случаях, когда показатель ВДФ не превышал 75 ед., развитие патологических изменений было выше, нежели в наблюдениях, где очаговая доза была эквивалентна 75-100 ед. ВДФ, р<0,0001. Вероятно, такое положение обусловлено фактором оперативного вмешательства и объемом облученных тканей, а также особенностями индивидуальной чувствительности к ионизирующему излучению и погрешностями при проведении лучевой терапии.
В составе комбинированного метода лечения в 184 (15,4 %) случаях продолженного роста первичной опухоли и в 285 (18,5 %) наблюдениях неполной регрессии регионарных метастазов применяли хирургические вмешательства.
В послеоперационном периоде, при расширенных и модифицированных вмешательствах на боковом лимфоколлекторе шеи, случаев развития ОРН отмечено не было.
Воспалительные изменения нижней челюсти и окружающих мягких тканей с выраженным болевым синдромом, расхождением краев операционной раны и образованием на коже язв, свищей с гнойным отделяемым отмечены у 64 (34,8 %) больных в сроки от 5 до 19 мес. (10,5 ± 4,3 мес.). В то время, как местные повреждения у 188 (22,1 %) из 851 пациента были выявлены после ЛТ, если хирургическое лечение не проводилось, в сроки от 6 до 102 мес. (28,7 ± 6,5 мес.). Различия статистически достоверны как по частоте (р=0,0004), так и по срокам (р=0,0002) возникновения поздних осложнений. Таким образом, операция в составе комбинированного метода лечения в случаях неполной регрессии первичной опухоли является предрасполагающим фактором в развитии поздних ЛП.
На фоне применяемого местного антифлогистического и антибактериального лечения явления воспаления постепенно стихали. Уменьшалась, а затем и прекращалась пиорея, рана постепенно заполнялась грануляционной тканью и эпителизировалась, как правило, после отхождения секвестров. В результате продолжающегося рассасывания костной ткани возникал перелом нижней челюсти и формирование ложного сустава.
Анализ частоты развития ЛП нижней челюсти в зависимости от объема оперативного лечения выявил следующие особенности.
При комбинированных операциях с иссечением обширных участков кожи околоушножевательной области, электрорезекцией языка, дна полости рта, щеки, тотальном или субтотальном удалением нижней губы без вмешательства на нижней челюсти остеорадионекроз диагностирован в 10 (15,3 %) из 65 наблюдений. При комбинированных операциях с удалением надкостницы и резекцией нижней челюсти – в 54 (45,4 %) из 119 наблюдений, р<0,0001, таблица 6.
Таблица 6
Частота развития остеорадионекроза нижней челюсти в зависимости от объема оперативного лечения и дозы лучевой терапии
|
Объем оперативного вмешательства |
Доза лучевой терапии |
|
|
до 40 Гр |
более 40 Гр |
|
|
Комбинированные операции без вмешательства на нижней челюсти |
1/25 (4 %) |
9/40 (22,5 %) |
|
Комбинированные операции с вмешательством на нижней челюсти |
15/56 (26,8 %) |
39/63 (61,9 %) |
|
Всего |
16/81 (19,8 %) |
48/103 (46,6 %) |
Примечание: в числителе – абсолютное число осложнений, в знаменателе – абсолютное число леченых больных.
В таблице 6 видно, что при увеличении лучевой нагрузки отмечается повышение частоты ОРН нижней челюсти с 19,7 % при очаговой дозе 40 Гр и менее до 46,6 % при очаговой дозе более 40 Гр, р=0,0002. Следовательно, лучевая терапия СОД более 40 Гр и последовавшая за ней операция, сопровождающаяся удалением надкостницы и резекцией окружающих мягких тканей, частично нижней челюсти в послеоперационном периоде приводили к нарушению питания костной ткани и как следствие к ее некрозу.
Заключение
Современные методики фотонной терапии больных опухолями головы и шеи характеризуются высокой агрессивностью, так как используются высокие суммарные очаговые дозы, измененные режимы фракционирования в сочетании с различными радиомодификаторами [1, 9]. При этом частота местных осложнений достигает 85 % [5]. Сравнительный анализ данных, полученных в нашем исследовании, во многом согласуется с данными мировой литературы. Местные осложнения после лучевого и комбинированного лечения выявлены у 252 (21,1 %) пациентов в сроки от 3 до 110 мес. Средняя частота проявления местных ЛП при ВДФ менее 75 ед. составляет 33,3 %, а при ВДФ от 75 до 100 ед. – 15,4 %. Учитывая существенные различия в показателях ВДФ и статистическую достоверность полученных результатов, такое положение можно объяснить фактором оперативного вмешательства и объемом облученных тканей, а также особенностями индивидуальной чувствительности к ионизирующему излучению и погрешностями при проведении лучевой терапии.
В результате ретроспективного анализа нами было выяснено, что независимо от метода комбинированного лечения и лучевой нагрузки чаще всего проявляются фиброзные изменения мягких тканей в самостоятельном варианте или в сочетании с другими местными осложнениями. На основании рассчитанных доверительных интервалов с достаточно высокой степенью вероятности можно утверждать, что фиброз, как первичный элемент, осложняется или является причиной развития других поздних ЛП. На момент формирования фиброзных изменений кожи и подкожной клетчатки с определенной достоверностью можно прогнозировать появление других местных повреждений в будущем. В частности, на фоне фиброза челюстно-лицевой области и шеи в будущем развитие лучевой язвы, ОРН нижней челюсти и их сочетания можно ожидать в 12,2; 4 и 4,9 % случаях соответственно. Достоверных различий в сроках возникновения поздних осложнений в зависимости от методики лечения выявлено не было, р=0,7523. Следовательно, комбинированное и комплексное лечение в сравнении с лучевой терапией в самостоятельном варианте не усугубляет восстановление окружающих опухоль нормальных тканей и позволяет добиться сходной реабилитации больных. Установлено, что риск возникновения лучевых повреждений у больных с распространением опухоли в области дна полости рта и десны оказался выше, чем при локализации первичного очага на нижней губе, щеке, языке, ротоглотке, мягких тканях головы и шеи, р=0,0003. Данное обстоятельство можно объяснить, главным образом, близостью расположения опухоли к нижней челюсти и существенной лучевой нагрузкой на последнюю.
Максимальная частота лучевых осложнений отмечена у больных, которым проводили курс конвенциональный лучевой терапии – 115 (23,7 %) наблюдений. Причем включение в схему лечения терморадиотерапии, регионарной внутриартериальной гипергликемии, химиотерапии через отдаленные сроки не повышает риск развития ЛП, р=0,71000. Минимальное количество ЛП установлено в группе пациентов, где использовалась сочетанная нейтронная терапия источниками 252Cf – 35 (15,7 %), р=0,00963. Следовательно, внутритканевая брахитерапия – это наиболее щадящий и чрезвычайно эффективный метод лечения, позволяющий обеспечить равномерное облучение и вызывающий наименьшее число осложнений со стороны окружающих нормальных тканей в условиях реализации максимальной суммарной очаговой дозы в первичном очаге.
Список литературы Местные лучевые повреждения после лучевого и комбинированного лечения злокачественных новообразований области головы и шеи
- Гулидов И.А., Мардынский Ю.С., Цыб А.Ф., Сысоев А.С. Нейтроны ядерных реакторов в лечении злокачественных новообразований. Обнинск: МРНЦ РАМН, 2001. С. 31-45.
- Павлов А.С., Фадеева М.А., Костромина К.Н. и др. Факторы время-доза-фракционирование и их использование в лучевой терапии злокачественных опухолей: метод. рекомендации. Москва, 1990. 36 с.
- Семин Д.Ю. Комбинированное лечение рака слизистой оболочки полости рта и ротоглотки (внутритканевая нейтронная терапия, дистанционная лучевая терапия, полихимиотерапия): дис. … канд. мед. наук. Обнинск, 2003. 135 с.
- Хосева Е.Н. Клинические варианты, особенности течения и дифференцированная терапия ранних лучевых реакций и повреждений кожи: автореф. дис. … канд. мед. наук. Екатеринбург, 2006. 21 с.
- Bhandare N., Monroe A.T., Morris C.G. et al. Does altered fractionation influence the risk of radiation-induced optic neuropathy?//Int. J. Radiat. Oncol. Biol. Phys. 2005. V. 62. P.1070-1077.
- Cox J.D., Stetz J., Pajak T.F. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC) [Editorial]//Int. J. Radiat. Oncol. Biol. Phys. 1995. V. 31. P. 1341-1346.
- Mendenhall W.M., Riggs C.E., Amdur R.J. et al. Altered fractionation and/or adjuvant chemotherapy in definitive irradiation of squamous cell carcinoma of the head and neck//Laryngoscope. 2003. V. 113. P. 546-551.
- Scully С., Epstein J., Sonis S. Oral mucositis: a challenging complication of radiotherapy, chemotherapy and radiochemotherapy. Part 2: Diagnosis and management of mucositis//Head & Neck. 2004. V. 1. P. 77-84.
- Trotti A., Bellm L.A., Epstein J.B. et al. Mucositis incidence, severity and associated outcomes in patients with head and neck cancer receiving radiotherapy with or without chemotherapy: a systemic literature review//RT&O. 2003. V. 66. P. 253-263.


