Метаболиты базидиальных грибов, эффективные в терапии рака и их молекулярные мишени: обзор
Автор: Змитрович И.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 3, 2015 года.
Бесплатный доступ
Рассмотрены история и современное состояние использования продуцируемых грибами базидио-мицетами веществ в терапии рака. Перечислены молекулярные мишени рака, связанные с его базовыми аспектами - митогенной гиперактивностью, уклонением от апоптоза, неоангиогенезом, клональной гетерогенностью. Показано, что грибные метаболиты могут быть задействованы в успешном воздействии практически на все основные мишени рака. Подробно рассмотрено опосредованное естественными киллерными клетками онкостатическое действие грибных р-глюканов. Показаны свойства ряда грибных метаболитов (хиноны, терпеноиды) игнибировать протеинкиназы, циклин-зависимые киназы, рецепторы эпидермального и эндотелиального факторов роста, хемо-кин NF-kB и металлопротеиназы, что ведет к аресту клеточного цикла раковых клеток, торможению неоангиогенеза, разблокировке проапоптотических путей и торможению опухолевой инвазии. Упоминаются грибы - продуценты витальных ядов и способ адресной доставки токсина до раковой ткани. Обсуждаются перспективы исследований лекарственных свойств базидиальных грибов. Показана необходимость сравнительного изучения воздействия низкомолекулярных ингибиторов пролиферативных путей на дифференцированные и стволовые раковые, а также здоровые проли-ферирующие клетки в свете представлений о циклозависимой химиотерапии. Обосновывается необходимость профилирования видов грибов по соотношению иммуностимулирующий и противовоспалительной активностей. Названы новые перспективные виды, сочетающие иммуностимулирующие и противовоспалительные свойства - Taiwanofungus camphoratus и Piptoporus betulinus. Обсуждаются онкопревентивные свойства базидиальных грибов.
Базидиомицеты, рак, таргетная терапия, бета-глюканы, тритерпеноиды, иммунотерапия, циклозависимая терапия, медицинские грибы, р-glucans
Короткий адрес: https://sciup.org/147204733
IDR: 147204733 | УДК: 582/284:
Текст научной статьи Метаболиты базидиальных грибов, эффективные в терапии рака и их молекулярные мишени: обзор
Начиная с 2010 г. в мире регистрируется более 14 млн новых случаев онкологических .заболеваний в год, и если существующая тенденция ежегодного прироста заболеваемости сохранится, через 20 лет эта цифра увеличится примерно вдвое. Наиболее распространены рак легкого (1.8 млн случаев 、 13% от общего количества зарегистрированных .заболеваний), рнк груди (1.7 млн, 11,9%), рак толстой кишки (1.4 млн, 9.7%), при этом наиболее распросгра ненным и причинами смертности стали метастатическое поражение легких (1.6 млн? 19.4% от общего количества), печени (0.8 млн? 9.1%) и брюшной полости (0.7 млн, 8.8%) [Forman et al.? 2014].
Основными методами лечения в онкологии до сих пор являются радикальная хирургия, цитотоксическая химиотерапия и лучевая терапия, при этом достаточно определились эффективность и сфера применения каждого из перечисленных методов в лечении конкретных онкозаболеваний. Основная проблема, однако, заключается в меньшей химио- и радиочувствительности злокачественных новообразований в сравнении с нормальными пролиферирующими тканями, чем обусловлены крайне негативные системные эффекты и последствия традиционных методов лечения. На сегодняшний день известно много жизненно важных («витальных») молекулярных мишеней (ферменты метаболизма ДНК и РНК, белки цитоскелета н теплового шока, дыхательной цепи митоховдрий), но они не* специфичны для рака [Blagosklonny, 2005].
В последние десятилетия осознание этого фундаментального противоречия привело к выработке « принципа ком плементарной онкотерапии» [Klaschka, 1996], подразумевающего взаимно усиливающее терапевтическое действие традиционных методов и методов иммунотерапии, проявляющих базисные онкостатические эффекты, демпфирующих побочные эффекты химио- и радиотерапии (лимф ( клгпрессия? миелосупрессия, интоксикация) и осуществляющих про 巾 илактнку рецидивов опухоли и сопз^твутощих инфекционных осложнений. Важной составляющей неспецифической и комбинированной иммунотерапии является использование биоактивных комплексов, синтезируемых рядом растительных и грибных организмов для активизации различных звеньев иммунной системы.
Целью настоящего обзора является оценка терапевтического потенциала метаболитов базиди-апьных грибов (Fungi, Basidiomycota), представление их молекулярных мишеней в нсопластичсски трансформированной клетке и рассмотрение основных онкостатичсских и иммуномодулир^тощих эффектов биоактивных комплексов, проецируемых базидиальными грибами.
Злокачественная ткань, ее ун и версал ьн ые свойства и молекулярные маркеры
Концепция злокачественных новообразований. В англоязычной традиции злокачественные новообразования именуются кратким термином cancer (рак), в то время как в отечественной традиции раком именуется наиболее распростри ненный класс злоі^ічественных образований, происходящих из эпителиальной ткани. То обстоятельство, что англоязычные публнкацнм определяют архитектору переднего края онкологии термины «рак» и «раковые клетки» используются в onpejeneHHOftf контексте при обсуждении не только карцином, но также гемобластозов, сарком и глиом в отечественной литературе* В некоторых контекстах б качестве синонима термина «злокачественные новообразования», помимо рака в широком смысле, используются также термины «неоплазии» и «неоплазмы». хотя, строго говорЯк они означают лю бое. а не только злокачественное новообралование*
В свете современных знаний о злокачественных новообразованиях рассмотрение их в качестве гнез 口 пролиферирующих клеток, не буд 户 к лишенным практического смысла, представляется недостаточным. Речь идет о комплексной ткани, отличительными признаками системообразующих элементов которой - раковых клеток - являются: 1) развитая способность к автономной генерации пролиферативных сигналов, 2) нечувствительность к экзогенным регуляторам и ингибиторам роста, 3) повышенная устойчивость к программируемой клеточной гибели - апоптозу. 4) преодоление пролиферирующими клонами лимита Хейфлика (репликативное бессмертие), 5) способность к стнму-.тяции ангиогенеза, 6) повышенная способность к диссеминации - тканевой дезинтеграции, образованию циркулирующих раковых клеток, микроэмболов, микрометастазов [Hanalian, Weinberg. 2000]. 7) перепрограммированным метаболизмом, 8) повышенной способностью уклонения от ИМ МУННОГО надзора* Эти особенности проявляются на фоне генетической нестабильности и адаптогенно-сти клонов, а таюке воспалительной реакции, усиливающей их злокачественные особенности [Hanahan, Weinberg, 2011].
Пролиферативная автоноуіизацпя и имуіор-талшация. Регуляция клеточного цикла в своей основе определяется взаимодействием регуглятор-ных слбъединиц - циклинов и каталитических субъединиц - циклинзависимых киназ (Cdk). интегрирующих митогенные и ингибирующие рост сигналы. В нормальной клетке Cdk находятся в комплексе с малыми ингибигорными молекулами -белками Семенегв INK4 (р15、р16, р18. р19) и С【Р/К【Р (p2L р27? р57); хз белки (а таюкс кодирующие их гены) получили название опухолевых супрессоров. 1к>мнз0 малых рінгиоріторньтх молекул регуляция акгивносги гирозинкина:^ определяется реглляп>рной активностью двух вах<ных п卩о-iVUHOB - Rb и Р53. I Іервый, находясь в норме в ги-пофосф op pi л ированном состоянии, связывает тран-скрипцрюнный 巾акт口卩 上2匕 препятствуя образованию им транскрипционно-атсгивньтх комплексов с эффекторами пролиферации - белками семейства Мус. Второй блокирует сразу несколько звеньев пролиферации, угнетая Cdk посредством активации p2L связываясь со многими факторами репликации, репарации и транскрипции, репрессируя ряд онкогенов (например. bcl-2; tbs; VEGF), стимулируя репарацию с параллельным ингибировп-нием репликации ДНК [Fukasawa et nL, 1997; Amundson et al., 1998: Sherr, McCormi* 2002; Deshpande et a].: 2005].
В норме все перечисленные молекулы действуют совместно в іквет на сигналы продолжения или осгановки КЛСГО4Н0Ш цикла. Мигогсн-акгиви- 口口阅 иные іірогеинкшіаізы запускаюг каскад собы-гий. и ісі ом когорого являсгся вхождение клегки в ми юз. Сгабильносгь зке пос гм и шги ческой фазы G0/G1 g возможностью на этом этапе клеточной ди ( | )( | ) срс н ци ров к и и специализации, включая необратимое «зистьтванис» в фазе G1, определяется слаженной работой пула ин гиб и горных молекул. Мутационные реаранжировки, амплификация pi л и гипсрэкспрсссия циклді новых генов, поломка гс-н or- рег\ляторов Rb и р53 ведут к разрушению сбалансированной системы контроля клеточного цикла. Фосфор ил ирован ие белка Rb пиклрінзави-симыми киназа.ми позволяет клетке безостановочно проходить ключевую точку GI — S. В результате дерепрессии транскрипционного фактора Е2Ғ теряется зависимость размножения клетки от негативной реглляии и пролиферации посредством экзогенных ростовых факторов и других системных сигнальных молекул |Testy; 1996. Копнин. 2000, 2002; Князькин. Цыган. 2007] и происходит интенсивная выработка клеткой собственник ростовых факторов (PDGF, FGF), рецепторов к экзогенным факторам роста (EGF-R, Ret. Rns) : транскрипционных факгоров (Мус. Jun) [Hunter, 1997]. Так pea-лизукугся ива базовых свойсгва злокачссгвснных клеток - высокая с гснснь ав гоном нос ги в генерации пролиферагивных сигналов и нечувегви ІЧ^ІЬ-нпсть к ^к югенным pci уля горам рост
Кроме того, аітівизаңия путей бесконтрольной пролиферации и вовлеченных в то і веі с ] вующи с сигнальные каскадь ( белков семейства Мус 、 обладаю іцих тел ом с 卩 а зной активностью, позволяст клетке осуществлять элонгацию концевых участков хромосом, что разрунтаст «счстн ( . ) -ограннчи-тельный» механизм клеточных делений и ведет к потенпиальной иммортал 网 за ңирі клана [Greider.
1998; Kiyono et al.? 1998; Волкова. Немова. 2006]
Уклонение от нпоптоза. Апоптоз — одна різ разновидностей программируемой гибели клеток, реализуемая с участи ем каеппз и эндонуклеаз, которые, будучи активированными на me югообразных сигнальных путях, осуществляют последовательную разборку цитозольных белков, фрагментацию ДНК с сохранением целостности клеточной мембраны Претерпевшая апоптоз клетка распадается на многочисленные окруженные мембраной апопгозные ] ельца, у гили дуемые макрофаіями. Это - механизм отбраковки мпогоклеточЕіым ор- ІЯІ1ИЗМ0М МОДуЛСЙ, НОЛучаЮЩИХ ІфОГЯЖСіІІІЫС или міюжесгвепные повреждения Д] ІК. Процесс аноп-тиаа можег бы гь запушен как экзогенными, іяк и эндогенными сигналами, причем болыиинсгво его “¥】 с 百 прямо или косвенно рсіулируюгся главным клсгонным он косу 11 рессором - геном р53 (рис. 1).
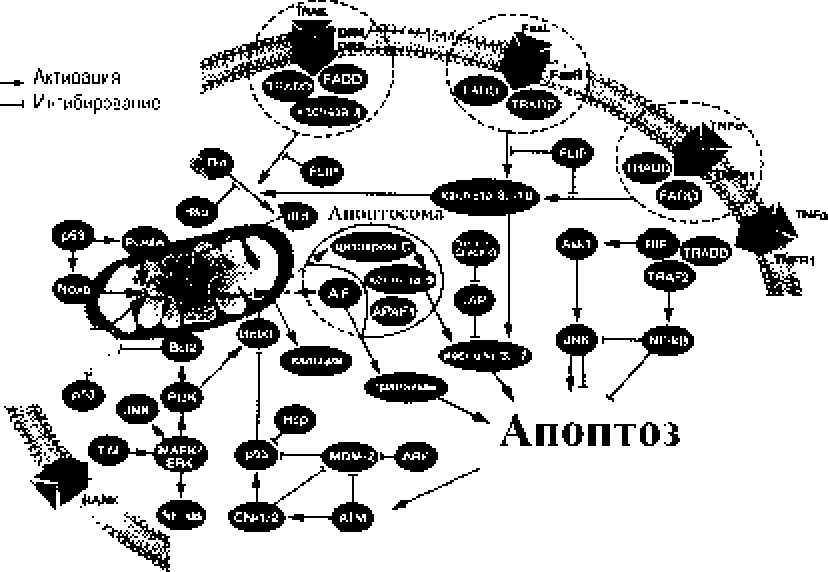
Рис. 1* Основные звенья и си гневные п\т 网 апоптоза. Ингибирование TNF-нндуциро-ванного пути апоптоза транскрип црю нным фактором NF-кВ [по: Змитрвич, 2014]
Fas-зависимый путь апоптоза индуцируется контактом ряда лигандов (] as-ли ( анд? I Nl -a. П.), предъявляемых иммуноңитами (Т-лимфоциты, ак-тнвнрова.нныс сстсствснньтс кріллерьт) под лежащим и перепрограммированию на гибель клеткам, имеющим на своей поверхности «домен смерти» (рецепторы Fns. TNF I и 2, DR. DCR) |Nagata, Gol stein. 1995], Взаимодействие Fas-л и ганда с Fas-рецептором приводит к кон форм анион н ы м изменениям последнего, ведущим к активации прокас-пазы-8 и последующим процессингом каспаз-3, 6-и -7 [Lacour et М , 2003]. Bcl-2-зависимый (мнто-хондриалыіый) путь апоптоза связан с экзогенными и элдогеиными нарушениями целосгносги мембраны митохондрий, набуханием митохондриального ма гр икса и выходом гв нет в цигопла^му клегки ряда іі^апоіггсггических агетов - ци го-хрпма С, прокаспа:^ -2 : -3. -9 н флавопрогсинов АРЛҒ-1 и А1Г . Первый учасгвуег в акгивации кас-па:іы-9. когорая, н свою очередь, ірансакгивирусг каспазы -3, -6 н -7. а в горой индуцируе] процесс кондснсапии хроматина и фрагментацию я дерн ой
ДНК [Susin el aL 1999]. Ключевая роль в активации митохондриального пути апоптоза принадлежит находящимся под непосредственным контролем транскрипционного фактора р53 митохондриальным трансмембранным комплексам Вс12 Вс1-xL, Noxa и PUMA, а также цитоплазматическом^7 белку Вах, изменение активности которых приводит к открытию каналов и образованию пор, нерва которые в цитоплазму выбрасывается ряд про-апоптотических агентов tAshkenazi, Herbst. 2()()Х: Черешнев и др.: 2011].
Другие тактики пролиферирующих клонов, позволяющие им уклоняться от апоптоза, проявляются в отборе клеток с поврежденными генами Вах, Bad, Apaf-L цитохром С-зависимых каспаз и, соответственно, заблокированным м итокондриально-опосредованным апоптотическим путем [Wolf el al.? 2 001 ; Heiser et al.. 2004]. клеток с гиперэкс-прсссисй Bcl-2t MDM2 - проектов, ингибирующих проапоігготичсскис факторы Вах и р53 [Rccdn 1999], клеток с подавленной экспрессией рецепторов «домена смерти», что позволяет им избегать Fas-опосредованный апоптоз [Friesen et aL 1999]“ то есть выходить из-под иммунного надзора.
Стимуляция ангиогенеза. Несмотря на относительно низкий катаболический потенциал, злокачественная ткань нугждается в притоке кислорода и пластических ресурсов и оттоке углекислоты и экскретируемых веществ. В условиях ГИПОКСИИ в злокачественной ткани фиксируется повышение ровней экспрессии фактора роста эндотелия VEGF [Ferrara. 2009] и фибробластов FGF [Baerisnyl, Christofbri. 2009] - основных индукторов ангиогенного сигнала* Эндотелиальные клетки сосудов микроокружения опухолевого узла, получая ангиогенный сигнал через рецепторные тиро-Зинкиназы 3-х типов (VEGFR-1-3). приступают к пролиферации. Гистологические картины неова-сқуляризашіи атипичны за счет большей разветвленности капиллярной сети и ее меньшей связности в совокупности с мозаичностью - наличием в стенках сосудов, помимо клеток эндотелия, трансформированных эпителиальных (раковых) клеток [На па nan, Folkiiian, 1996], В последнее время внимание исследователей привлекли перициты - мезенхимальные клетки, ассоциированные со стенками сосудов, главной функцией которых яв.іяется пролиферативная аутокринная деятельность, в частности, активная продукция VEGF [Gaengel 口 aL, 2009].
Опухачевая прогрессия. Концепция трех основных вех озлокзчесгвления опухоли - инициации, промоции и прогрессии [Boutwell, 1974; Foulds, 1976; Турусов, 1992] - не устарела и в эру молекулярной онкологии, хотя общепризнано, что границы стадии промоции достаточно вариабельны и вхождение клона в стадию прогрессии определяется масштабом геномных перт>грбаций. а также качеством иммунного надзора. Данные, накопленные за последнее десятилетие, свидетельст- bjtot о том, что безусловными антагонистами рака среди имап нных клеток нвяяютсн лишь субпопу-.тяции макрофагов, цитотоксических Т-лимфоцтов (ЦТЛ) и естественных киллерных клеток (ЕКК)* в то время как функции других клеточных участников иммунного ответа (нейтрофилы, тучные клетки И даже отдельные С}гбпОП}гЛЯЦИИ Т- EI В-лимфоцитов) многообразны и в целом вписываются в сценарий опухолевой прогресснн* В ходе развития воспалительной реакции эти клетки распространяют такие сигнальные молекулы, как эпите-лиальный? эндотелиальный и фибробластный факторы роста (EGF, VEGF? FGF). хемокины и про-воспалительные цитокины, а также протеолитические ферменты, способствующие понижению плотности тканевого матрикса и опухолевой инвазии [Coffelt et al., 2010; Mantovani, 2010; Qian 、 Pollard, 2010].
Выход злокачсствснно-тра нсформ ирова иных клонов из-под контроля противоопухолевого крыла имшъной системы в период опухолевой прогрессии связан с истощением Т-депо, экранированием огп'холевых антигенов молекулами имш'ноглобу-лннов, отбором опухолевых клеток, экспресси-ртащих Fas-лигзнд. инициирующий апопточ ЦТЛ иЕКК. '
Диссеминация. Характер роста солидной опухоли определяется сигналами, поступающими из микроокружения. Ряд опосредоваиных интегрина-ми и Е-кадгерином сигналов может активировать транскрипционные факторы Snail. Twist, Zcbl/2? запускающие в клетках карцином программу «эпителиально-мезенхимального перехода». «Эпителиально-мезенхимальный переход» характеризуется изменением адгезионных свойств клеток поверхностных слоев опухоли , их инвазией в прилежащие ткани или преобразованием в популяции клеток локомоторного (амебоидного) фенотипа [Пожарисский. Савостьянов. 1976; Friedt Wolf 2010; Madsen* Sahai, 2010], Ключевая роль в ме-^енхимоидной и амебоидной трансформации эпителиальных клеток принадлежит уже упоминавшимся в связи с генерацией теломеразной активности белкам семейства Мус [Partanen et aL? 2009]. В клетке белки семейства Мус, именуемые также белками раннего ответа* «представляют интересы» цитоскелета и ассоциированной с ним архаичной системы, обеспечивающей «инстинкт выживания» клетки вне связи с регуляторными и проапаптоти-ческими сигналами клеточного консорциума [Змитрович, 2014].
Диссеминация (метастазирование) опухоли -многофазный процесс, включающий как механическое распространение клеток и их агрегатов из первичного очага в отдаленные ткани, так и их последующую адаптацию к микроокружению, причем эта адаптация может включать десятки программ [Talmage, Fidler, 2010]. Единицами миграции Мут быть инвазионные клетки, но часто имеет место распространение микроэмболов. вк„тю-чающи^ инвазионные, клоногенные и детерминированные раковые клетки, а также «дружественную» им строму - оп ) холь-ассоциированные фибробласты. эндотелиальные клетки и клетки про-воспалнгельного крыла именной системы [Hanahan* Wcunbcrg. 2011]+ Адаптация таких агрегатов к новому тканевом^7 оіфужению оказывается более успешной. В некоторых случаях первичный очаг может распространять системные факторы” угнетающие рост микрометастазов путем перевода их в «спящее» состояние. Активизация таких очагов может происходить б ситуации снятия ингибирующего влияния первичного очага [Demicheli et ]2008].
Столовые раковые кііеікн. Представления о стволовых раковых клетках еще не устоялись [Kreso, Dick* 2014]+ Изначально они были сформулированы применительно к миелоидной лейкемии [Bonnet. D 把к* 1997] и в дальнейшем распространены на і<арциномы. Стволовыми (по аналоши со стволовыми клетками нормальных тканей) были названы постоянно делящиеся раковые клетки - в противоположность их дериватам, имеющим детерм инирова нный рост и претерпевающим определенную дифференцировку. При иммунной или лекарственной атаке на опухоль дифференцированные клетки, составляющие ее основную пассу* погибают (регрессия оп)лхоли), а клетки с гиперактивными митогенными путями (что в большинстве случаев означает ингибирование п^тей апоптоза) естественно остаются, составляя так называемою пролиферирующую субтюпуляцшо (или «фракцию роста») опухоли, на основе которой опухоль может восстановиться. С другой стороны, опухолевые клетки, выходящие ПО тем или ИНЫМ Причинам на стабилизацию в фале G0 («заторможенна я с>бпо-пуляшш次 также способны возобновлять свой рост. Для обоих случаев более подходящим будет термин «опухоль-инициирутощие клетки» (tumor-initiating cells), нежели «стволовые раковые клетки» (stem cancer cells). По сути, ^стволовые раковые клетки» - зто наиболее агрессивные и адаптивные клоны, выживающие после стаңцартного именного и лекарственного воздействия. Вместе с тем, с точки зрения онкотерапии, такое «умножение сущностей» все же полезно, поскольку7 выводит на первый план необходимость особого подхода к резистентным клонам. Недавние исследования показали, что одним из механизмов усиления ре-зистхнтности раковых клеток к лекарственной терапии является отбор на аутофагозную активность -вакуолизацию периферической зоны цитоплазмы с упаковкой И пос吟дюпшм ЛИЗИСОМ лекарственных субстанций [White, DiPaola* 2009] + Уничтожение резистентных клонов возможно только с использованием комбинации «витальных» И «вспомогательных» токсических веществ (б частности, ЛИЗОСОМАЛЬНАЯ активность клетки снижается ингибиторами аутофагии - 3 -мети л аденином. бафило-мицином AI).
Имея б виду все упомянутые аспекты озлокаче-сгвления, таргетная молекулярная терапия рака, очевидно, в своей основе должна сводиться к блокировке и ингиброванию активностей его молекулярных мишеней - циклин-зависимых киназ, рецепторов ростовых факторов и ангиогенеза, про-воспалительных факторов, блокаторов апоптоза, по возможности - витальных мишеней, а также к стимулированию опосредсваиного ЕКК апоптоза трансформироваиных клеток.
История изучения лекарственных свойств бязидиальных грибов
Использование человеком базидиомицетов в лекарственных целях восходит к доисторическим временам [Pcintncr ct al.? 1998], С древности до наших дней сохраняются традиции терапевтіріе-ского использования грибов в странах Восточной Азии. Такие грибы, как Gano^erma lucidum (Рей-ши), Lentimda edodes (Шиитаке), 加口并 о 『"帛 obUquus (Чага), многие сотни лет используются народами Кореи, Китая, Японии и Сибири. В лечебнике «Бэньцао ганм>» («Компенди ) гм лекарственных веществ»)* написанном китайским ^еным Ли
Шичжэнем в 1578 г+, упоминаются такие лекарственные базидиомицетЫк как Ganodenna /н 匚〃力〃乩 Poly рог us unibellatas^ ТенеМа faciformis [Wasserh Weis. 1999]. На Западе интерес исследователей к лекарственным свойствам базидиальных грибов наметился после этноботанического труда Уоссонов «Грибы. Россия и история» [Wasson, WasgiL 1957] и вышедшей в том же году статьи Лукаса с соавторами, посвященной инпібированию роста опухолей экстрактами boletus e 』 W 污 и некоторых других видов [Lucas et aL, 1957]. Первый крупный обзор по онкоспітическийі свойстеам экстрактов базидиальных грибов принадлежит Грегори и соавторам [Gregory et al. ч 1966].
В 1969 г. коллективом авторов, возглавляемым Коматсу [Komatsu ct al.? 1969], был выделен и испытан глюкановый биоактивный комплекс, названный шизофилланом. обладающий выраженным иммуномодулирующим эффектом. В том же году Икекавой с сотрудниками открывается цикл исследований противоогв^холевых эффектов базидиальных грибов, огюсредуемн 工 имш нной системой [Ikekawa et aL : 196 9, 19 8 2, 1992^ к которым впоследствии присоединяется коллектив, возглавляемый Мнзуно [Mizuno. 1996; Mizuno el aL 1986“ 1992, 1996, 1998* 1999]t В 1970 rt из экстрактов Lentinula (Lentinns) erodes был вьщелен биоактивный комплекс, названный лентинаном [Chichara ct al.? 1970]. основу которого также составляла определенная фракция р-глюканов. Наконец, в 1984 г. было всесторонне изучено действие выделенного из Tranietes (СorioIns) versicolor полисахарид-белкового комплекса, названного крестином [Tsukagoshi et al.. I9S4].
Особое место в истории исследования противораковых базңдиильных грибов занимает чига (InomHus obhquus f. д7еп7м). Гриб активно использовался народами Сибири как полифункциональ-ное лекарственное сырье. Фарма кологическое изучение его было начато в 1864 г. Г. Драгендорфом в Юрьевском университете. После химических и клинических испытаний, проведенных профессорами П.А. Якимовым и П К. Булатовым [Булатов к др., 1959] лекарственное сырье чаги было признано фармакологическим комитетом Минздрава СССР в качестве паллиативного средства при распространенном опукилевом процессе. Прием экстрактов чаги достоверно улучшал показатели кроен, угнетал рост метастазов и улучшал общее са-моч^Бсгвие пациентов. В дальнейшем было показано, что основу биоактивных комплексов, поставляемых этим грибом* составляют полифснолы и тритерпеноид инотодиол. Таюке б сырье чаги были выявлены бетулин, траметеновая кислота* лано-становые производные, простые и сложные сахара” ароматические и жирные кислоты, адіинокислоты. полипептиды [Бал<1ндайкин? 2(“3] 一 В последнее время изучение биомедицинских аспектов применения чаги вновь активизируется [Белова. 2014: Шнырева 、 Ван Гринсвен, 2014; Zhao et al., 2014:
BalandavkiiL Zmilrovich* 2015; Glamoclija el aL 2015].
Подмечаемые б 1970-е гг+ японскими исследователями данные по им м}тноопосрсдованном>г онко-статичсском} действию шизофиллана* лентинана и других глюкановых комплексов, продуцируемых базидиальными грибами* не вызвали интереса у онкологов-клиницистов, имеющих дело в основном с опухолями на стадии прогрессии, когда им-муноопосредованная цитотоксичность уже недостаточна.
Однако исследования лекарственных грибов и их метаболитов были продолжены, и к концу 1990-X гг. накопление информации в этой области потребовало обобщения и систематизации [Денисова, 1998; Булах, 2001; Stamcts, 2005; Юй и 口 р., 2 00 9: Переведенцева, 2011; Феофилова и др.? 2013; ©н-липпова, 2013],
Начиная с 1980-х гг. формируется вторая волна клинических испытаний биоактивных субстанций грибов, в которых они использлтотся уже с учетом продшеств™щего опыта - в сочетании с химиопрепаратами и радиотерапией. Таковы испытания сочетанного действия лентинана, шизофиллана и крестина, показавшие достоверное увеличение медианы выживаемости пациентов с карциномами ЖКТ. улучшение их иммунологических показателей и качества жизни [Taguchi el aL 1982 : Fujimoto et at. 1991 ; Mitomi et al.. 1992 ; Gordon et aL 1995: Kodama ct al.? 2002]. Были проведены таюкс клинические испытания цитотоксических компонентов биоактивных комплексов базидиальных грибов (в частности. Ganodema lucidum) на неоперабельных стадиях с достоверным улучшением гематологических, им мунологических показателей и качества жизни [Gao et al., 2(Ю2. 2(М)3],
Достаточно активно иғ?учзется действие грибных метаболитов на раковые клетки методами молекулярной онкологии. Действию грибных йіета- оолитов на основные мишени раковой клетки посвящен следующий раздел настоящего обзора.
Грибные метаболиты н механизм их воздействия на злокачественно-грянсформированные клегки
Индукция апоптоза, опосредованного естественными киллерными клетками. Цитотоксическая активность иммуноцитов против широкого спектра опухолевых клеток-мишеней, предсушествую та я направленной иммунизации грызунов, была выявлена сравнительно ледавло и названа естестве]той киллерной активлостыо; обладающие такой акгивностью клегки были названы есгесг-венными киллерными клегками [Herbernian, 1981 ]. ЕКК - филогенетически древняя разновидность Т-клсток, хотя и ряд других субполуляций Т-лимфоцитов обладает подобным действием. Распознавание цитотоксически м и лимфоцриами злокачественных клеток происходит в связи си значительным снижением экспрессии последними антигенов главного комплекса гистосовмест имости ] типа (МНСI). В ходе контакта с раковымы клетками клетки-киллеры индуцируют либо Fas(OHO)-зависимый апоптоз, либо неспецифический лизис клетки путем контаминации их цитол ити чески м и гранулами, содержащими перфорин и гранзим В [Kagi et aL, 1996; Froelich et aL, 1996].
Это основной тип противораковой активности, генерируемой веществамн грибного происхождения —р-D-глюканам и или глюкан-протеиновыми комплексами* Биологическая активность этих веществ зависит от растворимости в воде [Ishibashi et al.. 2001], молекулярного веса [Mueller et al., 20001, степени разветвленности и присутствия р-
(1^6)-связей по ходу основной р-( 1^3) цепи [Cleary et al., 1999].
Полисахариды клеточной стенки грибов ложно распознаются клетками врожденного иммунитета в качестве инвазивного клона микроорганизмов, поскольку у этой группы иммуноцитов сформирован целый класс рецепторов, настроенных на распознание молекулярных фрагментов самых разных клеточных стенок [Недоспасов, 2013]. Глюканы, маннаньц хитозан* являющиеся основными гидрофильными компонентами клеточных стенок грибов, выступают для иммунных клеток как один из «патоген-ассоин ированньтх молекулярных обра-зов», будучи ком пл ем е нта р н ы м и ряду их рецепторов (Toll— dectin-l рецепторы) [Brown, GordorK 2001J. Иммунная система распознает эти фрагменты и значительно активизируется.
Механизм этой активизации сегодня в общих чертах уже ясен. Поступающие в желудочно-кишечный тракт грибные полисахариды, не подвергаясь ферменга гивному разрушению, захвагы-ваюіся клегками слизисгой оболочки кишечника н переносятся нм и в подслизистый слой, где происходит их взаимодействие с рецепторами макрофагов и дендритных клеток, поглощающих, частично расщепляющих эти вещества и связывающих их фрагменты с молекулами МНС1. В селезенке и лимфатических узлах эти а нт и ген - репрезентирунощи е клетки стимулируют гранулоциты и клетки-киллеры, ответственные за местный иммунитет. На приводимой на рис. 2 схеме можно видеть набор рецепторов и м м ун о ком пете н тн ы х клеток, задействуемых теми или иными компонентами клеточной стенки грибов [Lee, Kim, 2013: Змитрович, 20141 ,
CL-маннан -Ы-Сйя^аічі-іий ^[Л][|1И11 -О-снлзанһьіи маннан -
MaiiiiJHiiL -
Маігнлзл -
В-маиііозильі ・
Dectin-2
[j-глюкапы — ^^paL'Meu'nipiusaiiiJhje р - Н hl р-г;іюканғя —
[^-ГЛІПкіНТЫ —
Xid гш]<^ВҺ]й 匸丿】с它
Плазм ал ем ма
|
MR |
NF-kB 丄 |
|
|
TLR4 |
MyDBS. NF・k |
|
|
DC-SIGN |
||
|
5IGNR1 |
||
|
Gaiectin 3 |
NF-kB 亠 |
|
|
г Deetjn-J |
Svk |
|
|
、 CR3 |
Syk. PIM К |
|
|
、 TLR2, TLRfi |
MyD8B |
|
|
、 LacCer |
PI3K |
|
|
Рітк |
||
TNF-a
IL-1, TNF-«
IL-8. TNF-otJFNb
IL-10
TNF-ci
IU TNF-p
忆 12 包 1 也 "A.23, ROS, TNF-a
GM-CSF
IL 10, TGF 屮

М;ікрофаі н> іріну 〃 “цніи>
J^elJ/^pL1■J■■lJҺJe KJitJ'KM, Г-ки/ыеры
Рис, 2. Полисахариды клеточной стенки, ком пл иментарные нм рецепторы иммунных клеток — медиаторов врожденного иммунитета, набор продуцируемых иммунными клетками цитокинов [по: Змитрович, 2014]
Часть глюканов с током крови попадает в пе- чень, где захватывается купферовыми клетками.
выделяющими в ответ на это взаимодействие тот же набор цитокинов и активирующих системный иммунитет. По современным представлениям г роль развития имшъной реакщіи в условиях опу-холевой прогрессии противоречива: помимо нн-терферона и ФНО. имеющие выраженное онкоста-тическое действие, в тканевой жидкости фиксируется увеличение концентрации VEGF и EGF , проецируемых гран>7лоцитами и В-лимфоцитам и; все клеточные участники реакции (включая злокачественные клетки) повышают уровень активности NF-кВ, Тем не менее, в ситуации неистощенных депо ЕКК такого рода провоцирование иммунной реакции себя оправдывает, поскольку стимулирует массовый ЕККчэпосредованный Fas-апоптоз либо перфорин-зависим ый цитолиз.
И нгибиров ание митоген ной активности. Прямое действие грибных метаболитов нн экспериментальные наборы злокачественно-трансфор-мированных клеток показнло, что ингибирование ими митогенной активности может быть связано с несколькими принципиально важными направлениями: 1) ингибированием протеинкиниз - основного генератора пролиферативных сигналов, 2) арестом клеточного цикла, 3) нарушением МАРК-сигнального каскада.
Изучено действие грибных метаболитов бензохиноновой природы кла вил актонов А, В и D, продуцируемых СШосуЬе clavipes на раковые клетки и показана их выраженная ингибирующая активность тирозинкиназ Ret/plcl, v-AbL gc・ рин/трионин-киназы и главное, рецептора эпидермального фактора роста EGF, запускающего внутриклеточный пролиферативный каскад [Cassinelli et al., 20001 ,
Арест клеточного цикла грибными метаболитами наиболее изучен на примере тритерпеноидов, продуцируемых грибом Ganockrma lucldum. воздействие которых приводит к остановке клеточного цикла на фазе Gl/S [Zhu et al., 2000: Hu et al., 200 2; Yang, 2 005] или G2ZM [Jiang et al., 2004; Muller et al.、2006]. К настоящему времени известно 316 различных тритерпеноидов, продуцируемых грибами рода Ganodema - ганодеровых кислот, люцидумолов, люцидодиолов [Xia et hL, 2014], Их действие нн прохождение сверочных точек клеточного цикла опосредуется ингибированием циклинов Cdc2, В и DL протеинкиназы С, а также стимулированием экспрессии ингибитора циклинзависимых киназ гена р21 [Автономова, Краснопольская, 2013]. Арест клеточного цикла может вызывать также гликозид генистеин. продуцируемый, в частности,尸/削修卅〃〃理白 velalipes [Kang et al.? 2003]. В клетках гепатоцеллюлярной карциномы генистеин регулирует активность Cdc2-киназы и ингибитора клеточного цикла белка р21, что приводит к аресту клеточного цикла в фазе G2/M [Chang et al., 2004]; подобное действие оказывает полисахарид-пептнд, проецируемый Tratnetes verst со for [Chow et al.. 2003]. В раковых клетках с неповрежденным опухолевым супресс。一 ром р53 эффект ареста клеточного цикла в фазах G1/S и G2/M проявляют эргостерол- и ланостансо-пержащие экстракты Font i topsis pinicoia, действие которых опосредугется содержанием внутрмклетои-него глутатнона, регулирующего активность р 53 [Wang et al t 2014].
Міпоіхн-активируемые протеинкиназы (МАРК) являются своеобразными интеграторами сигналов, поступающих от различных рецепторных И нерецепторных тирозинкиназ, ЦИТОКИНОВЫХ рецепторов и рецепторов трансформ ирующего фактора роста и ключевыми участниками ответа на стрессорные сигналыһ зависящего от клеточного и внутриклеточного контекста* В МАРК-каскад неминуемо оказываются вовлеченными онкогенные белки (Ras. Raf). и клетка становится значительно менее чу ветвите льной к проапоптотическим сигналам [Hilger el aL 2002]. Активация или ингибирование молекул* вовлеченных в МАРК-сигнальную сеть, может вести как к усилению пр 。- лиферации. так и к пролонгации фазы G2 клеточного цикла. Наибольшие надсады на нарушение пролиферативных сигнальных пут^й связаны с протеином р38 [Wagner* Nebreda. 2009] t Воздействие тритхрпеноидной фракции мицелия Ganudenna lucidum позитивно коррелировало с остановкой роста (фаза G2) клеток человеческой гепатомы линии Huli-7 и экспрессией р38 (Lin el aL 2003]. Показано также, что модулирующее гиперактивацию митогенных сигнальных путей действие р38 может усиливаться биоактивными комплексами, поставляемыми Inunotus luileus [Cho el aL, 2002]t Панэ-пофенантрин (продуцент - Рткз lecumlei) препятствует эпигенетическому выключению митогенноактивированной клеткой опухолевого супрессора р27 и связанному с ним уклонению клетки от апоптоза [Sekizawa el al.. 2002].
Блокирование неоангиогенеза. Говоря о прогрессии опухоли и роли грибных метаболитов в борьбе с ней, нельзя обойти вниманием и вопрос опухолевого ангиогенеза. Хорошо известна максима «пресечь ангиогенез - победить опухоль». Грибные биоактивные комплексы были также изучены на предмет антиангиогенной активности. Наибольшую активность проявляли Ganoderma『笈一 с I clu hi, Taiwanofhngus camphorates. Agaric us mur-r〃厶;и в особенности Amyhporia xantha и Rigido poms ubnanus. Полагается, что фукозные и маннозные фрагменты продуцируемых этими грибами полисахаридных комплексов связываются с регуляторными участками фактора VEGF и блокируют действие этого фактора, запускающего генетическою программу ангиогенеза [Chen et al” 2005]. Следует помнить, однако, что обратной стороной блокирования ангиогенеза является активизация поп^'ляции клеток локомоторного фенотипа, массово отрывающиеся от «голодающей опухоли»-
Ингибирование провоспалительных факторов и бмокаторов апоптоза. Основоположник клеточной патологии Рудольф Вирхов определял рак как хронически незаживающую рану. Изложенные выше данные о вовлеченности в воспаление «провоспалительного крыла» иммунной системы и секреция комплексной раковой тканью мзтриксных мета л лопротеинз з позволяют наполнить такое определение новым содержиниеді.
Как упоминалось выше, основным провоспали-тельным фактором, конституционально связанным с опухолевой прогрессией, является хемокин NF-кВ. блокирующий JNK- и р53-опосредованные пути апоптоіа. Блигодиря исследованиям группы Эр-келя из грибов
Lent In us crini tus
и некоторых видов роди
Panus {Panus conchaius, Р.
『曰匸口订打^丁)
был выделен терпеноид гганэпоксидон, препятствующий деградации ингибирующей частицы №
・
кВ □
IkBcu б
результате чего этот тра нскрипционный фактор остается связанным и не реагирующим на внешние стимулы [Erkel et al., 1996], Позднее из штамма аскомицетз
Ху lari а
45*93 был выделен циклоэпоксидон [Gelirt el al., 1998]. а из
Ранах conchatus
- нзопанэпоксидон [Shotwell el al., 2000] -вещества аналогичного действия. Помимо пн нт* поксидона и сходных веществ, деградации ингибирующей частицы ІкВа препятствует липополисахарид, выделенный из
Taiwano/ungus camphoratus
[Liu et
hL
2007]. Группой Маттилы было показано, что
б плодовых
телах
Lenlinuh
gd
Вторым важным направлением сдерживания онкогенной воспалительной реакции является ингибирование матриксных металлопротеина з. Цинксодержащие эндопептидазы, выделяемые рядом раковых клеток и гранулоцитов, способствуют размягчению фибриллярного и нефибриллярного соединительнотканного матрикса, что значительно облегчает опухолевую инвазию и метастазирование. Вьщеленные из базидиомицетов Piptoporus betMinns и Daedalea dickinsil полипореновая кислота С и (Е )-2 -(4 -гидрокси-3 -метил-2 -б ) тенил)-гидрохинон проявили ингибирующие эффекты в отношении коллагеназы MMP-L стромелизина ММР-3 и желатиназы ММР-9 [Kawagishi et al., 1997, 2002].
Воздействие на витальные молекулярные мишени. Цитотоксичность, проявляемая рядом грибных метаболитов и направленная на вывод из строя базовых жизнеобеспечивающих систем клетки, имеет те же ограничения, что и химиотерапия: большинство ш этих мишеней неспецифичны для рака. Тем не менее, в некоторых случаях в силу гиперэкспрессии опухолевой тканью ряда жизненно-важных ферментов, их ингибирование грибными метаболитами оказывается оправданным. С другой стороны, разрабатываются методы адресной доставки витальных ядов с минимизацией системной токсичности.
Жирнокислотная фракция гексанового экстракта мицелия Grifola frondosa (эргостерол, эргоста-4,6,8(14),22 -теграен-3 -он, 1 -олеоил-1 -линоеоил-3 -пальмитоглицерол) проявляет сильную ингиби-ртощуто активность в отношении циклооксигеназ Coxl и Сох2 [Zhang et al., 2002]. Подобным действием обладают бис-катехолы герронемины ADF, выделенные из мицелия грибов рода Gerronema [Silberborth et 』 L 2002] и ланосгановые тритерпе-ноііды Fomitopsis pUiiccS [Yoshikawa et 』 L 2005], Ланостановые тритерпеноиды, выделенные из склероциев Wolfiporla cocos ингибируют ДНК-топоизомерззы [Mizushina et al., 2004]. Тритерпе-ноидный компонент, выделенный из Perenniporia fraxinea и обозначенный как фомителловая кислота, а также тритерпеноиды 1. 2 и 3 Ganoderma /ucidum проявляли ингибирующую активность в отношении ряда ДНК-полимераз [Mizusliina et al, , 1999, 2000].
Мишенью циклического пептида а-аманитина (продуцент - Amanita phalloules^ использоваиного в качестве витального яда группой Мельденхау-эра-Фаульсгиха, является РНК-полимераза II. Попадая в клетку、аманитин связывает этот фермент, блокируя его работу; что, в свою очередь, приводит к прекращению синтеза беков и к разрушению клетки. Чтобы избежать системного токсического эффекта, вызываемого этим сильнейшим ядом, его доставка к раковым клеткам осуществлялась в связанном антителами виде. В качестве объекта связывания был выбран опухолевый маркер ЕрСАМ (epithelial cell adhesion molecule)-белок, экспрессируемый многими раковыми линиями. Ама нитин-конъюгированное а нтитело может нести от 4 до 8 молекул токсина, доставляя их адресно к клеткам, экспрессирующим на поверхности ЕрСАМ. Несмотря на возможные погрешности (ЕрСАМ экспрессируется не только раковыми клетками с одной стороны и не экспрессируется «спящими» раковыми клетками -с другой), результаты описанного воздействия впечатляют: 2 инъекции высоких доз аманитин-конъюгированного антитела привели к регрессии опухолей у 90% испытанных животных испытанных животных [Moldenliauer et at. 2012].
Проблемы и перспективы
Вышеизложенные факты позволяют относиться к онкотерапии с привлечениеді метаболитов, продуцируемых грибами - базидиомицетами с исключительным вниманием: биоактивные комплексыһ поставляемые этими организмами* характеризуются. как правило, множественным и в то же время мягким таргетным воздействием, что. в совокупности с относительной доступностью сырья, открывает определенные клинические перспективы. Однако, несмотря на прогресс в познании меха* низмоб онкостатического действия грибных метаболитов и сложившуюся, по крайней мере, б странах Востока, діноговековую традицию их придюне-ния, впечатляющего прорыва в онкотерапии. связанного с их применением, не происходит.
Причина такого положения связана с тем, что в более чем в половине случаев злокачественные новообразования диагностируются на стадии про-гресснн, когда клетки уже приобретают глухоту к большинству ингибирующих пролиферацию и проапоптотических сигналов, а арест клеточного цикла приводит к реализации злокачественного потенциала по паракринному механизму - клетки приступают к активной пролиферативной сигнализации IRobinson et at, 20t)l ; Blagosklonny, 2003]. Низкая степень связности клеток в раковой ткани и повышенная экспрессия генов семейства Мус чреваты амебоидной трансформацией клеток при любом сильном воздействии на раковую ткань. В такой ситуации все биоактивные комплексы, в том числе грибного происхождения, направленные на ингибирование процессов, происходящих в ілока-чественно-трансформироваиной ткани, не могут покрыть весь спектр вариабельности адаптивного ответа неоплазм. Ингибирование процессов без удара по витальным мишеням раковой клетки чревато ситуацией^ предельно лаконично описанной швейцарским онкологом Пиерпаоли: «Фактически, существуют противостоящие терлпии автоматические механизмы, предполагающие неизбежную промоцию, следуюп^ю за искусственным ингибированием. Чем более сильным было ингибирование. тем более сильной будет промоция» [РіеграоІЁ 2005]. Именно по этой причине на стадии прогрессии и б особенности распространенного опухолевого процесса одних грибных метаболитов - вне сочетания с витальными ядами (хим иотера ПИ я) либо лучевым воздействием - для борьбы с опухолевы-ми клонами недостаточно.
Сочетание грибных метаболитов (прежде всего, тритерпеноидов) с хим иотера певтически\г воздействием на опухоли, доказавшее свою клиническою эффективность^ требует дальнейшего осмысления в свете представлений о клональной гетерогенности оп>?холи с одной стороны и неоднозначной роли именной системы в оп>гхолевой прогрессии - с другой.
Говоря о гетерогенности опухоли и наличии более устойчивых к терапии клонов в связи с онко-статическими эффектами грибных метаболитов в сочетании с химиотерапией, вполне возможно, речь может идти не только о к}м>?лятивном цитотоксическом эффекте тритерпеноидов в сочетании с более сильными агентами, как бы зажимающими клоногенные клетки в своеобразною «клешню».-такого рода эффект не может быть превалирующим, поскольку он неизбежно осложняется нет-бирательной системной токсичностью. Вероятно, во многом реализуется другой сценарий, описанный группой Благосклонного [Blagosklonny, Darzyiikiewicz, 2 002 : Blagosklonny el al.. 2002]; 6a лее слабые стимулы (вызываемые е данном случае грибными метаболитами) приводят к аресту клеточного цикла нормальных делящихся и дифференцированных раковых клеток, в то время как 「 н-перактиБные клоногенные раковые клетки продолжают делиться и попадают в уязвимом делящемся состоянии под воздействие более жестких «стимулов»к которые несут химиотерапевтические агенты, результатом чего является в большинстве случаев их апоптоз или цитолиз. Соответственно, новым направлением клинических исследований может стать выявление соотношения цитотоксичности грибных метаболитов и их способности к аресту клеточного цикла как раковых клеток различной степени дифференцировки* так и нормальных пролиферирующих клеток.
Говоря о неоднозначной роли иммунной системы б развитии опухолевого процесса и подавлении противоопухолевого крыла иммунитета провоспа-лительным. следует говорить и о необходимости профилирования грибных биоактивных комплек- соб с выделением как им му ностиму л иру ющей, так и противовоспалительной (NF-кВ -ингибирующей) составляющих. И если основной объект грибной онкотерапии - Ganodenna lucidum - сочетает высокие иммуностимулирующие и противовоспалительные эффекты, то два других «фаворита 1970-х» - 2>н/ 汕廿 fq edodes и Schizuphylhun си/пплте, сырье которых богато разветвеленными р-глюканами. но бедно терпеноидами, даже по сегодняшним далеко не полным данным, явно уступают место таким перспективным объектам как Taiwanofiingus carnphofatus. обладающим также NF-кВ и VEGF-ингибирующей активностью [Liu et aL 2007 ; Sunk et aL 2008] или Piptoporus betuHmts. спектр активностей которого* как оказалось, достаточно широк и включает ингибирование прОБОспалительных факторов (ланостановые производные) и металлопротеиназ (гидрохиноны)
[Kawagishi et al., 2 002; Кдпю et al., 200 3; Wagnun et aL, 2004; Lemieszek el aL, 200 9; Cyranka et 或卄 2011].
К вопросу о профилировании биоактивных комплексов грибного происхождения примыкает вопрос о требованиях к экстрактам и их применению на различных этапах терапии. В исследованиях, проводимых in vitro, наибольшую проапопто-тическ^ю и цитостатическою активность проявляют спиртовые экстракты [Шнырева, Ван Гринсвен, 2014]. в то время как нһ«иуноі^идупирующая активность грибных глюканов лучше сохраняется при более мягком водном способе экстрагирования [Moradali el aL 2007] + Кардинально различаются и т€рапевти ческие ситуации, выдвигающие на первый план либо активизацию противоопухолевого крыла иммунитета, когда основную фармакологическую нагрузку несут грибные полисахариды и пред по чтительным сырьем являются виды* характеризующиеся мощным глюкановым «чехлом» клеточной стенки (Lenlinnlu 它£加£扣虽 Grifola frondosu^ Flummulina velutipe^ Тғет^Ікт mesentenca\ либо снижение митогенной активности и ингибирование провоспалительных факторов. когда основную нагрузку несут уже низкомолекулярные метаболиты (тритхрпеноиды. ланоста-новые производные, эргостерол)* Первая ситуация более характерна для локалиюванного. вторая -для распространенного опухолевого процесса [Змитрович. 2014].
Наконец, специальные исследования требуются для оценки онкопревентивного потенциала базидн-альных грибов - продуцентов полифенольных комплексов, который, по предварительным оцен-кам* чрезвычайно высок [Баландайкин. 2013: Ба-ландайкин, Змитрович. 2015; Balandaykinh Zmigvich* 2015]+ Полифенольные композиты представляют значительную емкость для поглощения свободных радикалов, ионов тяжелых металлов и ультрафиолета; полифенол-полисахаридные комплексы обладают значительной иммуномодулирующей активностью, механизм которой выяснен не до конца [Шнырева, Ван Гринсвен, 2014]. В иші направлении наиболее перспективными объектами являются Inonolus obliques f. sierilis^ 1. Iimens, различные биды рода Phellinust
Как видим, роль базидиальных грибов в тар-гетной терапии злокачественных новообразований заметна, перспективы просматриваются по не-скольким направлениям, и прогресс в онкотерапии б значительной мере может быть связан с адекватным встраиванием различных фармакологических эффектов метаболитоБ базидиальных грибов б уже отработанные техники иммунотерапии и лекарственной терапии на основе знаний о молекулярных мишенях неоплазм.
Автор благодарен М. Э. Баландайкин>\ М. А. Бондарцевой. Н. В. Беловой, С. И Вассеру, Н+ П. Денисовой, А+ Е+ Коваленко. Л. Г. Переведениевой за обсуждение в разное время ряда поднятых в статье проблем и обмен литературой.
Работа выполнена в рамках гос>гдарственного задания БИН РАН «Микобиота Южного Вьетнама»-01201255603.
Список литературы Метаболиты базидиальных грибов, эффективные в терапии рака и их молекулярные мишени: обзор
- Автономова А.В., Краснопольская Л.М. Противоопухолевые и иммуномодулирующие свойства трутовика лакированного//Микология и фитопатология. 2013. Т. 47, вып. 1. С. 3-11
- Баландайкин М.Э. К вопросу о химическом составе и медицинских свойствах Inonotus obliquus (Pers.) Pil.//Химия растительного сырья. 2013. № 2. С. 15-22
- Баландайкин М.Э., Змитрович И.В. Чага (Inonotus obliquus f. sterilis) как фармакологически ценное сырье и ее ресурсный потенциал//Материали за 11-а международна научна практична конференция, «Бъдещите изследования -2015». София, 2015. Т. 2. Лекарство. Биологии. География и геология. С. 58-59
- Белова Н.В. О необходимости изучения биологии и биохимической активности Inonotus obliquus//Микология и фитопатология. 2014. Т. 48, вып. 6. С. 401-403
- Булатов П.К., Березина М.П., Якимов П.А. (ред.) Чага и ее лечебное применение при раке IV стадии. Л.: Медгиз, 1959. 305 с
- Булах Е.М. Грибы -источник жизненной силы. Владивосток: Русский Остров, 2001. 64 с
- Вассер С.П. (ред.) Макромицеты: лекарственные свойства и биологические особенности. Киев: Ин-т ботаники им Н. Г. Холодного, 2012. 285 с
- Волкова Т.О., Немова Н.Н. Молекулярные механизмы апоптоза лейкозной клетки. М.: Наука, 2006. 205 с
- Денисова Н.П. Лечебные свойства грибов. Этно-микологический очерк. СПб: Изд-во СПбГМУ, 1998. 59 с
- Змитрович И.В. Грибы посылают сигналы//Планета грибов. 2014. № 2(6). С. 21-28; 37-39
- Князькин И.В., Цыган В.Н. Апоптоз в онкоурологии. СПб.: Наука, 2007. 240 с
- Копнин Б.П. Мишени действия онкогенов и опухолевых супрессоров: Ключ к пониманию базовых механизмов канцерогенеза//Биохимия. 2000. Т. 65, № 1. С. 5-33
- Копнин Б.П. Неопластическая клетка: основные свойства и механизмы возникновения//Практ. онкология. 2002. Т. 3, № 4. С. 235-239
- Недоспасов С.А. Врожденный иммунитет и его значение для биологии и медицины//Вестник РАН. 2013. Т. 83, № 9. С. 771-783
- Переведенцева Л.Г. Лекарственные грибы Пермского края. Пермь: Проектное бюро "Рейкьявик", 2011. 146 с
- Пожарисский К.М., Савостьянов Г.А. Ультраструктурная характеристика экспериментальных опухолей кишечника//Вопросы онкологии. 1976. Т. 22, № 1. С. 59-68
- Турусов В.С. Прогрессия опухолей: этиологические, морфологические и молекулярно-биологические аспекты//Архив патол. 1992. Вып. 7. С. 5-14
- Феофилова Е.П., Алехин А.И., Гончаров Н.Г., Мысякина И.С., Сергеева Я.Э. Фундаментальные основы микологии и создание лекарственных препаратов из мицелиальных грибов. Москва: Национальная академия микологии, 2013. 152 с
- Филиппова И.А. Популярная фунготерапия: лечение лекарственными грибами. СПб.: Диля, 2013. 128 с
- Черешнев В.А., Цыган В.Н., Одинак М.М., Иванов А.М., Бубнов В.А., Цыган Н.В. Фармакологическое регулирование программированной гибели клеток. СПб.: Наука, 2011. 255 с
- Шнырева А.В., Ван Гринсвен Л.Д. Проапоптотическая и иммуномодулирующая активность экстрактов некоторых гомобазидиальных грибов//Микология и фитопатология. 2014. Т. 48, вып. 4. С. 253-261
- Юй Л., Хайни Б., Широких А.А., Широких И.Г., Егошина Т.Л., Кириллов Д.В. Лекарственные грибы в традиционной китайской медицине и современных биотехнологиях. Киров: ОКраткое, 2009. 320 с
- Adams J.M., Cory S. The Bcl-2 apoptotic switch in cancer development and therapy//Oncogene. 2007. Vol. 26. P. 1324-1337
- Amundson S.A., Myers T.G., Fornace A.J. Roles for p53 in growth arrest and apoptosis: Putting on the brakes after genotoxic stress//Oncogene. 1998. Vol. 17, № 25. P. 3287-3299
- Asatiani M.D., Wasser S.P., Nevo E., Ruimi N., Mahajna J., Reznick A.Z. The Shaggy Ink Cap medicinal mushroom, Coprinus comatus (O. F. Mull.: Fr.) Pers. (Agaricomycetideae) substances interfere with H2O2 induction of the NF-kB pathway through inhibition of IKBa phosphorylation in MCF7 breast cancer cells//Int. J. Med. Mushrooms. 2011. Vol. 13, № 1. P. 19-25
- Ashkenazi A., Herbst R.S. To kill a tumor cell: the potential of proapoptotic receptor agonists//J. Clin. Invest. 2008. Vol. 118, № 6. P. 1979-1990
- Balandaykin M.E., Zmitrovich I.V. Review on Chaga medicinal mushroom, Inonotus obliquus (higher basidiomycetes): realm of medicinal applications and approaches on estimating its resource potential//Int. J. Med. Mushrooms. 2015. Vol. 17, № 2. P. 95-102
- Baeriswyl V., Christofori G. The angiogenic switch in carcinogenesis//Cancer Biol. 2009. Vol. 19. P. 329-337
- Blagosklonny M.V. Cell senescence and hypermitogenic arrest//EMBO Rep. 2003. Vol. 4. P. 358362
- Blagosklonny M. V. Cell proliferation and cancer therapy//L. M. Berstein (ed.). Hormones, age and cancer. Saint Petersburg: Nauka, 2005. P. 68-93
- Blagosklonny M.V., Darzynkiewicz Z. Cyclotherapy: protection of normal cells and unshielding of cancer cells//Cell Cycle. 2002. Vol. 1. P. 375-382
- Blagosklonny M.V., Darzynkiewicz Z., Figg W.D. Flavopiridol inversely affects p21WAF1/CIP1/and p 53 and protects p21-sensitive cells from paclitaxel//Cancer Biol. Therap. 2002. Vol. 1. P. 67-74
- Bonnet D., Dick J.E. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell//Nat. Med. 1997. Vol. 3. P. 730-737
- Boutwell R.K. The function and mechanism of promoters of carcinogenesis//Crit. Rev. Toxicol. 1974. Vol. 2. P. 419-443
- Brown G. D., Gordon S. Immune recognition: a new receptor for p-glucans//Nature. 2001. Vol. 413. P. 36-37
- Cassinelli G., Lanzi C., Pensa T., Gambetta R.A., Nasini G., Cuccuru G., Cassinis M., Pratesi G., Pollizi D., Tortoreto M., Zunino F. Clavilactones, a novel class of tyrosine kinase inhibitors of fungal origin//Biochem. Pharmacol. 2000. Vol. 59. P. 1539-1547
- Chang K.L., Kung M.L., Chow N.H., Su S.J. Genistein arrests hepatoma cells at G2/M phase: involvement of ATM activation and upregulation of p21waf1/cip1 and Wee1//Biochem. Pharmacol. 2004. Vol. 67. P. 717-726
- Chen S.C., Lu M.K., Cheng J.J., Wang D.L. Antiangiogenic activities of polysaccharides isolated from medicinal fungi//FEMS Microbiol. Lett. 2005. Vol. 249, № 2. P. 247-254
- Chichara G., Hamuro J., Maeda Y.Y., Arai Y., Fukuoka F. Fractionation and purification of the polysaccharides with marked antitumor activity, especially lentinan, from Lentinus edodes//Cancer Res. 1970. Vol. 30. P. 2776-2781
- Cho J.H., Cho S.D., Hu H., Kim S.H. Lee Y.S., Kang K.S. The roles of Erk1/2 and p38 kinases in the preventive mechanisms of mushroom Phellinus linteus against the inhibition of gap junctional intercellular communication by hydrogen peroxide//Carcinogenesis. 2002. Vol. 23. P. 1163-1169
- Chow L.W., Lo C.S., Loo W.T., Hu X.C., Sham J.C. Polysaccharide peptide mediates apoptosis by up-regulating p21 gene and down-regulating cyclin D1 gene//Am. J. Clin. Med. 2003. Vol. 31. P. 19
- Cleary J.A., Kelly G.E., Husband A.J. The effect of molecular weight and beta-1,6-linkages on priming of macrophage function in mice by (1,3)-betaD-glucan//Immun. Cell. Biol. 1999. Vol. 77. P. 395
- Coffelt S.B., Lewis C.E., Naldini L., Brown J.M., Ferrara N., De Palma M. Elusive identities and overlapping phenotypes of proangiogenic myeloid cells in tumors//Am. J. Pathol. 2010. Vol. 176. 1564-1576
- Cyranka M., Graz M., Kaczor J., Kandefer-Szerszen M., Walczak K., Kapka-Skrzypczak L., Rzeski W. Investigation of antiproliferative effect of ether and ethanol extracts of birch polypore medicinal mushroom, Piptoporus betulinus (Bull.: Fr.) P. Karst. (higher Basidiomycetes) in vitro grown mycelium//Int. J. Med. Mushrooms. 2011. Vol. 13, № 6. P. 525П533
- Demicheli R., Retsky M.W., Hrushesky W.J., Baum M., Gukas I.D. The effects of surgery on tumor growth: a century of investigations//Ann. Oncol. 2008. Vol. 19. P. 1821-1828
- Deshpande A., Sicinski P., Hinds P.W. Cyclins and cdks in development and cancer: a perspective//Oncogene. 2005. Vol. 24. P. 2909-2915
- Didukh M.Ya., Wasser S.P., Nevo E. Medicinal value of species of the family Agaricaceae Cohn (higher Basidiomycetes): current stage of knowledge and future perspectives//Int. J. Med. Mushrooms. 2003. Vol. 5. P. 133-152
- Erkel G., Anke T., Sterner O. Inhibition of NF-kappa B activation by panepoxydone//Biochem. Bio-phys. Res. Commun. 1996. Vol. 226, № 1. P. 214-221
- Evan G., Littlewood T. A matter of life and cell death//Science. 1998. Vol. 281. P. 1317-1322
- Ferrara N. Vascular endothelial growth factor//Ater. Thromb. Vasc. Biol. 2009. Vol. 29. P. 789-791
- Forman D., Bray F., Brewster D.H., Gombe Mbalawa C., Kohler B., Pineros M., Steliarova-Foucher E., Swaminathan R., Ferlay J. (eds). Cancer Incidence in Five Continents Vol. X//IARC Scientifi c Publications. 2014. № 164. 1436 p
- Foulds I. Neoplastic development. N. Y.: Acad. Press, 1976. 527 p. Friedl P., Wolf K. Plasticity of cell migration: a multiscale tuning model//J. Cell Biol. 2010. Vol. 188. P. 11-19
- Friesen C., Fulda S. Debatin K.M. Cytotoxic drugs and the CD95 pathway//Leukemia. 1999. Vol. 13, № 11. P. 1854-1858
- Froelich C.D., Orth K., Turbov J. Seth P., Gottlieb R., Babior B., Shah G.M., Bleackley R.Ch., Dixit V.M., Hanna W. New paradigm for lymphocyte granule-mediated cytotoxity. Target cells bind and internalize granzime B, but an endosomolytic agent is necessary for cytosolic delivery and subsequent apoptosis//J. Biol. Chem. 1996. Vol. 271. P. 29073-29079
- Fujimoto S., Furue H., Kimura T., Kondo T., Orita K., Taguchi T. Clinical outcome of postoperative adjuvant immunotherapy with schizophyllan for patients with resectable gastric cancer -a randomized controlled study//Eur. J. Cancer. 1991. Vol. 27. P. 1114-1118
- Fukasawa K., Wiener F., Woud G.F.V. et al. Genomic instability and apoptosis are frequent in p53 defecient young mice//Oncogene. 1997. Vol. 15, № 11. P. 1295-1302
- Gaengel K., Genove G., Armiluk A., Betsholz C. En-dothelia-mural cell signaling in vascular development and angiogenesis//Ater. Thromb. Vasc. Biol. 2009. Vol. 29. P. 630-638
- Gao Y., Zhou S., Chen G., Dai X., Ye J. A phase I/II study of Ganoderma lucidum (Curtis: Fr.) P. Karst. extracts (ganopoly) in patients with advanced cancer//Int. J. Med. Mushrooms. 2002. Vol. 4. P. 207-214
- Gehrt A., Erkel G., Anke T., Sterner O. Cycloepoxy-don, 1-hydroxy-2-hydroxymethyl-3-pent-1,3-1-enylbenzene and 1-hydroxy-2-hydroxymethyl-3-pent-1,3-dienylbenzene, new inhibitors of eu-karyotic signal transduction//J. Antibiot. 1998. Vol. 51. P. 455-463
- Glamoclija J., Ciric A., Nicolic M., Fernandes A., Barros L., Calhelha C., Ferreira I.C.F.R., Sokovic M., van Griensven L.J.L.D. Chemical characterization and biological activity of Chaga (Inonotus obliquus), a medicinal "mushroom"//J. Ethno-pharmacol. 2015. Vol. 162. P. 323-332
- Gordon M., Guralnik M., Kaneko Y., Mimura T., Goodgame J., DeMarzo C. A phase II controlled study of a combination of the immune modulator, lentinan, with didanosine (DDI) in HIV patients with CD4 cells of 200-500/MM(3)//J. Med. 1995. Vol. 26. P. 193-207
- Gregory F.J., Healy E.M., Agersborg H.P.Jr., Warren G.H. Studies on antitumor substances produced by Basidiomycetes//Mycologia. 1966. Vol. 58. P. 80-90
- Greider C.W. Telomerase activity, cell proliferation, and cancer//Proc. Nat. Acad. Sci. USA. 1998. Vol. 95, № 1. P. 90-92
- Hananan D., Folkman J. Patterns and emerging mechanisms of the angiogenic switch during tumorogenesis//Cell. 1996. Vol. 86. P. 353-364
- Hanahan D., Weinberg R.A. The hallmarks of cancer//Cell. 2000. Vol. 100. P. 57-70
- Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation//Cell. 2011. Vol. 144. P. 646674
- Heiser D., Labi V., Erlacher M., Villunger A. The Bcl-2 protein family and its role in the development of neoplastic disease//Exp. Gerontol. 2004. Vol. 39, № 8. P. 1125-1135
- Herberman R. (ed.). Natural cells mediated immunity against tumors. N. Y.: Acad. Press, 1980. 1100 p
- Hilger R.A., Scheulen M.E., Strumberg D. The Ras-Raf-MEK-ERK pathway in the treatment of cancer//Onkologie. 2002. Vol. 25. P. 511-518
- Hu H., Ahn N.S., Yang X., Lee Y.S., Kang K.S. Gano-derma lucidum extract induces cell cycle arrest and apoptosis in MCF-7 human breast cancer cell//Int. J. Cancer. 2002. Vol. 102, № 3. P. 250253
- Hunter T. Oncoprotein networks//Cell. 1997. Vol. 88, № 3. P. 333-346
- Ikekawa T., Uehara N., Maeda Y., Nakanishi M., Fukuoka F. Antitumor activity of aqueous extracts of edible mushrooms//Cancer Res. 1969. Vol. 29. P. 734-735
- Ikekawa T., Ikeda Y., Yoshioka Y., Nakanishi K., Yo-koyama E., Yamazaki E. Antitumor polysaccha-rides of Flammulina velutipes 2. The structure of EA-3 and further purification of EA-5//J. Phar-macobiol. Dyn. 1982. Vol. 5. P. 576-581
- Ikekawa T., Saitoh H., Feng W., Zhang H., Li L., Ma-tsuzawa T. Antitumor activity of extracts and polysaccharides//Chem. Pharm. Bull. (Tokio). 1992. Vol. 40. P. 1954-1957
- Ishibashi K., Miura N.N., Adachi Y., Ohno N., Yadomae T. Relationship between solubility of grifolan, a fungal 1,3-beta-D-glucan, and production of tumor necrosis factor by macrophages in vitro//Biosci. Biotechnol. Biochem. 2001. Vol. 65. P. 1993-2000
- Jiang J., Slivova V., Valachovicova T., Harvey K., Sliva D. Ganoderma lucidum inhibits proliferation and induces apoptosis in human prostate cancer cells PC-3//Int. J. Oncol. 2004. Vol. 24. P. 10931099
- Kagi D., Ledermann B., Burki K., Zinkernagel R.M., Hengartner H. Molecular mechanisms of lymphocyte-mediated cytotoxity and their role in immu-nological protection and pathogenesis in vivo//Ann. Rev. Biochem. 1996. Vol. 14. P. 207-232
- Kamo T., Asanoma N., Shibata H., Hirota M. Anti-inflammatory lanostane-type triterpene acids from Piptoporus betulinus//J. Nat. Prod. 2003. Vol. 66, № 8. P. 1104-1106
- Kang J., Wang H.-Q., Chen R.Y. Studies on the constituents of the mycelia produced from fermented culture of Flammulina velutipes (W. Curt.: Fr.) Singer (Agaricomycetidae)//Int. J. Med. Mushrooms. 2003. Vol. 5. P. 391-396
- Kawagishi H., Li H., Tanno O., Inoue S., Ikeda S., Ohnishi-Kameyama M., Nagata T. A lanostane-type triterpene froma a mushroom Daedalea dick-insii//Phytochemistry. 1997. Vol. 46. P. 959961
- Kawagishi H., Hamajima K., Inoue Y. Novel hydro-quinone as a matrix metallo-proteinase inhibitor from the mushroom, Piptoporus betulinus//Bio-sci. Biotechnol. Biochem. 2002. Vol. 66. P. 27482750
- Kiyono T., Foster S. A., Koo J. I. et al. Both Rb/p16INK4a inactivation and telomerase activity are required to immortalize human epithelial cells//Nature. 1998. Vol. 396, № 6706. P. 84-88
- Klaschka F. Oral enzymes -new approach to cancer treatment: immunological concepts for general and clinical practice. Complementary cancer treatment. Copenhagen: Forum, 1996. 200 p
- Kodama N., Komuta K., Nanba H. Can maitake MD-fraction aid cancer patients?//Alt. Med. Rev. 2002. Vol. 7. P. 236-239
- Komatsu N., Okubo S., Kikumoto S., Kimura K., Saito G. Host-mediated antitumor action of schizophyl-lan, a glucan produced by Schizophyllum commune//Gann. 1969. Vol. 60, № 2. P. 133-144
- Kreso A., Dick J. E. Evolution of the cancer stem Cell model//Cell. 2014. Vol. 14. P. 275-291
- Lacour S., Micheau O., Hammann A. et al. Chemotherapy enhances TNF-a-related apoptosis-inducing ligand DISC assembly in HT 29 human colon cancer cells//Oncogene. 2003. Vol. 287. P. 135-141
- Lee D.H., Kim H.W. Immunological host defence mechanism and applications of fungal p-glucans by employing Dectin-1 receptor in the innate immunity//Proc. 7th International Medicinal Mushroom Conference. Beijing, 2013. P. 244-258
- Lemieszek M.K., Langner E., Kaczor J., Kardefen-Szerzen M., Sanecka B., Mazurkiewicz W., Rzesi W. Anticancer effect of fraction isolated from medicinal birch polypore mushroom, Piptoporus betulinus (Bull.: Fr.) P. Karst. (Aphyllophoromy-cetideae): in vitro studies//Int. J. Med. Mushrooms. 2009. Vol. 11. P. 351-364
- Lin S.B., Li C.H., Lee S.S., Kan L.S. Triterpene-enriched extracts from Ganoderma lucidum inhibit growth of hepatoma cells via suppressing protein kinase C, activating mitogen -activated protein kinases and G2-phase cell cycle arrest//Life Sci. 2003. Vol. 72. P. 2381-2390
- Liu D.Z., Liang H.J., Chen C.H., Su S.H., Lee T.H., Huang C.T., Hou W.C., Lin S.Y., Zhong W.B., Ling P.G., Hung L.F., Liang Y.C. Comparative anti-inflammatory characterization of wild fruiting body, liquid-state fermentation, and solid-state culture of Taiwanofungus camphoratus in micro-glia and mechanism of its action//J. Ethnophar-macol. 2007. Vol. 113, № 1. P. 45-53
- Lucas E.H. Montesano R., Pepper M.S., Hafner M., Sablon E. Tumor inhibitors in Boletus edulis and other Holobasidiomycetes//Antibiot. Chemoterap. 1957. Vol. 7. P. 1-4
- Madsen C.D., Sahai E. Cancer dissemination -Lessons from leucocytes//Dev. Cell. 2010. Vol. 19. P. 13-26
- Mahajna J., Dotan N., Zaidman B.-Z., Petrova R. D., Wasser S. P. Pharmacological values of medicinal mushrooms for prostate cancer therapy: the case of Ganoderma lucidum//Nutrit. Cancer. 2009. Vol. 61, № 1. P. 16-26.
- Mantovani A. Molecular pathways linking inflammation and cancer//Curr. Mol. Med. 2010. Vol. 10. P. 369-373
- Mattila P., Konko K., Eurola M., Pihlava J.-M., Astola J., Vahteristo L., Hietaniemi V., Kumpulainen J., Valtonen M., Piironen V. Contents of vitamins, mineral elements, and some phenolic compounds in cultivated mushrooms//J. Agric. Food Chem. 2001. Vol. 49. P. 2443-2448
- Mitomi T., Tsuchiya S., Iijima A., Aso K., Suzuki K., Nishiyama K. Randomized, controlled study on adjuvant immunochemotherapy with PSK in cura-tively resected colorectal cancer//Dis. Colon Rectum. 1992. Vol. 35. P. 123-130
- Mizuno T. Development of antitumor polysaccharides from mushroom fungi//Foods Food. Ingred. J. Jap. 1996. Vol. 167. P. 69-85
- Mizuno T., Ohsawa K., Hagiwara N., Kuboyama R. Fractionation and characterization of antitumor polysaccharides from Maitake, Grifola frondosa//Agric. Biol. Chem. 1986. Vol. 50. P. 1679-1688
- Mizuno T., Ando M., Sugie R., Ito H., Shimura K., Sumiya T., Matsuura A. Antitumor activity of some polysaccharides isolated from an edible mushroom, ningyotake, the fruiting body and the cultured mycelium of Polyporus confluens//Bio-sci. Biotechnol. Biochem. 1992. Vol. 56. P. 3441
- Mizuno T., Yeohlui P. Kinoshita T., Zhuang C., Ito H., Mayuzumu Y. Antitumor activity and chemical modification of polysaccharides from Niohshimeji mushroom, Tricholoma giganteum//Biosci. Biotechnol. Biochem. 1996. Vol. 60. P. 30-33
- Mizuno T., Morimoto M., Minato K.I., Tsuchida H. Polysaccharides from Agaricus blazei stimulate lymphocyte T-cell subsets in mice//Biosci. Biotechnol. Biochem. 1998. Vol. 62. P. 434-437
- Mizuno T., Zhuang C., Abe K., Okamoto H., Kiho T., Ukai S., Leclerc S., Meijer L. Antitumor and hy-poglycemic activities of polysaccharides from the sclerotia and mycelia of Inonotus obliquus (Pers.: Fr.) Pil. (Aphyllophoromycetidae)//Int. J. Med. Mushrooms. 1999. Vol. 1. P. 301-316
- Mizushina Y., Takahashi N., Hanashima L., Koshino H., Esumi Y., Uzawa J., Sugawara F., Sakaguchi K. Lucidenic acid O and lactone, new terpene inhibitors of eukaryotic DNA polymerases from a basidiomycete, Ganoderma lucidum//Bioorg. Med. Chem. 1999. Vol. 7. P. 2047-2052
- Mizushina Y., Iida A., Ohta K., Suuguwara F., Sakaguchi K. Novel triperpenoids inhibit both DNA polymerase and DNA topoisomerase//Biochem. J. 2000. Vol. 350. P. 757-763
- Mizushina Y., Akihisa T., Ukiya M., Murakami C., Kuriyama I., Xu C., Yoshida H., Sakaguchi K. A novel DNA topoisomerase inhibitor: dehydroebri-conic acid, one of the lanostane-type triterpene ac ids of Poria cocos//Cancer Sci. 2004. Vol. 95. P. 354-360
- Moldenhauer G., Salnikov A.V., Luttgau S., Herr I., Anderl J., Faulstich H. Therapeutic potential of amanitin-conjugated anti-epithelial cell adhesion molecule monoclonal antibody against pancreatic carcinoma//J. Nat. Cancer Inst. 2012. Vol. 104, issue 8. P. 622-634
- Moradali M.-F., Mostafavi H., Ghods Sh., Hed-jaroude Gh.-A. Immunomodulating and antican-cer agents in the realm of macromycetes fungi (macrofungi)//Int. Immunopharmacol. 2007. Vol. 7. P. 701-724
- Mueller A., Raptis J. Rice P.J., Kalbefleich J.H., Stout R.D., Ensley H.E., Browder W., Williams D.L. The influence of glucan polymer structure and solution conformation on binding to (1-3)-beta-D-glucan receptors in a human monocytelike cell line//Glycobiology. 2000. Vol. 10. P. 339-346
- Muller C.I., Kumagai T., OKelly J., Seeram N.P., Heber D., Koeffler H.P. Ganoderma lucidum causes apoptosis in leukemia, lymphoma and multiple myeloma cells//Leukemia Res. 2006. Vol. 30, № 7. P. 841-848
- Nagata S., Golstein P. The Fas death receptor//Science. 1995. Vol. 267. P. 1449-1456
- Nakamura T., Akiyama Y., Matsugo S. Purification of caffeic acid as an anti-oxidant from submerged culture mycelia of Phellinus linteus (Ber. et Curt.) Teng (Aphyllophoromycetidae)//Int. J. Med. Mushrooms. 2003. Vol. 5. P. 163-167
- Partanen J.I., Nieminen A.I., Klefstrom J. 3D view to tumor suppression: Lkb1, polarity and the arrest of oncogenic c-Myc//Cell Cycle. 2009. Vol. 8. P. 716-724
- Peintner U., Poder R., Pumpel T. The iceman's fungi//Mycol. Res. 1998. Vol. 102. P. 1153 □ 1162
- Petrova R.D., Wasser S.P., Mahajna J.A., Denchev C.M., Nevo E. Potential role of medicinal mushrooms in breast cancer treatment: current knowledge and future perspectives//Int. J. Med. Mushrooms. 2005. Vol. 7. P. 141-155
- Petrova R.D., Reznick A.Z., Wasser S.P., Denchev C.M., Nevo E., Mahajna J. Fungal metabolites modulating NF-kB activity: An approach to cancer therapy and chemoprevention (Review)//Oncol. Rep. 2008. Vol. 19. P. 299-308
- Petrova R.D., Mahaja J., Wasser S.P., Ruimi N., Denchev C., Sussan Sh., Nevo E., Reznick A.Z. Marasmius oreades substances block NF-kB activity through interference with IKK activation pathway//Mol. Biol. Rep. 2009. Vol. 36. P. 737-744
- Pierpaoli W. Our endogenous «pineal clock» and cancer. Cancer and non-cancer. Strategies for early detection, prevention and cure of neoplastic processes//L. M. Berstein (ed.). Hormones, age and cancer. Saint Petersburg: Nauka, 2005. P. 207-225
- Robinson I.B., Broude E.V., Chang B.D. If not apop-tosis, then what? Treatment-induced senescence and mitotic catastrophe in tumor cells//Drug Resist. Update. 2001. Vol. 4. P. 303-313
- Qian B.Z., Pollard J.W. Macrophage diversity enhances tumor progression and metastasis//Cell. 2010. Vol. 141. P. 39-51
- Reed J. C. Disregulation of apoptosis in cancer//J. Clin. Oncol. 1999. Vol. 17, № 9. P. 2941-2953
- Reshetnikov S.V., Wasser S.P., Nevo E., Duckman I., Tsukor K. Medicinal value of the genus Tremella Pers. (Heterobasidiomycetes) (Review)//Int. J. Med. Mushrooms. 2000. Vol. 2. P. 169-193
- Ruimi N., Petrova R.D., Agbaria R., Sussan Sh., Wasser S.P., Reznick A.Z., Mahajna J. Inhibition of TNFa-induced iNOS expression in HSV-tk transduced 9L glioblastoma cell lines by Maras-mius oreades substances through NF-kB and MAPK-dependent mechanisms//Mol. Biol. Rep. 2009. Vol. 37. P. 3801-3812
- Ruimi N., Rwashdeh H., Wasser S., Konkimalla B., Efferth Th., Borgatt M., Gambari R., Mahajna J. Daedalea gibbosa substances inhibit LPS-induced expression of iNOS by suppression of NF-kB and MAPK activities in RAW 264.7 macrophage cells//Int. J. Molec. Med. 2010. Vol. 25. P. 421-432
- Silberborth S., Stumpf A., Erkel G., Anke T., Sterner O. Gerronemins A-F, cytotoxic biscatehols from a Gerronema species//Phytochemistry. 2002. Vol. 59. P. 643-648
- Sekizawa R., Ikeno S., Nakamura H., Naganawa H., Matsui S., Iinuma H., Takeuchi T. Panepophenan-thrin, from a mushroom strain, a novel inhibitor of the ubiquitin-activating enzyme//J. Nat. Products. 2002. Vol. 65. P. 1491-1493
- Sherr C.J., McCormick F. The RB and p53 pathways in cancer//Cancer Cell. 2002. Vol. 2. P. 103112
- Shotwell J.B., Hu S., Medina E., Abe M., Cole R., Crews C.M., Wood J.L. Efficient stereoselective synthesis of isopanepoixdone and panepoxidone: a re-assignment of relative configuration//Tetrahedron Lett. 2000. Vol. 41. P. 9639-9643
- Stamets P. Mycelium running: How mushrooms can help save the world. Ten Speed Press, 2005. 356
- Suk F.M., Lin S.Y., Chen S.H., Yen S.J., Su C.H., Liu D.Z., Hou W.C., Hung L.F., Lin P.J., Liang Y.C. Taiwanofungus camphoratus activates peroxisome proliferator-activated receptors and induces hypotriglyceride in hypercholesterolemic rats//Biosci. Biotech. Biochem. 2008. Vol. 73. P. 17041713
- Taguchi T., Furue H., Kimura T., Kondoh T., Hattori T., Itoh A. Life-span prolongation effect of lenti-nan on patients with advanced or recurrent colo-rectal cancer//Int. J. Immunopharmacol. 1982. Vol. 4. P. 271
- Talmadge J.E., Fidler I.J. AACR centennial series: the biology of cancer metastasis: historical perspective//Cancer Res. 2010. Vol. 70. P. 56495669
- Testy N.D. Regulation of genomic instability in pre-neoplastic cells//J. Toose (ed.). Genetic instability in cancer. N. Y.: Cold Spring Harbor Laboratory Press, 1996. P. 217-224
- Tsukagoshi S., Hashimoto Y., Fujii G., Kobayashi H., Nomoto K., Orita K. Krestin (PSK)//Cancer Treat. Rev. 1984. Vol. 11. P. 31-55
- Vinogradov E., Petersen B.O., Duus J.0. Wasser S.P. The isolation, structure, and applications of the exocellular heteropolysaccharide glucuronoxylo-mannan produced by yellow brain mushroom Tremella mesenterica Retz.: Fr. (Heterobasidiomycetes)//Int. J. Med. Mushrooms. 2004. Vol. 6. P. 335-345
- Wagner E.F., Nebreda A.R. Signal integration by JNK and p39 MAPK pathways in cancer development//Nat. Rev. Cancer. 2009. Vol. 9. P. 537549
- Wangun K., Berg A., Hertel W., Nkengfack A.E., Hertweck C. Anti-inflammatory and anti-hyalu-ronate lyase Activities of lanostanoids from Pip-toporus betulinus//J. Antibiot. 2004. Vol. 57, № 11. P. 755-758
- Wang Y., Cheng X., Wang P., Wang L., Fan J., Wang X., Liu Q. Investigating migration inhibition and apoptotic effects of Fomitopsis pinicola chloroform extract on human colorectal cancer SW-480 cells//PLoS ONE. 2014. Vol. 9, № 7 DOI: 10.1371/journal.pone.0101303
- Wasser S.P. Medicinal mushrooms as a source of an-titumor and immunomodulating polysaccharides//Appl. Microbiol. Biotechnol. 2002. Vol. 60. P. 258-274
- Wasser S.P. Reishi or Ling Zhi (Ganoderma lucidum)//Encyclopedia of dietary supplements by Marcel Dekker. N. Y., 2005a. P. 603-622
- Wasser S.P. Shiitake (Lentinus edodes)//Encyclopedia of dietary supplements by Marcel Dekker. N. Y., 2005b. P. 653-664
- Wasser S.P. Medicinal mushroom science: history, current status, future trends, and unsolved problems//Int. J. Med. Mushrooms. 2010. Vol. 12, № 1. P. 1-16
- Wasser S.P., Weis A.L. Medicinal properties of substances occurring in higher basidiomycetes mushrooms: current perspectives (review)//Int. J. Med. Mushrooms. 1999. Vol. 1. P. 31-62
- Wasser S.P., Tan K.-K., Elisashvili V. Hypoglycemic, interferonogenous, and immunomodulatory activity of tremellastin from the submerged culture of Tremella mesenterica Retz.: Fr. (Heterobasidiomycetes)//Int. J. Med. Mushrooms. 2002. Vol. 4. P. 215-227
- Wasser S.P., Zmitrovich I.V., Didukh M.Ya., Maly-sheva V.F. New medicinal Ganoderma mushroom from China: G. tsugae Murrill var. jannieae var. nov. (Aphyllophoromycetidae)//Int. J. Med. Mushrooms. 2006. Vol. 8. P. 161-172.
- Wasson V.P., Wasson R.G. Mushrooms, Russia and history. N. Y.: Panteon Books, 1957. 433 p
- White E., DiPaola R.S. The double edged sword of autophagy modulation in cancer//Curr. Op. Cell Biol. 2009. Vol. 15. P. 5308-5316
- Wolf. B., Schuler M., Li W. et al. Defective cyto-chrome c-dependent caspase activation in ovarian cancer cell lines due to diminished or absent apop-totic protease activating factor-1 activity//J. Bio-chem. 2001. Vol. 276, № 36. P. 34244-34251
- Xia Q., Zhang H., Sun X., Zhao X., Wu L., Zhu D., Yang G., Shao Y., Zhang X. Mao X., Zhang L., She G. A comprehensive review of the structure elucidation and biological activity of triterpenoids from Ganoderma spp.//Molecules. 2014. Vol. 19. P. 17478-17535
- Yang H.L. Ganoderic acid produced from submerged culture of Ganoderma lucidum induces cell cycle arrest and cytotoxicity in human hepatoma cell line BEL7402//Biotechnol. Lett. 2005. Vol. 27. P. 835-838
- Yamamoto Y., Gaynor R.B. Therapeutic potential of inhibition of the NF-kappaB pathway in the treatment of inflammation and cancer//J. Clin. Invest. 2001. Vol. 107, № 2. P. 135-142
- Yassin M., Wasser S.P., Mahajna J. Substances from the medicinal mushroom Daedalea gibbosa inhibit kinase activity of native and T315I mutated Bcr-Abl//Int. J. Oncol. 2008. Vol. 32. P. 1197-1204
- Yoshikawa K., Inoue M., Matsumoto Y., Sakakibara C., Miyataka H., Matsumoto H., Arihara S. Lanostane triterpenoids and triterpene glycosides from the fruit body of Fomitopsis pinicola and their inhibitory activity against COX-1 and COX-2//J. Nat. Prod. 2005. Vol. 68, № 1. P. 69-73
- Zaidman B.-Z., Yassin M., Mahajna J., Wasser S. P. Medicinal mushroom modulators of molecular targets as cancer therapeutics//Appl. Microbiol. Biotechnol. 2005. Vol. 67. P. 453-468
- Zaidman B.-Z., Wasser S.P., Nevo E., Mahaja J. An-drogen receptor-dependent and -independent mechanisms mediate Ganoderma lucidum activities in LNCaP prostate cancer cells//Int. J. Oncol. 2007. Vol. 31. P. 959-967
- Zaidman B.-Z., Wasser S.P., Nevo E., Mahaja J. Co-prinus comatus and Ganoderma lucidum interfere with androgen receptor function in LNCaP prostate cancer cells//Mol. Biol. Rep. 2008. Vol. 35. P. 107-117
- Zhang Y., Mills G.L., Nair M.G. Cyclooxygenase inhibitory and antioxidant compounds from the my-celia of the edible mushroom Grifola frondosa//J. Argic. Food Chem. 2002. Vol. 50. P. 7581-7585
- Zhao L.W., Zhong X.H., Yang S.Y., Zhang Y.Z., Yang N.J. Inotodiol inhibits proliferation and induces apoptosis through modulating expression of cy clinE, p27, bcl-2 and bax in human cervical cancer HeLa cells//Asian Pacific J. Cancer Prevention. 2014. Vol. 15. P. 3195-3199
- Zhu H.S., Yang X.L., Wang L.B., Zhao D.X., Chen L. Effects of extracts from sporoderm-broken spores of Ganoderma lucidum on HeLa cells//Cell Biol. Toxicol. 2000. Vol. 16. P. 201-206
- Zhuang C., Wasser S.P. Medicinal value of culinary-medicinal maitake mushroom Grifola frondosa (Dicks.: Fr.) S. F. Gray (Aphyllophoromycetidae). Review//Int. J. Med. Mushrooms. 2004. Vol. 6. P. 287-313


