Метаболизм азотсодержащих соединений в изолированной перфузируемой печени крысы
Автор: Шадрин К.В., Пахомова В.Г., Рупенко А.П., Моргулис И.И.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Экология
Статья в выпуске: 10, 2012 года.
Бесплатный доступ
В статье представлены результаты исследований метаболизма азотсодержащих и углеводных соединений в изолированной перфузируемой печени крыс после гипоксии, имитированной введением хлорида кобальта.
Гипоксия, метаболизм углеводов, метаболизм аминов, перфузия изолированного органа
Короткий адрес: https://sciup.org/14082053
IDR: 14082053 | УДК: 577.359
Текст научной статьи Метаболизм азотсодержащих соединений в изолированной перфузируемой печени крысы
Введение. Гипоксия является патологическим процессом, возникающим при недостаточном снабжении тканей организма кислородом или нарушении его утилизации в процессе биологического окисления. Она возникает в биологических системах вследствие широкого спектра причин, включая как нормальные физиологические отклонения (при снижении парциального давления кислорода во вдыхаемом воздухе), так и патологические состояния (дыхательная недостаточность [3, 16] , анемия [7, 8] , отравление токсичными веществами [10, 13] ).
Одним из видов гипоксии, приводящих к воспалению мозга [11] , повреждениям почек и печени [10, 12, 13, 15] , раку [6, 9], является гистотоксическая гипоксия. Она может быть следствием ишемии, как в случае инсульта [18] , или воспаления, при нейро-воспалительных заболеваниях, таких как болезнь Альцгеймера, болезнь Паркинсона и рассеянный склероз [1] . Такой вид гипоксии можно имитировать хлоридом кобальта (CoCl 2 ). Хлорид кобальта является общепризнанным агентом, имитирующим состояние гипоксии как in vivo, так и in vitro [5] .
Известно, что хлорид кобальта также оказывает влияние на метаболизм аминокислот: аланина, гистидина и аспарагиновой кислоты [2] . Последняя участвует в процессе синтеза мочевины – главного механизма детоксикации аммиака, который проходит преимущественно в печени. Аммиак является высокотоксичным продуктом, который сформирован эндогенно в процессе катаболизма аминокислот в клетках млекопитающих или в результате уреолитического действия кишечных бактерий. Если концентрация аммиака превышает потенциал синтеза мочевины, проявляются токсические симптомы, такие как печеночная энцефалопатия и гипераммониемия [14, 17] . Поэтому очень важно понимать особенности метаболизма печени, из-за интенсивного изменения окружающей среды часто находящейся в экстремальном состоянии.
Цель исследования . Выявить динамику параметров метаболизма азотсодержащих соединений в изолированной перфузируемой печени крысы в условиях гистотоксической гипоксии, имитируемой введением хлорида кобальта.
Методика исследования. В экспериментах использовали крыс-самцов Wistar массой тела 200–250 г. Операцию выделения печени проводили под общим тиопентал-натриевым наркозом (100 мг/кг массы животного). Стабилизацию гемостаза осуществляли внутривенным введением в бедренную вену гепарина (1000 ед/кг массы). Печень после канюлирования воротной вены инфузировали (под давлением 5–7 см вод. ст.) охлажденным до +10°С раствором Кребса-Хенселейта. После канюлирования грудного отдела полой вены печень изолировали и помещали в камеру установки для перфузии изолированных органов. Перфузию проводили с использованием установки с разомкнутым контуром циркуляции среды.
Проведены 4 серии экспериментов:
-
• серия 1 – печень интактных животных перфузировали по стандартной схеме без дополнительных воздействий (контроль);
-
• серия 2 – печень интактных животных перфузировали раствором Кребса-Хенселейта с добавлением в перфузат аспарагиновой кислоты ([Asp]=0,2мМ) и хлористого аммония ([NH 4 Cl]=5мМ);
-
• серия 3 – печень животных, подвергшихся премедикации хлоридом кобальта ([СоСl 2 ×6H 2 O]=25мM) за сутки до операции, перфузировали по стандартной схеме раствором Кребса-Хенселейта;
-
• серия 4 – печень животных, подвергшихся премедикации хлоридом кобальта ([СоСl 2 ×6H 2 O]=25мM) за сутки до операции, перфузировали по схеме Кребса-Хенселейта с добавлением в перфузат аспарагиновой кислоты и хлористого аммония.
Хлорид кобальта вводили животному подкожно.
Всего в эксперименте использовали 24 животных: по 6 животных на каждую серию экспериментов.
Забор проб осуществляли каждые 10 минут первые 30 минут перфузии, далее – каждые 5 минут. Длительность перфузии – 120 минут, при общей длительности эксперимента (вместе с операцией) около 150 минут.
В ходе эксперимента измеряли следующие параметры: скорость выделения желчи, импеданс сосудов органа, потребление кислорода изолированным органом, продукция глюкозы, продукция мочевины.
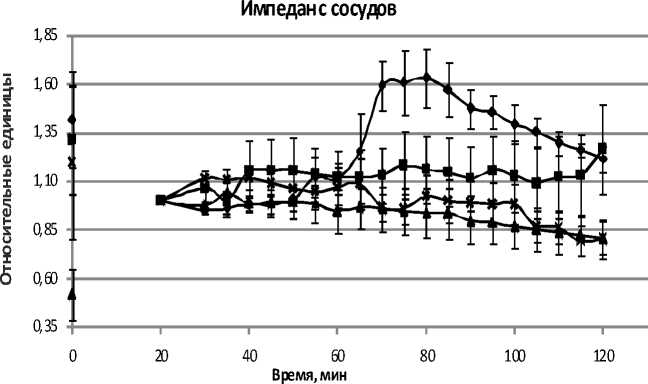
Результаты исследования. Динамика импеданса сосудов изолированной печени представлена на рисунке 1. Из рисунка можно видеть, что после 70-й минуты в серии 1 импеданс сосудов возрастает, в то время как в сериях 2, 3, 4, т.е. тех, в которых орган подвергался какому-либо воздействию, значение импеданса было постоянным.
—♦—Серия 1 -*-Серия2 -■- Серия 3 —х—Серия4
Рис. 1. Динамика импеданса сосудов в течение перфузии
На рисунке 2 представлена динамика скорости продукции желчи в ходе перфузии. График показывает, что орган живет и метаболизирует, выделяя желчь.
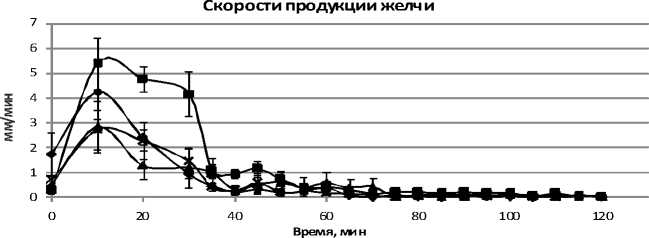
Ри
Для органов сери дов, а хлорид кобальта да. Сочетание воздейст не изменяет (рис. 3).
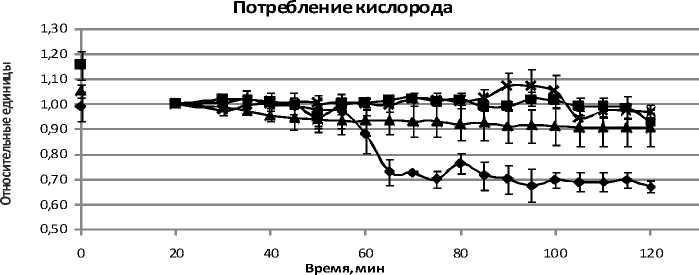
♦ Серия 1 А Серия 2 И Серия 3 X Серия 4
Р
Динамика уровн перфузате колеблется. колебания ярко выражен периментов на 95-й мин

Рис. 4. Динамика уровня глюкозы в течение перфузии
На рисунке 5 пред печени. Как свидетельст чени крыс, предварител хлорида кобальта не пол

Рис. 5. Динамика уровня мочевины в течение перфузии
Выводы
В результате проделанной работы оценены параметры жизнедеятельности и метаболизма (импеданс сосудов, скорость продукции желчи, потребление кислорода, концентрации глюкозы и мочевины в перфузионной среде) в изолированной перфузируемой печени крыс, как интактных, так и подвергшихся премедикации хлоридом кобальта.
Представленные результаты указывают на то, что, возможно, за сутки, в течение которых на животное воздействовал кобальт, в клетках печени произошли адаптивные метаболические сдвиги и орган приспособился к условиям недостатка кислорода.
При этом, вероятно, кобальт, стимулируя активность транскрипционного фактора чувствительности к гипоксии (HIF), запускает синтез ферментов гликолиза, что может являться причиной концентрационных осцилляций глюкозы, наблюдаемых в ходе эксперимента. Высокое содержание глюкозы на 95-й минуте перфузии может быть вызвано добавлением аспарагиновой кислоты, входящей в перечень гликогенных аминокислот [19] .
Более низкий уровень мочевины в 4-й серии может быть объяснен тем, что хлорид кобальта вызывает повышение активности фермента орнитин декарбоксилазы в печени крыс на 2 порядка [4] . Присутствие хлорида кобальта может приводить к активизации процесса декарбоксилирования орнитина и выведению орнитина из цикла Кребса-Хенселейта, что и выражается в снижении уровня мочевины в перфузате.
Можно заметить, что при воздействии хлоридом кобальта снижается уровень продукции мочевины в печени (как мы полагаем, в результате снижения мощности орнитинового цикла, к которому приводит введение хлорида кобальта), а выброс глюкозы, наблюдаемый на 95-й минуте перфузии, особенно велик. Можно предположить, что в условиях изолированной перфузии хлорид кобальта вызывает относительное изменение мощностей орнитинового цикла и цикла трикарбоновых кислот, что приводит к переключению метаболических путей между обменами аминов и углеводов.


