Металлопротеиназы как регуляторы неоангиогенеза в злокачественных новообразованиях
Автор: Спирина Л.В., Кондакова И.В., Клишо Е.В., Какурина Г.В., Шишкин Д.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 1 (21), 2007 года.
Бесплатный доступ
Неоангиогенез имеет существенное значение в прогрессировании неогшастических заболеваний. Роль металлопротеиназ в качестве регуляторов роста опухолей связана с балансом ангиогенных и ангио статических факторов. Нарушение баланса между ангиогенными агентами и ингибиторами ангиогенеза, скорее всего, служит основным механизмом роста опухолей и их метастазирования. Выявлено участие ММП в процессах образования эндогенных ингибиторов ангиогенеза, которые способны останавливать рост новых сосудов и рост опухоли. Накопленные данные позволяют разрабатывать фармакологические препараты ингибиторов ангиогенеза и способствуют их широкому применению в онкологической практике.
Злокачественные опухоли, неоангиогенез, метастазирование, металлопротеиназы
Короткий адрес: https://sciup.org/14054549
IDR: 14054549 | УДК: 616-006.04:
Текст научной статьи Металлопротеиназы как регуляторы неоангиогенеза в злокачественных новообразованиях
Основными проявлениями злокачественного роста являются неограниченный инвазивный рост и метастазирование. Неоангиогенез – формирование новых сосудов, является важнейшим патогенетическим звеном, поддерживающим эти свойства опухолей [19]. Национальный институт рака (США) обозначил исследование ангиогенеза при раке одним из приоритетных медико-биологических направлений. Опухоли, достигая размера 2–3 мм, далее не могут расти без кровоснабжения растущей ткани. По вновь образованным сосудам доставляется кислород, питательные вещества и удаляются продукты обмена. Рост опухолей строго зависит от неоангиогенеза, а блокирование образования новых сосудов может его подавлять [10]. Кроме того, вновь образовавшиеся сосуды важны для процесса метастазирования. Доказано, что опухоли, для которых характерна одновременная продукция различных ангиогенных факторов, чаще метастазируют [1, 14]. Таким образом, неоангиогенез является одним из определяющих факторов опухолевой прогрессии и играет ключевую роль в поддержании роста злокачественных новообразований и их метастатического потенциала.

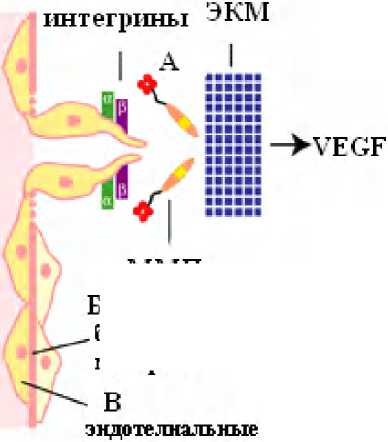
ммп
базальная мембрана
Рис. 1. Инициация ангиогенеза матриксными металлопротеиназами (ММП). Примечание: А – ММП расщепляют компоненты периваскулярного экстраклеточного матрикса (ЭКМ) и освобождают ангиогенные факторы роста (VEGF, FGF, G-CSF, HGF, IL-8, TGF, TNF и др.); Б – ММП расщепляют базальную мембрану, способствуя перемещению и пролиферации эндотелиальных клеток в направлении ангиогенного стимула; В – ММП участвуют в перемещении эндотелиальных клеток, регулируя их адгезивные свойства
клетки
Стимуляторы ангиогенеза включают такие факторы роста, как сосудистый эндотелиальный фактор роста (VEGF), фактор роста фибробластов (FGF), трансформирующий фактор роста (TGF) и другие [3]. Значение индуцированной VEGF васкуляризации при метастазировании опухолей подтверждено экспериментами, в которых выявлено, что снижение экспрессии VEGF приводило к значительному ингибированию развития сосудов в опухолях, замедлению роста опухолей и метастазов [18].
Процесс образования новых сосудов требует предварительного протеолиза экстраклеточного матрикса, пролиферации и миграции эндотелиальных клеток, а также синтеза новых компонентов матрикса. Матриксные металлопротеиназы (ММП) – представители семейства цинковых протеаз, участвующие в протеолитической деградации различных компонентов внеклеточного матрикса, осуществляют регулирующую и модулирующую функцию в неоангиогенезе за счет их комплексного участия в инвазивном росте и метастазировании опухоли. Ключевым моментом регуляции неоангиогенеза является баланс ангиогенных и ангиостатических факторов, который определяет тенденцию в развитии неопластических заболеваний. Однако в настоящее время большое вни- мание уделяется эндогенным ингибиторам ангиогенеза в качестве потенциальных мишеней противораковой терапии.
Значение металлопротеиназ в неоангиогенезе
Понимание процесса ангиогенеза и участие в этом специфических ММП являются основной целью многих исследований [22]. Известно, что высокий уровень экспрессии ММП представлен в новообразованиях различных локализаций, что связано со способностью опухоли к инвазивному росту, метастазированию и рецидивированию [24]. Значение металлопротеиназ в развитии сосудистой сети в опухолях неоднозначно. До настоящего времени роль ММП сводилась только к разрушению экстраклеточ-ного матрикса, что необходимо для роста новых сосудов. Однако уже доказано, что в процессе внеклеточного протеолизиса происходит высвобождение ангиогенных ростовых факторов, формируются проан-гиогенные центры связывания интегрина и активные факторы клеточной миграции (рис. 1). Показано, что ММП-2 и ММП-9 играют критическую роль в процессе неоангиогенеза и инициируют образование сосудов в начальной стадии васкуляризации опухоли [19]. В экспериментальных исследованиях показана связь ММП-3 с ростом опухоли и образованием новых сосудов [13]. ММП также вовлечены в другой механизм неоангиогенеза, сосудистую мимикрию, в ходе которой опухолевые клетки способны вести себя как эндотелиальные и формируют сообщающиеся каналы между островками неопластических клеток. Выявлено, что высокая экспрессия ММП-2 и МТ1-ММП связана с этой способностью неопластических клеток [11].
В то же время доказано участие ММП в образовании ангиостатических факторов. Исследования, проведенные на различных экспериментальных моделях, показали, что ингибирование ММП-9 может приводить как к ингибированию роста сосудистой сети опухолей, так и к уменьшению уровня ангиостатина и стимуляции опухолевого роста и васкуляризации [3]. Вероятно, ММП-2 и ММП-9 являются белками, контролирующими процесс ангиогенеза в злокачественных опухолях.
Роль ММП в ингибировании ангиогенеза
В настоящее время пристальное внимание уделяется изучению ингибиторов ангиогенеза, которые могут подавлять неоваскуляризацию первичного узла и препятствовать процессу метастазирования, что дает основание использовать их для антиметастати-ческой терапии злокачественных новообразований [6]. В экспериментах на животных с опухолью меланома B16-F10 было выявлено, что снижение васкуляризации опухолей, оцениваемое по экспрессии VEGF и уменьшению плотности микрососудов, в большинстве случаев сокращает частоту образования метастазов в легких [16]. У больных раком молочной железы считается перспективным использование антител к VEGF в схемах адьювантной терапии для предупреждения развития метастазов в послеоперационном периоде [21].
Охарактеризован ряд эндогенных антиангиоген-ных факторов, которые являются фрагментами внеклеточного матрикса и протеинов базальных мембран или ферментов, участвующих в их протеолизе [15]. Наиболее распространенными являются ангиостатин, эндостатин, аррестен и тумстатин. Наибольший интерес представляет ангиостатин, 38-kDa внутренний фрагмент профибринолизина, который может снижать экспрессию VEGF в опухоли и ингибировать FGF [8]. Кроме того, показано, что ангиостатин мо- жет индуцировать апоптоз или остановку митотического цикла эндотелиальных клеток [9] и ингибировать их миграцию [23]. Представлено большое количество работ, посвященных изучению механизма действия ангиостатина [10, 26]. Выявлено, что в протеолитической генерации ангиостатина из профибринолизина могут участвовать матриксные металлопротеиназы. Внеклеточный протеолизис профибринолизина может осуществляться матриксными металлопротеиназами MMП-2, MMП-7, MMП-9 и MMП-12 [7, 19]. Выяснение роли различных ММП в механизме образования ангиостатина и, в целом, неоангиогенеза будет служить основой для определения факторов, которые будут использоваться как перспективные избирательные мишени для ингибирования васкуляризации опухолевых тканей, что позволит найти новые подходы к антиметастатической противоопухолевой терапии.
Баланс ангиогенных и ангиостатических факторов
Большинство опухолей могут существовать в течение ряда лет без ангиогенеза, но они неспособны к росту более 2–3 мм. Переключение на ангиогенный фенотип приводит к прогрессивному росту. Считается, что бессосудистые, микроскопические опухоли пролиферируют и растут так же быстро, как и сосудистые опухоли. Однако в бессосудистой стадии коэффициент пролиферации сбалансирован апоптозом опухолевых клеток, появление сосудов приводит к уменьшению апоптотического коэффициента и изменению баланса в пользу клеточной пролиферации [2].
Ангиогенные факторы роста, такие как FGF, фактор некроза опухоли, VEGF, ангиогенин и другие, выделяемые опухолями, эндотелиальными клетками и стромальными клетками, действуют как аутокринные или паракринные факторы и ускоряют процесс ангиогенеза. В то же время опухолевая ткань продуцирует несколько антиангиогенных факторов: ангиостатин, тромбоспондин, тканевые ингибиторы металлопротеиназ (TIMP), которые препятствуют переключению опухоли на ангиогенный фенотип и задерживают рост опухолей. [16]. Для инициации ангиогенеза в опухоли должно увеличиться производство проангиоген-ных факторов или должен уменьшиться уровень ингибиторов [17].
Опухолевый ангиогенез начинается с растворе-
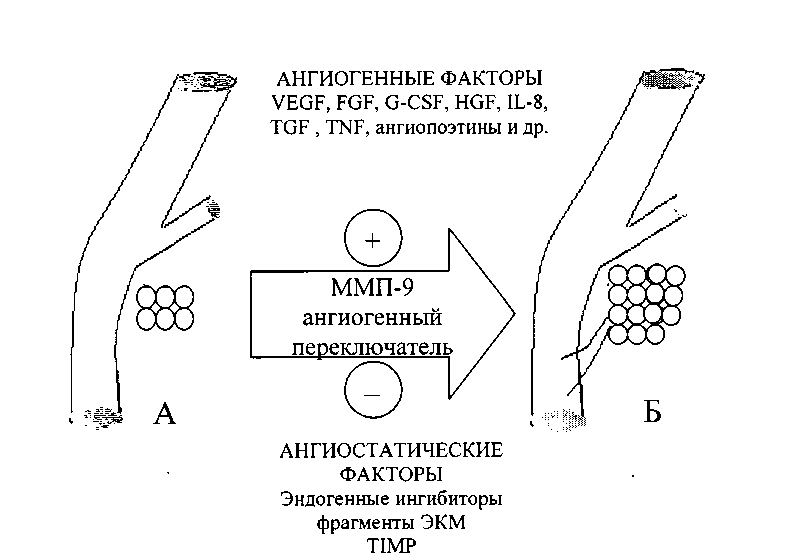
Рис. 2. Регуляция баланса ангиогенных и ангиостатических факторов в опухоли металлопротеиназами. Примечание: А – первичный опухолевый узел; Б – ангиогенез в первичной опухоли и интравазация опухолевых клеток в сосудистую систему; VEGF – сосудистый эндотелиальный фактор роста; FGF – фактор роста фибробластов; G-CSF – колониестимулирующий фактор гранулоцитов, HGF – фактор роста гепатоцитов; IL-8 – интерлейкин 8; TGF – трансформирующий ростовой фактор; TNF – фактор некроза опухолей; TIMP – тканевые ингибиторы матриксных металлопротеиназ; ММП-9 – матриксная металлопротеиназа 9
ния базальной мембраны, окружающей существующий ранее кровеносный сосуд, матриксными металлопротеиназами, произведенными опухолевыми и стромальными клетками. Эндотелиальные клетки мигрируют к опухоли через разрушенный межклеточный матрикс. Растворение внеклеточного матрк-са облегчает выпуск изолированных ангиогенных факторов. Поэтому увеличение активности ММП коррелирует с увеличением метастатического и ангиогенного потенциала опухоли.
В целом, развитие сосудистой сети в опухолях регулируется балансом ангиогенных и ангиостатических факторов. Например, преобладание экспрессии VEGF и FGF при немелкоклеточном раке легких над антиангиогенными связано с увеличением плотности микрососудов в опухоли и является признаком агрессивности заболевания [5], а высокий уровень экспрессии VEGF и ангиопоэтина-2 по сравнению с тромбоспондином, ингибитором ангиогенеза коррелирует с вероятностью рецидивирования гепатоцеллюлярного рака печени [25]. В то время как преобладание экспрессии ангиостатических факторов, например TIMP-1, по сравнению с ангиогенными в экспериментальной модели на трансгенных мышах значительно ингибировало опухолевый рост подавлением ангиогенеза [12].
Тенденция в сторону преобладания про- или ан-тиангиогенных факторов определяет развитие неопластических заболеваний. По-видимому, ММП и их ингибиторы являются ключевыми ферментами-регуляторами баланса ангиогенных и ангиостатических факторов (рис.2). Большое значение данный факт имеет в развитии феномена вторичной противоопухолевой устойчивости (concomitant antitumoral resistance – CAR), который заключается в сдерживании роста метастазов первичной опухолью. Выявле- но, что в феномене CAR самым важным является наличие тенденции преобладания ангиостатических факторов [19]. Основную роль в этом процессе играет эндогенный ингибитор – ангиостатин [4].
Таким образом, неоангиогенез имеет существенное значение в прогрессировании неопластических заболеваний. Роль металлопротеиназ в качестве регуляторов роста опухолей связана с балансом ангиогенных и ангиостатических факторов. Нарушение баланса между ангиогенными агентами и ингибиторами ангиогенеза, скорее всего, служит основным механизмом поддержания роста солидных опухолей и их метастазирования. Выявлено участие ММП в процессах образования эндогенных ингибиторов ангиогенеза, которые способны останавливать рост новых сосудов и препятствовать метастазированию опухоли. Накопленные данные позволяют разрабатывать фармакологические препараты ингибиторов ангиогенеза и способствуют их широкому применению в онкологической практике.


