Метан и сероводород в донных отложениях лиманов Азово-Черноморского бассейна
Автор: Гарькуша Дмитрий Николаевич, Федоров Юрий Александрович, Трубник Роман Геннадьевич, Доценко Николай Витальевич
Журнал: Антропогенная трансформация природной среды @atps-psu
Рубрика: Сохранение природной среды
Статья в выпуске: 1 т.8, 2022 года.
Бесплатный доступ
В летне-осенний период 2013-2018 гг. проведены исследования распределения метана (СН4) и сероводорода (ΣH2S) в лиманах Азовского (Ейский, Бейсугский, Сладкий, Курчанский и Ахтанизовский) и Черного (Витязевский, Кизилташский и Бугазский) морей, характеризующихся различной соленостью. Впервые для характеристики сопряженного распределения СН4 и ΣH2S в донных отложениях водных экосистем использован коэффициент «метанизации» (КCH4), представляющий собой процентное содержание СН4 от суммы концентраций (в мг/г) восстановленных газов - ΣH2S и СН4. Концентрации СН4 и ΣH2S в донных отложениях опресненных лиманов с соленостью воды от 0,26 до 8,20‰ (Сладкого, Ахтанизовского и Курчанского) варьируют в пределах от 0,01 до 114,34 мкг/г влажного осадка и от
Лиманы, азовское и черное море, донные отложения, метан, сероводород, окислительно-восстановительные условия, кислотно-щелочная обстановка
Короткий адрес: https://sciup.org/147238233
IDR: 147238233 | УДК: 504.064+543.31 | DOI: 10.17072/2410-8553-2022-1-6-20
Текст научной статьи Метан и сероводород в донных отложениях лиманов Азово-Черноморского бассейна
Dmitry N. Gar'kusha1, Yury A. Fedorov2, Roman G. Trubnik3, Nikolay V. Dotsenko4 1,2,3,4 Institute of Earth Sciences of Southern Federal University, Rostov-on-Don, Russia 1 , 2 , 3 , 4 ,
Метан и сероводород являются основными восстановленными газами водных экосистем, образующимися, главным образом, вследствие протекания в донных отложениях сложных метаболических процессов разложения органического вещества [9,24]. Актуальность изучения сопряженного распределения этих газов обусловлена не только с точки зрения их непосредственного влияния на экологическое состояние водных экосистем, но и тем, что метан является также одним из наиболее значимых парниковых газов (см., например, [18,20-21]).
Считается, что между процессами образования метана и сероводорода, в зависимости от условий, складывающихся в водных объектах, могут наблюдаться как конкурентные, так и синтрофные взаимоотношения, проявляющиеся в характере связи между концентрациями этих газов [9,28,31]. Генерация метана и сероводорода биохимическим путем в донных осадках водных экосистем различного типа (пресные и солоноватые водоемы и водотоки), как правило, происходит в одних и тех же экологических нишах [10,17,30]. Биогенный метан образуется метаногенными археями из простых продуктов минерализации органического вещества донных осадков (Н2, СО2, ацетат, метанол, формиат, метиламины) [7,26]. Сероводород генерируется в основном вследствие протекания процесса сульфатредукции, в то время как вклад гнилостного распада в его образование обычно не учитывается [25]. Сульфатредукторы и метаногены, занимая одни и те же экологические ниши, нередко используют одни и те же питательные субстраты, в частности ацетат, формиат и молекулярный водород. Поэтому между ними за обладание этими субстратами возникает конкурентная борьба, преимущество в которой принадлежит бактериям-сульфат-редукторам [17,27,29]. Исследования [5,10,25] показали, что в пределах нескольких десятков сантиметров для океанических и морских акваторий обычно характерно обратное распределение содержаний метана и сероводорода и скоростей их образования по вертикали донных осадков, что хорошо согласуется с вышеизложенными представлениями об ингибировании процесса метаногенеза сульфатредукцией. В то же время, в отдельных случаях данная закономерность не проявляется. Нередко, наряду с обратной, наблюдается и прямая связь между концентрациями метана и суммарного сероводорода [17,25]. Синхронное продуцирование метана и сероводорода в работе [17] объясняется возможным течением реакции метаногенеза как по пути ферментации ацетата, так и путем восстановления диоксида углерода молекулярным водородом. Наличие в больших количествах последнего обусловлено распадом лабильного органического вещества в местах его свала на участках загрязнения водных экосистем хозяйственно-бытовыми стоками, что нивелирует конкуренцию между метаногенами и сульфатвосстанавливающими бактериями за обладание молекулярным водородом. В работе [25] высказано предположение, что синхронное образование метана и сероводорода может быть связано также с развитием на загрязненных участках альтернативных процессов их генерации. Это, прежде всего, образование сероводорода гнилостными бактериями и бактериями, участвующими в гидролизе древесины, поступающей различными путями в водотоки и водоемы. В местах поступления загрязненных фекалиями стоков и стоков с сельскохозяйственных полей, где применяются органические удобрения возможен при-внос сульфитредуцирующих клостридий, способных также генерировать сероводород [23]. Что касается метана, то его образование на таких участках может протекать и по реакции восстановления метилированных аминов (моно-, ди-, триметиламины) [32], не являющихся питательным субстратом для сульфатре-дукторов.
В настоящей работе рассматриваются результаты сопряженного изучения распределения концентраций метана (СН 4 ) и сульфидной серы (∑H 2 S) в донных отложениях лиманов Азовского и Черного морей, а также роли в формировании уровня их содержания, физико-химических условий и литологического фактора. Впервые для характеристики сопряженного распределения СН 4 и ∑H 2 S в донных отложениях предложен коэффициент «метанизации», представляющий собой процентное содержание СН 4 от суммы концентраций (в мг/г) восстановленных газов – ∑H 2 S и СН 4 .
Материалы и методы
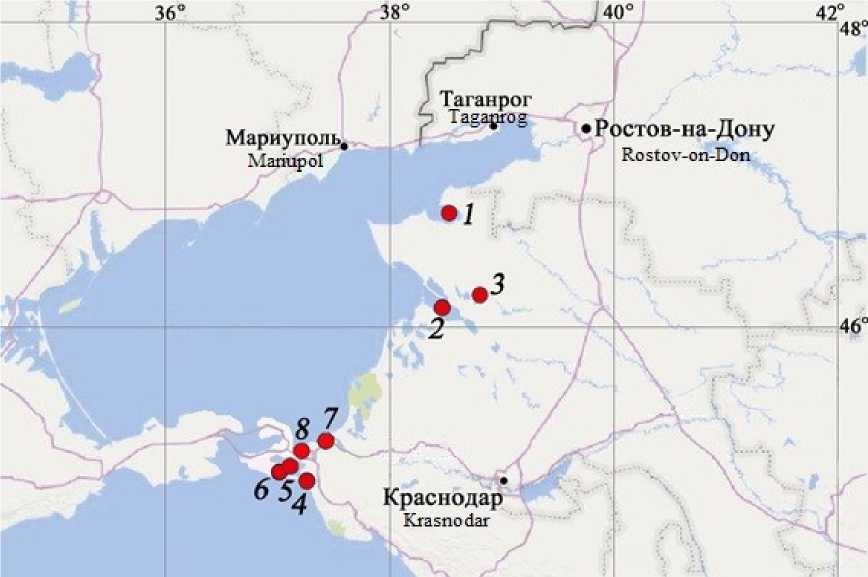
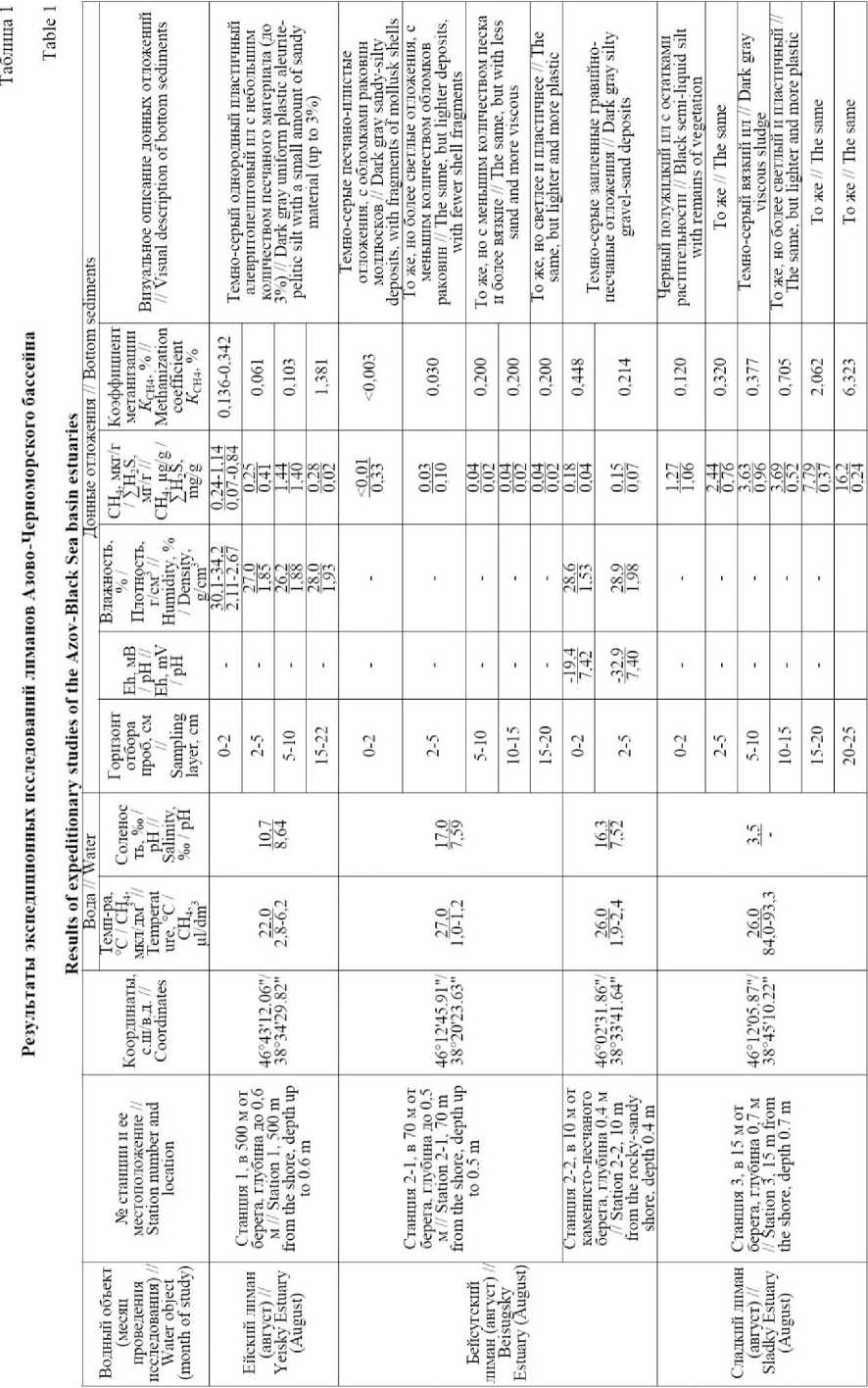
В летне-осенний период (августе и октябре) в Азово-Черноморском бассейне проведены исследования лиманов, относящихся по географическому положению и гидрологическим особенностям к четырем группам [2]: лиманы юго-восточного побережья Азовского моря (Ейский и Бейсугский), АзовоКубанские лиманы (Ахтанизовский и Курчанский), Черноморско-Кубанские или Кизилташские лиманы (Витязевский, Кизилташский и Бугазский) и степные лиманы Азовского моря, гидрологически не связанные с морем (Сладкий лиман) (Рис. 1, Табл. 1).
В ходе исследований вышеназванных лиманов, помимо метана (СН 4 ) и общего содержания сульфидной серы (далее, суммарный сероводород – ΣH 2 S), в отдельных лиманах в различных горизонтах (до 25
см) донных отложений определены значения Eh и рН, влажность и плотность, а также соленость воды. Пробы донных отложений отбирали с помощью специально сконструированной трубки с остро заточенными краями и фторопластовым поршнем для выдавливания керна.
Отбор, транспортировка, хранение проб и последующее определение СН 4 и ΣH 2 S проводили согласно аттестованным методикам [12-14]. Определение метана выполняли на газовом хроматографе «Хроматэк-Кристалл 5000.2» с дозатором равновесного пара на пламенно-ионизационном детекторе. Выполнение измерений массовой доли ΣH 2 S основано на переводе сульфидов донных отложений в сероводород действием соляной кислоты и последующей отдувке сероводорода азотом особой чистоты в раствор гидроксида натрия и определения сульфид-ионов фотометрическим методом с N,N-диметил-п-фенилен-диамином [14]. При этом в общее содержание сульфидной серы, входят как растворенные в поровой воде сероводород и сульфиды щелочных металлов, так и сульфиды, содержащиеся в твердой фракции, которые представляют собой кислоторастворимые сульфиды железа и тяжелых металлов, нерастворимые в воде. Определение газов производилось в донных отложениях при их естественной влажности и выражалось в мкг/г и мг/г влажного осадка (вл. о.), соответственно, для метана и сероводорода.
Мариуполь, Mariupol
Краснодар
Krasnodar
Таганрог
Taganrog
140е
• Ростов-на-Дону
Ro stov-on-Don
Рис. 1. Местоположение исследованных лиманов Азово-Черноморского бассейна
1 – Ейский; 2 – Бейсугский; 3 – Сладкий; 4 – Витязевский; 5 – Кизилташский; 6 – Бугазский;
7 – Курчанский; 8 – Ахтанизовский
Fig. 1. Location of the studied estuaries of the Azov-Black Sea basin
-
1 – Yeisky; 2 – Beysugsky; 3 – Sladky; 4 – Vityazevsky; 5 – Kiziltashsky; 6 – Bugazsky; 7 – Kurchansky;
-
8 – Akhtanizovsky
Одновременно с отбором проб в заранее взвешенные и пронумерованные бюксы отбирали навеску донных отложений для определения их влажности и плотности. Определение величин Eh и pH выполнено с помощью электродов портативного рН метра иономера – “Экотест 2000” сразу после отбора проб. Минерализация воды определялась по методике, описанной в работе [15]. Также привлекались опубликованные данные других исследователей
Результаты исследования
Исследованные лиманы Азовского (Ейский, Бей-сугский, Сладкий, Курчанский и Ахтанизовский) и Черного морей (Витязевский, Кизилташский и Бугаз-ский), расположены на Азово-Кубанской равнине и Таманском полуострове и по происхождению относятся к лагунно-морским водоемам, за исключением Сладкого лимана, относящегося к пойменным водоемам [6]. Для лиманов характерны частые внутригодовые и межгодовые изменения объемов воды и уровенного режима и, как следствие, химического состава воды и ее минерализации. При изменении гидрологического режима, способствующего снижению или увеличению минерализации воды (рапы), может иметь место изменение значений физико-химических параметров, содержания органического вещества, его состава и качества, и как следствие, перестройка микробного сообщества и метаболического цикла метана и сероводорода [16].
Ейский лиман (площадь водного зеркала – 240 км2), расположенный на юго-восточном побережье Азовского моря, является эстуарием реки Ея, впадающей в него с востока. С запада лиман широким (до 3,5 км) гирлом соединяется с Таганрогским заливом Азовского моря. Лиман мелководен, здесь преобладают глубины от 0 до 1,5 м, и только ближе к морю они возрастают до 3–3,5 м. Дно лимана плоское и покрыто слоем ила. Уровень воды в лимане зависит в основном от уровня воды в Азовском море и обусловливается изменениями водного баланса моря и сгонно-нагонными явлениями. Минерализация и химический состав воды в лимане зависят в первую очередь от его водообмена с Азовским морем, а также от стока реки Еи [2]. Соленость воды Ейского лимана в августе 2017 г. на исследуемом участке составляла 10,7‰.
Бейсугский лиман (площадь водного зеркала – 270 км2), расположенный на юго-восточном побережье Азовского моря, представляет собой затопленную морем устьевую часть долины реки Бейсуг. От Азовского моря лиман отделен сравнительно узкой Ясен-ской косой, сложенной в основном из ракушечника. С обеих сторон косы имеются гирла – Ясенское и Бу-газское, через которые лиман сообщается с морем. Мелкими гирлами лиман соединяется также с многочисленными мелкими водоемами, разбросанными по его северо-восточному берегу. Дно лимана пологое, его глубины невелики, но в направлении Ясенского гирла имеется ложбина, в пределах которой наблю- даются глубины от 2–2,5 м, а в центральной ее части у самого гирла – до 4–5 м [2]. Амплитуда среднемесячных уровней воды в лимане достигает 1 м, а при сгонно-нагонных ветрах колебания уровней значительно выше. Соленость воды Бейсугского лимана в августе 2013 и 2018 гг. на исследуемых участках составляла 16,3–17,0‰.
Сладкий лиман – это относительно небольшой (площадь водного зеркала – 23 км2) и неглубокий замкнутый водоем, удаленный от Азовского моря на значительное расстояние. Его гидрологический и гидрохимический режим зависит от реки Челбас, в низовьях которой данный лиман располагается [2]. В период исследования в августе 2013 г. соленость воды Сладкого лимана составляла 3,5‰.
Витязевский, Кизилташский и Бугазский лиманы относятся к наиболее крупным лиманам из группы Черноморско-Кубанских лиманов [2], расположенных на Таманском полуострове между Таманским заливом и городом Анапой. Это лагунные водоемы древней дельты реки Кубань, отделенные от Черного моря узкой песчаной косой (Анапской пересыпью). В начале XIX века жители Тамани изменили расположение русла Кубани, построив канал для опреснения лиманов, находящихся в северной части полуострова. Лишившись подпитки водами р. Кубань, Кизилташские лиманы быстро засолонились. В настоящее время соленость воды в лиманах значительно колеблется как во времени, так и пространстве, составляя в Витязев-ском лимане – 41,6‰ [1], в Кизилташском и Бугаз-ском лиманах – 29,0–58,0‰ и 39,5–50,0‰, соответственно [3]. В летний период лиманы сильно мелеют, значительно изменяя свои очертания.
Витязевский лиман является самым южным из Черноморско-Кубанских лиманов Таманского полуострова. Он представляет собой закрытый бессточный соленый водоем (с площадью водного зеркала – 54 км2), пресные воды в который поступают в виде атмосферных осадков. С севера в полноводные годы в лиман поступают воды русла Старая Кубань; на востоке в лиман впадает маловодная речка Гостагайка. Несмотря на то, что Анапская пересыпь (коса) отделяет Витязевский лиман от Черного моря, тем не менее, морские воды просачиваются в лиман через дно пересыпи, а также переливаются во время штормовых нагонов [19].
Кизилташский лиман является самым большим лиманом юга России, площадь которого составляет 153 км2. На севере Кизилташский лиман соединён протокой с лиманом Цокур, на востоке – с Бугазским лиманом, имеющим связь с Черным морем, и как следствие, влияющим на осолонение вод Кизилташ-ского лимана [19]. До начала ХХ века именно в Кизи-лташский лиман вливалась большая часть вод реки Кубань. Постепенное заиление реки привело к смещению ее основного русла на север. Позднее пресный водоток был восстановлен благодаря расчистке русла Старой Кубани.
|
Водный объект (месяц проведения исследования) // Water object (month of study) |
№ станции и ее местоположение // Station number and location |
Координаты, с.ш/в.д. И Coordinates |
Вода // Water |
Донные отложения // Bottom sediments |
||||||
|
Темп-pa. °C/CH*, мкл/дм^ Temp erat иге. °C / CH4 pl/dm |
Соленое IB. %o/ pH// Salinity. %o / pH |
Горизонт отбора проб, см Sampling layer, cm |
Eh. мВ /pH// Eh, mV /pH |
Влажность. %/ Плотность, г/см3 // Humidity, % / Density, g/cm3 |
CH4, мкг/г / £h2S, мг/г // CIL. pg/g / £h2s, mg g |
Коэффициент метанизации ^CH4, % // Methanrzation coefficient ^4, % |
Визуальное описание донных отложений И Visual description of bottom sediments |
|||
|
15-20 |
-101.0 7.51 |
- |
0,03 0,19 |
0,016 |
To же, но более плотный, не пластичный, с включениями обломков раковин моллюсков И The same, but more dense, not plastic, with inclusions of fragments of mollusk shells |
|||||
|
20-25 |
-125.0 |
- |
0,03 0,16 |
0.019 |
To же // The same |
|||||
|
7.59 |
||||||||||
|
Курчанский лиман (август) ii Ktuchansky Estuary (August) |
Станция 7-1, в 3 м от уреза воды, вблизи тростниковых зарослей, глубина 0.3 м И Station 7-1, 3 ш h orn the water's edge, neat reed beds, depth 0.3 m |
45=13'49.987 37=33'43.56" |
28,0 27.2 |
Данные [11]: 2.95-8.20 Data[ll]: 2.95-8,20 |
0-2 |
-133.1 7.21 |
41.4 1.76 |
10.98 1.41 |
0,773 |
Черный глинистый ил // Black elay silt |
|
2-5 |
-162.0 7,17 |
33.6 1.78 |
1,15 0,04 |
2,795 |
Черный до темно-серого влажный ил. книзу уплотняется и светлеет // Black to dark gr ay wet silt, thickens downwards and brightens |
|||||
|
5-10 |
-82.3 7.50 |
17.0 1.93 |
0.02 <0.001 |
>1,961 |
Серые до коричневого песчаные отложения // Gray to brown sand deposits |
|||||
|
Станция 7-2, в 50 м от уреза воды, глубина 0,6 м /7 Station 7-2, 50 m from the water's edge, depth 0.6 m |
45=13'52.467 37=33'42.25" |
0-2 |
-177.8 7.51 |
23,6 2.13 |
0,01 0,13 |
0.008 |
Темно-серый заиленный песок с вктючениязш черного цвета (<3%) // Dark gray silty sand with black inclusions (<3%) |
|||
|
2-5 |
-182.2 7.57 |
24.0 2.15 |
0,01 0,09 |
0,011 |
||||||
|
5-10 |
-89,1 7)91 |
20,4 1,76 |
0,01 0,05 |
0,020 |
||||||
|
Ахтанизовский лиман (август) Н Akhtanizovsky Estuary (August) |
Станция 8-1. в 3 м от уреза воды, вблизи тростниковых зарослей, глубина 0,4 м // Station 8-1. 3 m from the water’s edge, near reed beds, depth 0.4 m |
45=19'06.787 37=06'31.32" |
24,0 68,6-94.5 |
Данные [11]: 0,26-1.75 // Data [11]: 0.26-1.75 |
0-2 |
-159.9 7,17 |
72,2 1.26 |
61.55 0,26 |
19.142 |
Серо-бурый наилок П Gray-brown silt |
|
2-5 |
-157.3 7,17 |
52.8 1.58 |
114.34 1,12 |
9,263 |
Темно-серый до черного ил с полуразложнвшимнея остатками растительности // Dark gray to black silt with semi-decomposed vegetation |
|||||
|
Станция 8-2, в 100 м от уреза воды, глубина 0.6 м// Station 8-2,100 ш from the water's edge, depth 0.6 m |
45=19'05.277 37=06'34.90" |
24.0 10,2 |
0-2 |
-151.8 7.05 |
36,4 1.89 |
0,63 3,07 |
0.021 |
Темно-серый заиленный песок // Dark Slav silty7 sand |
||
|
2-5 |
-181.7 |
25,8 1.75 |
0,51 1,61 |
0,032 |
To же // The same |
|||||
|
7.25 |
||||||||||
|
5-10 |
-177.9 7,28 |
26.8 1.66 |
0,58 0,75 |
0.0"" |
To же // The same |
|||||
|
15-20 |
-205.0 7.46 |
29.0 1.86 |
4.88 1,12 |
0.434 |
Темно-серый до черного песчаный ил .7 Dark gray to black sandy silt |
|||||
|
20-25 |
-220.1 |
31,2 1,99 |
1,02 1,45 |
0.070 |
To же // The same |
|||||
|
7.44 |
||||||||||
Антропогенная трансформация природной среды
Бугазский лиман (площадь – 36 км2), отделенный узкой и невысокой Бугазской косой от Чёрного моря, имеет непосредственную связь с морем через искусственное гирло. От Кизилташского лимана Бугаз-ский лиман отделен косой Голенькой.
Ахтанизовский лиман – крупнейший пресный водоем Азово-Черноморского бассейна, расположенный в северной части Таманского полуострова. Площадь лимана составляет 71,5 км2, наибольшая глубина – 1,6 м. Еще в начале XIX века Ахтанизов-ский лиман представлял собой замкнутый соленый водоём, связанный только с Азовским морем через Пересыпское (Ахтанизовское) гирло. Но в 1819 году жители станиц Старотитаровская и Темрюкская, с целью опреснить лиман, соединили его с Кубанью. С тех пор примерно шестая часть стока Кубани поступает в лиман, что способствует интенсивному накоплению ила на дне водоема.
Курчанский лиман, расположенный на правом берегу реки Кубань, к северо-востоку от города Темрюк, относится к Куликовской группе Центральной системы лиманов Кубани. Площадь лимана составляет 57,5 км², наибольшая глубина около 1,5 м. Питание происходит за счёт вод Кубани, поступающих по Курчанскому каналу. Лиман поддерживает непосредственную связь с Азовским морем через Соловьевское гирло.
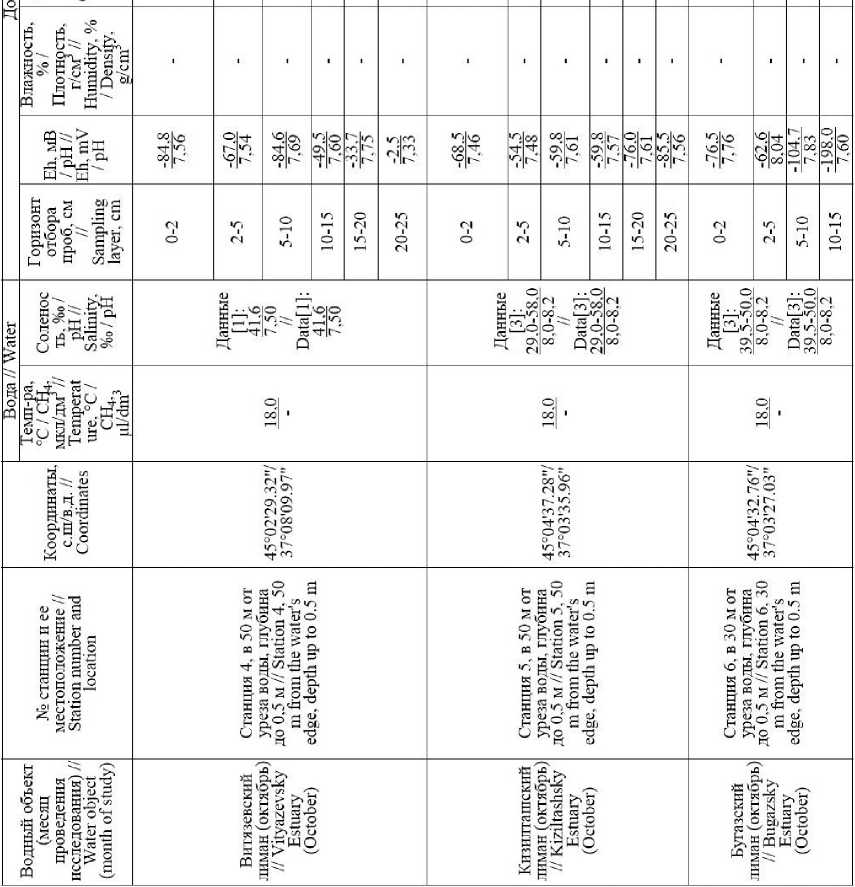
Согласно наблюдениям, проведенным в весеннелетний (апрель – июнь) период 2017–2018 гг. [11] соленость воды в Ахтанизовском и Курчанском лиманах соответственно изменялась в пределах 0,26– 1,75‰ и 2,95–8,20‰. Более высокая соленость вод Курчанского лимана обусловлена лучшим водообменом лимана с Азовским морем через достаточно широкое Соловьевское гирло, по сравнению с Пере-сыпским гирлом Ахтанизовского лимана.
Исследованные мелководные лиманы, имея в целом сходное происхождение, различаются длительностью формирования, что накладывает отпечаток на степень их «отшнурованности» от морей, структуру и состав преобладающих в них донных отложений и, как следствие, на физико-химические условия и интенсивность протекания биогеохимических процессов [16]. Донные отложения лиманов представлены преимущественно илисто-песчаными отложениями от темно-серого до черного цвета, для которых характерна нейтральная или слабощелочная среда (рН – от 7,05 до 8,04, в среднем 7,50) и восстановительные условия (Eh – от -220,1 до -2,5 мВ, в среднем -106,9 мВ). При этом в донных отложениях опресненных лиманов с соленостью воды от 0,26 до
-
8,20‰ (Сладкий, Курчанский и Ахтанизовский), наряду с минимальными величинами рН (в среднем 7,36), фиксируются и наиболее восстановительные условия (в среднем -160,0 мВ) (см. табл. 1).
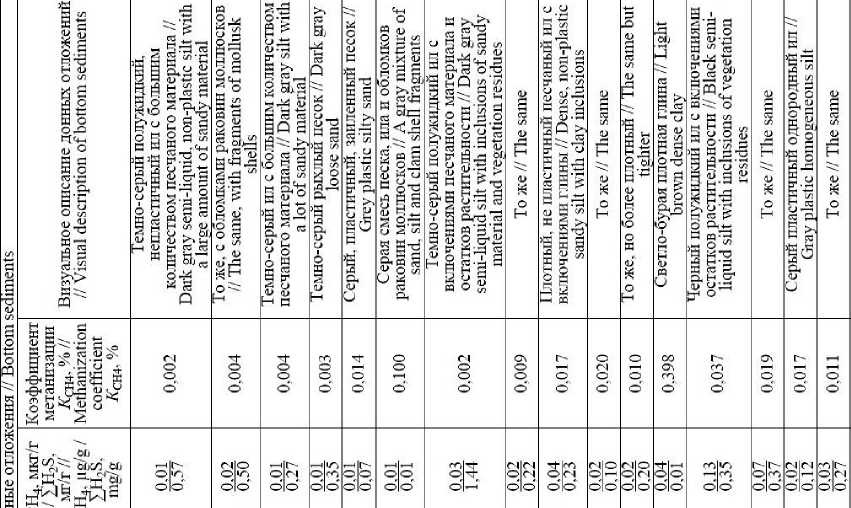
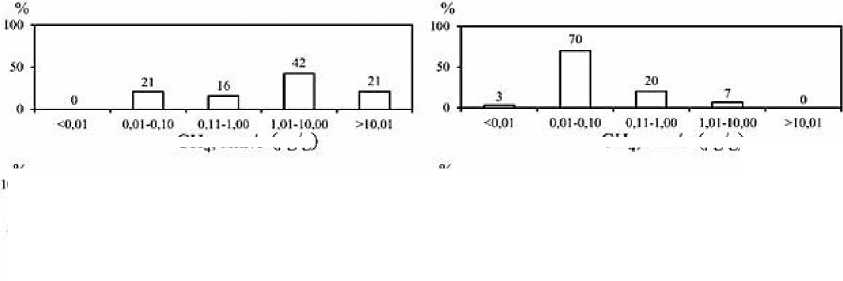
Концентрации СН 4 и ΣH 2 S в донных отложениях опресненных лиманов – Сладкого, Ахтанизовского и Курчанского – изменяются в пределах от 0,01 до 114,34 мкг/г вл. о. (среднее значение – 12,1 мкг/г, медиана – 1,27 мкг/г) и от <0,001 до 3,07 мг/г вл. о. (среднее значение – 0,79 мг/г, медиана – 0,75 мг/г) соответственно. Экстремально высокие концентрации СН 4 (61,55–114,34 мкг/г) зафиксированы в верхних горизонтах (0–5 см) илистых отложений, отобранных возле берега Ахтанизовского лимана, заросшего сообществом тростника и рогоза, в то время как максимальные концентрации ΣH 2 S (3,07 мг/г) наблюдались в 70 м от берега в 0–2 см слое отложений данного лимана (см. Табл. 1). В Курчанском лимане максимальные концентрации СН 4 (10,98 мкг/г) и ΣH 2 S (1,41 мг/г) зафиксированы в 0–2 см горизонте илистых отложений, отобранных вблизи прибрежных тростниковых зарослей. В нижних более песчаных горизонтах концентрации ΣH 2 S в отложениях Курчанского и Ахтанизовского лиманов, как правило, несколько снижались, а концентрации СН 4 либо уменьшались, либо оставались примерно на одном уровне (Рис. 2). В Сладком лимане концентрации ΣH 2 S по вертикали отобранной 25 см колонки отложений также снижаются (с 1,06 до 0,24 мг/г), а концентрации СН 4 , напротив, значительно возрастают (с 1,27 до 16,2 мкг/г). В целом распределение концентраций СН 4 и ΣH 2 S в донных отложениях коррелирует с гранулометрическим составом донных отложений; наиболее высокие их концентрации характерны для более тонкозернистых отложений, минимальные – для песчаных осадков. Процентное содержание СН 4 от суммы изученных восстановленных газов (коэффициент метанизации К СН4 ) варьирует в диапазоне 0,008– 19,14% (среднее значение – 2,34%, медиана – 0,38%), с максимальными значениями в 0–5 см горизонте илистых отложений, отобранных вблизи прибрежных тростниковых зарослей, и минимальными в 0–5 см горизонте песчаных отложений, отобранных на участках, удаленных от берега. Для изученных опресненных лиманов наиболее встречаемым (42% отобранных проб) является диапазон концентраций СН 4 – 1,01–10,0 мкг/г, для ΣH 2 S наиболее частыми диапазонами концентраций являются 0,11–1,00 мг/г (42%) и >1,01 мг/г (37%) (Рис. 3). В 68% отобранных проб донных отложений содержание СН 4 не превышает 1% от суммы концентраций СН 4 и ΣH 2 S.
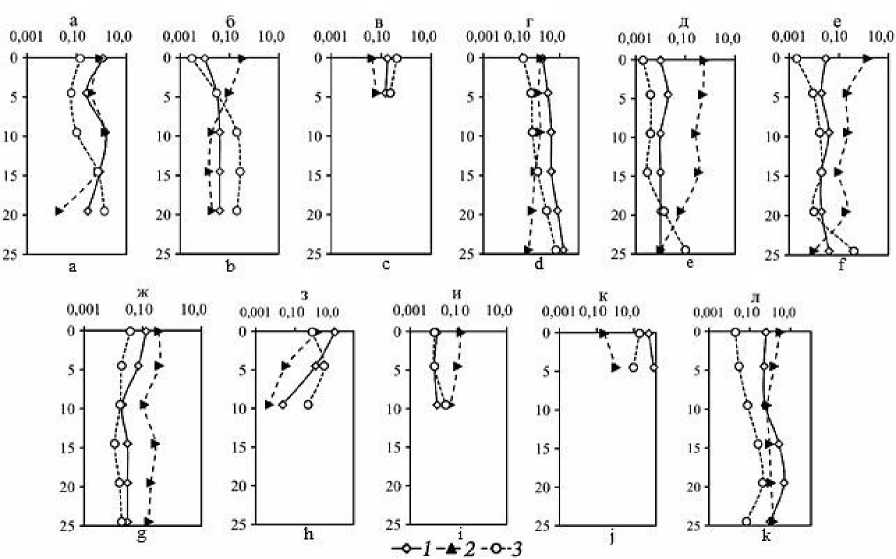
Рис. 2. Распределение концентраций СН 4 в мкг/г ( 1 ) и ΣH 2 S в мг/г ( 2 ), а также процентного содержания метана ( 3 ) по вертикальному профилю донных отложений лиманов Азовского и Черного морей: а – ст. 1, Ейский; б – ст. 2-1, Бейсугский; в – ст. 2-2, Бейсугский; г – ст. 3, Сладкий; д – ст. 4, Витязевский; е – ст. 5, Кизилташский; ж – ст. 6, Бугазский; з – ст. 7-1, Курчанский; и – ст. 7-2, Курчанский; к – ст. 8-1, Ахтанизовский; л – ст. 8-2, Ахтанизовский
Fig. 2. Distribution of CH 4 concentrations in μg/g (1) and ΣH 2 S concentrations in mg/g (2), as well as the percentage of methane (3) along the vertical profile of bottom sediments in the estuaries of the Azov and Black Seas: a – st. 1, Yeisky (August 2017); b – st. 2-1, Beisugsky (August 2013); c – st. 2-2, Beisugsky Estuary (August 2018); d – st. 3, Sladky (August 2013); e – st. 4, Vityazevsky (October 2014); f – st. 5, Kiziltashskiy (October 2014); g – st. 6, Bugazsky (October 2014); h – st. 7-1, Kurchansky (August 2018); i – Art. 7-2, Kurchansky (August 2018); j – st. 8-1, Akhtanizovsky (August 2018); k – st. 8-2, Akhtanizovsky (August 2018)
СН., мкг/г (Mg'g)
CH.„ мкг/г (pg'g)
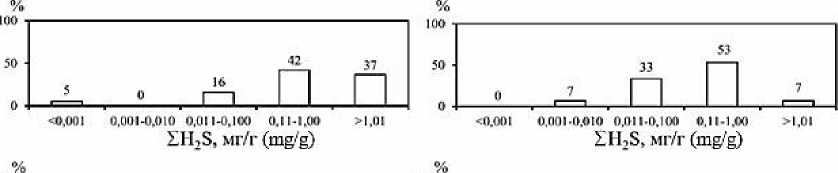
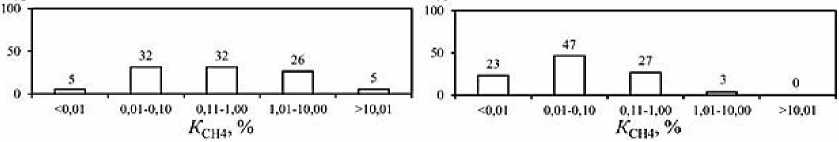
Рис. 3. Частота встречаемости (в %) концентраций СН 4 в мкг/г и ∑H 2 S в мг/г, а также процентного содержания СН 4 в донных отложениях опресненных (а) и солоноватых (б) лиманов Азовского и Черного морей
Fig. 3. Frequency of occurrence (%) of CH 4 concentrations in μg/g and ∑H 2 S in mg/g, as well as the percentage of CH 4 in bottom sediments of desalinated (a) and brackish (b) estuaries of the Azov and Black Seas
Концентрации СН4 и ΣH2S в донных отложениях более минерализованных лиманов (соленость >10‰) – Ейского, Бейсугского, Витязевского, Кизилташского и Бугазского – изменяются в пределах от 0,01 до 1,44 мкг/г вл. о. (среднее значение – 0,15 мкг/г, медиана – 0,03 мкг/г) и от 0,01 до 1,44 мг/г вл. о. (среднее значение – 0,29 мг/г, медиана – 0,19 мг/г) соответственно. Максимальные концентрации ΣH2S (до 1,44 мг/г), при относительно низких концентрациях СН4 (0,02– 0,04 мкг/г) установлены в отложениях Кизилташского лимана (см. Табл. 1), представленных темно-серым илом с включениями песчаного материала и растительных остатков. Максимальные концентрации СН4 (1,14–1,44 мкг/г) и одни из самых высоких концентраций ΣH2S (0,84–1,40 мг/г) характерны для 0–10 см горизонта коричневых мелкоалевритовых илов Ейского лимана. Для изученных отложений остальных лиманов концентрации СН4 и ΣH2S не превышали соответственно 0,18 мкг/г и 0,57 мг/г и, как правило, синхронно снижались по направлению к нижним горизонтам (Рис. 2). Процентное содержание СН4 от суммы изученных восстановленных газов варьирует в диапазоне 0,002–1,38% (среднее значение – 0,13%, медиана – 0,02%) и, обычно, несколько возрастает вниз по колонке отложений. Для изученных морских лиманов наиболее встречаемым (70% отобранных проб) является диапазон концентраций СН4 от 0,01 до 0,10 мкг/г, для ΣH2S наиболее частыми (53%) являются концентрации от 0,11 до 1,0 мг/г (Рис. 3). В подавляющем большинстве отобранных проб донных отложений (97%) концентрации СН4 не превышают 1% от суммы концентраций СН4 и ΣH2S.
В целом концентрации метана и его процентное содержание от суммы исследуемых восстановленных газов в отложениях опресненных лиманов на 1–2 порядка выше его концентраций в отложениях более минерализованных лиманов (соленость >10‰), в то время как между концентрациями ΣH 2 S в этих двух группах лиманов наблюдаются относительно небольшие различия (Рис. 4). Концентрации метана в воде опресненных лиманов также были существенно более высокими (10,2–94,5 мкл/дм3), по сравнению с его концентрациями (1,0–6,2 мкл/дм3) в воде лиманов с соленостью выше 10‰ (см. Табл. 1).
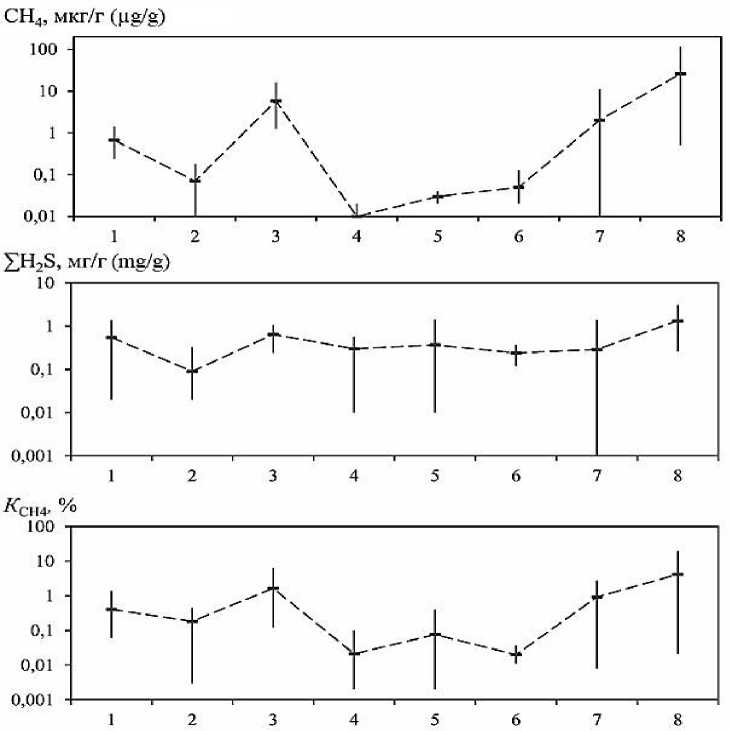
Рис. 4. Пределы изменения и средние концентрации СН 4 , ∑H 2 S и процентного содержания СН 4 в донных отложениях исследованных лиманов Азовского и Черного морей: 1 – Ейский; 2 – Бейсугский;
3 – Сладкий; 4 – Витязевский; 5 – Кизилташский; 6 – Бугазский; 7 – Курчанский; 8 – Ахтанизовский
Fig. 4. Limits of change and average concentrations of CH 4 , ∑H 2 S and the percentage of CH 4 in the bottom sediments of the studied estuaries of the Azov and Black Seas: 1 – Yeisky; 2 – Beisugsky; 3 – Sladky;
4 – Vityazevsky; 5 – Kiziltashky; 6 – Bugazsky; 7 – Kurchansky; 8 – Akhtanizovsky
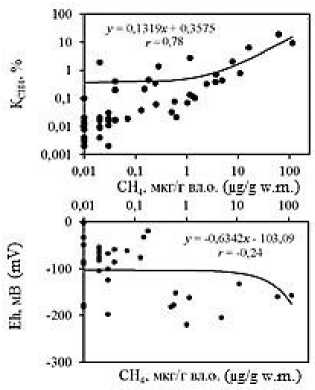
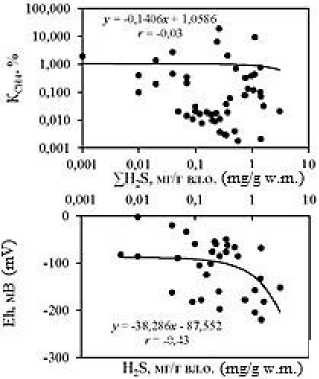
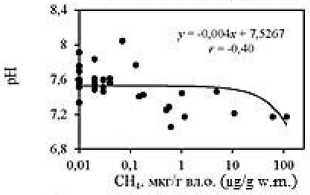
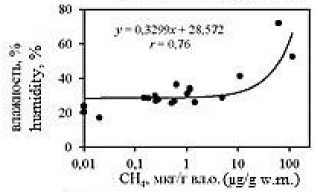
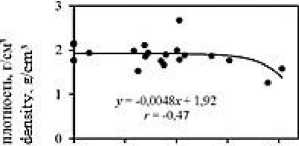
Анализ корреляционных зависимостей между исследуемыми гидрохимическими показателями в донных отложениях лиманов (Рис. 5; зависимости построены для всего массива данных) выявил наличие достаточно тесных связей концентраций метана с влажностью ( r = 0,76) и плотностью ( r = –0,47) отложений, значениями рН ( r = –0,40) и Eh ( r = –0,24); а также концентраций ∑H 2 S со значениями рН ( r =
–0,52), Eh ( r = –0,43) и влажностью ( r = 0,44). Анализ тесноты связи коэффициента метанизации К СН4 с концентрациями СН 4 , ∑H 2 S и другими исследуемыми показателями показывает наличие высокой прямолинейной связи его значений с концентрациями СН 4 ( r = 0,78), а также влажностью ( r = 0,88) и плотностью ( r = –0,59) отложений.
, Л43
0.01 0.1 1 10 100
СИ,, мкр' г пл.о. (jis'g w.m.)
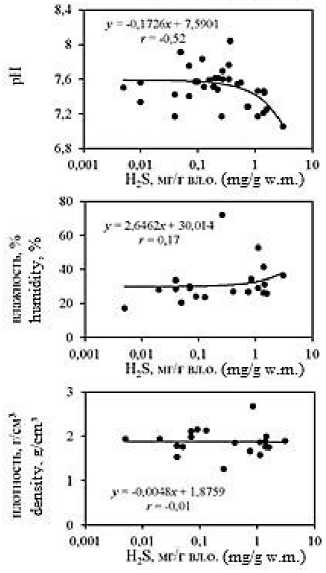
Рис. 5. Зависимости между исследуемыми гидрохимическими показателями в донных отложениях исследованных лиманов Азовского и Черного морей
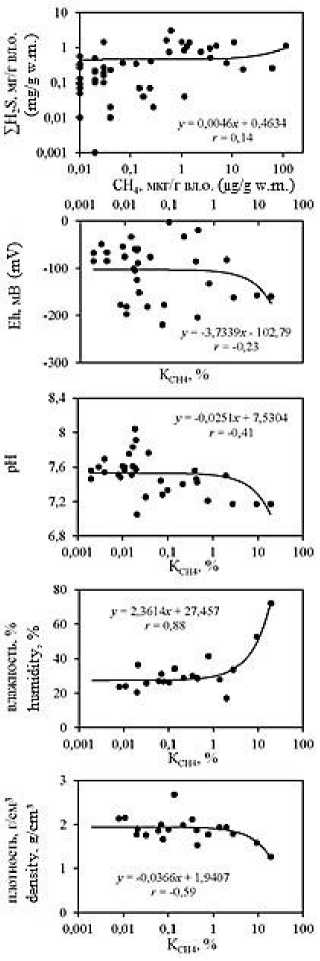
Fig. 5. Relationships between the studied hydrochemical parameters in the bottom sediments of the Azov and Black Seas estuaries
Наличие отрицательных зависимостей между концентрациями восстановленных газов и значениями рН и Eh в донных отложениях обусловлено тем, что распад органических и неорганических веществ, приводит к выделению диоксида углерода, разнообразных органических кислот и соответственно подкислению среды [7], а также поглощению кислорода. Последнее способствует снижению окислительно-восстановительного потенциала, что активизирует анаэробные процессы в донных отложениях, в том числе метаногенез и сульфатредукцию.
Наличие в донных осадках прямой зависимости между влажностью и концентрациями восстановленных газов в них, обусловлена тем, что влажность от- ложений является функцией их гранулометрического состава: тонкозернистый материал характеризуется более значительной удельной поверхностью слагающих его частиц, поэтому влажность в них выше [4], что подтверждается и нашими данными [22]. Кроме того, глинистые минералы являются сорбентами органического вещества и катализаторами его биохимической трансформации [8]. Все это способствует возникновению в тонкозернистых осадках благоприятной физико-химической обстановки для биохимической трансформации аккумулированного в них лабильного живого (включая бактерии) и отмершего органического вещества, с образованием in situ восстановленных газов [22]. Чем выше влажность отложений, тем меньше их плотность (r = -0,68), что и обуславливает опосредованную обратную связь последней с концентрациями СН4 и КСН4.
Между концентрациями СН 4 и ∑H 2 S для всего массива данных проявляется относительно слабая прямая связь ( r = 0,14). При этом отдельно для осоло-ненных лиманов теснота прямой связи между данными восстановленными газами существенно увеличивается ( r = 0,60, P <0,01), что указывает на сопряженные процессы их генерации, обусловленные при наличии сульфатов достаточным количеством органического вещества и нивелированием конкурентных взаимоотношений между бактериями сульфатредук-торами и метаногенами за обладание питательными субстратами [17]. В то же время в опресненных лиманах просматривается изменение направленности корреляционной связи на обратную ( r = -0,18), вызванное существенным увеличением концентраций метана в прибрежных донных отложениях, богатых полу-разложившимися растительными остатками, на фоне в целом относительно невысокой вариативности концентраций ∑H 2 S.
Выводы
-
1. Вода исследованных лиманов бассейнов Азовского (Ейский, Бейсугский, Сладкий, Курчанский и Ахтанизовский лиманы) и Черного (Витязевский, Ки-зилташский и Бугазский лиманы) морей характеризуется различной соленостью – от 0,26 до 58‰ и уровнем концентраций метана – от 1,0 до 94,5 мкл/дм3.
-
2. Донные отложения лиманов представлены преимущественно илисто-песчаными отложениями от темно-серого до черного цвета, для которых характерна нейтральная или слабощелочная среда (рН от 7.05 до 8.04) и восстановительные условия (Eh от -220,1 до -2,5 мВ).
-
3. В донных отложениях лиманов, сложенных тонкозернистым материалом (илах), идет активный процесс образования CH 4 и ∑H 2 S. Концентрации СН 4 и ΣH 2 S в донных отложениях опресненных лиманов с соленостью от 0,26 до 8,20‰ (Сладкого, Ахтанизов-ского и Курчанского) варьируются в пределах от 0.01 до 114.34 мкг/г влажного осадка и от <0,001 до 3,07 мг/г вл. о., соответственно. Концентрации СН 4 и ΣH 2 S в донных отложениях осолоненных лиманов с соленостью от 10,7 до 58‰ (Ейского, Бейсугского, Витязевского, Кизилташского и Бугазского) изменяются в пределах от 0,01 до 1,44 мкг/г и от 0,01 до 1,44 мг/г, соответственно. Таким образом, диапазон
-
4. Процентное содержание СН 4 от суммы изученных восстановленных газов (коэффициент метаниза-ции К СН4 ) в донных отложениях осолоненных лиманов (соленость >10‰) варьирует в диапазоне от 0,002 до 1,38% (среднее значение – 0,13%) и в 97% отобранных проб не превышает 1%, что свидетельствует о существенном доминировании процесса суль-фидообразования над процессом метаногенеза. В донных отложениях опресненных лиманов (соленость <8,5‰) процентное содержание СН 4 заметно возрастает – до 0,008–19,14% (среднее значение – 2,34%), достигая максимальных значений в прибрежных отложениях, содержащих полуразложив-шиеся растительные остатки. При этом в опресненных лиманах доля проб отложений с процентным содержанием метана более 1% от суммы концентраций СН 4 и ΣH 2 S повышается до 32%.
-
5. В донных отложениях лиманов установлено наличие достаточно тесных прямых связей концентраций СН 4 и ∑H 2 S со значениями рН и Eh, а также влажностью и плотностью отложений. Анализ тесноты связи коэффициента метанизации К СН4 с концентрациями СН 4 и ∑H 2 S и другими исследуемыми показателями, показывает наличие высокой прямой связи его значений с концентрациями СН 4 и влажностью отложений, а также обратной связи с плотностью осадка. Между концентрациями СН 4 и ∑H 2 S для всего массива данных проявляется относительно слабая прямая связь ( r = 0,14). При этом отдельно для осоло-ненных лиманов теснота прямой связи между данными восстановленными газами существенно увеличивается ( r = 0,60), в то время как в опресненных лиманах просматривается изменение направленности корреляционной связи на обратную ( r = -0,18).
колебания концентраций изученных восстановленных газов составляет 3–5 порядков – для СН 4 и 3–4 порядка – для ΣH 2 S.
Сведения об авторском вкладе:
Гарькуша Д.Н. – научное руководство исследованием; организация экспедиционных исследований (35%).
Федоров Ю.А. – научное руководство исследованием; формулировка научных гипотез, проверяемых посредством экспериментальных исследований (25%).
Трубник Р.Г. – интерпретация полученных результатов, участие в экспедиционных исследованиях (25%).
Доценко Н.В. – интерпретация полученных результатов, участие в экспедиционных исследованиях (15%).
Contribution of the authors:
D.N. Gar'kusha – scientific management of the research; organization of expeditionary research (35%).
Yu.A. Fedorov – scientific management of the research; formulation of scientific hypotheses, tested through experimental studies (25%).
R.G. Trubnik – interpretation of the obtained results, participation in expeditionary research (25%).
N.V. Dotsenko – interpretation of the obtained results, participation in expeditionary research (15%).
Список литературы Метан и сероводород в донных отложениях лиманов Азово-Черноморского бассейна
- Аносов Д.Ю. Суспензии иловых сульфидных грязей озера Ханское как ингредиент амбулаторного восстановительного лечения больных хроническими простатитами: автореф. ... дис канд. мед. наук: 14.00.51. Сочи, 2006. 22 с.
- Белюченко И.С. Экология Кубани, часть I. Краснодар: Изд-во КГАУ, 2005. 513 с.
- Водно-болотные угодия России. [Электронный ресурс]. URL: http://www.fesk.ru/about.html (дата обращения: 26.02.2022).
- Выхристюк Л.А. Органическое вещество донных осадков Байкала. Новосибирск: Наука, 1980. 130 с.
- Галимов Э.М. Метанообразование в морских осадках в зоне сульфатредукции // Доклады РАН. 1995. Т. 342. № 2. С. 219-221.
- Гарькуша Д.Н., Фёдоров Ю.А., Крамаренко В.А. Минерализованные грязевые озера юга европейской части России: генетические типы, особенности распространения и развития // Вопросы степеведения. 2021. № 2. С. 4-18. https://doi.org/10.24412/2712-8628-2021-2-4-18
- Гарькуша Д.Н., Фёдоров Ю.А. Факторы формирования концентраций метана в водных экосистемах. Ростов-на-Дону; Таганрог: Изд-во Южного федерального университета, 2021. 366 с.
- Дегенс Э. Геохимия осадочных отложений / Пер. с англ. М.: Мир, 1967. 299 с.
- Кузнецов С.И., Саралов A.E., Назина T.Н. Микробиологические процессы круговорота углерода и азота в озерах. М.: Наука, 1985. 213 с.
- Леин А.Ю., Иванов М.В. Биогеохимический цикл метана в океане. М.: Наука, 2009. 576 с.
- Порошина Е.А., Попова Т.М., Безрукавая Е.А. Влияние солености на эффективность воспроизводства судака и тарани в Курчанском лимане Темрюкского района Краснодарского края // Водные биоресурсы и среда обитания. 2018. Т. 1. № 3-4. С. 91-96.
- РД 52.24.511-2013. Массовая доля метана в донных отложениях. Методика измерений газохрома-тографическим методом с использованием анализа равновесного пара. Ростов-на-Дону: Гидрохимический институт, 2013. 19 с.
- РД 52.24.512-2012. Объемная концентрация метана в водах. Методика измерений газохромато-графическим методом с использованием анализа равновесного пара. Ростов-на-Дону: Гидрохимический институт, 2012. 23 с.
- РД 52.24.525-2011. Массовая доля сульфидной серы в донных отложениях. Методика выполнения измерений фотометрическим методом с N,N-диметил-п-фенилендиамином. Ростов-на-Дону: Гидрохимический институт, 2011. 26 с.
- Руководство по химическому анализу поверхностных вод суши. Часть 1. / Под ред. Л.В. Боевой. Ростов-на-Дону: НОК, 2009. 1037 с.
- Федоров Ю.А., Гарькуша Д.Н., Потапов Е.Г., Трубник Р.Г. Газовый состав пелоидов Таманского полуострова // Курортная медицина. 2017. № 3. С. 26-33.
- Фёдоров Ю.А., Тамбиева Н.С., Гарькуша Д.Н., Хорошевская В.О., Кизицкий Р.М. Теоретические аспекты связи метаногенеза с загрязнением воды и донных отложений веществами неорганической и органической природы // Известия ВУЗов. СевероКавказский регион. Серия Естественные науки. 2000. № 4. С. 68-73.
- Фёдоров Ю.А. Сухоруков В.В., Трубник Р.Г. Аналитический обзор: эмиссия и поглощение парниковых газов почвами. Экологические проблемы // Антропогенная трансформация природной среды. 2021. Т. 7. № 1. С. 6-35. https://doi.org/10.17072/2410-8553-2021-1-6-34
- Холопов А.П., Шашель В.А., Перов Ю.М., Настенко В.П. Грязелечение. Краснодар: Переодика Кубани. 2003. 283 с.
- Ciais P., Sabine C., Bala G., Bopp L., Brovkin V., Canadell J., et al. Carbon and other biogeochemical cycles // In Proceedings pf the Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge, MA: Cambridge Univ. Press, 2013. Р. 465-570.
- Conrad R. The global methane cycle: recent advances in understanding the microbial processes involved // Environ. Microbiol. 2009. Rep. 1. Р. 285-292.
- Fedorov Yu.A., Gar'kusha D.N., Tambieva N.S., Andreev Yu.A., Mikhailenko O.A. Influence of the Grain Size Composition of Bottom Sediments in Lake Baikal on the Distribution of Methane and Sulfide Sulfur // Litholo-gy and Mineral Resources. 2019. Vol. 54. № 1. P. 53-65. https://doi.org/10.1134/S0024490219010024
- Fedorov Y.A., Gar'kusha D.N., Trubnik R.G., Morozova M.A. Sulfite-Reducing Clostridia and their Participation in Methane and Hydrogen Sulfide Formation in the Bottom Sediments of Water Objects and Streams of the ETR South // Water Resources. 2019. Vol. 46. № 1. P. 85-93. https://doi.org/10.1134/S009780781907008X
- Ferry J.G. Biochemistry of methanogenesis // Critical Reviews in Biochemistry and Molecular Biology. 1992. Vol. 27(6). Р. 473-503.
- Gar'kusha D.N., Fedorov Y.A. Methane in Water and Bottom Sediments of the Mouth Area of the Severna-ya Dvina River during the Winter Time // Oceanology. 2014. Vol. 54. № 2. Р. 160-169. https://doi.org/10.1134/S000143701402009X
- Kirschke S., Bousquet P., Ciais P., Saunois M., Canadell J.G., Dlugokencky E.J., et al. Three decades of global methane sources and sinks // Nature Geoscience. 2013. Vol. 6. Р. 813-823.
- Kristjansson J.K., Schönheit P., Thauer R.K. Different Ks values for hydrogen of methanogenic bacteria and sulfate reducing bacteria: an explanation for the apparent inhibition of methanogenesis by sulfate // Archives of Microbiology. 1982. Vol. 131. P. 278-282.
- Reeburgh W.S. Oceanic methane biogeochemis-try // Chemical Reviews. 2007. Vol. 107. Р. 486-513.
- Schönheit P., Kristjansson J.K., and Thauer R.K. Kinetic mechanism for the ability of sulfate reducers to out-compete methanogens for acetate // Archives of Microbiology. 1982. Vol. 132. Р. 285-288.
- Wallenius A.J., Dalcin Martins P., Slomp, C.P. and Jetten M.S.M. Anthropogenic and Environmental Constraints on the Microbial Methane Cycle in Coastal Sediments // Frontiers in Microbiology. 2021. 12:631621. https://doi.org/10.3389/fmicb.2021.631621
- Winfrey M.R. and Zeikus I.G. Effect of sulphate on carbon and electron flow during microbial methano-genesis in freshwater sediments // Applied and Environmental Microbiology Journal. 1977. Vol. 22. № 2. P. 275-281.
- Zeikus J.G. The biology of methanogenetic bacteria // Bacteriological Reviews. 1977. Vol. 41. № 2. P. 514-541.


