Метастатический колоректальный рак печени. Современные тенденции хирургического лечения и результаты их применения
Автор: Шабунин А.В., Бедин В.В., Греков Д.Н., Тавобилов М.М., Дроздов П.А., Лебедев С.С., Карпов А.А., Чеченин Г.М., Цуркан В.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 5 т.21, 2022 года.
Бесплатный доступ
Цель исследования - проанализировать результаты мультидисциплинарного подхода на базе многопрофильной онкологической клиники в лечении больных метастатическим колоректальным раком печени. Материал и методы. С 2007 по 2021 г на базе отделения хирургии печени и поджелудочной железы ГКБ им. С.П. Боткина ДЗМ выполнено 315 хирургических вмешательств у больных с метастатическим колоректальным раком печени: резекция печени различного объема - 201 (63,8 %), радиочастотная аблация (РЧА) - 29 (9,2 %), микроволновая аблация (МВА) - 22 (6,9 %), двухэтапное миниинвазивное хирургическое лечение (ХЭПА + РЧА) - 22 (6,9 %), трехэтапное миниинвазивное хирургическое лечение (ХЭПА + РЧА + ХЭПА) - 41 (13,2 %). Результаты. Летальные исходы в первые 90 дней после вмешательства зафиксированы у 6 (1,9 %) больных, во всех случаях после резекции печени. Послеоперационные осложнения после резекции печени наблюдались у 49 (24,3 %) больных. Общая 5- и 10-летняя выживаемость после резекции печени составила 38,8 и 23,2 % соответственно. Факторами плохого прогноза после резекции печени явились: возраст более 70 лет (p=0,03), локализация первичной опухоли в правой половине ободочной кишки или в прямой кишке (p=0,037), три и более метастатических очага в печени (p=0,01), максимальный размер опухолевого очага более 5 см (p=0,021), синхронный характер поражения печени (p=0,039), билобарное поражение печени (p=0,007). Послеоперационные осложнения после РЧА, ХЭПА + РЧА, ХЭПА + РЧА + ХЭПА наблюдались в 5,8; 9,1 и 7,3 % случаев соответственно. При размере метастазов не более 3 см трехлетняя безрецидивная и общая выживаемость при применении РЧА составила 45,8 и 54,2 % соответственно. При размере образований от 3 до 5 см лучшие показатели трехлетней безрецидивной и общей выживаемости отмечены при трехкомпонентном миниинвазивном хирургическом лечении (ХЭПА + РЧА + ХЭПА) - 56,1 и 63,4 % соответственно. Заключение. Применение мультидисциплинарного подхода на базе многопрофильной онкологической клиники позволяет улучшить результаты лечения больных метастатическим колоректальным раком.
Колоректальный рак, метастазы печени, резекция печени, радиочастотная аблация
Короткий адрес: https://sciup.org/140296682
IDR: 140296682 | УДК: 616.34-006.6-033.2:611.36 | DOI: 10.21294/1814-4861-2022-21-5-90-101
Текст научной статьи Метастатический колоректальный рак печени. Современные тенденции хирургического лечения и результаты их применения
В настоящее время в широкую клиническую практику внедряется большое количество диагностических и лечебных технологий для лечения пациентов с метастатическим колоректальным раком печени – концепция перехода от расширенных к паренхимосберегающим резекциям [1], внедрение лапароскопических и роботических резекций печени [2], методы профилактики острой пострезекционной печеночной недостаточности [3, 4], методы локальной деструкции опухоли в монорежиме [5] или в комбинации с регионарной химиотерапией [6]. Применение вышеперечисленных технологий возможно лишь в условиях многопрофильного онкологического стационара с привлечением муль-тидисциплинарного консилиума.
Цель исследования – проанализировать результаты мультидисциплинарного подхода на базе многопрофильной онкологической клиники в лечении больных метастатическим колоректальным раком печени.
Материал и методы
С 2007 по 2021 г. в хирургической клинике ГКБ им. С.П. Боткина проведено хирургическое лечение 315 больным с метастатическим колоректальным
раком печени. Среди них 151 мужчина (47,9 %), их средний возраст составил 54,65 ± 13,56 (18–80) года, и 164 женщины (52,1 %), средний возраст которых составил 53,21 ± 11,25 (20–78) года (табл. 1). В качестве хирургического лечения применялись резекционные вмешательства различного объема (n=201), методы локальной деструкции опухоли: радиочастотная аблация (РЧА) (n=29), микроволновая аблация (МВА) ( n=22), комбинация РЧА и химиоэмболизации печеночной артерии (ХЭПА) (n=63) (табл. 2).
При выборе объема резекции печени отдавали предпочтение паренхимосберегающим резекциям в объеме анатомических сегментэктомий, бисег-ментэктомий, атипичных резекций печени. При невозможности выполнения резекции в объеме R0 или в объеме паренхимосберегающей резекции выполняли стандартную или расширенную гемигепатэктомию. При обширных резекциях печени, при наличии в анамнезе более 6 курсов химиотерапии или при объеме ремнанта печени (aFLR) менее 40 % по данным КТ органов брюшной полости с внутривенным контрастированием выполняли однофотонную эмиссионную компьютерную томографию (ОФЭКТ/КТ) с определением объема остающейся функционирующей
Таблица 1/table 1
Характеристика больных метастатическим колоректальным раком печени паренхимы печени (fFLR). При fFLR менее 30 % выполняли предпоперационную эмболизацию правой ветви воротной вены (ЭПВВВ) для формирования викарной гипертрофии FLR. С 2015 г. при планировании паренхимосберегающей резекции в пределах передних сегментов печени выполняли лапароскопические и роботические резекции.
Радиочастотную и микроволновую аблацию применяли при наличии противопоказаний к резекционным вмешательствам, отказе больного от подобного объема вмешательства, при наличии не более 3 метастазов, размером не более 5 см каждый (рис. 1). Локальную деструкцию опухоли выполняли с помощью одного электрода. При размере образований более 5 см локальную деструкцию опухоли не выполняли.
C 2013 г. при наличии противопоказаний для резекционного вмешательства и наличии не более 3 очагов в одной доле печени, размерами от 3 до 5 см, выполняли двух- или трехэтапное миниинва-зивное хирургическое лечение. Двухэтапный метод заключался в выполнении на первом этапе ХЭПА с введением митомицина С 10 мг и липиодола, через 7 дней – РЧА под УЗ-наведением. При трехэтапном
методе на первом этапе выполняли химиоэмболизацию печеночной артерии с введением митомицина С 10 мг и липиодола, через 7 дней – РЧА под УЗ-наведением и через 7 дней – повторную ХЭПА с введением митомицина С 10 мг и липиодола.
Статистическая обработка и анализ данных выполнялись в программе SPSS Statistics для Microsoft Windows 26 версии (США). Для сравнения двух групп количественных показателей при нормальном распределении, в зависимости от равенства дисперсий, использовались t-критерий Стьюдента либо t-критерий Уэлча. При распределении, отличающемся от нормального, для сравнения 2 групп количественных данных – U-критерий Манна–Уитни, для 3 и более – критерий Краскела–Уоллиса. Анализ выживаемости выполнялся методом Каплана–Мейера с определением статистически значимых различий с помощью log-rank test Мантеля–Кокса.
Результаты
Летальные исходы в течение 90 дней после резекции печени по поводу метастазов колоректального рака в печень отмечены у 6 (3 %) больных.
characteristics of patients with metastatic colorectal liver cancer
|
Показатель/Parameter |
Число больных/Number of patients |
|
Возраст/Age |
|
|
<70 лет/<70 years old |
239 |
|
> 70 лет/> 70 years old |
76 |
|
Пол/Sex |
|
|
Мужской/Male |
151 |
|
Женский/Female |
164 |
|
Локализация первичной опухоли/Localization of the primary tumor |
|
|
Правая половина толстой кишки/Right-sided colon cancer |
101 |
|
Левая половина толстой кишки/Left-sided colon cancer |
176 |
|
Прямая кишка/Rectum |
38 |
|
Число метастазов в печени /Number of liver metastases |
|
|
Один метастаз/One metastasis |
154 |
|
Два метастаза/Two metastasis |
72 |
|
Три метастаза/Three metastasis |
44 |
|
Более трех метастазов/More than three metastasis |
45 |
|
Максимальный размер метастаза/Maximum metastasis size |
|
|
0–3 см/cm |
162 |
|
3–5 см/cm |
78 |
|
5–10 см/cm |
48 |
|
Более 10 см/More than 10 cm |
27 |
|
Время возникновения метастазов/Time of occurrence of metastasis |
|
|
Синхронные/Synchronous |
59 |
|
Метахронные/Metachronous |
256 |
|
Локализация метастазов в печени/Localization of metastasis in the liver |
|
|
Унилобарные/Unilobar |
211 |
|
Билобарные/Bilobar |
104 |
Таблица 2/table 2
Виды хирургических вмешательств у больных c метастатическим колоректальным раком types of surgery in patients with metastatic colorectal liver cancer
Виды хирургических вмешательств/Types of surgery Число больных/Number of patients
Открытая резекция печени/Open liver resection
Менее 3 сегментов печени/Less than 3 liver segments63
Более 3 сегментов печени/More than 3 liver segments73
ЭПВВВ + гемигепатэктомия/PVE + hemihepatectomy24
Лапароскопическая резекция печени/Laparoscopic liver resection
Менее 3 сегментов печени/Less than 3 liver segments32
Более 3 сегментов печени/More than 3 liver segments0
Роботическая резекция печени/Robotic liver resection
Менее 3 сегментов печени/Less than 3 liver segments9
Более 3 сегментов печени/More than 3 liver segments0
Локальная деструкция опухоли/Local tumor destruction
РЧА/RFA29
МВА/MWA22
Комбинация ХЭПА и РЧА/Combination of TACE and RFA
ХЭПА + РЧА/TACE + RFA22
ХЭПА + РЧА + ХЭПА/TACE + RFA + TACE41
В 3 (1,5 %) случаях летальные исходы возникли вследствие острой пострезекционной печеночной недостаточности, в 2 (1 %) – по причине желчного перитонита с полиорганной недостаточностью, в 1 (0,5 %) – за счет аррозивного кровотечения из печеночной артерии. У 49 (24,3 %) больных наблюдалось 64 послеоперационных осложнения, из них тяжелых послеоперационных осложнений (Clavien-Dindo III–V) – 38 (табл. 3). Зафиксировано 13 (6,4 %) случаев острой пострезекционной печеночной недостаточности (ОППН). Во всех наблюдениях данное осложнение возникло после расширенных резекций печени. Большинство
случаев ОППН отмечено до внедрения ОФЭКТ/ КТ – 10 больных, после внедрения данной технологии – у 3 пациентов. Факторами риска развития ОППН являются объем резекции печени (p=0,003), отсутствие данных ОФЭКТ/КТ на предоперационном этапе (p=0,01). Желчные осложнения диагностированы у 15 (7,4 %) больных. Объем резекции имел значимое влияние на развитие данного осложнения (p=0,006): при расширенных резекциях, в том числе с формированием билио-дигестивных анастомозов, в этом случае желчные осложнения зафиксированы у 13 больных, тогда как при паренхимосберегающих операциях – у 2
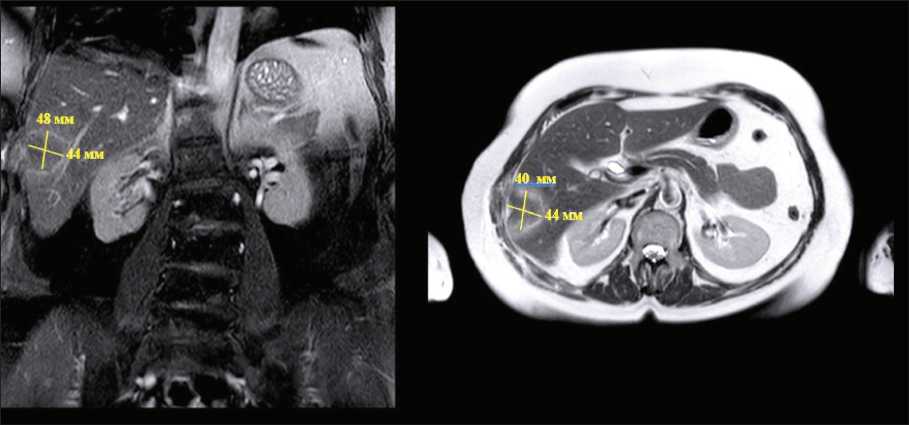
Рис. 1. МРТ органов брюшной полости на 1-е сут после РЧА. Полный некроз опухолевой ткани
Fig. 1. MRI of the abdominal organs on the 1st day after RFA. Complete necrosis of the tumor tissue
Таблица 3/table 3
Структура послеоперационных осложнений после резекции печениstructure of postoperative complications after liver resection
|
Вид осложнений/ Type of complications |
Число осложнений/ Number of complications |
Clavien–Dindo |
|
Специфические осложнения/Specific complications |
||
|
Острая пострезекционная печеночная недостаточность/Acute post-resection liver failure (n=13) |
||
|
Класс А/Class A |
6 |
II |
|
Класс B/Class B |
3 |
II |
|
Класс С/Class C |
4 |
1 – IVa, 3 – V |
|
Желчный свищ/Biliary fistula (n=15) |
||
|
Класс А/Class A |
2 |
II |
|
Класс B/Class B |
7 |
IIIa |
|
Класс С/Class C |
6 |
2 – IVa, 2 – IVb, 2 – V |
|
Геморрагические осложнения/Hemorrhagic complication (n=12) |
||
|
Класс А/Class A |
5 |
II |
|
Класс B/Class B |
4 |
II |
|
Класс С/Class C |
3 |
2 – IVa, 1 – V |
|
Неспецифические осложнения/Non-specific complications |
||
|
Абсцесс брюшной полости/Abdominal abscess |
9 |
IIIa |
|
Тромбоз глубоких вен нижних конечностей/ Deep vein of the lower extremities |
7 |
5 – II, 2 – IIIa |
|
Гидроторакс/Hydrothorax |
5 |
IIIa |
|
Пневматоракс/Pneumothorax |
2 |
IIIa |
|
Лимофоррея/Limphorrea |
1 |
II |
Таблица 4/table 4
Факторы плохого прогноза общей выживаемости после резекции печени у больных с метастатическим колоректальным раком
Factors of poor prognosis of overall survival after liver resection in patients with metastatic colorectal cancer
|
Показатель/Parameter |
Общая 5-летняя выживаемость/ Overall 5-year survival |
p |
|
Возраст/Age |
||
|
<70 лет/<70 years old |
43,2 % |
0,03 |
|
> 70 лет/> 70 years old |
38,1 % |
|
|
Локализация первичной опухоли/Localization of the primary tumor |
||
|
Правая половина толстой кишки/Right-sided colon cancer |
37,3 % |
p1–2=0,02 |
|
Левая половина толстой кишки/Left-sided colon cancer |
45,8 % |
р1–3=0,1 |
|
Прямая кишка/Rectum |
40,4 % |
р2–3=0,013 |
|
Число метастазов в печени/Number of liver metastases |
||
|
1–3 метастаза/1–3 metastasis |
48,2 % |
0,01 |
|
3 и более метастазов/3 and more metastasis |
32,1 % |
|
|
Максимальный размер метастаза/Maximum metastasis size |
||
|
0–3 см/cm |
47,3 % |
p1–2=0,015 |
|
3–5 см/cm |
40,5 % |
р1–3=0,003 |
|
Более 5 см /More than 5 cm |
37,2 % |
р2–3=0,2 |
|
Сроки возникновения метастазов/Time of occurrence of metastasis |
||
|
Синхронные/Synchronous |
39,6 % |
0,039 |
|
Метахронные/Metachronous |
46,2 % |
|
|
Локализация метастазов в печени/Localization of metastasis in the liver |
||
|
Унилобарные/Unilobar |
49,1 % |
0,007 |
|
Билобарные/Bilobar |
34,5 % |
|
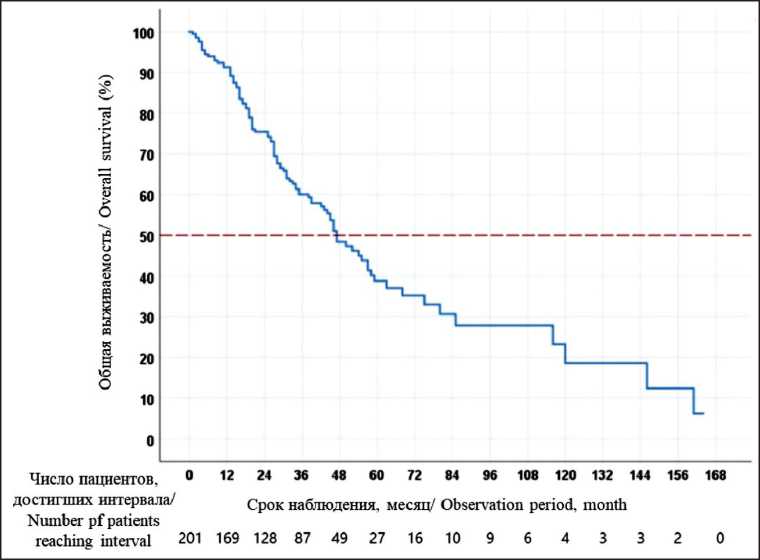
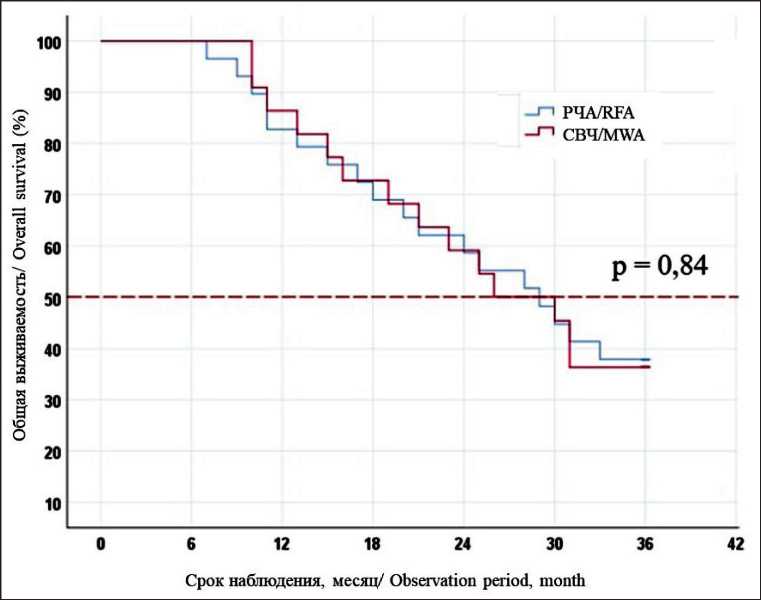
Рис. 2. Общая выживаемость больных с метастазами колоректального рака в печень после резекционных вмешательств
-
Fig. 2. Overall survival of patients with metastatic colorectal liver cancer after resection
Рис. 3. Безрецидивная 3-летняя выживаемость после РЧА и МВА
-
Fig. 3. The 3-year disease-free survival of patients after RFA and MWA
пациентов. Геморрагические осложнения наблюдались у 12 больных, значимых факторов риска развития данного осложнения не выявлено.
Одно-, трех-, пяти- и десятилетняя выживаемость после резекции печени составила 91,3; 60,1; 38,8 и 23,2 % соответственно (рис. 2). Факторами, ассоциирующимися с низкой отдаленной выживаемостью, явились возраст более 70 лет, локализация первичной опухоли в прямой кишке или правой половине толстой кишки, более 3 опухолей в печени, размер более 5 см опухолевого очага, синхронный характер поражения метастазов и билобарное поражение печени (табл. 4).
При использовании методов локальной деструкции метастазов колоректального рака в печень летальных исходов в течение 90 дней после вмешательства не наблюдалось. Послеоперационные осложнения диагностированы у 3 (5,8 %) больных. В 2 случаях наблюдался правосторонний гидроторакс, в 1 случае – пневмоторакс. Постэмболиза- ционный синдром возник у 49 (96 %) больных, он был купирован в течение 3 сут после манипуляции во всех случаях. Безрецидивная 3-летняя выживаемость при РЧА и МВА составила 37,9 и 36,4 % (рис. 3); общая 3-летняя выживаемость – 51,7 и 45,5 % соответственно (рис. 4).
При комбинации методов деструкции и регионарной химиотерапии с применением двух-, трехкомпонентного миниинвазивного хирургического вмешательства летальных исходов в течение 90 дней не зафиксировано. Послеоперационные осложнения диагностированы у 2 (9,1 %) больных, у обоих наблюдался правосторонний гидроторакс. Постэмболизационный синдром возник у 21 (95,4 %) больного, он был купирован в течение 3 сут после каждого этапа. Безрецидивная и общая 3-летняя выживаемость после ХЭПА + РЧА составила 36,4 и 54,5 % соответственно.
При трехкомпонентном миниинвазивном хирургическом лечении летальности в течение 90 дней не
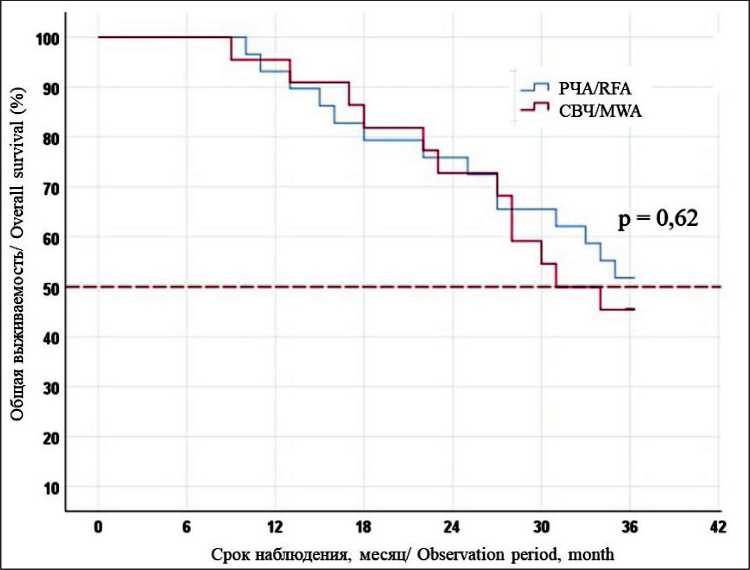
Рис. 4. Общая 3-летняя выживаемость после РЧА и МВА
Fig. 4. The 3-year overall survival after RFA and MWA

Анатомический FLR/ Anatomical FLR 796 см3/ст3 (33,8%)
Функциональный FLR/ Functional FLR 302 см3/ст3 (13,9%)
Рис. 5. ОФЭКТ/КТ. Несоответствие объема анатомического и функционального FLR
Fig. 5. SPECT/CT. Volume mismatch between anatomical FLR and functional FLR
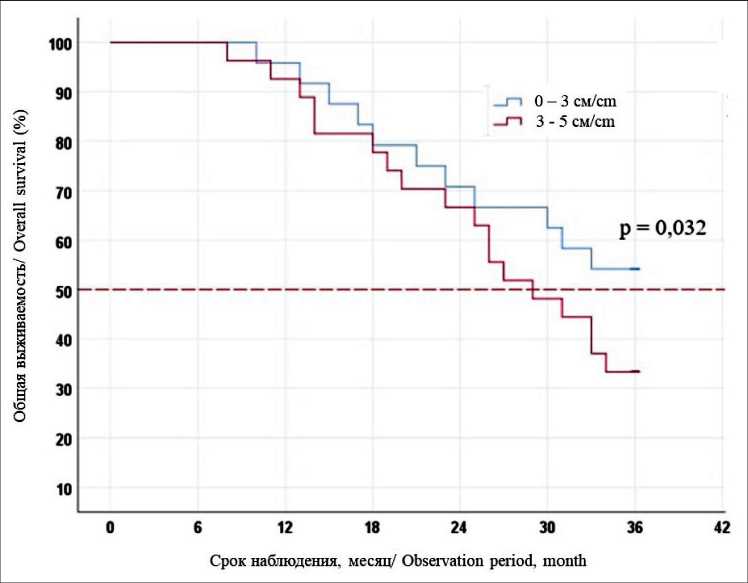
Рис. 6. Безрецидивная 3-летняя выживаемость после локальной деструкции в зависимости от размера метастаза
Fig. 6. The 3-year disease-free survival of patients after the application of methods of local destruction, depending on the size of the metastasis зафиксировано. Послеоперационные осложнения диагностированы у 3 (7,3 %) больных. Во всех случаях наблюдался правосторонний гидроторакс. Постэмболизационный синдром зафиксирован у 39 больных (95,1 %), был купирован в течение 3 сут после каждого этапа. Безрецидивная и общая 3-летняя выживаемость при ХЭПА + РЧА + ХЭПА составила 56,1 и 63,4 % соответственно.
Обсуждение
Резекционные вмешательства при метастазах колоректального рака в печень остаются первой линией хирургического лечения, так как ассоциируются с лучшими результатами общей выживаемости (5-летняя выживаемость – 38,8 %). В нашем исследовании 63,8 % пациентов перенесли резекцию печени различного объема. В то же время резекция печени – это лишь один их этапов лечения метастатического колоректального рака, поэтому улучшение непосредственных результатов резекционных вмешательств – важная цель хирурга-гепатолога. Специфические осложнения (острая пострезекционная печеночная недостаточность, желчеистече-ние, кровотечение) вносят существенный вклад в структуру послеоперационных осложнений (62,5 %) и являются основной причиной летальности в раннем послеоперационном периоде (100 %).
В нашем исследовании факторами риска развития ОППН явились объем резекции более 3 сегментов печени (p=0,003) и отсутствие данных ОФЭКТ/КТ на предоперационном этапе (p=0,01). В то же время частота билиарных осложнений также зависит от объема резекции (p=0,006). Минимизация риска развития ОППН и желчных осложнений [7], схожие результаты отдаленной выживаемости [8] побудили нашу клинику к пересмотру концепции выбора объема резекционого вмешательства в пользу паренхимосберегающих операций. В настоящее время соотношение обширных резекций к паренхимосберегающим в год составляет 1:3.
При необходимости выполнения обширных резекций нужно иметь представление о функциональной активности ремнанта печени. Предшествующая химиотерапия, пограничный анатомический объем FLR – факторы риска развития ОППН, для ее профилактики посредством предоперационной эмболизации правой ветви воротной вены [9] необходимо проведение ОФЭКТ/КТ с определением объема остающейся функционирующей паренхимы печени. По данным нашей клиники, в 25 % случаев достаточный анатомический объем FLR ассоциируется с недостаточным функциональным объемом FLR, эти больные входят в группу риска развития ОППН (рис. 5).
Основной пик геморрагических осложнений пришелся на этап увлечения «модными» технологиями диссекции паренхимы печени (ультразвуковой скальпель, LigaSure, CUSA и т. д.). В процессе анализа собственных результатов мы сделали вывод, что в большинстве случаев при обработке вен электрохирургические технологии не всегда в состоянии эффективно заменить лигирование и/ или прошивание интрапаренхиматозных сосудов. В нашей клинике мы придерживаемся протокола диссекции паренхимы, который включает использование CUSA, биполярной коагуляции с обязательным прошиванием или перевязыванием сосудов диаметра более 1 мм и отказ от клипирования на стороне остающейся паренхимы печени [10].
Результаты отдаленной выживаемости при колоректальном раке с метастазами в печень зависят от большого числа характеристик опухоли, проводимого системного лекарственного и лучевого лечения, соматического статуса пациента. По нашим данным, факторами плохого прогноза являются билобарное поражение печени (p=0,007), синхронный характер ее поражения (p=0,039), размер метастазов более 5 см (p=0,021), количество метастазов более трех (p=0,01), что необходимо учитывать после резекции печени при планировании лекарственного лечения на мультидисципли-нарном онкологическом консилиуме.
Несмотря на активное развитие резекционных технологий в лечении больных метастатическим колоректальным раком, прооперировать возможно менее 50 % пациентов [11]. Основными противопоказаниями к резекции являются генерализация опухолевого процесса, техническая невозможность выполнения R0 резекции с условием сохранения более 30 % fFLR, тяжелое состояние пациента, отказ больного от операции. В двух последних случаях показаны методы локальной деструкции. Нами не получено значимых показателей в без-рецидивной и общей выживаемости при радиочастотной (37,9 и 51,7 %) и микроволновой аблации (36,4 и 45,5 %), на основании чего мы сделали вывод об отсутствии преимуществ одной из этих технологий над другой.
Значимым ограничением применения методов локальной деструкции является размер опухолевого очага. Добиться полного коагуляционного некроза при размере метастаза более 5 см удается менее чем в 50 % случаев, и это является противопоказанием к вмешательству [11]. Кроме того, по нашим данным, при размере образований от 3 до 5 см результаты безрецидивной (25,9 vs 45,8 %, p=0,032) и общей выживаемости (33,3 vs 54,2 %, p=0,02) значимо хуже, чем у пациентов, которым применялись методы локальной деструкции для лечения очагов менее 3 см (рис. 6, 7). Это объясняется наличием небольших сателлитных метастазов, расположенных по периферии основного очага, которые в дальнейшем являются причиной локального рецидива. В этом случае мы применяем РЧА в сочетании с химиоэмболизацией печеночной артерии. Использование на первом этапе ХЭПА воздействует на периферию опухоли и сателлитные очаги, проведение РЧА через 7 дней позволяет
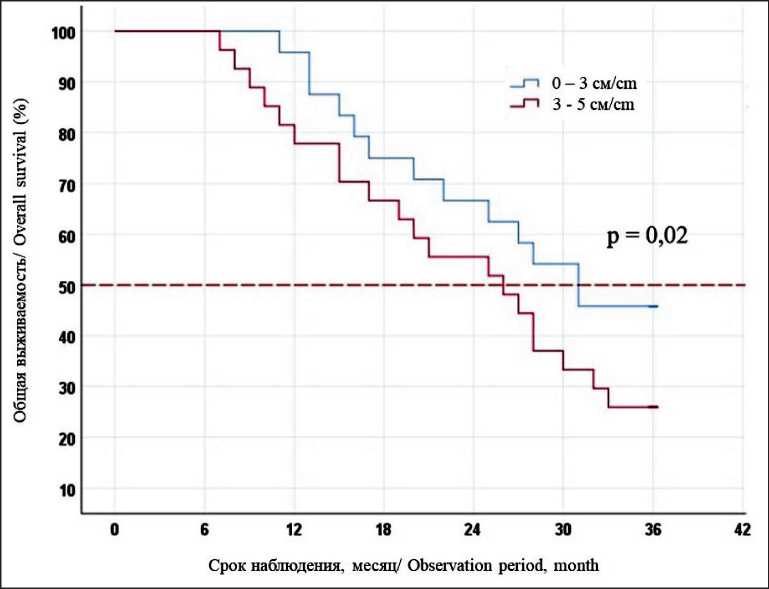
Рис. 7. Общая 3-летняя выживаемость после локальной деструкции в зависимости от размера метастаза
Fig. 7. The 3-year overall survival after local destruction methods, depending on the size of the metastasis
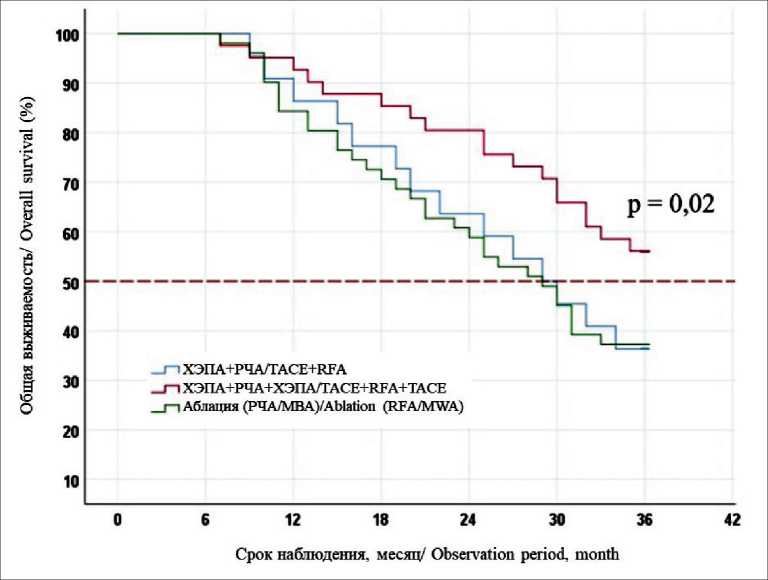
Рис. 8. Безрецидивная 3-летняя выживаемость после локальной деструкции в монорежиме или в комбинации с ХЭПА
Fig. 8. The 3-year disease-free survival of patients after the methods of local destruction used in mono mode or in combination with TACE
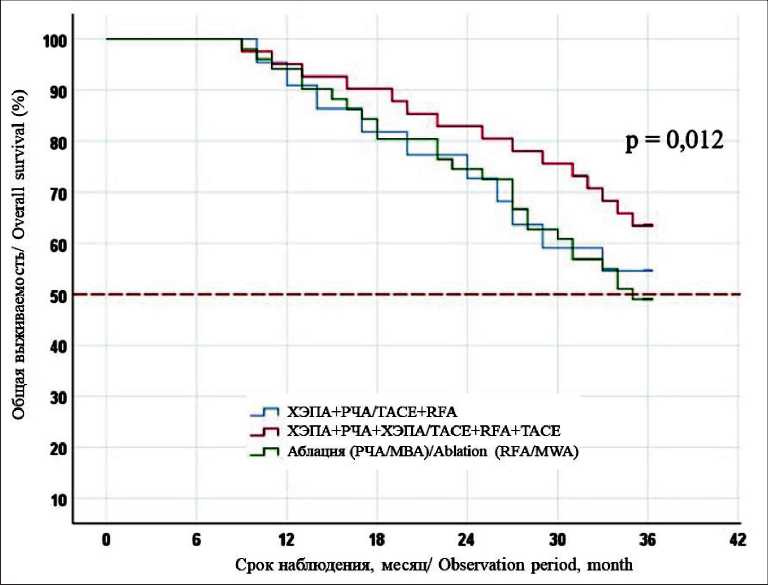
Рис. 9. Общая 3-летняя выживаемость после локальной деструкции в монорежиме или в комбинации с ХЭПА
Fig. 9. The 3-year overall survival of patients after the use of local destruction methods alone or in combination with TACE добиться более полного коагуляционного некроза опухолевой ткани. Наш опыт двухэтапного мини-инвазивного хирургического лечения не показал преимуществ в безрецидивной (36,4 vs 37,3 %, p=0,7) и общей выживаемости (54,5 vs 49 %, p=0,6). Это объясняется особенностями артериального кровоснабжения метастазов колоректального рака, что снижает эффективность ХЭПА. Для повышения эффективности хирургического лечения мы добавили третий компонент в виде повторной ХЭПА через 7 дней после РЧА, обосновывая это тем, что ответом на аблацию являются местная гиперемия, усиление кровоснабжения тканей вокруг очага, тем самым повторный курс артериальной химиотерапии позволит добиться полного некроза опухолевой ткани. Применение трехкомпонентного миниинвазивного вмешательства позволило значимо улучшить результаты трехлетней без-рецидивной (56,1 vs 36,4 %, p=0,02) и общей выживаемости (63,4 vs 49 %, p=0,012) по сравнению с двухкомпонентной методикой (рис. 8, 9).
Заключение
В настоящее время для хирургического лечения больных с метастазами колоректального рака в печень должны использоваться современные протоколы резекционных вмешательств с минимизацией хирургического доступа и применением паренхимосберегающих технологий, методы локальной деструкции опухолевой ткани в монорежиме при размере образований до 3 см или в составе трехкомпонентного миниинвазивного вмешательства с использованием химиоэмболизации печеночной артерии при размере образований до 5 см. Решение о применении метода хирургического лечения необходимо принимать мультидисципли-нарным консилиумом на базе многопрофильного онкологического стационара. Применение муль-тидисциплинарного подхода позволяет улучшить результаты лечения больных метастатическим колоректальным раком.
Список литературы Метастатический колоректальный рак печени. Современные тенденции хирургического лечения и результаты их применения
- Moris D., Ronnekleiv-Kelly S., Rahnemai-Azar A.A., Felekouras E., Dillhoff M., Schmidt C., Pawlik T.M. Parenchymal-Sparing Versus Anatomic Liver Resection for Colorectal Liver Metastases: a Systematic Review. J Gastrointest Surg. 2017; 21(6): 1076-85. https://doi.org/10.1007/s11605-017-3397-y.
- Efanov M., Alikhanov R., Tsvirkun V., Kazakov I., Melekhina O., Kim P., Vankovich A., Grendal K., Berelavichus S., Khatkov I. Comparative analysis of learning curve in complex robot-assisted and laparoscopic liver resection. HPB (Oxford). 2017; 19(9): 818-24. https://doi.org/10.1016/j.hpb.2017.05.003.
- Granov D.A., Polikarpov A.A., Sergeev V.I., Tarazov P.G. Predoperatsionnaya embolizatsiya vorotnoi veny i khimioembolizatsiya pechenochnoi arterii v kombinirovannom lechenii patsientov so zlokachestvennymi opukholyami pecheni. Annaly khirurgicheskoi gepatologii. 2016; 21(3): 20-4. https://doi.org/10.16931/1995-5464.2016320-24.
- Kulikova N., Kulezneva Yu., Melekhina O., Alikhanov R., Efanov M. Immediate outcomes of percutaneous radiofrequency-assisted liver partition and portal vein embolization for staged hepatectomy (PRALPPS) in patients with intrahepatic cholangiocarcinoma (IHCC). Annals of Hepato-Biliary-Pancreatic Surgery. 2021; 25(1): 190. https://doi.org/10.14701/ahbps.LV-PP-3-3.
- Chzhao A.V., Vishnevskii V.A., Ionkin D.A., Olifir A.A., Aivazyan Kh.A., Kovalenko Yu.A., Zhavoronkova O.I., Stepanova Yu.A., Karel'skaya N.A. Vybor metoda lokal'noi destruktsii metastazov kolorektal'nogo raka v pecheni. Annaly khirurgicheskoi gepatologii. 2019; 24(4): 30-6. https://doi.org/10.16931/1995-5464.2019430-36.
- Shabunin A.V., Tavobilov M.M., Grekov D.N., Drozdov P.A. Kombinirovannoe lechenie bol'nykh neoperabel'nymi metastazami kolorektal'nogo raka pecheni. Sibirskii onkologicheskii zhurnal. 2018; 17(3): 34-40. https://doi.org/10.21294/1814-4861-2018-17-3-34-40.
- Borakati A., Froghi F., Shetye A., Fusai G.K., Davidson B.R., Mirnezami R. Assessing the Impact of Primary Tumour Location on Survival After Resection of Colorectal Liver Metastases: A Propensity Weighted Retrospective Cohort Study. World J Surg. 2022; 46(7): 1734-55. https://doi.org/10.1007/s00268-022-06514-z.
- Shabunin A.V., Parfenov I.P., Bedin V.V., Grekov D.N., Tavobilov M.M., Drozdov P.A., Karpov A.A., Zhuravel' O.S., Ozerova D.S. Sravnenie parenkhim-sberegayushchikh i obshirnykh rezektsii v lechenii bol'nykh s metastazami kolorektal'nogo raka v pechen'. Vestnik khirurgicheskoi gastroenterologii. 2019; (1): 42-9.
- Dobrodeev A.Yu., Kostromitskii D.N., Afanas'ev S.G., Tarasova A.S., Avgustinovich A.V. Sovremennye podkhody k khirurgicheskomu lecheniyu bol'nykh kolorektal'nym rakom s metastazami v pecheni. Annaly khirurgicheskoi gepatologii. 2022; 27(1): 80-6. https://doi.org/10.16931/1995-5464.2022-1-80-86.
- Shabunin A.V., Parfenov I.P., Bedin V.V., Tavobilov M.M., Grekov D.N., Karpov A.A. Rezektsiya pecheni. Spetsificheskie oslozhneniya i ikh profilaktika. Khirurgiya. Zhurnal im. N.I. Pirogova. 2020; (3): 5-12. https://doi.org/10.17116/hirurgia20200315.
- Mulier S., Ni Y., Jamart J., Ruers T., Marchal G., Michel L. Local recurrence after hepatic radiofrequency coagulation: multivariate metaanalysis and review of contributing factors. Ann Surg. 2005; 242(2): 158-71. https://doi.org/10.1097/01.sla.0000171032.99149.fe.


