Метастатическое поражение центральной нервной системы
Автор: Насхлеташвили Д.Р., Банов С.М., Бекяшев А.Х., Голанов А.В., Зайцев А.М., Кобяков Г.Л., Пронин А.И., Смолин А.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Практические рекомендации
Статья в выпуске: 3S2-1 т.13, 2023 года.
Бесплатный доступ
Метастатические опухоли головного мозга, таргетная терапия, химиотерапия, иммунотерапия, лучевая терапия, стереотаксическая лучевая терапия, радиохирургия, нейрохирургическое лечение
Короткий адрес: https://sciup.org/140302374
IDR: 140302374 | DOI: 10.18027/2224-5057-2023-13-3s2-1-148-156
Текст статьи Метастатическое поражение центральной нервной системы
По данным популяционных канцер-регистров, частота метастазов в головном мозге (МГМ) составляет 10–17% всех случаев онкологических заболеваний. Ежегодный показатель частоты поражения головного мозга зависит от локализации первичного очага и составляет при локализованных формах мелкоклеточного рака легких (МРЛ) — 15,8%, меланомы — 0,6%, немелкоклеточного рака легких (НМРЛ) — 14,4%, HER2-положитель-ного рака молочной железы (РМЖ) — 1,1 %, тройного негативного РМЖ — 0,7%, рака почки — 1,5%. При генерализованной форме заболевания частота МГМ составляет при МРЛ — 23,5%, меланоме — 28,2%, НМРЛ — 26,8%, HER2-положительном РМЖ — 11,5%, тройном негативном РМЖ — 11,4%, раке почки — 10,9%.
МГМ проявляется в виде солитарного очага приблизительно у 37–50% пациентов, а у 50–63% пациентов метастазы имеют множественный характер и могут локализоваться в различных анатомических образованиях головного мозга: в паренхиме, в твердой или мягкой мозговой оболочках, в субарахноидальном пространстве и желудочках головного мозга. Супратенториальные метастазы составляют 80–85%, метастазы в мозжечке — 10–15%, в стволе мозга — 3–5%, в мозговых оболочках — 1–2%.
Скрининг метастазов в головном мозге
-
• Скрининг МГМ следует рассматривать для пациентов с МРЛ любой стадии, НМРЛ (начиная со II стадии) и с меланомой (начиная с IIIC стадии)
-
• МРТ головного мозга с в / в контрастированием следует проводить пациентам с наличием неврологических симптомов, клинических симптомов повышенного внутричерепного давления, судорог или при появлении новых неврологических нарушений.
1. ФАКТОРЫ ПРОГНОЗА
Общая выживаемость пациентов с МГМ и планирование лечения зависят от ряда клинических факторов (возраст пациента, общее состояние, неврологический дефицит), биологических характеристик опухоли, объема поражения головного мозга (количество и объем метастазов и их локализация), наличия масс-эффекта и активности экстракраниального опухолевого процесса. В настоящее время общепринятой шкалой для оценки прогноза больных с МГМ является шкала прогноза общей выживаемости GPA (онлайн калькулятор доступен на сайте .
Целесообразно выделять:
1) группу благоприятного прогноза: ожидаемая общая выживаемость ≥ 6 мес. по шкале GPA, отсутствие или стабильное состояние экстракраниальных метастазов, наличие резервов эффективной лекарственной терапии;
2) группу неблагоприятного прогноза: ожидаемая общая выживаемость < 6 мес. по шкале GPA, экстракраниальная прогрессия, отсутствие резервов лекарственной терапии. У пациентов с лептоменингиальным поражением выделяют:
1) группу благоприятного прогноза: высокий функциональный статус (индекс Кар-новского ≥ 60%), отсутствие неврологического дефицита, олигометастатический характер экстракраниальных метастазов, наличие эффективных опций лекарственного лечения;
2) группу неблагоприятного прогноза: низкий функциональный статус (индекс Кар-новского < 60%), выраженный неврологический дефицит, множественные экстра-и интракраниальные метастазы, энцефалопатия.
2. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Метастатическое поражение головного мозга — это всегда IV стадия опухолевого процесса, по классификации TNM соответствует М1 независимо от значения индексов Т и N. В зависимости от количества очагов в головном мозге выделяют:
1) одиночный МГМ, в т. ч. солитарный (в случае отсутствия других отдаленных метастазов);
2) олигометастатическое поражение головного мозга: 2–4 очага в головном мозге;
3) множественные метастазы: ≥ 5 очагов в головном мозге.
3. ДИАГНОСТИКА
В зависимости от макроструктуры МГМ могут быть cолидной, кистозной и кистозносолидной структуры.
Обследование пациентов с МГМ проводится в соответствии с клиническими рекомендациями по лечению первичного опухолевого очага, метастазирующего в головной мозг. Дополнительно рекомендуется:
-
1) неврологический осмотр;
-
2) офтальмологический осмотр с оценкой симптомов внутричерепной гипертензии;
-
3) МРТ головного мозга с контрастным усилением;
-
4) КТ с контрастированием (с шагом 1 мм) для диагностики метастатического поражения головного мозга рекомендуется только при наличии противопоказаний к проведению МРТ.
МРТ головного мозга рекомендуется выполнять в следующих режимах:
• до в/в введения контрастного вещества: в режимах Т1 в аксиальной проекции (толщина среза 1–1,5 мм), Т2, ДВИ, FLAIR (толщина среза 3–5 мм);
• после в /в введения контрастного вещества: Т1 в аксиальной проекции (толщина среза 1–1,5 мм), 3D T1 взвешенные изображения высокого разрешения в аксиальной (или сагиттальной) плоскости с захватом всей головы с применением технологии изотропного воксела (1 мм × 1 мм × 1 мм).
4. ЛЕЧЕНИЕ МГМ
У пациентов с МГМ применяются локальные и системные методы лечения. К локальным методам относятся: хирургическое удаление МГМ и дистанционная ЛТ, которая может быть реализована в виде стереотаксической ЛТ (СЛТ) в режиме радиохирургии или гипофракционирования и облучения всего головного мозга (ОВГМ). Оптимальным вариантом лечения у пациентов с МГМ является комбинация методов локального лечения. Варианты комбинации локальных методов лечения определяются числом и объемом МГМ. К системным методам лечения относится ХТ, ГТ, иммунотерапия и таргетная терапия.
В соответствии с Приказом Министерства здравоохранения Российской Федерации от 19.02.2021 г. № 116н «Об утверждении Порядка оказания медицинской помощи взрослому населению при онкологических заболеваниях» алгоритм лечения пациентов с МГМ формируется на мультидисциплинарном онкологическом консилиуме с участием врача-нейрохирурга, врача-радиотерапевта и врача-онколога, которые определяют объем и последовательность различных вариантов локального (хирургического и/или лучевого) и системного (противоопухолевого, симптоматического, противоотечного и противосудорожного) лечения. План лечения разрабатывается индивидуально, учитываются следующие факторы:
-
1) распространенность экстракраниальных метастазов, наличие/отсутствие их контроля;
-
2) наличие/отсутствие резервов противоопухолевой лекарственной терапии;
-
3) биологические характеристики первичной опухоли и МГМ;
-
4) размеры МГМ (< 2 см или ≥ 2 см в максимальном измерении);
-
5) объем метастатического поражения головного мозга: одиночный метастаз, ограниченное (2–4 очага) или множественное (≥ 5 очагов) метастатическое поражение головного мозга или диссеминированное поражение (по типу милиарного без возможности выделения целевого объема для проведения стереотаксической радиотерапии);
-
6) лептоменингеальное поражение головного мозга;
-
7) функциональный статус пациента, обусловленный опухолевым процессом и сопутствующей патологией;
-
8) прогноз в отношении общей выживаемости (больше или меньше 6 мес. по шкале GPA, онлайн калькулятор доступен на сайте https:/ /brainmetgpa.com );
-
9) локализация МГМ в функционально значимых зонах мозга;
-
10) наличие неврологических симптомов, обусловленных метастатическим поражением головного мозга.
-
4.1. Нейрохирургическое лечение
Нейрохирургическую резекцию следует рассматривать у пациентов с первично выявленными или рецидивирующими симптоматическими (или асимптомными ≥ 2,0 см в максимальном измерении) МГМ. Нейрохирургическая резекция может быть предложена пациентам в следующих клинических ситуациях:
-
1) наличие МГМ без выявленного первичного очага: нейрохирургическая резекция является оптимальным методом верификации диагноза и удаления опухоли;
-
2) наличие крупных (более 2,0 см в диаметре) МГМ: нейрохирургическая резекция — оптимальной метод для обеспечения локального контроля;
-
3) наличие МГМ любых размеров с симптомами внутричерепной гипертензии или масс-эффекта: нейрохирургическое лечение позволяет быстро уменьшить неврологические симптомы и улучшить состояние пациента;
-
4) наличие клинических ситуаций, контроль которых невозможен с помощью других лечебных мероприятий (локальный рецидив после стереотаксической ЛТ, симптом-ный радионекроз, резистентный к проводимой лекарственной терапии).
-
4.2. Лучевая терапия
Необходимым условием проведения нейрохирургической резекции является локализация метастатического очага в зонах мозга, где его удаление не сопровождается развитием/нарастанием неврологического дефицита. Лучшие показатели общей выживаемости достигаются у пациентов с высоким функциональным статусом и контролем экстракраниального опухолевого процесса. После нейрохирургической резекции рекомендуется послеоперационная стереотаксическая ЛТ ложа удаленных очагов в режиме радиохирургии или гипофракционирования, которая проводится в интервале от 4 до 6 недель после операции или предоперационная ЛТ, которая проводится за 24–48 часов до операции.
Целесообразно проведение КТ головного мозга в сочетании или без контрастирования в течение 24–48 часов после нейрохирургической резекции для диагностики послеоперационного кровоизлияния.
ЛТ следует рассматривать у пациентов с первично выявленными МГМ в самостоятельном варианте лечения или как компонент комбинированного/комплексного варианта лечения, а также у пациентов с интракраниальной прогрессией (локальные рецидивы или развитие новых (дистантных) метастазов) после ранее проведенного лечения. Вариантами ЛТ МГМ являются СЛТ и ОВГМ. СЛТ может быть реализована в режиме радиохирургии (1 фракция) или гипофракционирования (от 3 до 7 фракций) и используется в самостоятельном варианте лечения или в комбинации с ОВГМ или нейрохирургическим лечением. Не рекомендуется проведение ЛТу пациентов с бессимптомными МГМ, низким функциональным статусом (индекс Карновского ≤ 50%) или у пациентов с индексом Карновского < 70%, экстракраниальной прогрессией болезни и отсутствием резервов лекарственной противоопухолевой терапии. Проведение ЛТ противопоказано при наличии симптомов внутричерепной гипертензии, неконтролируемом судорожном синдроме и неконтролируемых психических расстройствах.
Выбор режима фракционирования СЛТ зависит от дозовой нагрузки на нормальную ткань мозга, которая определяется количеством и размерами МГМ. СЛТ в режиме радиохирургии может быть реализована при условии, что при подведении очаговой дозы 20–24 Гр объем нормальной ткани мозга, облученный дозой 12 Гр, не превышает 10 см 3 (V12Гр ≤ 10 см 3 ). Для любых МГМ, при которых V12Гр > 10 см 3 , показано проведение СЛТ в режиме гипофракционирования.
У пациентов с наличием от 1 до 4 метастазов в головном мозге и ожидаемой общей выживаемостью ≥ 6 мес. рекомендуется:
-
• СЛТ в режиме радиохирургии при наличии метастатических очагов в головном мозге максимальным размером ≤ 2 см:
СЛТ в режиме радиохирургии является оптимальной лечебной опцией у пациентов с очагами < 2 см в максимальном измерении и реализуемой очаговой дозой радиации 20–24 Гр. У пациентов с очагами ≥ 2 см в максимальном измерении СЛТ в режиме радиохирургии может быть реализована при условии, что при очаговой дозе радиации не ниже 20 Гр объем нормальной ткани мозга, облученный дозой 12 Гр, не превышает 10 см 3 (V 12 Гр ≤ 10 см 3 );
-
• СЛТ в режиме гипофракционирования при наличии метастатических очагов в головном мозге с максимальным диаметром ≥ 2 см и наличием противопоказаний к нейрохирургическому лечению:
СЛТ в режиме гипофракционирования является оптимальной опцией у пациентов с наличием очагов ≥ 2 см в максимальном измерении либо при наличии очагов, локализованных в критических структурах мозга (зрительные тракты, ствол головного мозга и пр.); рекомендуемыми режимами гипофракционирования являются 3 ежедневные фракции по 8 Гр/9 Гр, 5 фракций по 6 Гр и 7 фракций по 5 Гр. При проведении гипофракционирования необходимо учитывать, что объем 10 см 3 нормальной ткани мозга не должен быть облучен дозой выше 19,2 Гр (за 3 фракции), 23,4 Гр (за 5 фракций) и 26,5 Гр (за 7 фракций).
-
• У пациентов с наличием ≥ 5 МГМ и благоприятным прогнозом общей выживаемости рекомендуется СЛТ или ОВГМ:
-
4.3. Противоопухолевая лекарственная терапия
У пациентов с множественными МГМ (5–10 очагов) и благоприятным прогнозом общей выживаемости СЛТ в режиме радиохирургии или гипофракционирования в самостоятельном варианте лечения является предпочтительной лечебной опцией.
Проведение ОВГМ рекомендуется у пациентов, не соответствующих критериям для проведения нейрохирургического лечения и/или СЛТ в качестве основного метода локального лечения. Клиническим сценарием, при котором показано проведение ОВГМ, является наличие множественного (более 10 очагов), диссеминированного или лептоменингеального поражения головного мозга, прогрессирующего на фоне противоопухолевой лекарственной терапии c отсутствием резервов системной терапии с установленной активностью в ЦНС. Стандартные суммарные дозы ОВГМ: 30 Гр (за 10 ежедневных фракций), 37,5 Гр (за 15 ежедневных фракций). У пациентов с благоприятным прогнозом общей выживаемости рекомендуется проведение ОВГМ на фоне приема мемантина и с дозовой разгрузкой гиппокампа (при условии, что метастазы в пределах 5 мм от гиппокампа отсутствуют).
Для пациентов с неблагоприятным прогнозом общей выживаемости (< 6 мес.) и сим-птомными МГМ возможно проведение короткого курса ОВГМ: 20 Гр за 5 фракций или симптоматическое лечение. В отдельных клинических ситуациях возможно проведение локального лечения (нейрохирургическое и/или ЛТ) с целью коррекции неврологических расстройств. Решение о проведении локального лечения у пациентов с неблагоприятным прогнозом общей выживаемости должно приниматься на мультидисциплинарном консилиуме с учетом потенциальной клинической эффективности и возможных лечебных рисков для пациента.
При метастатическом поражении головного мозга противоопухолевая лекарственная терапия проводится в соответствии с клиническими рекомендациями по лечению первичных нозологических форм (рак легкого, рак молочной железы, меланома, колоректальный рак, почечноклеточный рак и т. д.). Задачей системной противоопухолевой терапии является улучшение общей выживаемости посредством достижения контроля экстракраниальных метастатических очагов, снижения риска развития новых (дистантных) МГМ.
В случае выявления МГМ при отсутствии экстракраниального прогрессирования целесообразно проведение локального лечения МГМ в соответствии с текущими Клиническими рекомендациями и продолжение проводимой противоопухолевой лекарственной терапии.
Наличие гематоэнцефалического барьера ограничивает проникновение лекарственных препаратов в головной мозг, однако, в последние годы в клинической практике появляются препараты с установленной активностью в ЦНС, способные обеспечить регрессию МГМ, что позволяет отложить локальное лечение (ЛТ/нейрохирургическое) до дальнейшей интракраниальной прогрессии и отсрочить риск возможных осложнений локальной терапии без значимого снижения общей выживаемости.
В соответствии с рекомендациями ASCO и ESMO-EANO при бессимптомных МГМ по решению консилиума можно отложить локальную терапию до последующей клинически значимой прогрессии со стороны МГМ и проводить терапию экстракраниальных проявлений болезни в соответствии с принципами лечения данной нозологической формы. Любое решение об отсрочке локального лечения МГМ должно приниматься на консилиуме с участием нейрохирурга, радиотерапевта, специалиста в области противоопухолевой лекарственной терапии. При принятии решения необходимо учитывать характер и локализацию очагов в головном мозге: некоторым пациентам с бессимптомными метастазами, локализованными в функционально значимых зонах мозга, желательно проведение локального лечения даже в отсутствие неврологических симптомов с целью снижения риска развития неврологического дефицита. При отсрочке локальной терапии регулярное выполнение МРТ головного мозга имеет решающее значение для своевременного старта локальной терапии.
Подробные рекомендации по лечению больных НМРЛ, МРЛ и меланомой с МГМ представлены в соответствующих разделах.
При интракраниальной прогрессии и исчерпанных резервах локального лечения предпочтение отдается препаратам с установленной противоопухолевой эффективностью в головном мозге.
-
4.4. Терапия глюкокортикостероидами, противосудорожная терапия и поддерживающее лечение
Целью терапии ГКС является временное облегчение клинических симптомов, связанных с масс-эффектом вследствие перифокального отека. Как правило, минимально необходимую дозу ГКС следует использовать в течение как можно более короткого времени c попыткой уменьшения дозы всякий раз, когда это возможно. Пациентам с обширным отеком в сочетании или без масс-эффекта следует назначать ГКС не менее чем за 24 часа до начала ЛТ. Пациенты с высоким риском желудочно-кишечных побочных эффектов (например, пациенты, имеющие в анамнезе язвы/кровотечение из ЖКТ, принимающие НПВС или антикоагулянты) должны получать Н2-блокаторы или ингибиторы протонной помпы. Начальная доза дексаметазона составляет 4–8 мг/сут. Дозы дексаметазона снижаются постепенно, в течение 2-х недель и более с учетом индивидуальной динамики клинических симптомов и возможных осложнений ГКС терапии. Снижение/отмена дексаметазона до хирургического удаления и/или ЛТ нецелесообразна. Назначение и прием ГКС осуществляется в 1–3 приема, перорально (при суточных дозах менее 4 мг) или в/м в соответствии с циркадным ритмом с максимальными дозами в утренние часы и последним приемом не позднее 16–17 часов. Следует воздержаться от назначения ГКС у пациентов, получающих терапию ингибиторами контрольных точек.
При наличии симптомного радионекроза, резистентного к терапии ГКС, рекомендуется терапия бевацизумабом. Бевацизумаб проявляет более высокую активность по сравнению с ГКС и, вероятно, не влияет на эффективность иммунотерапии. Следует назначать терапию бевацизумабом в следующих случаях:
1) противопоказания к назначению ГКС;
2) радионекроз и локальный рецидив (по данным ПЭТ КТ с тирозином или метионином) в ранее облученном очаге с целью минимизации объема повторного облучения;
3) симптомные метастазы при планировании терапии ингибиторами контрольных точек.
5. ЛЕПТОМЕНИНГЕАЛЬНОЕ ПОРАЖЕНИЕ
6. ПРОФИЛАКТИКАИ ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
Доза бевацизумаба составляет 5 мг/кг массы каждые 2 недели или 7,5 мг/кг каждые 3 недели; лечение проводится до регресса симптомов или улучшения рентгенологической картины (обычно 4–6 введений).
Пациенты, у которых имелись судороги, должны получать вторичную противосудорожную профилактику. При планировании и проведении противоопухолевой лекарственной терапии желательно использование антиконвульсантов, не индуцирующих ферменты печени (ламотриджин, леветирацетам). Нежелательно использование карбамазепина, фенитоина, фенобарбитала, а также вальпроата натрия (из-за его возможной гематологической токсичности). Первичная профилактика эпиприступов не рекомендуется, так как не было доказано, что она эффективна в предотвращении первого приступа. Следует применять противосудорожные препараты, которые не взаимодействуют с противоопухолевыми лекарственными средствами.
Проведение паллиативной и симптоматической терапии рекомендуется у пациентов с МГМ и/или с распространенным лептоменингиальным поражением головного мозга при наличии неблагоприятного прогноза в отношении общей выживаемости.
Рекомендуемый алгоритм лечения пациентов с МГМ представлен на рис. 1.
Метастатическое лептоменингеальное поражение (ЛМП) диагностируется приблизительно у 10% пациентов с распространенным онкологическим заболеванием. Типичными клиническими проявлениями ЛМП у онкологических пациентов являются неврологические симптомы со стороны черепно-мозговых нервов, корешковые боли, синдром конского хвоста, нарушения слуха и зрения, сенсомоторные симптомы и др. У пациентов с рентгенологической картиной ЛМП рекомендуется исследование спинномозговой жидкости для цитологического подтверждения диагноза ЛМП.
У пациентов с благоприятным прогнозом без признаков нарушения ликвородинамики проводится системная терапия. Выбор схемы лечения осуществляется с учетом проникновения препаратов в ЦНС. Возможно проведение интратекальной терапии. При наличии симптомных оболочечных метастатических очагов рекомендуется ЛТ (СЛТ или ОВГМ). В отдельных ситуациях рассматривается краниоспинальное облучение. При наличии признаков нарушения ликвородинамики на первом этапе проводится локальное лечение (нейрохирургическое, ЛТ) с целью восстановления ликвородинамики с последующим проведением системной и/или интратекальной терапии. У пациентов с неблагоприятным прогнозом рассматривается поддерживающее лечение и проведение ЛТ (СЛТ или ОВГМ) симптомных очагов.
Рекомендуется соблюдать следующую периодичность наблюдения после лечения по поводу МГМ: первые 1–2 года — каждые 3 мес., 3–5-й годы — 1 раз в 6 мес. При высоком риске рецидива перерыв между обследованиями может быть сокращен. МРТ головного мозга с контрастным усилением выполняется каждые 3 мес. Обследование с целью оценки экстракраниального статуса болезни выполняется в соответствии с Клиническими рекомендациями по лечению первичного заболевания, ставшего источником метастазирования в головной мозг.
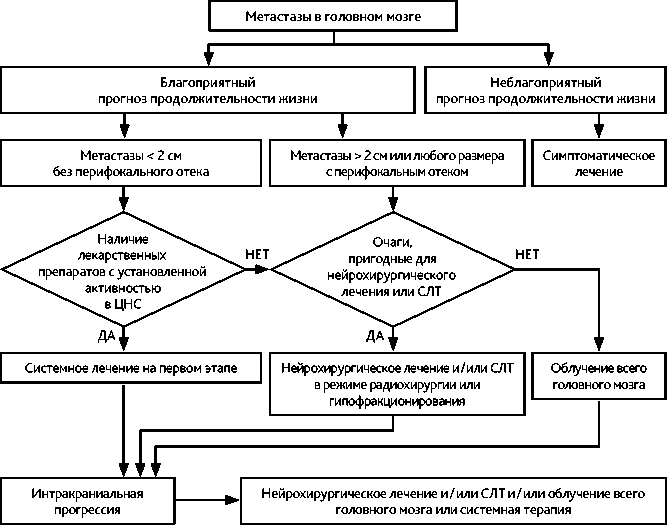
Рисунок 1. Рекомендуемый алгоритм лечения пациентов с метастатическим поражением головного мозга.


