Метастатическое поражение центральной нервной системы
Автор: Насхлеташвили Д.Р., Банов С.М., Бекяшев А.Х., Голанов А.В., Зайцев А.М., Кобяков Г.Л., Пронин А.И., Смолин А.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Практические рекомендации
Статья в выпуске: 3S2-1 т.14, 2024 года.
Бесплатный доступ
Метастатические опухоли головного мозга, таргетная терапия, химиотерапия, иммунотерапия, лучевая терапия, стереотаксическая лучевая терапия, радиохирургия, нейрохирургическое лечение
Короткий адрес: https://sciup.org/140307388
IDR: 140307388 | DOI: 10.18027/2224-5057-2024-14-3s2-1.1-11
Текст статьи Метастатическое поражение центральной нервной системы
По данным популяционных канцер-регистров, частота метастазов в головном мозге (МГМ) составляет 10–17% всех случаев онкологических заболеваний. Ежегодный показатель частоты поражения головного мозга зависит от локализации первичного очага и составляет при локализованных формах мелкоклеточного рака легких (МРЛ) — 15,8%, меланомы — 0,6%, немелкоклеточного рака легких (НМРЛ) — 14,4%, HER2-положитель-ного рака молочной железы (РМЖ) — 1,1 %, тройного негативного РМЖ — 0,7%, рака почки — 1,5%. При генерализованной форме заболевания частота МГМ составляет при МРЛ — 23,5%, меланоме — 28,2%, НМРЛ — 26,8%, HER2-положительном РМЖ — 11,5%, тройном негативном РМЖ — 11,4%, раке почки — 10,9%.
МГМ проявляется в виде солитарного очага приблизительно у 37–50% пациентов, а у 50–63% пациентов метастазы имеют множественный характер и могут локализоваться в различных анатомических образованиях головного мозга: в паренхиме, в твердой или мягкой мозговой оболочках, в субарахноидальном пространстве и желудочках головного мозга. Супратенториальные метастазы составляют 80–85%, метастазы в мозжечке — 10–15%, в стволе мозга — 3–5%, в мозговых оболочках — 1–2%.
Скрининг метастазов в головном мозге
-
• Скрининг МГМ следует рассматривать для пациентов с МРЛ любой стадии, НМРЛ (начиная со II стадии) и с меланомой (начиная с IIIC стадии)
-
• МРТ головного мозга с в/в контрастированием следует проводить пациентам с наличием неврологических симптомов, клинических симптомов повышенного внутричерепного давления, судорог или при появлении новых неврологических нарушений.
1. ФАКТОРЫ ПРОГНОЗА
Общая выживаемость пациентов с МГМ и планирование лечения зависят от ряда клинических факторов (возраст пациента, общее состояние, неврологический дефицит), биологических характеристик опухоли, объема поражения головного мозга (количество и объем метастазов и их локализация), наличия масс-эффекта и активности экстракраниального опухолевого процесса. В настоящее время общепринятой шкалой для оценки прогноза больных с МГМ является шкала прогноза общей выживаемости GPA (онлайн калькулятор доступен на сайте .
Целесообразно выделять:
-
1) группу благоприятного прогноза: ожидаемая продолжительность жизни ≥ 6 мес. по шкале GPA, отсутствие или стабильное состояние экстракраниальных метастазов, наличие резервов эффективной лекарственной терапии;
-
2) группу неблагоприятного прогноза: ожидаемая продолжительность жизни < 6 мес. по шкале GPA, экстракраниальная прогрессия, отсутствие резервов лекарственной терапии.
-
У пациентов с лептоменингиальным поражением выделяют:
1) группу благоприятного прогноза: высокий функциональный статус (индекс Кар-новского ≥ 60%), отсутствие неврологического дефицита, олигометастатический характер экстракраниальных метастазов, наличие эффективных опций лекарственного лечения;
2) группу неблагоприятного прогноза: низкий функциональный статус (индекс Кар-новского < 60%), выраженный неврологический дефицит, множественные экстра-и интракраниальные метастазы, энцефалопатия.
2. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Метастатическое поражение головного мозга — это всегда IV стадия опухолевого процесса, по классификации TNM соответствует М1 независимо от значения индексов “Т” и “N”. В зависимости от количества очагов в головном мозге выделяют:
1) одиночный МГМ, в т. ч. солитарный (в случае отсутствия других отдаленных метастазов);
2) олигометастатическое поражение головного мозга: 2–4 очага в головном мозге;
3) множественные метастазы: ≥ 5 очагов в головном мозге.
3. ДИАГНОСТИКА
В зависимости от макроструктуры МГМ могут быть cолидной, кистозной и кистозносолидной структуры.
Обследование пациентов с МГМ проводится в соответствии с клиническими рекомендациями по лечению первичного опухолевого очага, метастазирующего в головной мозг. Дополнительно рекомендуется:
-
1) неврологический осмотр;
-
2) офтальмологический осмотр с оценкой симптомов внутричерепной гипертензии;
-
3) МРТ головного мозга с контрастным усилением;
-
4) КТ с контрастированием (с шагом 1 мм) для диагностики метастатического поражения головного мозга рекомендуется только при наличии противопоказаний к проведению МРТ.
МРТ головного мозга рекомендуется выполнять в следующих режимах:
• до в/в введения контрастного вещества: в режимах Т1 в аксиальной проекции (толщина среза 1–1,5 мм), Т2, ДВИ, FLAIR (толщина среза 3–5 мм);
• после в /в введения контрастного вещества: Т1 в аксиальной проекции (толщина среза 1–1,5 мм), 3D T1 взвешенные изображения высокого разрешения в аксиальной (или сагиттальной) плоскости с захватом всей головы с применением технологии изотропного воксела (1 мм × 1 мм × 1 мм).
4. ЛЕЧЕНИЕ МГМ
У пациентов с МГМ применяются локальные и системные методы лечения. К локальным методам относятся: хирургическое удаление МГМ и дистанционная ЛТ, которая может быть реализована в виде СЛТ в режиме радиохирургии или гипофракционирования и ОВГМ. Оптимальным вариантом лечения у пациентов с МГМ является комбинация методов локального лечения. Варианты комбинации локальных методов лечения определяются числом и объемом МГМ. К системным методам лечения относится ХТ, ГТ, иммунотерапия и таргетная терапия.
В соответствии с Приказом Министерства здравоохранения Российской Федерации от 19.02.2021 г. №116н «Об утверждении Порядка оказания медицинской помощи взрослому населению при онкологических заболеваниях» алгоритм лечения пациентов с МГМ формируется на мультидисциплинарном онкологическом консилиуме с участием врача-нейрохирурга, врача-радиотерапевта и врача-онколога, которые определяют объем и последовательность различных вариантов локального (хирургического и/или лучевого) и системного (противоопухолевого, симптоматического, противоотечного и противосудорожного) лечения. План лечения разрабатывается индивидуально, учитываются следующие факторы:
-
1) распространенность экстракраниальных метастазов, наличие/отсутствие их контроля;
-
2) наличие/отсутствие резервов противоопухолевой лекарственной терапии;
-
3) биологические характеристики первичной опухоли и МГМ;
-
4) наличие крупных по размеру очагов (> 2 см в минимальном измерении);
-
5) объем метастатического поражения головного мозга: одиночный метастаз, ограниченное (2–4 очага) или множественное (≥ 5 очагов) метастатическое поражение головного мозга или диссеминированное поражение (по типу милиарного без возможности выделения целевого объема для проведения стереотаксической радиотерапии);
-
6) лептоменингеальное поражение (ЛМП) головного мозга;
-
7) функциональный статус пациента, обусловленный опухолевым процессом и сопутствующей патологией;
-
8) прогноз в отношении ожидаемой продолжительности жизни (больше или меньше 6 мес. по шкале GPA, онлайн калькулятор доступен на сайте https://brainmetgpa.com );
-
9) локализация МГМ в функционально значимых зонах мозга;
-
10) наличие неврологических симптомов, обусловленных метастатическим поражением головного мозга.
-
4.1. Нейрохирургическое лечение
Нейрохирургическую резекцию следует рассматривать у пациентов с крупными, первично выявленными или рецидивирующими симптоматическими МГМ. Нейрохирургическая резекция может быть предложена пациентам в следующих клинических ситуациях:
-
1) наличие МГМ без выявленного первичного очага: нейрохирургическая резекция является оптимальным методом верификации диагноза и удаления опухоли;
-
2) наличие крупных МГМ: нейрохирургическая резекция — оптимальной метод для обеспечения локального контроля;
-
3) наличие МГМ любых размеров с симптомами внутричерепной гипертензии или масс-эффекта: нейрохирургическое лечение позволяет быстро уменьшить неврологические симптомы и улучшить состояние пациента;
-
4) наличие клинических ситуаций, контроль которых невозможен с помощью других лечебных мероприятий (локальный рецидив после СЛТ, симптомный радионекроз, резистентный к проводимой лекарственной терапии).
-
4.2. Лучевая терапия
Необходимым условием проведения нейрохирургической резекции является локализация метастатического очага в зонах мозга, где его удаление не сопровождается раз-витием/нарастанием неврологического дефицита. Лучшие показатели общей выживаемости достигаются у пациентов с высоким функциональным статусом и контролем экстракраниального опухолевого процесса. После нейрохирургической резекции рекомендуется послеоперационная СЛТ ложа удаленных очагов в режиме радиохирургии или гипофракционирования, которая проводится в интервале от 4 до 6 недель после операции или предоперационная радиохирургия, которая проводится за 24–48 часов до операции.
Целесообразно проведение КТ головного мозга в сочетании или без контрастирования в течение 24–48 часов после нейрохирургической резекции для диагностики послеоперационного кровоизлияния.
ЛТ следует рассматривать у пациентов с первично выявленными МГМ в самостоятельном варианте лечения или как компонент комбинированного/комплексного варианта лечения, а также у пациентов с интракраниальной прогрессией (локальные рецидивы или в случае развития новых (дистантных) метастазов) после ранее проведенного лечения. Вариантами ЛТ МГМ являются СЛТ и ОВГМ. СЛТ может быть реализована в режиме радиохирургии (1 фракция) или гипофракционирования (от 3 до 7 фракций) и используется в самостоятельном варианте лечения или в комбинации с ОВГМ или нейрохирургическим лечением.
Не рекомендуется проведение ЛТ у пациентов с бессимптомными МГМ, низким функциональным статусом (индекс Карновского ≤ 50%) или у пациентов с индексом Карновского < 70%, экстракраниальной прогрессией болезни и отсутствием резервов лекарственной противоопухолевой терапии. Проведение ЛТ противопоказано при наличии симптомов внутричерепной гипертензии, неконтролируемом судорожном синдроме и неконтролируемых психических расстройствах.
Выбор режима фракционирования СЛТ зависит от дозовой нагрузки на нормальную ткань мозга, которая определяется количеством и размерами МГМ. СЛТ в режиме радиохирургии может быть реализована при условии, что при подведении очаговой дозы 20–24 Гр объем нормальной ткани мозга, облученный дозой 12 Гр, не превышает 10 см 3 (V12Гр ≤ 10 см 3 ). Для любых МГМ, при которых V12Гр > 10 см 3 , показано проведение СЛТ в режиме гипофракционирования.
У пациентов с наличием от 1 до 4 метастазов в головном мозге и ожидаемой общей выживаемостью ≥ 6 мес. рекомендуется:
-
• СЛТ в режиме радиохирургии при наличии метастатических очагов в головном мозге максимальным размером ≤ 2 см:
СЛТ в режиме радиохирургии является оптимальной лечебной опцией у пациентов с очагами ≤ 2 см в максимальном измерении и реализуемой очаговой дозой радиации 20–24 Гр. У пациентов с очагами ≥ 2 см в минимальном измерении СЛТ в режиме радиохирургии может быть реализована при условии, что при очаговой дозе радиации не ниже 20 Гр объем нормальной ткани мозга, облученный дозой 12 Гр, не превышает 10 см 3 (V12 Гр ≤ 10 см 3 );
-
• СЛТ в режиме гипофракционирования при наличии крупных метастатических очагов в головном мозге и наличии противопоказаний к нейрохирургическому лечению: СЛТ в режиме гипофракционирования является оптимальной опцией у пациентов с наличием крупных очагов либо при наличии очагов, локализованных в критических структурах мозга (зрительные тракты, ствол головного мозга и пр.); рекомендуемыми режимами гипофракционирования являются 3 ежедневные фракции по 8 Гр/9 Гр, 5 фракций по 6 Гр и 7 фракций по 5 Гр. При проведении гипофракционирования необходимо учитывать, что объем 10 см 3 нормальной ткани мозга не должен быть облучен дозой выше 19,2 Гр (за 3 фракции), 23,4 Гр (за 5 фракций) и 26,5 Гр (за 7 фракций).
-
• У пациентов с наличием ≥ 5 МГМ и благоприятным прогнозом общей выживаемости рекомендуется СЛТ или ОВГМ:
-
4.3. Противоопухолевая лекарственная терапия
У пациентов с множественными МГМ (5–10 очагов) и благоприятным прогнозом общей выживаемости СЛТ в режиме радиохирургии или гипофракционирования в самостоятельном варианте лечения является предпочтительной лечебной опцией. Проведение ОВГМ рекомендуется у пациентов, не соответствующих критериям для проведения нейрохирургического лечения и/или СЛТ в качестве основного метода локального лечения. Клиническим сценарием, при котором показано проведение ОВГМ, является наличие множественного (более 10 очагов), диссеминированного или лептоменингеального поражения головного мозга, прогрессирующего на фоне противоопухолевой лекарственной терапии c отсутствием резервов системной терапии с установленной активностью в ЦНС. Стандартные суммарные дозы ОВГМ: 30 Гр (за 10 ежедневных фракций), 37,5 Гр (за 15 ежедневных фракций). У пациентов с благоприятным прогнозом общей выживаемости рекомендуется проведение ОВГМ на фоне приема мемантина и с дозовой разгрузкой гиппокампа (при условии, что метастазы в пределах 5 мм от гиппокампа отсутствуют).
Для пациентов с неблагоприятным прогнозом общей выживаемости (< 6 мес.) и симптом-ными МГМ возможно проведение короткого курса ОВГМ: 20 Гр за 5 фракций или симптоматическое лечение. В отдельных клинических ситуациях возможно проведение локального лечения (нейрохирургическое и/или ЛТ) с целью коррекции неврологических расстройств. Решение о проведении локального лечения у пациентов с неблагоприятным прогнозом общей выживаемости должно приниматься на мультидисциплинарном консилиуме сучетом потенциальной клинической эффективности и возможных лечебных рисков для пациента.
При МГМ противоопухолевая лекарственная терапия проводится в соответствии с клиническими рекомендациями по лечению первичных нозологических форм (рак легкого, РМЖ, меланома, колоректальный рак, почечноклеточный рак и т. д.). Задачей системной противоопухолевой терапии является улучшение общей выживаемости посредством достижения контроля экстракраниальных метастатических очагов, снижения риска развития новых (дистантных) МГМ.
В случае выявления МГМ при отсутствии экстракраниального прогрессирования целесообразно проведение локального лечения МГМ в соответствии с текущими клиническими рекомендациями и продолжение проводимой противоопухолевой лекарственной терапии.
Наличие гематоэнцефалического барьера ограничивает проникновение лекарственных препаратов в головной мозг, однако, в последние годы в клинической практике появляются препараты с установленной активностью в ЦНС, способные обеспечить регрессию МГМ, что позволяет отложить локальное лечение (ЛТ/нейрохирургическое) до дальнейшей интракраниальной прогрессии без значимого снижения общей выживаемости.
Любое решение об отсрочке локального лечения должно приниматься на консилиуме с участием нейрохирурга, радиотерапевта, специалиста в области лекарственной терапии. При отсрочке локальной терапии регулярное выполнение МРТ головного мозга имеет решающее значение для своевременного старта локальной терапии.
У пациентов с бессимптомными МГМ в случае решения вопроса об отсрочке локального лечения необходимо учитывать характер и локализацию очагов в головном мозге. Некоторым пациентам с бессимптомными метастазами, локализованными в функциональных зонах мозга, желательно проведение локального лечения с целью снижения возможного риска развития неврологического дефицита.
В соответствии с рекомендациями ASCO и ESMO-EANO локальную терапию можно отложить до последующей интракраниальной прогрессии у пациентов с первично выявленными бессимптомными МГМ:
-
1) НМРЛ с наличием мутации / транслокации EGFR/ALK/ROS1: следует проводить тар-гетную терапию I линии лечения (осимертиниб, алектиниб, бригатиниб);
-
2) НМРЛ без мутации/транслокации EGFR/ALK/ROS1: следует проводить монотерапию ингибиторами иммунных контрольных точек, если PD-L1 > 50% или системную ХТ в сочетании с ингибиторами иммунных контрольных точек, если PD-L1 < 50%;
-
3) меланома независимо от BRAF статуса опухоли: следует проводить терапию ипи-лимумабом и ниволумабом;
-
4) HER2-позитивный РМЖ: следует проводить терапию согласно клиническим рекомендациям по лечению HER-2-позитивного РМЖ; для пациентов с тройным негативным РМЖ и прогрессирующими МГМ после локального лечения может рассматриваться стандартная лекарственная терапия. При интракраниальной прогрессии и исчерпанных резервах локального лечения предпочтение отдается препаратам с установленной противоопухолевой эффективностью в головном мозге.
-
4.4. Терапия глюкокортикостероидами, противосудорожная терапия и поддерживающее лечение
При наличии симптомного радионекроза, резистентного к терапии ГКС, рекомендуется терапия препаратом бевацизумаб. Бевацизумаб проявляет более высокую активность по сравнению с ГКС и, вероятно, не влияет на эффективность иммунотерапии. Следует назначать терапию бевацизумабом в следующих случаях:
1) противопоказания к назначению ГКС;
2) радионекроз и локальный рецидив (по данным ПЭТ-КТ с тирозином или метионином) в ранее облученном очаге с целью минимизации объема повторного облучения;
3) симптомные метастазы при планировании терапии ингибиторами контрольных точек.
5. ЛЕПТОМЕНИНГЕАЛЬНОЕПОРАЖЕНИЕ
Доза бевацизумаба составляет 5 мг/кг массы каждые 2 недели или 7,5 мг/кг каждые 3 недели; лечение проводится до регресса симптомов или улучшения рентгенологической картины (обычно 4–6 введений).
Пациенты, у которых имелись судороги, должны получать вторичную противосудорожную профилактику. При планировании и проведении противоопухолевой лекарственной терапии желательно использование антиконвульсантов, не индуцирующих ферменты печени (ламотриджин, леветирацетам). Нежелательно использование карбамазепина, фенитоина, фенобарбитала, а также вальпроата натрия (из-за его возможной гематологической токсичности). Первичная профилактика эпиприступов не рекомендуется, так как не было доказано, что она эффективна в предотвращении первого приступа. Следует применять противосудорожные препараты, которые не взаимодействуют с противоопухолевыми лекарственными средствами.
Проведение паллиативной и симптоматической терапии рекомендуется у пациентов с МГМ и/или с распространенным ЛМП головного мозга при наличии неблагоприятного прогноза в отношении общей выживаемости.
Рекомендуемый алгоритм лечения пациентов с МГМ представлен на рис. 1.
Метастатическое ЛМП диагностируется приблизительно у 10% пациентов с распространенным онкологическим заболеванием. Типичными клиническими проявлениями ЛМП у онкологических пациентов являются неврологические симптомы со стороны черепно-мозговых нервов, корешковые боли, синдром конского хвоста, нарушения слуха и зрения, сенсомоторные симптомы и др. У пациентов с рентгенологической картиной ЛМП рекомендуется исследование спинномозговой жидкости для цитологического подтверждение диагноза ЛМП.
У пациентов с благоприятным прогнозом без признаков нарушения ликвородинамики проводится системная терапия. Выбор схемы лечения осуществляется с учетом проникновения препаратов в ЦНС.
Возможно проведение интратекальной терапии. Интратекальное введение противоопухолевых лекарств (при наличии возможности) желательно проводить через резервуар Оммайя или через люмбальные пункции. Для интратекальной ХТ при метастатическом поражении мягких мозговых оболочек у пациентов с РМЖ используется метотрексат. Схема лечения: метотрексат по 15 мг интратекально 2 раза в неделю (в первый месяц лечения), по 15 мг интратекально 1 раз в неделю во второй месяц лечения, далее — поддерживающая терапия (по 15 мг интратекально 1 раз в 4 недели). Лечение проводится в медицинских центрах, имеющих опыт проведения интратекальной ХТ.
При наличии симптомных оболочечных метастатических очагов рекомендуется ЛТ (СЛТ или ОВГМ). В отдельных ситуациях рассматривается КСО. При наличии признаков нарушения ликвородинамики на первом этапе проводится локальное лечение (нейрохирургическое, ЛТ) с целью восстановления ликвородинамики с последующим проведением системной и/или интратекальной терапии. У пациентов с неблагоприятным прогнозом рассматривается поддерживающее лечение и ЛТ (СЛТ или ОВГМ) симптомных очагов.
6. ПРОФИЛАКТИКАИ ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
Рекомендуется соблюдать следующую периодичность наблюдения после лечения по поводу МГМ: первые 1–2 года — каждые 3 мес., 3–5-й годы — 1 раз в 6 мес. При высоком риске рецидива перерыв между обследованиями может быть сокращен. МРТ головного мозга с контрастным усилением выполняется каждые 3 мес. Обследование с целью оценки экстракраниального статуса болезни выполняется в соответствии с Клиническими рекомендациями по лечению первичного заболевания, ставшего источником метастазирования в головной мозг.
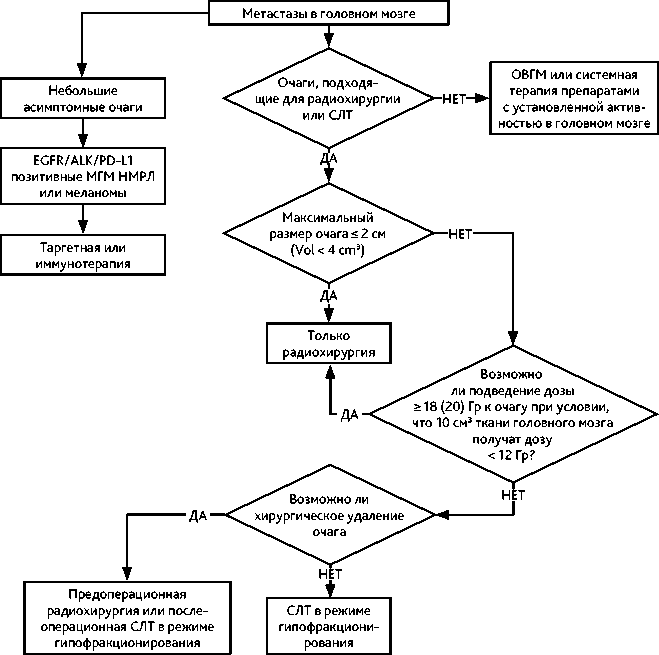
Рисунок 1. Рекомендуемый алгоритм лечения пациентов с метастатическим поражением головного мозга
| том /vol. 14(3s2) 2024
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


