Метод двухэтапного лечения пациентов с тотальными и субтотальными дефектами стопы при нейроостеоартропатии Шарко
Автор: Оснач Станислав Александрович, Оболенский Владимир Николаевич, Процко Виктор Геннадьевич, Борзунов Дмитрий Юрьевич, Загородний Николай Васильевич, Тамоев Саргон Константинович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.28, 2022 года.
Бесплатный доступ
Введение. Одним из осложнений сахарного диабета является остеоартропатия Шарко с развитием ангионевропатических и метаболических нарушений стоп, потерей опороспособности конечностей. Присоединение гнойной инфекции не только ухудшает качество жизни пациентов, но и создает угрозу жизни. По данным литературы, мы имеем весьма противоречивую информацию о выборе технологий реконструкции и способах фиксации стоп. Отсутствие единых подходов и общепризнанных протоколов свидетельствует о неудовлетворенности ортопедов достигнутыми результатами и о несовершенстве применяемых технологий. Цель. Оценить эффективность комбинированного применения технологии Masquelet и чрескостного остеосинтеза по Илизарову при остеоартропатии Шарко в условиях гнойной инфекции. Материалы и методы. Авторы представляют оригинальный подход при реконструкции стопы у 8 пациентов, основанный на комбинированном применении технологии Masquelet и чрескостного остеосинтеза по Илизарову. Период наблюдения составил от 1 до 11 месяцев с момента первичной операции. Результаты. У всех пациентов, пролеченных по данной методике, восстановлена опороспособность конечности, формирования несращений, потери коррекции и поздних гнойно-воспалительных осложнений не выявлено. Обсуждение. Комбинированное применение чрескостного остеосинтеза позволяет дискретно выполнить коррекцию многокомпонентных деформаций стоп без создания дополнительных ангиотрофических расстройств, а применение костной пластики по Masquelet - санировать патологически измененные ткани с формированием индуцированной мембраны, продуцирующей факторы роста и обладающей антимикробной активностью. При выборе тактики лечения и сохранения стопы, как органа, у пациентов с тяжелыми поражениями стоп при остеоартропатии Шарко метод двухэтапного оперативного лечения является оправданным и позволяет сохранять длину сегментов, опороспособность конечности даже в тех случаях, когда, на первый взгляд, ампутация имеет относительные показания. Заключение. Дифференцированное применение технологий Илизарова и Masquelet эффективно и оправдано в условиях артропатии Шарко.
Синдром диабетической стопы, стопа шарко, аппарат илизарова, антибактериальный спейсер, rimmer irrigator aspirator synthes
Короткий адрес: https://sciup.org/142235731
IDR: 142235731 | УДК: 616.379-008.64:617.586-007.248-001.5-089.227.84 | DOI: 10.18019/1028-4427-2022-28-4-523-531
Текст научной статьи Метод двухэтапного лечения пациентов с тотальными и субтотальными дефектами стопы при нейроостеоартропатии Шарко
Диабетическая остеоартропатия Шарко — это осложнение сахарного диабета в виде сенсомоторной и автономной невропатии, травмы и метаболических нарушений кости [1]. Наличие субтотальных и тотальных дефектов стопы при остеоартропатии Шарко приводит к нарушению опорной функции. Нестабильный характер деформации препятствует успешному использованию лечебной обуви или ортезов, а присоединение инфекции создает угрозу жизни. В ряде случаев только реконструктивная хирургия может быть единственным способом избежать ампутации конечности [2–6].
По данным литературы, мы имеем весьма противоречивую информацию о выборе технологий фиксации стопы. Так, некоторые специалисты отказались от погружных фиксаторов при артродезировании голеностопного сустава в пользу аппарата Илизарова для сохранения ранее оперированного сегмента при артропатии Шарко [8–29].
Вместе с тем, по данным литературы, ряд исследователей скептически оценивает возможности внешней фиксации при восстановительном лечении пациентов с остеоартропатией Шарко, отдавая предпочтение в использовании погружных металлофиксаторов [30].
Сторонники внешней фиксации при лечении пациентов с остеоартропатией Шарко отмечают множество преимуществ применения чрескостного остеосинтеза при выраженном остеопорозе, гнойных осложнениях, остеомиелите, мягкотканных дефектах [13].
Выбор технологии остеосинтеза может зависеть от многих факторов, поэтому информация о преимуществах и недостатках различных вариантов фиксации имеет решающее значение для достижения наилучших результатов [31].
В случаях резекционного артродеза погружными фиксаторами при стадии 2 по классификации Eichenholtz повышается вероятность несращения, вторичного смещения фрагментов, потери костной массы, вторичной ампутации.
Недостатком методик одномоментного артродеза как погружными, так и внеочаговыми фиксаторами является необходимость укорочения сегментов, придания стопе вынужденного положения с последующим изготовлением и постоянным использованием индивидуально изготовленной ортопедической обуви. Достижение костного анкилоза не всегда представляется возможным из-за отсутствия конгруэнтности и достаточной площади контакта артродезируемых фрагментов.
Замещение таранной кости с одномоментным заполнением дефекта трабекуллярными металлическими имплантами и аутотрансплантатами при интрамедуллярной фиксации и применении Rimmer Irrigator Aspirator Synthes описано зарубежными авторами у двух пациентов с артропатией Шарко. При этом этап замещения был одномоментным, что значительно снижает возможности регенерата для органотипической перестройки [32].
Способ замещения обширных дефектов длинных трубчатых костей двухэтапно по методике Masquelet активно используется и подробно демонстрируется во многих клинических работах. Предложенный способ приводит к формированию остеоиндуктивной мембраны в зоне костного дефекта, что позволяет обеспечить полноценную органотипическую перестройку имплантационного материала [33–35].
По данным литературы, в настоящее время имеется опыт успешного замещения костных дефектов при комбинированном использовании несвободной костной пластики по Илизарову и техники Masquelet при реабилитации пациентов с приобретенными костными дефектами и ложными суставами [36].
При костной пластике по Masquelet хирурги отдавали приоритет внешней фиксации, при этом оценивали возможности чрескостного остеосинтеза с позиции возможности длительной жесткой фиксации костных отломков при снижении качества жизни пациентов [36, 37].
Замещение частичных дефектов среднего отдела стопы при артропатии Шарко двухэтапно было описано в виде кейс-репорта [38]. Несмотря на хороший клинический результат, единичный описанный случай оставляет открытым вопрос о возможностях замещения тотальных и субтотальных дефектов стопы.
Процесс забора аутотрансплантата из гребня подвздошной кости обладает рядом недостатков: помимо косметического дефекта, высокой травматичностью, риском повреждения кожного бедренного нерва, повреждением париетального листка брюшины [39]. Особенности анатомии крыла подвздошной кости не позволяют получить большой объем губчатой кости, и для замещения обширных дефектов костной ткани прибегают к билатеральному забору из гребней подвздошных костей, что сопровождается обширным повреждением мягких тканей и кортикального слоя кости на большом протяжении.
Задачей хирургического лечения пациентов с осложненной диабетической нейроостеоарторопатией является радикальное устранение хирургическим путем очага деструкции костной ткани и восстановление функциональных возможностей стопы за счет реконструкции ее анатомической структуры, восстановление длины сегмента и биомеханики.
Достигаемым при использовании предлагаемой методики техническим результатом является устранение гнойно-деструктивного очага и возникшего на этом фоне дефект-диастаза отделов стопы, восстановление опороспособности стопы, ее длины, а также сохранение ее функциональности за счет создания костного анкилоза.
Таким образом, в настоящее время мы имеем большое разнообразие применяемых оперативных технологий и способов фиксации при реконструктивно-восстановительных операциях у пациентов с артропатией Шарко. Вместе с тем, отсутствие единых подходов и общепризнанных протоколов свидетель- ствует о неудовлетворенности ортопедов достигнутыми результатами и о несовершенстве применяемых технологий. При аналитическом обзоре литературы мы не встретили публикаций о возможности хирургической реабилитации пациентов с артропатией Шарко при использовании чрескостного остеосинтеза и техники Masquelet.
Цель исследования – оценить клиническую эффективность и перспективы исходов оперативного лечения пациентов с диабетической стопой Шарко с деструкцией среднего и заднего отдела стопы в условиях ремиссии и активной гнойной инфекции при комбинации применения технологии Masquelet и чрескостного остеосинтеза по Илизарову.
МАТЕРИАЛЫ И МЕТОДЫ
Более ранняя идея объединения данных классификаций в одну для простоты и более полноценной характеристики истинного локального статуса пациентов SERW [46] была изменена. Вместо классификации Rogers [1], описывающей деформацию стопы без уточнения ее вида, указывался тип деформации с описанием типа деформации: VL – valgus, VR – varus, QU – equinus, PP – press-papie; предлагаемая классификация переименована соответственно в SEDW.
Всем пациентам обеспечивали разгрузку конечности, выполняли контроль и коррекцию гликемии, проводили нейропротекторную терапию и, по показаниям, системную антибактериальную терапия.
На первом этапе предлагаемого двухэтапного способа под спинальной анестезией в асептических условиях под пневможгутом через доступ с учетом вида и локализации деформации проводили удаление частей деформированных и пораженных костей, рубцовых тканей и патологических грануляций, резекцию хрящей суставных поверхностей костей и синовэктомию; при наличии язвы, последняя иссекалась с формированием кожно-фасциальных лоскутов для последующего пластического закрытия раневого дефекта.
Стопу выводили скелетной тракцией в функционально правильное положение диафиксирующими спицами с сохранением зоны дефект-диастаза, правильного соотношения и длины сегментов (стопы и/или голени). В сформированный диастаз имплантировали полиметилметакрилатный цементный спейсер, изготовленный из ревизионного костного цемента средней степени вязкости и содержащий 1 грамм гентамицина. Самостоятельно в процессе формирования спейсера в цемент добавляли до 2–4 граммов ванкомицина. Объем интегрируемого спейсера зависел от объема образовавшегося диастаза. При нехватке одной дозы костного цемента (40 г) использовали 2 дозы. Размеры имплантированного спейсера составляли 6 × 4 × 2 (± 1) см с заполнением образовавшихся дефектов от 30 до 80 см3. Сформированный спейсер имел аналогичный диаметр по отношению к прилегающей кости, а его объем соответствовал объему сформированного диастаза. Раны на стопе ушивались послойно наглухо без дренажей.
Затем выполняли внеочаговый остеосинтез компрессионно-дистракционным аппаратом внешней фиксации, состоящим из двух колец, фиксируемых на голени при поражении голеностопного и подтаранного суставов или одного кольца на голени при поражении среднего отдела стопы, а также двух полуколец на стопе: одно полукольцо устанавливалось в задней части стопы и одно на переднем отделе стопы. В проекции колец и полуколец проводились спицы в косо-фронтальной плоскости, спицы фиксировались в плоскости колец и натягивались спиценатягивателем. Полукольца соединялись между собой резьбовыми стержнями и одно-двухплоскостными шарнирами.
На втором этапе через 6–8 недель (по технологии Masquelet) цементный спейсер удаляли, не повреждая образовавшуюся индуктивную мембрану, дефект-диастаз заполняли комбинированным трансплантатом.
Забор аутотрансплантата осуществлялся из бедренного канала. Предварительно диаметр канала бедренной кости измерялся в поперечном направлении в наиболее узкой части при помощи С-дуги, и подбирался размер головки фрезы из расчета на 1–1,5 мм шире диаметра костномозгового канала бедренной кости. Доступ к бедренному каналу производился в асептических условиях из стандартного латерального доступа к проксимальному отделу бедренной кости. Точка входа спицы в канал определялась под контролем мобильного электронно-оптического преобразователя (С-дуги). В сформированную точку в проекции большого вертела бедренной кости вводилась спица-направитель; далее по направителю вводилось канюлированное шило. Под контролем мобильного электронно-оптического преобразователя (С-дуги) в канале бедренной кости производился забор аутокости с помощью системы риммер-ир-ригатор-аспиратор (Rimmer Irrigator Aspirator Synthes). Рана на бедре ушивалась наглухо послойными швами без дренажа.
Забранный аутологичный биоматериал в асептических условиях смешивался с аллокостью в виде деминерализированной спонгиозной костной крошки в соотношении "один-к-одному", комбинированный трансплантат интегрировался в раневую полость. Рана на стопе ушивалась наглухо послойными швами без дренажа. Стабилизация фрагментов сохранялась в аппарате внешней фиксации.
Швы снимали через 2–4 недели с момента операции. Этапный рентгенологический контроль проводится каждые 1–1,5 месяца. Демонтаж аппарата внешней фиксации производился при выявлении явных рентгенологических признаков консолидации и после осуществления клинической пробы. Аппаратную фиксацию стопы заменяли фиксацией задней гипсовой лонгетой сроком на 2–3 недели – до заживления ран в местах удаленных фиксирующих элементов. В дальнейшем пациент продолжал фиксацию стопы индивидуальной повязкой Total Contact Cast с последующими рекомендациями ношения индивидуальной ортопедической обуви.
В контрольную группу исследования были отобраны пациенты, оперированные ранее по стандартным методикам резекционного артродеза аппаратом внешней фиксации или винтами одномоментно.
Результаты исследования оценены методом описательной статистики.
Работа была выполнена в соответствии с этическими нормами Хельсинкской декларации Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2013 г. и «Правилами клинической практики в Российской Федерации», утвержденными приказом Минздрава РФ от 19.06.2003 г. № 266. Пациенты подписали информированное согласие на проведение хирургического вмешательства и публикацию полученных данных без идентификации личности.
РЕЗУЛЬТАТЫ
Артродез заднего отдела стопы был произведен у 16 пациентов: у 8 – с помощью внеочагового остеосинтеза по Илизарову, у 8 – внутренней фиксацией винтами (табл. 1).
В ранние сроки (до 1 месяца с момента операции) осложнений выявлено не было. Осложнения в более поздние сроки развились у 4 больных: у троих с внутренней фиксацией и у одного – с внешней.
У одного пациента с морбидным ожирением (ИМТ = 44), комбинированным поражением и остео- миелитом была допущена тактическая ошибка – произведена внутренняя фиксация винтами, что на фоне несоблюдения режима разгрузки через два месяца после операции привело к нестабильности фиксации, вторичной инфекции с развитием синдрома системной воспалительной реакции; удаление имплантов и использование индивидуальной съемной иммобилизирующей повязки не позволило справиться с гнойновоспалительным процессом, и случай закончился ампутацией на уровне верхней трети голени.
Таблица 1
Распределение пациентов контрольной группы и выявленных осложнений по классификации SEDW. Задний отдел
|
Классификация, стадия |
Количество пациентов |
Количество осложнений абс. % |
|
|
Локализация патологического процесса |
|||
|
Sanders 3–4: суставы предплюсны и голеностопный сустав |
4 |
1 |
25 |
|
Sanders 4: голеностопный сустав |
5 |
1 |
20 |
|
Sanders 4–5: голеностопный и подтаранный суставы |
1 |
0 |
0 |
|
Sanders 3–4–5: комбинированное поражение |
6 |
2 |
33,3 |
|
Стадия патологического процесса |
|||
|
Eichenholtz 1: стадия фрагментации |
10 |
3 |
30 |
|
Eichenholtz 2: стадия сращения |
4 |
0 |
|
|
Eichenholtz 3: стадия консолидации |
2 |
1 |
50 |
|
Деформация и осложнения |
|||
|
Деформация с раной (VR) |
4 |
0 |
0 |
|
Деформация с остеомиелитом (VR – 9, VL – 2, QU – 1) |
12 |
4 |
33,3 |
|
Глубина поражения тканей |
|||
|
Wagner 2: глубокая инфицированная язва без вовлечения кости |
4 |
0 |
0 |
|
Wagner 3: глубокая инфицированная язва с остеомиелитом |
12 |
4 |
33,3 |
Еще у двух пациентов с внутренней фиксацией через 9 и 13 месяцев было отмечено образование свищей и септическая нестабильность имплантов. Последние были удалены с рассверливанием каналов и пломбировкой импрегнированной гентамицином коллагеновой губкой без потери коррекции стопы и без рецидивов в сроки до одного года у одного пациента. Один случай несращения и нестабильности через 9 месяцев потребовал использования наружной фиксации.
У одного больного с внешней фиксацией через 12 месяцев был выявлен спицевой остеомиелит в средней трети голени; секвестрэктомия произведена без рецидивов в дальнейшем (1,5 года).
Артродез среднего отдела стопы был произведен у 76 пациентов внутренней фиксацией винтами (табл. 2).
Выявлен один случай (1,3 %) раннего послеоперационного осложнения (< 1 месяца) – нагноение раны и септическая нестабильность винта, что потребовало его удаления, хирургической обработки и фиксации в гипсе – без рецидива, стабильная стопа; 5 (6,6 %) случаев поздней септической нестабильности винтов (в сроки от 2 до 37 месяцев) – винты удалены без потери коррекции стоп; 1 случай (1,3 %) перелома встречных винтов в сроки более 1 года без потери коррекции стопы и без необходимости удаления винтов. Основной причиной осложнений было несоблюдение пациентами режима разгрузки конечности.
Отмечено два случая (2,6 %) рецидива язвы стопы, но другой локализации, что потребовало произвести плоскостную резекцию экзостоза боковым доступом без вмешательства на язве; в дальнейшем на фоне ношения разгрузочного ортеза язвы зажили; один случай (1,3 %) рецидива изъязвления при несоблюдении режима разгрузки стопы пациентом с морбидным ожирением, что потребовало привлечения психолога и родственников, использования иммобилизации конечности в индивидуальной разгрузочной повязке – язва зажила.
Итак, всего было отмечено 9,2 % случаев ранних и поздних осложнений и 3,9 % случаев рецидива язвоо-бразования в сроки от 1 до 5 лет.
Несмотря на хорошие результаты реконструктивных вмешательств и восстановление опороспособ-ности конечности, относительное укорочение длины конечности при поражении заднего отдела стопы и относительное укорочение стопы наблюдалось у всех пациентов контрольной группы: от 1–4 см при поражении заднего отдела и 1–5 см при реконструкции среднего отдела стопы. Сохранение данного укорочения требовало повторных оперативных вмешательств для восстановления длины конечности, но оставался нерешенным вопрос о компенсации длины среднего отдела стопы. Всем пациентам требовалось изготовление сложных ортопедических изделий и постоянного их ношения.
Пациенты исследуемой группы находятся на разных этапах лечебного процесса.
Так, трое пациентов, завершивших лечение (срок наблюдения – 10 и 9 месяцев с момента первичного оперативного вмешательства), активно ходят в индивидуальной ортопедической обуви; артродез состоялся. У этих пациентов в раннем послеоперационном периоде после второго этапа отмечалось сохранение сукровичного раневого отделяемого сроком до двух недель без последующего нагноения. Авторы связывают это с погрешностью установки трансплантата, недостаточной компактизацией последнего в полости дефекта и проведением остеоперфорации костных торцов, которая могла привести к дополнительному скоплению гематомы и ее выведению через рану. Несращений, потери коррекции и поздних гнойно-воспалительных осложнений не выявлено.
Четверо пациентов, которым произведены оба этапа оперативного лечения, находятся на завершающем этапе фиксации методом чрескостного остеосинтеза (срок наблюдения от 4 до 6 месяцев с момента первичной операции). У одной пациентки отмечалось па-распицевое нагноение в нижней трети голени; после перемонтажа аппарата и перепроведения спиц явления были купированы. У другого пациента на фоне низкой комплаентности и продолжения полной нагрузки на стопу развились явления нестабильности аппарата после проведения первого этапа, установки спейсера, что потребовало провести демонтаж аппарата и замену спейсера с чрескостным реостеосинтезом. Других осложнений у этих четверых пациентов выявлено не было.
Таблица 2
Распределение пациентов контрольной группы и выявленных осложнений по классификации SEDW. Средний отдел
|
Классификация, стадия |
Количество пациентов |
Количество осложнений |
|
|
абс. |
% |
||
|
Локализация патологического процесса |
|||
|
Sanders 3: суставы предплюсны |
76 |
7 |
9,2 |
|
Стадия патологического процесса |
|||
|
Eichenholtz 1: стадия фрагментации |
17 |
2 |
2,6 |
|
Eichenholtz 2: стадия сращения |
14 |
1 |
1,3 |
|
Eichenholtz 3: стадия консолидации |
45 |
4 |
5,3 |
|
Деформация и осложнения |
|||
|
Деформация с раной (РР – 31, VR – 3) |
34 |
0 |
0 |
|
Деформация с остеомиелитом (РР – 36, VR – 4, VL – 2) |
42 |
7 |
9,2 |
|
Глубина поражения тканей |
|||
|
Wagner 2: глубокая инфицированная язва без вовлечения кости |
34 |
0 |
0 |
|
Wagner 3: глубокая инфицированная язва с остеомиелитом |
42 |
7 |
9,2 |
Двум пациентам проведен первый этап оперативного лечения – резекция костей, установка спейсера и фиксация конечности в аппарате Илизарова. Осложнений за период наблюдения не выявлено, в ближайшее время планируется второй этап лечения.
Клинический пример
В 2015 году выполнена остеонекрэктомия с заполнением дефекта среднего отдела импрегнированной гентамицином коллагеновой губкой и фиксацией стопы и голени в аппарате Илизарова (рис. 2); срок фиксации в аппарате – 6 месяцев.
Раны зажили, сохранилась флотация стопы в среднем отделе, что не мешало пациенту свободно передвигаться в ортопедической обуви.
В 2017 году пациент обратился с картиной плантарной язвы, стадия 2 по Вагнеру; коррекция разгрузочной обуви и консервативная терапия привели к заживлению дефекта.
Обращение в феврале 2021 года: деформация в области голеностопного сустава, свищ со скудным гнойным отделяемым в этой области; рентгенологически определен тотальный лизис таранной кости, деструктивные изменения контактных поверхностей большеберцовой и пяточной костей (рис. 3).
На первом этапе под спинальной анестезией и пневможгутом выполнена остеонекрэктомия зоны пяточнобольшеберцового неоартроза, вскрытие остеомиелитической полости большеберцовой кости. Произведена ревизия зоны диастаза среднего отдела стопы, создание костных торцов конгруэнтными с последующим заполнением зон диастазов двумя цементными спейсе-рами и остеосинтезом стопы и голени аппаратом внешней фиксации (рис. 4) с наложением первичных швов.
Через шесть недель был выполнен второй этап – удаление спейсеров и костная пластика диастазов комбинированными костными трансплантатами (RIA плюс аллокость) с наложением первичных швов. В течение двух недель сохранялось сукровичное отделяемое в области швов, что купировалось самостоятельно.
Еще через шесть месяцев рентгенологически констатировано образование плотного костного регенерата с образованием анкилоза в проекциях голеностопного сустава и среднего отдела стопы; после клинической пробы произведен демонтаж аппарата внешней фиксации (рис. 5, 6).
Пациент проведен через этапы разгрузки в гипсовой лонгете и Total Contact Cast, активизирован в ортопедической обуви. На сроке 11 месяцев с момента первого этапа оперативного лечения по предлагаемой методики несращений, потери коррекции и поздних гнойно-воспалительных осложнений в этот период не выявлено.
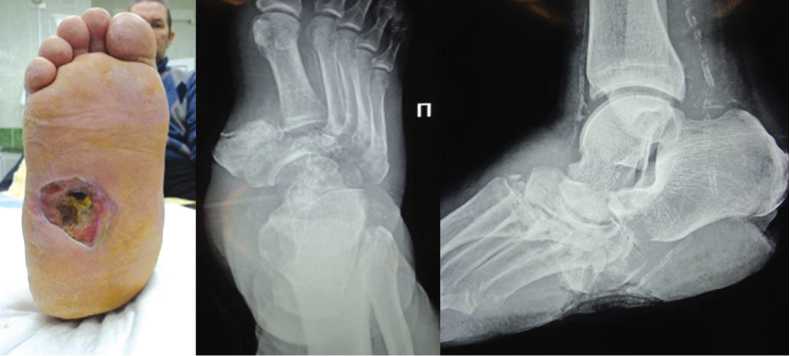
Рис. 1. Фото и рентгенограммы стопы в двух проекциях до лечения
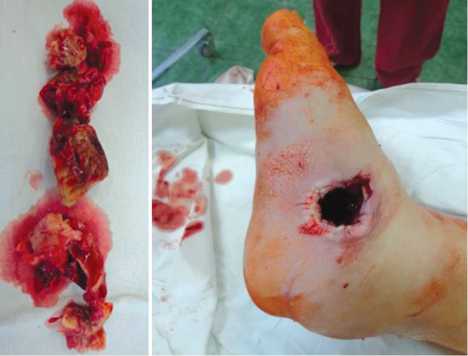
Рис. 2. Интраоперационное фото стопы и резецированных тканей после секвес-трнекроэктомии
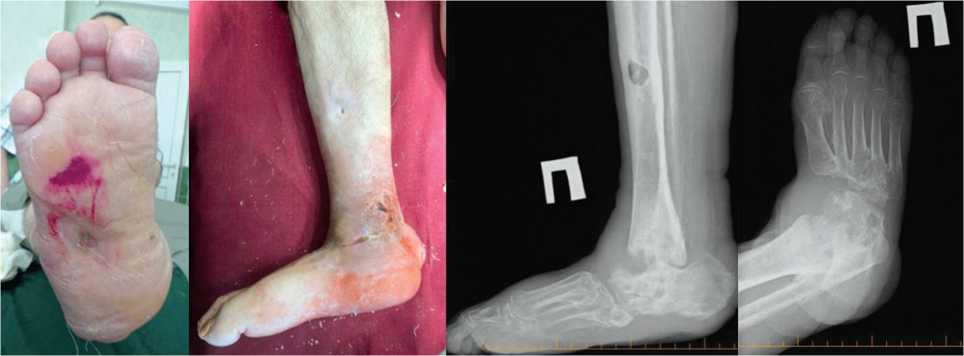
Рис. 3. Фото и рентгенограммы стопы перед первым этапом реконструктивного вмешательства
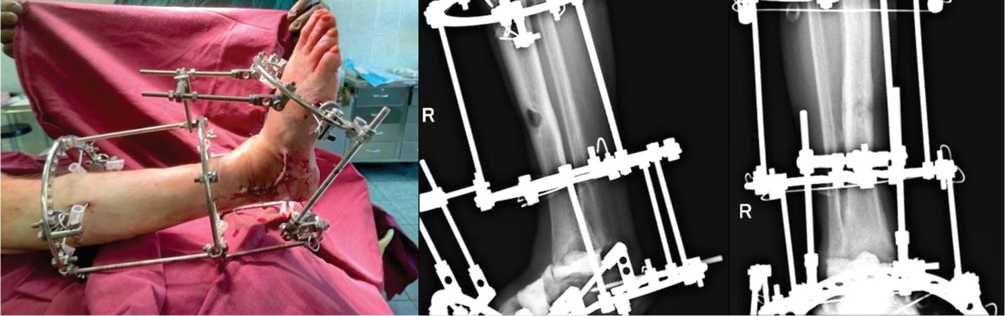
Рис. 4. Фото и рентгенограммы голени и стопы после первого этапа вмешательства
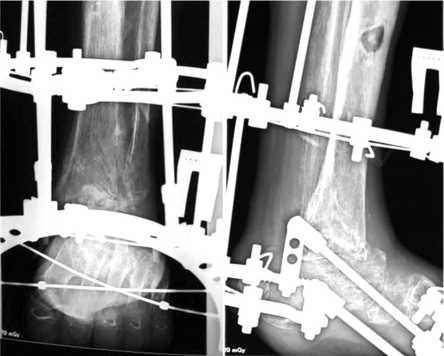
Рис. 5. Рентгенограммы стопы через 6 месяцев
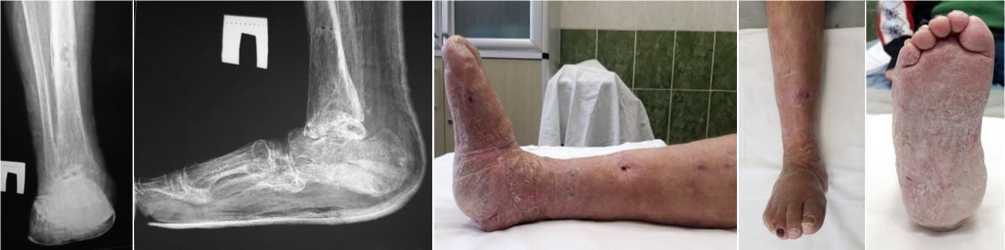
Рис. 6. Фото и рентгенограммы стопы. Результат лечения
ОБСУЖДЕНИЕ
В настоящее время в литературе появились публикации об эффективном комбинированном применении несвободной костной пластики по Илизарову и техники Masquelet при реабилитации пациентов с гетерогенными костными дефектами и ложными суставами [36, 47].
Концепция комбинированного применения несвободной костной пластики по Илизарову и техники Masquelet зиждется на идее использования известных преимуществ двух технологий. По мнению авторитетных авторов, несвободная костная пластика по Илизарову является идеальной формой костной пластики, когда в проблемную зону дозированно и направленно перемещается васкуляризированный аутотрансплантат с сохраненным покровом мягких тканей, позволяющий теоретически создать в дефекте трубчатую кость любой длины и формы [48].
По данным литературы, формируемая вокруг спей-сера мембрана хорошо васкуляризирована, продуцирует факторы роста (VEGF, TGF-бета1) и морфогенетические белки ВМР-2 и ВМР-7 [37].
Индуцированная мембрана также обладает антимикробной активностью [49].
Комбинированное применение чрескостного остеосинтеза позволяет выполнить коррекцию многокомпонентных деформаций стоп без создания дополнительных ангиотрофических расстройств, а применение костной пластики по Masquelet – санировать патологически измененные ткани с формированием индуцированной мембраны, продуцирующей факторы роста и обладающей антимикробной активностью.
На наш взгляд, при выборе тактики лечения и сохранения стопы, как органа, у пациентов с тяжелыми поражениями стоп при остеоартропатии Шарко, метод двухэтапного оперативного лечения является оправданным и позволяет сохранять длину сегментов, опоро-способность конечности даже в тех случаях, когда, на первый взгляд, ампутация имеет показания. Безусловно, использование данной методики требует когнитивного баланса и приверженности пациента к лечению, соблюдения им предписанных режимов иммобилизации и разгрузки, активизации и реабилитации.
ЗАКЛЮЧЕНИЕ
Таким образом, дифференцированное применение технологий Илизарова и Masquelet с учетом их преимуществ может быть использовано в условиях нейроостеоартропатии Шарко. Достигнутые предварительные результаты клинического применения ме-
тодики двухэтапного оперативного лечения пациентов с тотальными и субтотальными дефектами стопы при остеоартропатии Шарко доказывают оправданность, эффективность и перспективность использованной технологии.
Список литературы Метод двухэтапного лечения пациентов с тотальными и субтотальными дефектами стопы при нейроостеоартропатии Шарко
- The Charcot foot in diabetes / L.C. Rogers, R.G. Frykberg, D.G. Armstrong, A.J. Boulton, M. Edmonds, G.H. Van, A. Hartemann, F. Game, W. Jeffcoate, A. Jirkovska, E. Jude, S. Morbach, W.B. Morrison, M. Pinzur, D. Pitocco, L. Sanders, D.K. Wukich, L. Uccioli // Diabetes Care. 2011. Vol. 34, No 9. P. 2123-2129. DOI: 10.2337/dc11-0844.
- Baravarian B., Van Gils C.C. Arthrodesis of the Charcot foot and ankle // Clin. Podiatr. Med. Surg. 2004. Vol. 21, No 2. P. 271-289. DOI: 10.1016/j. cpm.2004.01.007.
- Ramanujam C.L., Stapleton J.J., Zgonis T. Diabetic Charcot neuroarthropathy of the foot and ankle with osteomyelitis // Clin. Podiatr. Med. Surg. 2014. Vol. 31, No 4. P. 487-492. DOI: 10.1016/j.cpm.2013.12.001.
- Arthrodesis as an early alternative to nonoperative management of Charcot arthropathy of the diabetic foot / S.R. Simon, S.G. Tejwani, D.L. Wilson, T. J. Santner, N.L. Denniston // J. Bone Joint Surg. Am. 2000. Vol. 82-A, No 7. P. 939-950. DOI: 10.2106/00004623-200007000-00005.
- Should one consider primary surgical reconstruction in Charcot arthropathy of the feet? / T. Mittlmeier, K. Klaue, P. Haar, M. Beck // Clin. Orthop. Relat. Res. 2010. Vol. 468, No 4. P. 1002-1011. DOI: 10.1007/s11999-009-0972-x.
- Hartig N., Krenn S., Trnka H.J. Operative Versorgung des Charcot-Fußes am Rückfuß : Langzeitergebnisse und systematischer Überblick // Orthopade. 2015. Vol. 44, No 1. P. 14-24. DOI: 10.1007/s00132-014-3058-8.
- Assal M., Stern R. Realignment and extended fusion with use of a medial column screw for midfoot deformities secondary to diabetic neuropathy // J. Bone Joint Surg. Am. 2009. Vol. 91, No 4. P. 812-820. DOI: 10.2106/JBJS.G.01396.
- Herbst S.A. External fixation of Charcot arthropathy // Foot Ankle Clin. 2004. Vol. 9, No 3. P. 595-609. DOI: 10.1016/j.fcl.2004.05.010.
- Burns P.R., Wukich D.K. Surgical reconstruction of the Charcot rearfoot and ankle // Clin. Podiatr. Med. Surg. 2008. Vol. 25, No 1. P. 95-120, vii-viii. DOI: 10.1016/j.cpm.2007.10.008.
- Die Rückfußarthrodese bei postinfektiöser Sprunggelenkdestruktion mit einem intramedullären retrograden Arthrodesennagel / C. Kappler, R. Staubach, A. Abdulazim, M. Kemmerer, G. Walter, R. Hoffmann // Unfallchirurg. 2014. Vol. 117, No 4. P. 348-354. DOI: 10.1007/s00113-012-2341-6.
- Tibiotalocalcaneal arthrodesis using an intramedullary nail: a systematic review / F. Franceschi, E. Franceschetti, G. Torre, R. Papalia, K. Samuelsson, J. Karlsson, V. Denaro // Knee Surg. Sports Traumatol. Arthrosc. 2016. Vol. 24, No 4. P. 1316-1325. DOI: 10.1007/s00167-015-3548-1.
- (inar M., Derincek A., Akpinar S. Tibiocalcaneal arthrodesis with posterior blade plate in diabetic neuroarthropathy // Foot Ankle Int. 2010. Vol. 31, No 6. P. 511-516. DOI: 10.3113/FAI.2010.0511.
- Stapleton J.J., Zgonis T. Surgical reconstruction of the diabetic Charcot foot: internal, external or combined fixation? // Clin. Podiatr. Med. Surg. 2012. Vol. 29, No 3. P. 425-433. DOI: 10.1016/j.cpm.2012.04.003.
- Papa J., Myerson M., Girard P. Salvage, with arthrodesis, in intractable diabetic neuropathic arthropathy of the foot and ankle // J. Bone Joint Surg. Am. 1993. Vol. 75, No 7. P. 1056-1066. DOI: 10.2106/00004623-199307000-00012.
- Charcot arthropathy of the diabetic foot. Current concepts and review of 36 cases / T.K. Pakarinen, H.J. Laine, S.E. Honkonen, J. Peltonen, H. Oksala, J. Lahtela // Scand. J. Surg. 2002. Vol. 91, No 2. P. 195-201. DOI: 10.1177/145749690209100212.
- Stone N.C., Daniels T.R. Midfoot and hindfoot arthrodeses in diabetic Charcot arthropathy // Can. J. Surg. 2000. Vol. 43, No 6. P. 449-455.
- Pinzur M. Surgical versus accommodative treatment for Charcot arthropathy of the midfoot // Foot Ankle Int. 2004. Vol. 25, No 8. P. 545-549. DO I: 10.1177/107110070402500806.
- Garapati R., Weinfeld S.B. Complex reconstruction of the diabetic foot and ankle // Am. J. Surg. 2004. Vol. 187, No 5A. P. 81S-86S. DOI: 10.1016/ S0002-9610(03)00309-X.
- A protocol for treatment of unstable ankle fractures using transarticular fixation in patients with diabetes mellitus and loss of protective sensibility / M.M. Jani, W.M. Ricci, J. Borrelli Jr., S.E. Barrett, J.E. Johnson// FootAnkle Int. 2003. Vol. 24, No 11. P. 838-844. DOI: 10.1177/107110070302401106.
- Salvage of failed neuropathic ankle fractures: use of large-fragment fibular plating and multiple syndesmotic screws / M.D. Perry, W.S. Taranow, A. Manoli 2nd, J.B. Carr // J. Surg. Orthop. Adv. 2005. Vol. 14, No 2. P. 85-91.
- Cooper P.S. Application of external fixators for management of Charcot deformities of the foot and ankle // Foot Ankle Clin. 2002. Vol. 7, No 1. P. 207-254. DOI: 10.1016/s1083-7515(02)00019-0.
- Wang J.C. Use of external fixation in the reconstruction of the Charcot foot and ankle // Clin. Podiatr. Med. Surg. 2003. Vol. 20, No 1. P. 97-117. DOI: 10.1016/s0891-8422(02)00055-1.
- Fabrin J., Larsen K., Holstein P.E. Arthrodesis with external fixation in the unstable or misaligned Charcot ankle in patients with diabetes mellitus // Int. I. Low Extrem. Wounds. 2007. Vol. 6, No 2. P. 102-107. DOI: 10.1177/1534734607302379.
- Limb salvage in Charcot foot and ankle osteomyelitis: combined use single stage/double stage of arthrodesis and external fixation / L. Dalla Paola, E. Brocco, T. Ceccacci, S. Ninkovic, S. Sorgentone, M.G. Marinescu, A. Volpe // Foot Ankle Int. 2009. Vol. 30, No 11. P. 1065-1070. DOI: 10.3113/ FAI.2009.1065.
- Pinzur M.S. Neutral ring fixation for high-risk nonplantigrade Charcot midfoot deformity // Foot Ankle Int. 2007. Vol. 28, No 9. P. 961-966. DOI: 10.3113/FAI.2007.0961.
- Single stage correction with external fixation of the ulcerated foot in individuals with Charcot neuroarthropathy / D.C. Farber, P. J. Juliano, P.R. Cavanagh, J. Ulbrecht, G. Caputo // Foot Ankle Int. 2002. Vol. 23, No 2. P. 130-134. DOI: 10.1177/107110070202300209.
- Complications encountered with circular ring fixation in persons with diabetes mellitus / D.K. Wukich, R.J. Belczyk, P.R. Burns, RG. Frykberg // Foot Ankle Int. 2008. Vol. 29, No 10. P. 994-1000. DOI: 10.3113/FAI.2008.0994.
- Bevilacqua N.J., Rogers L.C. Surgical management of Charcot midfoot deformities // Clin. Podiatr. Med. Surg. 2008. Vol. 25, No 1. P. 81-94. DOI: 10.1016/j.cpm.2007.10.007.
- Predictors of postoperative complications of Ilizarov external ring fixators in the foot and ankle / L.C. Rogers, N.J. Bevilacqua, R.G. Frykberg, D.G. Armstrong // J Foot Ankle Surg. 2007. Vol. 46, No 5. P. 372-375. DOI: 10.1053/j.jfas.2007.06.004.
- Akkurt M.O., Demirkale I., Oznur A. Partial calcanectomy and Ilizarov external fixation may reduce amputation need in severe diabetic calcaneal ulcers // Diabet. Foot Ankle. 2017. Vol. 8, No 1. 1264699. DOI: 10.1080/2000625Х.2017.1264699.
- Ramanujam C.L., Zgonis T. An Overview of Internal and External Fixation Methods for the Diabetic Charcot Foot and Ankle // Clin. Podiatr. Med. Surg. 2017. Vol. 34, No 1. P. 25-31. DOI: 10.1016/j.cpm.2016.07.004.
- Kreulen C., Lian E., Giza E. Technique for Use of Trabecular Metal Spacers in Tibiotalocalcaneal Arthrodesis with Large Bony Defects // Foot Ankle Int. 2017. Vol. 38, No 1. P. 96-106. DOI: 10.1177/1071100716681743.
- Masquelet A.C. Muscle reconstruction in reconstructive surgery: soft tissue repair and long bone reconstruction // Langenbecks Arch. Surg. 2003. Vol. 388, No 5. P. 344-346. DOI: 10.1007/s00423-003-0379-1.
- Masquelet A.C. La Technique de la membrane induite. Montpellier: Sauramps Medica. 2020. 231 p.
- Reconstruction des os longs par membrane induite et autogreffe spongieuse / A.C. Masquelet, F. Fitoussi, T. Begue, G.P. Muller // Ann. Chir. Plast. Esthet. 2000. Vol. 45, No 3. P. 346-353.
- Комбинированное применение несвободной костной пластики по Илизарову и техники Masquelet при реабилитации пациентов с приобретенными костными дефектами и ложными суставами / Д.Ю. Борзунов, Д.С. Моховиков, С.Н. Колчин, Е.Н. Горбач // Гений ортопедии. 2020. Т. 26, № 4. С. 532-538. DOI 10.18019/1028-4427-2020-26-4-532-538.
- Masquelet A.C., Begue T. The concept of induced membrane for reconstruction of long bone defects // Orthop. Clin. North Am. 2010. Vol. 41, No 1. P. 27-37. DOI: 10.1016/j.ocl.2009.07.011.
- Mak M.F., Stern R., Assal M. Masquelet technique for midfoot reconstruction following osteomyelitis in Charcot diabetic neuropathy: a case report // JBJS Case Connect. 2015. Vol. 5, No 2. P. e28. DOI: 10.2106/JBJS.CC.N.00112.
- Nonvirally engineered porcine adipose tissue-derived stem cells: use in posterior spinal fusion / D. Sheyn, G. Pelled, Y. Zilberman, F. Talasazan, J.M. Frank, D. Gazit, Z. Gazit // Stem Cells. 2008. Vol. 26, No 4. P. 1056-1064. DOI: 10.1634/stemcells.2007-0858.
- Sanders L., Frykberg R. Diabetic neuropathic osteoarthropathy: The Charcot foot // The high risk foot in diabetes mellitus / Frykberg R.G., editor. Edinburgh: Churchill Livingston,1991. P. 325-333.
- Chantelau E.A., Grutzner G. Is the Eichenholtz classification still valid for the diabetic Charcot foot? // Swiss Med. Wkly. 2014. Vol. 144. P. w13948. DOI: 10.4414/smw.2014.13948.
- Алгоритмы специализированной медицинской помощи больным сахарным диабетом : клинические рекомендации, 9-й выпуск (дополненный) / под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова // Сахарный диабет. 2019. № 22 (S1) [Приложение]. 212 с.
- Eichenholtz S.N. Charcot joints. Springfield, IL, USA: Charles C. Thomas. 1966.
- Wagner F.W. Jr. The dysvascular foot: a system for diagnosis and treatment // Foot Ankle. 1981. Vol. 2, No 2. P. 64-122. DOI: 10.1177/107110078 100200202.
- The Society for Vascular Surgery Wound, Ischemia, and foot Infection (WIfI) classification system correlates with cost of care for diabetic foot ulcers treated in a multidisciplinary setting / C.W. Hicks, J.K. Canner, H. Karagozlu, N. Mathioudakis, R.L. Sherman, J.H. Black 3rd, C.J. Abularrage // J. Vasc. Surg. 2018. Vol. 67, No 5. P. 1455-1462. DOI: 10.1016/j.jvs.2017.08.090.
- Obolenskiy V.N., Protsko V.G, Komelyagina E.Y. Classification of diabetic foot (revisited article) // Wound Med. Elsevier GmbH. 2017. Vol. 18. P. 1-7.
- Комбинированные костнопластические вмешательства при реабилитации пациентов с врожденным ложным суставом костей голени / Д.Ю. Борзунов, Е.Н. Горбач, Д.С. Моховиков, С.Н. Колчин // Гений ортопедии. 2019. Т. 25, No 3. С. 304-311. DOI 10.18019/1028-4427-201925-3-304-311.
- Management of segmental defects by the Ilizarov intercalary bone transport method / S.A. Green, J.M. Jackson, D.M. Wall, H. Marinow, J. Ishkanian // Clin. Ortop. Relat. Res. 1992. No 280. P. 136-142.
- Does the induced membrane have antibacterial properties? An experimental rat model of a chronic infected nonunion / S. Roukoz, G. El Khoury, E. Saghbini, I. Saliba, A. Khazzaka, M. Rizkallah // Int. Orthop. 2020. Vol. 44, No 2. P. 391-398. DOI: 10.1007/s00264-019-04453-4.


