Метод интраоперационной чреспищеводной эхокардиографии при выполнении операции Озаки (клинический случай)
Автор: Сокольская Н.О., Иванов А.В., Копылова Н.С., Асатрян Т.В., Скопин И.И.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 2 т.37, 2022 года.
Бесплатный доступ
Современные методы визуализации, в том числе различные технологии эхокардиографии (ЭхоКГ), прочно вошли в практику кардиохирургии. Особое значение для обеспечения безопасности пациентов при выполнении открытых операций на сердце имеет метод интраоперационной чреспищеводной эхокардиографии (ЧП ЭхоКГ), который необходим при выполнении реконструктивных вмешательств на клапанном аппарате сердца у пациентов с исходной дисфункцией миокарда для оценки анатомо-функционального состояния сердца и его структур на всех этапах оперативного лечения. Информация, получаемая в операционной с помощью ЧП ЭхоКГ, позволяет хирургу выбрать оптимальную тактику хирургического вмешательства, оценить результаты операции и прогнозировать характер течения раннего послеоперационного периода. В представленном клиническом случае показаны возможности интраоперационного применения ЧП ЭхоКГ при выполнении операции Озаки у пациента с врожденным двухстворчатым аортальным клапаном (АК).
Эхокардиография, интраоперационная чреспищеводная эхокардиография, аортальный клапан, операция озаки
Короткий адрес: https://sciup.org/149140493
IDR: 149140493 | УДК: 616.126.52-089.844:616.329-073.43-8 | DOI: 10.29001/2073-8552-2022-37-2-134-139
Текст научной статьи Метод интраоперационной чреспищеводной эхокардиографии при выполнении операции Озаки (клинический случай)
УДК616.126.52-089.844:616.329-073.43-8
Интраоперационная чреспищеводная эхокардиография (ЧП ЭхоКГ) в настоящее время входит в комплекс мер по обеспечению безопасности выполнения кардиохирургических операций и относится к IB классу. Согласно рекомендациям Американского общества эхокардиографии, которые были опубликованы в 2020 г., ЧП ЭхоКГ в условиях операционной является стандартным инструментом диагностики и мониторинга [1–4].
Данный клинический случай демонстрирует значимость интраоперационной ЧП ЭхоКГ при выполнении операции Озаки у пациента с врожденным двухстворчатым аортальным клапаном (АК) и тяжелым стенозом.
Золотым стандартом лечения патологии АК различного генеза является его протезирование. Прогресс в области кардиохирургии позволил минимизировать риск хирургического лечения пациентов с пороками АК, летальность после протезирования, по данным мировой литературы, колеблется от 0,3 до 4% [5–9].
К инновационным технологиям в хирургии порока АК следует отнести операцию, которую предложил в 2011 г. японский хирург Shigeyuki Ozaki. Операция заключается в протезировании АК неостворками из аутоперикарда [10–13].
Описание случая
Больной Ш., 63 года, 29.09.2020 г. поступил в отделение реконструктивной хирургии клапанов сердца и коронарных артерий Института коронарной и сосудистой хирургии Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева» Министерства здравоохранения Российской Федерации (директор Центра академик РАН Е.З. Голухова, директор Института коронарной и сосудистой хирургии и руководитель отделения – профессор И.И. Скопин).
При поступлении пациент предъявлял жалобы на одышку при умеренной физической нагрузке (подъем по лестнице более трех этажей), сжимающие боли в левой половине грудной клетки вне связи с физической нагрузкой, учащенное сердцебиение в покое и при физической нагрузке, перебои в работе сердца, купирующиеся самостоятельно, головокружение, слабость, утомляемость, повышение артериального давления (АД) максимально до 180/100 мм рт. ст.
Из анамнеза известно, что в течение 2019 г. пациент стал отмечать повышение АД (максимально до
180/100 мм рт. ст., адаптирован к АД 130/80 мм рт. ст.), ранее АД не контролировал. Появились вышеперечисленные жалобы. Резкое ухудшение состояния с июля 2020 г., когда стали беспокоить учащенное сердцебиение и перебои в работе сердца.
Обследовался по месту жительства, где на основании данных клинических и инструментальных исследований был поставлен диагноз: двустворчатый АК, кальцинированный аортальный порок: тяжелый стеноз. Относительная недостаточность трехстворчатого клапана. Пароксизмальная форма фибрилляции предсердий.
29.09.2020 г. поступил в ФГБУ «НМИЦ ССХ им. А. Н. Бакулева» Минздрава России для решения вопроса о хирургическом лечении в условиях искусственного кровообращения.
При осмотре: общее состояние средней тяжести, обусловлено основным заболеванием. Сознание ясное. Гиперстеническое телосложение. Рост – 168 см, вес – 89 кг. Площадь поверхности тела 2,05 м².
Сердечно-сосудистая система. Тоны сердца приглушены, ритмичные. Шумы сердца: грубый систолический шум над всей областью сердца, максимально на аорте. АД: на левой руке – 150/90 мм рт. ст., на правой – 145/90 мм рт. ст. Пульс ритмичный, удовлетворительного наполнения – 58 уд./мин.
Данные инструментальных обследований
ЭКГ: ритм синусовый, частота сердечных сокращений (ЧСС) – 80 уд./мин, положение электрической оси сердца (ЭОС) нормальное, признаки гипертрофии левого желудочка (ЛЖ).
Трансторакальная эхокардиография
Левый желудочек: конечно-диастолический объем (КДО) – 88 мл, конечно-систолический объем (КСО) – 35 мл, ударный объем (УО) – 53 мл,
Фракция выброса (ФВ) – 66%. Конечно-диастолический индекс (КДИ) – 43 мл/м², конечно-систолический индекс (КСИ) – 17 мл/м², ударный индекс (УИ) – 26 мл/м², минутный объем (МО) – 4 л/мин, сердечный индекс (СИ) – 1,9 л/мин/м². Кинетика миокарда ЛЖ не нарушена.
Митральный клапан: фиброзное кольцо (ФК) – 34 мм, фиброз створок, градиент давления: пиковый 4 мм рт. ст., средний 1 мм рт. ст., регургитация незначительная.
Левое предсердие: 43 × 50 мм.
Аорта: восходящая 37 мм.
Аортальный клапан: двухстворчатый, ФК 22 мм, краевой фиброз створок, градиент давления: пиковый 78 мм рт. ст., S эффективного отверстия – 0,8 см², регургитация 1 (+).
Правое предсердие: 42 × 50 мм.
Правый желудочек: конечно-диастолический размер (КДР) – 38 мм.
Трикуспидальный клапан: ФК – 37 мм, створки подвижные, градиент давления: пиковый 3 мм рт. ст., регургитация незначительная.
Межжелудочковая перегородка: толщина 15 мм.
Толщина задней стенки ЛЖ 13 мм.
Заключение: Врожденный порок сердца: двустворчатый аортальный клапан. Кальцинированный аортальный порок: тяжелый стеноз и недостаточность 1-й степени. Сократительная способность миокарда ЛЖ сохранена (ФВ 66%).
Данные ангиокоронарографии
Гемодинамически значимых стенозов не выявлено. Клинико-биохимические показатели крови Показатели в пределах нормы.
На основании данных клинических и инструментальных методов обследования поставлен диагноз: кальцинированный аортальный порок: тяжелый стеноз. Относительная недостаточность трехстворчатого клапана. Пароксизмальная форма фибрилляции предсердий. Гипертоническая болезнь 3 степени, риск ССО – 4. Атеросклероз брахиоцефальных артерий. НК 2А. ФК 3.
Рекомендовано хирургическое лечение.
30.09.2020 г. выполнена операция: неокуспидализа-ция АК по методике Ozaki, пластика трикуспидального клапана по de Vega в условиях искусственного кровообращения, гипотермии (28 ºС) и фармакохолодовой кардиоплегии. Время искусственного кровообращения – 202 мин, пережатия аорты – 156 мин.
Анестезиологическое пособие выполнялось по принятому в Центре протоколу.
Протокол операции: Срединная стернотомия. Вскрыта правая плевральная полость. Произведен забор перикарда. Перикард обработан в растворе глутарового альдегида. Канюляция аорты. Раздельная канюляция полых вен. Начато искусственное кровообращение с гипотермией до 28 °С. Дренаж левых отделов через правую верхнюю легочную вену. Затянуты турникеты на полых венах. Охлаждение. Поперечно пережата и вскрыта аорта. Вскрыто правое предсердие. Кардиоплегия раствором Кустодиола. Ревизия АК – клапан 2створчатый, общая коронарная створка, комиссура между ними спаяна, но четко определяется, створки фиброзированы, спаяны по комиссурам, кальциноз 3-й ст. Клапан иссечен. Из аутоперикарда выкроены 3 неостворки (31 размер – правая, 31 размер – левая коронарная створка, 29 – некоронарная створка, согласно лекалам Ozaki. Сформирован неоклапан по технике Ozaki (рис. 1, 2). Стандартное завершение операции.
Восстановление сердечной деятельности самостоятельное, ритм синусовый с ЧСС 62 уд./мин.
После выполнения основного этапа операции и стабилизации гемодинамики (АД – 85/50 мм рт. ст., ЧСС – 100 уд./мин, ритм синусовый) на параллельной перфузии для оценки функции неоклапана и внутрисердечной гемодинамики выполнена ЧП ЭхоКГ. Исследование проводилось на ультразвуковом аппарате фирмы Philips CX 50 с использованием чреспищеводного датчика X7-2t.
Данные интраоперационной ЧП ЭхоКГ.
Левый желудочек: КДО – 60 мл, КСО – 23 мл, УО – 37 мл, МО – 3,7 л/мин, ФВ – 62%, КДИ – 29 мл/м², КСИ – 11 мл/м², УИ – 18 мл/м². СИ – 1,8 л/мин/м².
Левое предсердие: 38 мм.
Правый желудочек КДР ПЖ – 43 мм, кинетика сохранена.
Правое предсердие: 42 мм.
АК: протез представлен неостворками. Градиент давления: пиковый 9,8 мм рт. ст., S эффективного отверстия – 3 см², регургитация незначительная.
Заключение: Функция протеза АК удовлетворительная. Низкие объемные характеристики ЛЖ. Признаки гиповолемии. Насосная функция миокарда ЛЖ и правого желудочка (ПЖ) сохранена (рис. 3, 4).
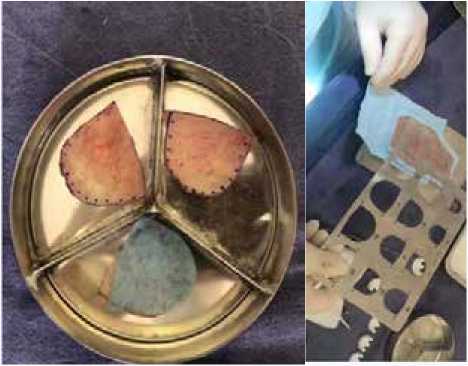
Рис. 1. Выкраивание с помощью специального шаблона неостворок аортального клапана из аутоперикарда
Fig. 1. Cutting out the aortic valve neocusps from autopericardium using a special template
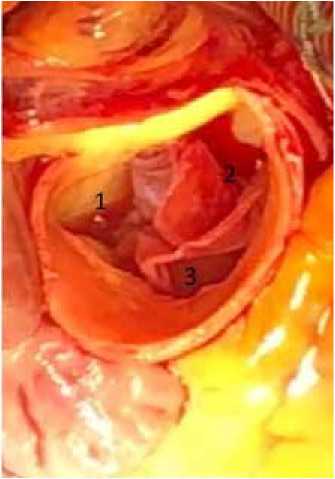
Рис. 2. Интраоперационное фото: вид неоклапана
Примечание: 1 – левая коронарная створка, 2 – правая коронарная створка, 3 – некоронарная створка.
Fig. 2. Intraoperative photo showing neovalve
Note: 1 – left coronary cusp, 2 – right coronary cusp, 3 – non-coronary cusp.
Проведен необходимый стандартный комплекс мероприятий, направленный на коррекцию гемодинамических расстройств.
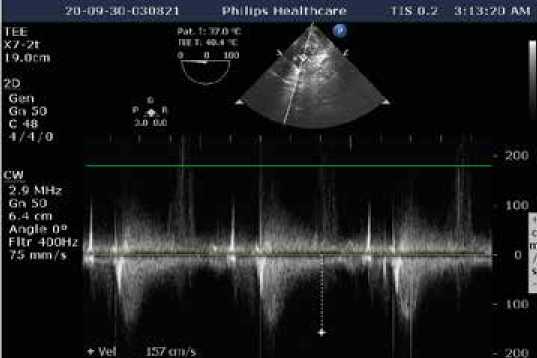
Рис. 3. Интраоперационная чреспищеводня эхокардиография. Трансгастральный доступ по длинной оси левого желудочка. Пиковый градиент давления на аортальном неоклапане 9,8 мм рт. ст.
Fig. 3. Intraoperative transesophageal echocardiography. Transgastric access along the long axis of the left ventricle. The peak pressure gradient across the aortic neovalve was 9.8 mmHg
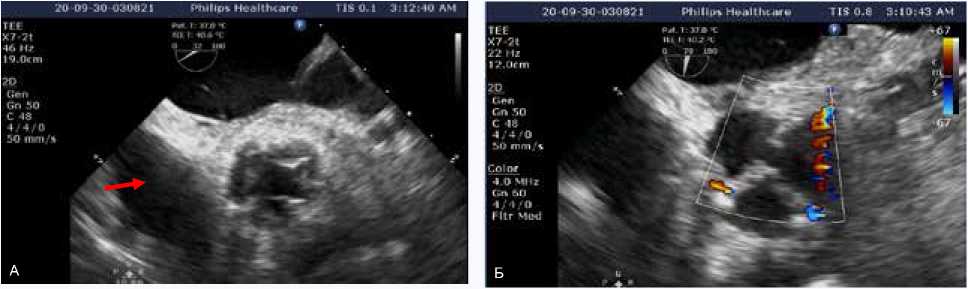
Рис. 4. Интраоперационная чреспищеводная эхокардиография. Среднепищеводный доступ по короткой оси аортального клапана:
А – открытие неостворок в систолу; Б – аортальный неоклапан в режиме цветового допплеровского картирования в диастолу отсутствие регургитации
Fig. 4. Intraoperative transesophageal echocardiography. Mid-esophageal aortic valve short axis view:
A – Opening of neocusps during systole; Б – Aortic neovalve in color Doppler mapping mode without any regurgitation during diastole
Данные повторного ЧП ЭхоКГ исследования.
Левый желудочек: КДО – 86 мл, КСО – 36 мл, УО – 50 мл, МО – 4,0 л/мин, ФВ – 58%, КДИ – 42 мл/м², КСИ – 18 мл/м², УИ – 24 мл/м², СИ – 1,9 л/мин/м². Остальные показатели – без отрицательной динамики.
Заключение: Нормализация объемных показателей ЛЖ.
Ранний послеоперационный период протекал без осложнений.
На 10-е сут после операции пациент в удовлетворительном состоянии выписан.
Обсуждение
Согласно клиническим рекомендациям, при выполнении реконструктивных вмешательств на клапанах сердца обязательным условием является использование интраоперационной ЧП ЭхоКГ. Методика позволяет оценить функцию клапана после его реконструкции, своевременно диагностировать несостоятельность выполненного вмешательства, определить этиологию и патогенез гемодинамических расстройств.
В представленном клиническом случае показаны возможности мониторинга внутрисердечной гемодина- мики и контроля адекватности выполненной операции с помощью интраоперационной ЧП ЭхоКГ у пациента с врожденной патологией АК при выполнении операции Озаки. У пациента после успешной реконструкции АК выявлены низкие объемные показатели ЛЖ, что является ЭхоКГ критерием диагностики гиповолемии. Такие параметры ЭхоКГ в литературе образно относят к гемодинамическому профилю колибри и указывают на то, что сердце пациента недостаточно наполнено, соответственно, это приводит к низкому УО и СИ [14].
Основной компенсаторный механизм в данной ситуации – увеличение ЧСС. Вовремя не скорректированное сочетание низкого УО и тахикардии является предиктором развития миокардиального стресса, острой сердечной и полиорганной недостаточности. На основании полученных данных своевременно проведена патогенетически обоснованная интенсивная терапия, направленная на восполнение объема. На заключительном этапе мониторинга и оценки результата хирургического лечения получены показатели, характеризующие восстановление анатомо-функционального состояния ЛЖ.
Заключение
Интраоперационная ЧП ЭхоКГ является основным методом визуализации при выполнении кардиохирургических операций. Метод позволяет проводить оценку внутрисердечной гемодинамики, анатомо-функционального состояния миокарда и структур сердца после выпол- ненного хирургического вмешательства. На основании данных интраоперационной ЧП ЭхоКГ определяется результат операции, дается прогноз в отношении характера течения раннего послеоперационного периода, проводится мониторинг эффективности проводимой интенсивной терапии, направленной на коррекцию гемодинамических расстройств.
Список литературы Метод интраоперационной чреспищеводной эхокардиографии при выполнении операции Озаки (клинический случай)
- Nicoara A., Skubas N., Ad N., Finley A., Hahn R.T., Mahmood F. et al. Guidelines for the use of transesophageal echocardiography to assist with surgical decision-making in the operating room: A Surgery-based approach: From the American Society of Echocardiography in Collaboration with the Society of Cardiovascular Anesthesiologists and the Society of Thoracic Surgeons. J. Am. Soc. Echocardiogr. 2020;33(6):692-734. https://doi.org/10.1016/j.echo.2020.03.002.
- Otto C.M., Nishimura R.A., Bonow R.O., Carabello B.A., Erwin J.P. 3rd, Gentile F. et al. 2020 ACC/AHA guideline for the management of patients with valvular heart disease: A report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2021;143(5):e72-e227. https://doi.org/10.1161/CIR.0000000000000923.
- Скопин И.И., Сокольская Н.О., Копылова Н.С., Иванов А.В. Интраоперационная чреспищеводная эхокардиография в диагностике инфекционного эндокардита. Грудная и сердечно-сосудистая хирургия. 2019;61(1):61-67. https://doi.org/10.24022/0236-2791-2019-61-1-61-67.
- Бокерия Л.А., Алшибая М.М., Мерзляков В.Ю., Сокольская Н.О., Копылова Н.С., Скрипник Е.В. Интраоперационная чреспищеводная эхокардиография у больных с различными формами ишемической болезни сердца. Клиническая физиология кровообращения. 2016;13(3):139-147.
- Kim H.J., Kim J.B., Kim H.R., Ju M.H., Kang D.Y., Lee S.A. et al. Impact of valve replacement on long-term survival in asymptomatic patients with severe aortic stenosis. Am. J. Cardiol. 2019;123(8):1321-1328. https://doi.org/10.1016/j.amjcard.2019.01.035.
- Koerber J.P., Bennetts J.S., Psaltis P.J. Early valve replacement for severe aortic valve disease: Effect on mortality and clinical ramifications. J. Clin. Med. 2020;9(9):2694. https://doi.org/10.3390/jcm9092694.
- Муратов Р.М., Бабенко С.И., Мидинов А.Ш., Титов Д.А., Салохиддинов М.А. Непосредственные результаты протезирования аортального клапана из мини-стернотомии у пациентов старше 70 лет. Бюллетень НЦССХ им. А.Н. Бакулева РАМН. 2021;22(2):282-288. https://doi.org/10.24022/1810-0694-2021-22-2-282-288.
- Скопин И.И., Отаров А.М., Кахкцян П.В., Асатрян Т.В., Курбанов Ш.М., Паронян Х.В. Протезирование аортального клапана у больных пожилого и старческого возраста: анализ предоперационных факторов риска. Комплексные проблемы сердечно-сосудистых заболеваний. 2018;7(4S):24-35. https://doi.org/10.17802/2306-1278- 2018-7-4S-24-35.
- Чернов И.И., Энгиноев С.Т., Комаров Р.Н., Базылев В.В., Тарасов Д.Г., Кадыралиев К.Б. и др. Непосредственные результаты операции Ozaki: многоцентровое исследование. Российский кардиологический журнал. 2020;25(4S):4157. https://doi.org/10.15829/1560-4071-2020-4157.
- Duran C., Gometza B., Kumar N., Gallo R., Bjornstad K. From aortic cusp extension to valve replacement with stentless pericardium. Ann. Thorac. Surg. 1995;60(2):S428-S432. https://doi.org/10.1016/0003-4975(95)00200-5.
- Ozaki S., Kawase I., Yamashita H., Uchida S., Takatoh M., Hagiwara S. et al. Aortic valve reconstruction using autologous pericardium for aortic stenosis. Circ. J. 2015;79(7):1504-1510. https://doi.org/10.1253/circj.cj-14-1092.
- Song M.G., Yang H.S., Choi J.B., Shin J.K., Chee H.K., Kim J.S. et al. Aortic valve reconstruction with use of pericardial leaflets in adults with bicuspid aortic valve disease: early and midterm outcomes. Tex. Heart Inst. J. 2014;41(6):585-591. https://doi.org/10.14503/thij-13-3619.
- Ozaki S., Kawase I., Yamashita H., Uchida S., Nozawa Y., Matsuyama T. et al. Aortic valve reconstruction using self-developed aortic valve plasty system in aortic valve disease. Interact. Cardiovasc. Thorac. Surg. 2011;12(4):550-553. https://doi.org/10.1510/icvts.2010.253682.
- Patel A.R., Patel A.R., Singh S., Singh S., Khawaja I. Cardiac Ultrasound in the Intensive Care Unit: A Review. Cureus. 2019;11(5):e4612. https://doi.org/10.7759/cureus.4612.


