Метод оценки антигликирующей активности in vitro новых веществ
Автор: Кузнецова В.А., Соловьева О.А., Мацевич А.И., Спасов А.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Новые методы в эксперименте и клинике
Статья в выпуске: 3 (43), 2014 года.
Бесплатный доступ
В ходе исследования была воспроизведена реакция гликирования in vitro. Известный ингибитор неферментативного гликозилирования аминогуанидин проявил дозозависимое антигликирующее действие. По результатам эксперимента показано, что данная модель может быть использована для поиска новых ингибиторов реакции Майяра.
Антигликирующая активность, аминогуанидин, сахарный диабет
Короткий адрес: https://sciup.org/142149121
IDR: 142149121 | УДК: 615.015:547.77
Текст научной статьи Метод оценки антигликирующей активности in vitro новых веществ
Неферментативная реакция между свободными аминогруппами белков и карбонильными группами восстановленных сахаров и других карбонильных соединений известна как реакция Майяра, названная так в честь Louis-Camille Maillard, который в 1912 г. первым обнаружил и описал коричнево-окрашенные конечные продукты реакции глюкозы с аминогруппой глицина [6]. Данная реакция протекает в несколько этапов. На ранней стадии глюкоза (или другие восстановленные сахара) реагирует со свободной аминогруппой биологических аминов с образованием нестабильного соединения, основания Шиффа, которое подвергается перегруппировке до более стабильного вещества известного как продукт Амадори. В поздней стадии гликирования необратимые соединения, называемые конечными продуктами усиленного гликозилирования (КПГ), формируются за счет реакций окисления, дегидратации и циклизации [12].
Процесс гликирования, усиливающийся при гипергликемии, лежит в основе патогенеза микро-и макрососудистых осложнений сахарного диабета (СД) [1]. КПГ влияют на коллаген типа IV, миелин, тубулин, активатор плазминогена-1, фибриноген. Рецептор-зависимые эффекты КПГ опосредованы их взаимодействием со специфическими рецепторами, что приводит к активации ядерного фактора NF-κB, который перемещается в ядро и приводит к повышению транскрипции молекул межклеточной адгезии-1, E-селектина, эндотелина-1, сосудистого эндотелиального фактора роста, провоспалительных цитокинов [4].
Первым и наиболее изученным веществом, ингибирующим гликирование белков, является аминогуанидин, который предотвращает формирование КПГ [9]. Однако клинические испытания данного препарата были остановлены в связи с его недостаточной эффективностью и наличием побочных эффектов (гастроинтестинальные симптомы, волчаночно-подобный, гриппоподобный синдромы, васкулит [3], анемия [2]). Антигликирующая активность выявлена у пиридок-самина, гидразиновых производных тиазолидина [9] и карбоксимидамида [13], имеющие структурное сходство с аминогуанидином, производные феноксиизомасляной кислоты [11]. Все вышеперечисленное обусловливает актуальность поиска веществ, предотвращающих образование КПГ, с целью создания лекарственных препаратов для патогенетической профилактики осложнений СД.
В настоящее время существует большое количество разнообразных методов моделирования реакции Майяра in vitro . Например, методические подходы, связанные с определением конечных продуктов гликирования, образовавшихся в результате реакции между модельным белком (бычий сывороточный альбумин, человеческий сывороточный альбумин) и сахарами (глюкоза, фруктоза, рибоза) или дикарбонильными веществами (глиоксаль, метилглиоксаль) [10, 7], часто используют для поиска новых ингибиторов неферментативного гликозилирования. Наиболее часто для регистрации КПГ в реакционной смеси используют метод определения специфической флуоресценции гликированных белков при длине волны возбуждения/испускания 370/440 нм [8].
* Работа была выполнена за счет средств гранта Российского научного фонда (проект №14-25-00139).
ЦЕЛЬ РАБОТЫ
Воспроизвести реакцию Майяра in vitro для оценки антигликирующей активности новых соединений.
МЕТОДИКА ИССЛЕДОВАНИЯ
Реакцию гликирования воспроизводили по методу [5]. Конечный объем реакционной смеси составлял 1,5 мл. Реакционная смесь содержала растворы бычьего сывороточного альбумина (1 мг/мл) и глюкозы (500 мМ) в фосфатном буфере (pH 7,4).
Для оценки адекватности воспроизведения метода использовали аминогуанидин, раствор которого добавляли в экспериментальные образцы в различных концентрациях в объеме 50 мкл. В контрольные пробы добавляли фосфатный буфер в аналогичном объеме. Для предупреждения бактериального роста в буферный раствор вносили азид натрия в конечной концентрации 0,02 %. Все экспериментальные образцы инкубировали в течение 24 часов при 60 °С.
По истечении срока инкубации проводили определение специфической флуоресценции гликированного бычьего сывороточного альбумина на спектрофлуориметре MPF-400 (Hitachi,
Япония) при длине волны возбуждения 370 нм и испускания 440 нм.
Обработку полученных данных проводили с использованием табличного редактора Microsoft Excel 2007 и непараметрических методов статистики в программе GraphPad Prism (версия 5.0).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Формирование КПГ подтверждается наличием характерного пика флуоресценции контрольных образцов при длинах волн возбужде-ния/испускания 370/440 нм. В ходе проведенных исследований была подтверждена антигликирующая активность аминогуанидина, которая носила дозозависимый характер (см. рис.). Было показано, что аминогуанидин снижал гликирование БСА в концентрации 1 мМ; 0,5 мМ и 0,1 мМ на 70, 54 и 7 % соответственно. На основании полученных данных, был рассчитан показатель IC 50 , который составил 459 мкМ.
ЗАКЛЮЧЕНИЕ
Таким образом, воспроизведенная модель является адекватной и может служить для оценки антигликирующей активности соединений и поиска новых ингибиторов реакции Майяра.
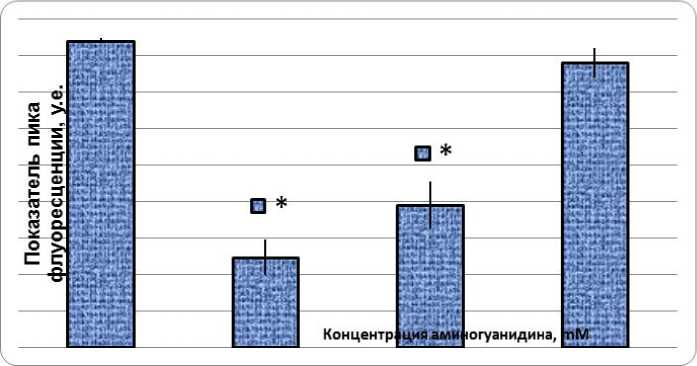
Рис. Антигликирующая активность аминогуанидина:
* – данные достоверны по отношению к контролю (р < 0,01), U-критерий Манна–Уитни
Список литературы Метод оценки антигликирующей активности in vitro новых веществ
- Шестакова М. В., Шамхалова М. Ш., Ярек-Мартынова И. Я. и др.//Сахарный диабет. -2011. -№1. -С. 81-88.
- Bolton W. K., Cattran D. C., Williams M. E., et al.//Am. J. Nephrol. -2004. -Vol. 24. -P. 32-40.
- Freedman B. I., Wuerth J.-P., Cartwright K., et al.//Control. Clin. Trials -1999. -Vol. 20 (5). -P. 493-510.
- Goh S.-Y., Cooper M. E.//J. Clin. Endocrinol. Metab. -2008. -Vol. 93 (4). -P. 1143-1152.
- Jedsadayanmata A.//Naresuan University Journal. -2005. -Vol. 13 (2). -P. 35-41.
- John W. G., Lamb E. J.//Eye. -1996. -Vol. 7. -P. 230-237.
- Luers L., Rysiewski K., Dumpitak C., et al.//Rejuvenation Research. -2012. -Vol. 15 (2). -P. 201-205.
- Matsuura N., Aradate T., Sasaki C., et al.//J. Health. Sci. -2002. -Vol. 48. -P. 520-526.
- Peyroux J., Sternberg M.//Pathologie Biologie. -2006. -Vol. 54. -P. 405-419.
- Rahbar S., Yerneni K. K., Scott S., et al.//Mol. Cell. Biol. Res. Commun. -2000. -Vol. 3. -P. 360-366.
- Rahbar S., Figarola J. L.//Archives of Biochemistry and Biophysic. -2003. -Vol. 419 (1). -P. 63-79.
- Singh V. P., Bali A., Singh N., et al.//Korean J. Physiol. Pharmacol. -2014. -Vol. 18. -P. 1-14.
- Wilkinson-Berka J. L., Kelly D. J., Koerner S. M., et al.//Diabetes. -2002. -Vol. 51. -P. 3283-3289.


