Метод определения электропроводности растворов кислот и оснований
Автор: Балданова Д.М., Танганов Б.Б.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 4 (43), 2013 года.
Бесплатный доступ
В рамках плазменно-гидродинамической теории растворов электролитов предложена теоретическая модель оценки электропроводности кислот и оснований, учитывающая радиусы гидратированных ионов. Полученные результаты хорошо коррелируют с экспериментальными данными.
Электропроводность, радиус, гидратированные ионы, кислоты, основания
Короткий адрес: https://sciup.org/142142722
IDR: 142142722 | УДК: 544.35.03:537.311
Текст научной статьи Метод определения электропроводности растворов кислот и оснований
Исследование электропроводности имеет большое значение при изучении процессов сольватации и транспортных свойств ионов в растворах электролитов. Особенно интересными являются растворы кислот и оснований, так как ионы гидроксония и гидроксила движутся по эстафетному механизму, а механизм движения противоионов неэстафетный:
H 3 O + + H 2 O о H 2 O + H 3 O + . (1)
OH - + H 2 O о H 2 O + OH - . (2)
В процессе (1) ионы H 3 O + группируют 4 молекулы воды [1]. При этом отрицательные заряды диполей воды направлены к H 3 O + , что облегчает туннельный переход протона H + в H 3 O + к молекулам воды и далее.
В случае процесса (2) ионы OH - ориентируют 2 молекулы H 2 O положительными зарядами диполей. Тогда за счет туннельного эффекта ионы H + из H 2 O переходят к иону OH - .
Эти процессы и объясняют аномально высокую электропроводность растворов кислот и оснований.
Метод определения электропроводности растворов кислот и оснований
На кафедре «Неорганическая и аналитическая химия» ВСГУТУ разработана плазменно-гидродинамическая концепция состояния ионов в растворах электролитов. В рамках данной теории получено уравнение для теоретических оценок электропроводности водных растворов электролитов [2]:
NAe 2 exp( — — ) • 1,11 • 10 —12
A Э 7 T7 ’ 7 17
Л =___________ k B ___________, Ом - см моль - .
6nnRs (1 + R s -)
rD
Для кислот и оснований остается неформализованной величина Rs . Обзор литературы показал, что значения радиусов гидратированных ионов H 3 O + и OH — вообще отсутствуют. Приемлемых методов теоретических оценок этих величин, соответствующих данным Стокса, нет.
Эффективные радиусы этих гидратированных ионов формализуются известной задачей механики [3] о системе, состоящей из одной частицы с массой M и n частиц с одинаковыми массами m .
Если исключить движение центра инерции, то проблема сводится к задаче движения n частиц с M - массой ионов H 3 O + или OH — ; m - массой молекул воды; n s - гидратным числом.
^
Рассматривается гидратный комплекс, в котором R - радиус-вектор H 3 O + или
OH ; R a a = (1,2,3,..., n ) - радиус вектор
комплексе. Расстояние от H 3 O + или OH
гидратированных молекул воды в гидратном до молекул в этом комплексе обеспечивается
выражением:
^ ^
r a = R a
^
— R ,
а начало координат в центре инерции формализуется равенством:
^
^
M • R + m У R a = 0.
a
Очевидно, введение в уравнение (5) значения Ra из [4] дает безразмерное равенство в оригинальной постановке задачи
R
m
У ra M + n s • m
a
— ■
.
Гидратированные ионы имеют центрально-симметричное распределение вещества и заряда, и при их движении под действием внешнего поля меняется система отсчета. Тогда возможно умножение левой и правой частей уравнения (6) на величину R a • M . Далее в левую часть уравнения (6) вводится значение ra из выражения (4), что приводит к следующему уравнению:
^ ^
^
У Г =У1 Ra — R | = n • Ra as
^
— R .
a
a
В этом случае
^ ^
R • R a
^ n s • R a
—
M • m ^ — • M =-- R a .
r M + ns • m
Наглядная трансформация векторных величин к их скалярам в виде модулей можна в виде
^ ^ ^ ^ ^ ^
R • R a • M =-- ( nsR a • R a — R • R a ).
M + ns • m
^ ^ о ^ ^
Угол между векторами Ra и Ra равен a = 180 , а между векторами R и Ra — воз-
a
00. Тогда, согласно правилам векторного анализа, скалярное произведение двух векторов равно произведению их модулей на cos а (где a - угол между направлениями этих век-
→→ →→ торов). Поэтому R⋅ Ra = -R ⋅ Ra, так как cos1800 = -1 и R⋅Ra=R⋅R ввиду того, что cos00 = 1.
Приведенные факты дают основание следующему представлению
R ⋅ R a = M ⋅ m ⋅ R a . (8)
R + ns ⋅ Ra M + ns ⋅ m M
Таким образом, приведенная симметричная форма выражения (8) в скалярных ар-
M⋅m гументах с учетом приведенной массы системы, равной , показывает, что
M + ns ⋅ m
R⋅R a = r есть эффективный приведенный радиус системы. R+ns ⋅Ra
8 см [5],
Радиус молекулы воды в жидком состоянии при 298 K равен R = 1,15 ⋅ 10
радиус R + =1,35 ⋅ 10 - 8 см и радиус R H 3 O OH
- 8 H O +
=1,53 ⋅ 10 8 см [4]. Далее гидратное число nsH 3 O = 4
[1] и nsOH - = 2,2 из уравнения (8) при ri =1,53 ⋅ 10 - 8
При этих значениях R , Ra и ns эффективные радиусы ионов H 3 O + и OH - равны:
R s ( H 3 O + )
1,35 ⋅ 10 - 8 ⋅ 1,15 ⋅ 10 - 8
1,34 ⋅ 10 - 8 + 4 ⋅ 1,15 ⋅ 10 - 8
= 0,261 ⋅ 10 - 8
см,
R s ( OH ) =
1,53 ⋅ 10 - 8 ⋅ 1,53 ⋅ 10 - 8
1,53 ⋅ 10 - 8 + 2,2 ⋅ 1,15 ⋅ 10 - 8
= 0,43 ⋅ 10 - 8
см.
Результаты исследования
Полученные значения радиусов гидратированных ионов H 3 O + и OH - могут быть использованы при оценке электропроводности водных растворов кислот и оснований. Результаты теоретических оценок эквивалентных электрических проводимостей растворов электролитов в рамках плазменно-гидродинамической модели по уравнению (3) приведены в таблицах 1, 2 и на рисунках 1, 2. Литературные значения Λ лит взяты из [6].
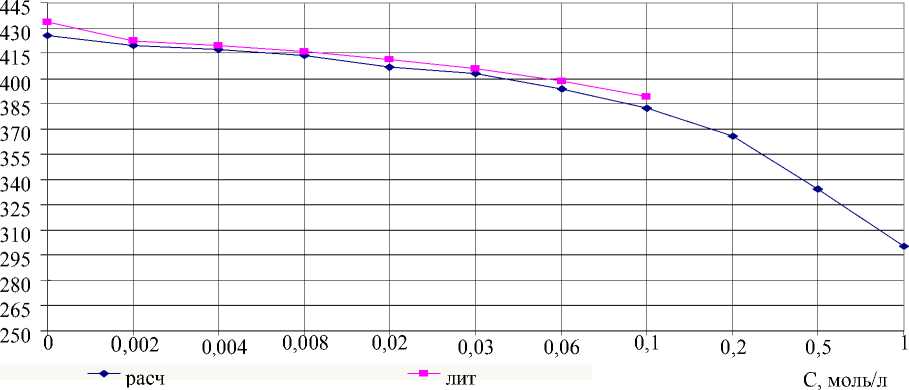
Рис. 1. Графическая зависимость электропроводности Λ водного раствора HBr от концентрации при 298K
Λ, Ом-1∙см2∙моль-1
|
•--------------< |
.—__: |
1---— |
|||||||||||
|
^------■ |
|||||||||||||
|
- |
|||||||||||||
0,5 1
0,001 0,002 0,005 0,01 0,02 0,03 0,05 0,1 0,2 0,3
расч
—■— лит
С, моль/л
Рис. 2. Графическая зависимость электропроводности Λ водного раствора KOH от концентрации при 291К
Таблица 1
Концентрационная зависимость эквивалентной электропроводности ( Λ , Ом - 1 ⋅ см2 ⋅ моль - 1) HCl при 291K
µ = 9,24; rs Kt = 0,26 ⋅ 10 - 8см; rs An = 1,34 ⋅ 10 - 8см; rs прив = 0,22 ⋅ 10 - 8см
|
C, моль/л |
0 |
0,001 |
0,01 |
0,1 |
5 |
10 |
|
Х = ( z kt z an ⋅ С / µ )1/2 |
0,000 |
0,010 |
0,033 |
0,104 |
0,736 |
1,040 |
|
exp( - 0,84 ⋅ X ) |
1,000 |
0,991 |
0,973 |
0,916 |
0,539 |
0,418 |
|
rD = 0,02814( ε T / C )1/2 |
∞ |
48,50 |
15,34 |
48,50 |
6,85 |
4,85 |
|
Λ теор |
372 |
367 |
361 |
340 |
146 |
91 |
|
Λ лит |
378 |
377 |
370 |
351 |
150 |
66 |
Таблица 2
Концентрационная зависимость эквивалентной электропроводности (Λ , Ом - 1 ⋅ см2 ⋅ моль - 1) NaOH при 291K
µ = 9,75; r s Kt = 1,75 ⋅ 10 - 8 см; r s An =0,43 ⋅ 10 - 8см; r s прив = 0,345 ⋅ 10 - 8см
|
C , моль/л |
0 |
0,001 |
0,01 |
0,1 |
10 |
|
Х = ( z kt z an ⋅ С / µ )1/2 |
0,000 |
0,010 |
0,32 |
0,319 |
1,011 |
|
exp( - 0,82 ⋅ X ) |
1,000 |
0,992 |
0,973 |
0,764 |
0,427 |
|
rD = 0,02814 ⋅ ( ε T / С )1/2 |
∞ |
136,5 |
43,16 |
4,315 |
1,3647 |
|
Λ теор |
226 |
223 |
216 |
159 |
18,000 |
|
Λ лит |
220 |
208 |
200 |
160 |
20,0 |
Заключение
Таким образом, полученные значения электропроводности кислот и оснований на основе плазменно-гидродинамической модели состояния ионов в растворах электролитов, учитывающие теоретически оцененные радиусы гидратированных ионов H3O+ и OH-, имеющих центрально-симметричное распределение вещества и заряда, хорошо коррелируют с литературными данными.


