Метод получения штаммов Escherichia coli с конститутивной экспрессией фосфонатного оперона
Автор: Бузиков Рустам Мансурович, Янов Сергей Николаевич, Погорельский Иван Петрович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биологические ресурсы: фауна
Статья в выпуске: 3-3 т.15, 2013 года.
Бесплатный доступ
В настоящей работе представлены результаты получения рекомбинантных штаммов E. coli c конститутивной экспрессией фосфонатного оперона с помощью сайт-специфичной системы рекомбинации бактериофага.
Фосфонаты, с-р лиаза, глифосат, ксенобиотики, биоремедиация, фосфонатный оперон
Короткий адрес: https://sciup.org/148201913
IDR: 148201913 | УДК: 579.254.26
Текст научной статьи Метод получения штаммов Escherichia coli с конститутивной экспрессией фосфонатного оперона
Широкое применение агрохимикатов вывело сельскохозяйственные технологии на новый уровень, сделало возможным переход к интенсивному принципу ведения хозяйства, что, к сожалению, сопровождается загрязнением почвы и сельхозпродукции, особенно в случаях, связанных с несоблюдением норм внесения агрохимикатов и САмих технологий. У многих агрохимикатов со временем обнаруживаются свойства, отрицательно влияющие на природные экосистемы и здоровье человека. В результате длительного и неконтролируемого применения агрохимикатов сельхозпроизводителями на территории СНГ осталось множество свалок зачастую неизвестных препаратов или их смесей, существенно ухудшающих экологическую обстановку в регионах. До сих пор ситуация не изменилась, нередки случаи использования уже запрещенных веществ и препаратов. Часть ксенобиотиков не может быть достаточно эффективно переработана биотической компонентой экосистемы. Некоторые из них не только устойчивы к физии-ческому воздействию, но и к биодеструкции почвенными микроорганизмами. Более того, они обладают антибиотической активностью.
Одной из групп подобных ксенобиотиков являются фосфонаты (например, производные метилфосфоновой кислоты) – сильные органические фосфатные хелаторы, которые удерживают положительно заряженные ионы Mn, Co, Fe, Zn, Cu и др., необходимые для протекания физиологических процессов в почве, организмах растений и животных. Представителем данной группы соединений является глифосат – неселективный системный гербицид, использующийся для борьбы с сорняками, а его этил- и фенил- фосфонатные производные как инсектициды для борьбы с
насекомыми. Глифосат занимает среди гербицидов первое место в мире по производству [1]. Долгое время считалось, что для млекопитающих глифосат малотоксичен (ЛД 50 : для крыс 4900 мг/кг, для кроликов 3800 мг/кг), но при совместном воздействии с другими так называемыми «инертными компонентами» токсичность существенно увеличивается. Были выявлены онкогенный и мутагенный эффекты глифосата [2, 3]. Препарат может поступать с пищей в организм человека, отрицательно влияет на синтез ароматических аминокислот растениями, оказывает угнетающее воздействие на микрофлору кишечника [5].
Характерной особенностью фосфонатов является наличие С-Р связи, устойчивой не только к химическому гидролизу и фотолизу, но и к термическому расщеплению [6]. Благодаря этому фосфонаты способны долгое время сохраняться в почве, быстро адсорбируясь на ее частицах. Многие микроорганизмы в определенных условиях способны к биодеградации фосфонатов с помощью различных ферментов: фосфоноацетальдегидгидролазы (разлагает 2- аминоэтилфосфоновую кислоту); фосфо-ноацетатгидролазы (деградирует фосфоноацетат), фосфонопируватгидролазы и С-Р лиазы – фермента с наиболее широким спектром разлагаемых фосфонатов. Проблема заключается в том, что биодеградация фосфонатов ингибируется даже невысокими концентрациями неорганических фосфатов, которые являются более доступным источником фосфора для микроорганизмов [6]. В природе практически не встречаются условия, оптимальные для эффективной экспрессии фосфонатного оперона – группы генов, отвечающих за синтез С-Р лиазного ферментативного комплекса и его функционирование. Для определения перспектив и направлений исследования проблемы биодеградации фосфонатных ксенобиотиков необходима селекция микроорганизмов, способных к синтезу С-Р лиазы не только на минимальной питательной среде, но и в почве, содержащей значительное количество фосфатов. Метаболизм фосфонатов и структура фосфонатного оперона требуют более подробного изучения, но на сегодняшний день полученных данных уже достаточно для того, чтобы решить проблему биоремедиации почвы с использованием полученных методами генной инженерии, позволяющих получить четкий, предсказуемый конечный результат.
Фосфонатный оперон E. coli , размером 10,9 т.п.н., состоит из 14 генов: phnCDEFGHIJKLMNOP, которые транскрибируются с одного промотора, расположенного перед геном phnC. Продукты генов phnC, phnD и phnE кодируют транспортную систему алкилфосфо-натов. Гены phnG-phnM кодируют связанные с мембраной компоненты С-Р лиазного комплекса [8]. Продукты генов phnN и phnP – вспомогательные белки С-Р лиазы. Гены рhnN, рhnO кодируют регуляторные белки [9, 10]. Промотор фосфо-натного оперона содержит РНО-бокс (CTGTTAGTCACTTTTAAT), сходный с обнаруженной в промоторах pho-генов, что позволяет предположить общность с рho-регулоном, который обуславливает ответ микробной клетки на дефицит фосфора и подвергается весьма сложной регуляции, связанной с метаболизмом фосфора [7, 10, 11].
Наиболее приемлемым подходом является невмешательство в сложную систему регуляции фосфатного обмена бактериальной клетки, а исключение из нее фосфонатного оперона. Для этого необходимо заменить регулируемый промотор этого оперона на конститутивный. При этом целесообразнее не клонировать оперон протяженностью 10,9 т.п.н. в вектор с конститутивным промотором, а вставить этот промотор перед геном phnС фосфонатного оперона в месте его локализации (хромосоме бактерии). Методами классической генетики такая манипуляция трудноосуществима. В этой связи было необходимо разработать универсальную систему для встраивания фрагментов ДНК, в том числе и содержащие регуляторные последовательности (промоторы, операторы, эн-хансеры и др.), в выбранное место в геноме бактерии. С этой целью была сконструирована плазмида с генами интеграции бактериофага λ (гены exo, β, γ встроены в хелперную плазмиду pTrcHis2C) (рис. 1).
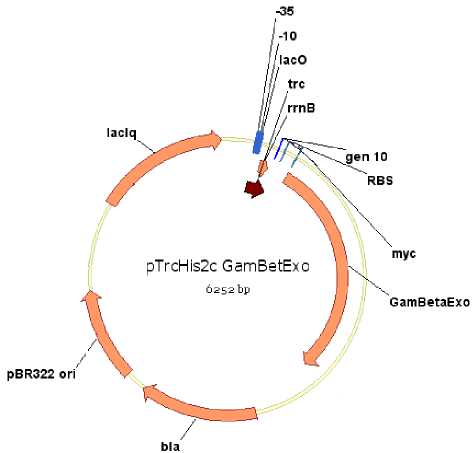
Рис. 1. Вектор pTrcHis2c со вставкой генов exo, β,γ
В качестве конститутивного промотора использовался антитетрациклиновый промотор плазмиды pSC 101, который амплифицировался вместе с геном резистентности к тетрациклину с помощью праймеров, состоящих из двух частей: 3'-часть комплементарна фланкирующим конститутивный промотор последовательностям, a 5'-часть гомологична участкам, фланкирующим промотор фосфо-натного оперона (рис. 2).
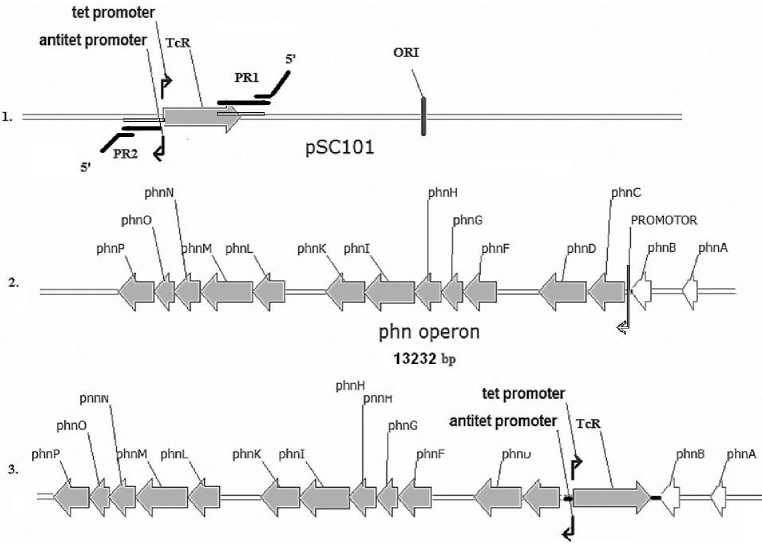
Рис. 2. Механизм замены промотора фосфонатного оперона
Получение штаммов кишечной палочки с конститутивной экспрессией фосфонатного опе-рона сводилось к следующему: компетентные клетки кишечной палочки E. coli Top10 трансформировали ДНК хелперной плазмиды pTrcHis2 с генами exo, β,γ и амплифи-цированного фрагмента pSC101. Для селекции трансформантов использовали плотную питательную среду с добавлением 100 мкг/мл ампициллина (маркер хелперной плазмиды) и 10 мкг/мл тетрациклина (маркер встраиваемого фрагмента). Полученные трансформанты изучали на наличие вставки гена устойчивости к тетрациклину с помощью ПЦР с праймерами Pr1 и Pr2. Для дальнейшей работы было отобрано 13 клонов, способных к расщеплению изопропилового эфира метилфосфоновой кислоты даже в присутствии в питательной среде неорганического фосфата. При множественных пересевах в жидкой питательной среде без селективно давления антибиотиков были получены варианты кишечной палочки, утратившие резистентность к ампициллину (маркер хелперной плазмиды), но сохранившие устойчивость к тетрациклину. Следует заметить, что реципиентный штамм E. coli Top10 является ауксотрофом и не способен конкурировать с аборигенной микрофлорой природных экологических ниш. В дальнейшем разработанную технологию получения штаммов с конститутивной экспрессией фосфонатного оперона планируется использовать применительно к почвенным микроорганизмам с целью разработки биотехнологии для ремедиации загрязненных фосфонатами территорий.
Выводы: итогом работы является разработка методологической основы получения штаммов микроорганизмов, выделенных из различных экологических ниш, с модифицированной регуляцией фосфонатного оперона, перспективных для использования при создании биопрепарата и технологии его применения при очистке территорий от фосфонатных соединений.
Список литературы Метод получения штаммов Escherichia coli с конститутивной экспрессией фосфонатного оперона
- Gasnier, C. Glyphosate-based herbicides are toxic and endocrine disruptors in human cell lines/C. Gasnier et al.//Toxicology. 2009. Vol. 10. P. 33-35.
- De Roos, J. Cancer Incidence among Glyphosate-Exposed Pesticide Applicators in the Agricultural Health Study/J. De Roos et al.//Environmental Health Perspectives, 2005, P. 113.
- Dallegrave, E. The teratogenic poten al. of the herbicide glyphosate-Roundup® in Wistar rats/E. Dallegrave et al.//Toxicology Leers. 2003. Vol. 142(1-2). P. 45-52.
- Hardell, L. A Case-Control Study of Non-Hodgkin Lymphoma and Exposure to Pesticides/L. Hardell, M. Eriksson//Cancer. 1999. Vol. 85. P. 1353-1360.
- Brandli, D. Herbicides found in Human Urine/D. Brandli, S. Reinacher//Ithaka Journal. 2012. Vol. 1. P. 2-4.
- Нифантьев, Э.Е. Химия фосфорорганических соединений. -М.: Изд-во МГУ, 1971. 24 с.
- Микробные биотехнологии ремедиации почв, загрязненных фосфорорганическими пестицидами [электронный ресурс]//Коммерческая биотехнология. 01.07.09 URL: http://www.cbio.ru/
- Metcalf, W.W. Mutational Analysis of an Eschenichia coli Fourteen-Gene Operon for Phosphonate Degradation, Using TnphoA' Elements/W.W. Metcalf, B.L Wanner//Journal of bacteriology. 1993. Vol. 6. P. 3430-3442.
- Jochimsen, B. Five phosphonate operon gene products as components of a multi-subunit complex of the carbon-phosphorus lyase pathway/B. Jochimsen et al.//Proc. Natl. Acad. Sci. USA. 2011. Vol. 7. P. 12-28.
- Datsenko, K.A. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products/K.A. Datsenko, B.L. Wanner//Communicated by Jonathan Beckwith, Harvard Medical School, Boston, MA (received for review February 13, 2000).
- Kamat, S.S. Intermediates in the transformation of phosphonates to phosphate by bacteria/S.S. Kamat, H.J. Williams, F.M. Raushel//Nature. 2011. Vol. 480. P. 570-573.


