Метод повышения помехоустойчивости в оптоакустической системе визуализации
Автор: Кравчук Д.А.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Математические методы и моделирование в приборостроении
Статья в выпуске: 4 т.29, 2019 года.
Бесплатный доступ
При оптоакустической визуализации объект освещается коротким лазерным импульсом, и энергия поглощенного фотона преобразуется в тепло, что приводит к кратковременному локальному повышению температуры. Повышение температуры вызывает термоупругое расширение, которое вызывает локальное повышение давления и излучает акустические волны. Существуют теории для описания процесса пространственной когерентности как функции расстояния между элементами на приемной акустической антенне, что позволяет оптимизировать изображение, полученное в результате оптоакустического эффекта. Однако в этих теориях отсутствует модель шума, который вносит значительные отклонения в измерениях. Оптоакустическая томография классифицируется как метод гибридной визуализации на основе оптоакустического эффекта. Оптоакустические сигналы по своей природе регистрируются в шумной среде, а также подвержены воздействию шума компонентов системы. Поэтому важно уменьшить шум в сигналах, чтобы восстановить изображения с меньшей ошибкой. В работе приведены алгоритмы обработки акустического сигнала для получения изображения, сформированного в результате оптоакустического эффекта.
Оптоакустический эффект, акустический сигнал, цитомер, томография, лазер, optoacoustic signal, erythrocytes, power spectral density, laser
Короткий адрес: https://sciup.org/142221449
IDR: 142221449 | УДК: 535.015 +57.087.1 + 004.418 | DOI: 10.18358/np-29-4-i119123
Текст статьи Метод повышения помехоустойчивости в оптоакустической системе визуализации
Оптоакустическая томография в последнее десятилетие стала использоваться для получения биомедицинских изображений [1]. Клинически оптоакустическая томография используется для добавления оптического контраста к ультразвуковой визуализации рака молочной железы, благодаря ее способности визуализировать с акустическим разрешением на глубинах до 2 см in vivo, превышающих предел оптической диффузии [2], и 2 и 8 см — в фантомах тканей, сохраняя специфическую молекулярную чувствительность от оптического поглощения [3]. Оптоакустика также оказалась высокомасштабируемой техникой, позволяющей достигать субклеточного разрешения на глубине до миллиметра ткани [1, 4, 5]. Поскольку оптоакустический эффект включает преобразование энергии света в звуковую энергию, оптоакустические изображения в основном не содержат фона и обладают 100 % чувствительностью к оптическому поглощению [6]. Высокая контрастность изображения фотоакустики позволила количественно оценить ряд сосудистых показателей, включая общую концентрацию гемоглобина (HGB), насыщение крови кислородом (SaO2), скорость потока или объемный расход, капиллярную плотность, скорость метаболизма кислорода (MRO2) и скорость пульсовой волны [7, 8]. Кроме того, нелинейные эффекты позволили проводить ультраострую спектроскопию [9] и даже субдифракционную визуализацию с пространственным разрешением <100 нм, делая оптоакустическую визуализацию единственной технологией оптической визуализации, которая преодолевает ограничения как оптической диффузии, так и оптической дифракции [10]. Однако на шкале субдифракции достижимое разрешение ограничено чувствительностью, поскольку число молекул в разрешимом вокселе становится очень маленьким; например, 10-нанометровый куб содержит только три молекулы гемоглобина с корпускулярной концентрацией, т.е. концентрацией внутри эритроцита (HGB/RBC).
Оптоакустический сигнал генерируется модулированным по интенсивности светом в диапазоне частот от сотен кГц до нескольких ГГц. Амплитуда формируемого давления пропорциональна интенсивности модулированного света, что означает, что интенсивность генерируемого звука пропорциональна квадрату интенсивности модулированного света. Таким образом, в смысле преобразования энергии, оптоакустический эффект является нелинейным. Повышение чувствительности требует использования высокой оптической интенсивности, однако как и в любом методе оптического возбуждения, оптоакустическая генерация акустических волн демонстрирует нелинейность из-за насыщения оптического поглощения, которое предотвращает неограниченное увеличение амплитуды волны давления с оптической интенсивностью. При очень высокой оптической интенсивности тепло может отводиться достаточно быстро, чтобы генерировать ударные волны:
p ( r, to) -i^'o (to) e[ar / \ 4πr где r — расстояние от центра сферического поглотителя до точки измерения; ω — угловая частота; vs — это скорость звука; Q(ω) является фурье-преобразованием функции силы источника Q(t). Физически Q(t) — скорость объемного расширения объекта за счет тепла, так что Q(t) = = β H(t)/(ρСp), где H(t) — поглощенная оптическая сила, выделяемая в виде тепла внутри объекта; ρ — плотность массы; β — коэффициент теплового расширения и Сp — это удельная теплоемкость.
МОДЕЛИРОВАНИЕ
Для регистрации акустического сигнала в результате оптоакустического эффекта в биологической ткани предлагается использовать антенную решетку из пьезоэлектрических датчиков с каналами обработки данных. Глубина проникновения лазерного луча в биологическую ткань может изменяться, поэтому результаты измерения уровня гемоглобина и кислородонасыщения необходимо улучшить путем удаления шума в оптоакустическом цитомере. Источником помех в оптоакустическом цитомере могут являться приемные преобразователи и электронные тракты антенной решетки. Отказ некоторых каналов датчика может быть временным, постоянным или частичным, например, когда выборочные данные отражают слишком высокий или слишком низкий уровень сигнала или шума. Неисправные каналы преобразователя могут также давать непоследовательный или ненадежный вывод данных даже в пределах одной синограммы. "Неисправность" каналов преобразователя может возникать при плохом контакте с тканью под одним или несколькими элементами преобразователя.
При идентификации "неисправного" канала информация с него отмечается, и после этого данные, предоставленные этим датчиком, могут игнорироваться, заменяться или отдельно предварительно обрабатываться. Чтобы компенсировать "неверный сигнал" какого-либо канала преобразователя, запускается препроцессор для удаления из матрицы сигналов аномального отклика преобразователя или для компенсации выпадающих данных они заменяются средним значением данных из двух соседних каналов. "Неисправный" канал может быть обнаружен по тому факту, что синограмма имеет "кожный" сигнал, т.е. акустический сигнал, отраженный от поверхности, значительно слабее, чем в среднем по другим каналам. Это может быть из-за плохого акустического контакта датчика канала. Чтобы избежать артефактов, канал идентифицируется как "неисправный".
Предложенный алгоритм позволяет избежать неточных артефактов изображения. Алгоритм работает следующим образом: каждый канал, помечается как "неисправный" в том случае, если среднее значение для группы из нескольких последовательных выборок данных канала мало и считается статистическим выбросом при сравнении со всеми каналами.
На рис. 1 представлена блок-схема алгоритма. Приведенный алгоритм является примером исключения "неисправных" каналов, которые могут отрицательно повлиять на формирование изображения. Другим способом для обнаружения "неисправных" каналов может служить вычисление автокорреляции между каналами.
Важной помехой при формировании изображения может быть появление в нем горизонтальных полос. Эти ошибки в изображении можно удалить с использованием метода, основанного на двумерном дискретном вейвлет-преобразовании, или с помощью фильтра (например, одномерного или двумерного фильтра частотной области или FIR-фильтра).
Алгоритм, приведенный на рис. 2, используется для удаления горизонтальных полос с синограммы.
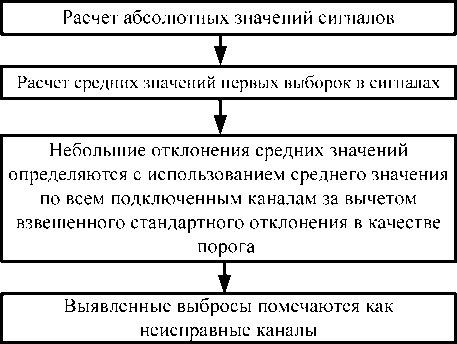
Рис. 1. Алгоритм идентификации "неисправных" каналов
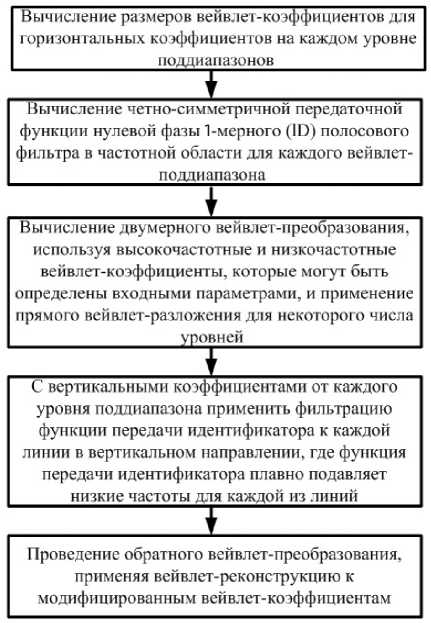
Рис. 2. Алгоритм удаления горизонтальных полос
Разработан интерфейс программы для отображения акустического сигнала при оптоакустическом преобразовании (рис. 3). Система визуализации включает в себя ручной датчик с лазерами, работающими на разных длинах волн. Оба источника света излучают световые импульсы. Приемный датчик имеет матрицу ультразвуковых преобразователей для приема сформированного в жидкости акустического сигнала. Блок формирования изображения восстанавливает изображение на основе дискретизированных данных, соответствующих импульсу света от первого лазера, и восстанавливает изображение на основе дискретизированных данных, от второго лазерного импульса. По результатам обработки синограмм с учетом алгоритма определения "неисправных" каналов формируется изображение жидкой ткани. На рис. 3 приведено моделирование построения изображения по синограммам от двух лазерных источников.
ЗАКЛЮЧЕНИЕ
Представленный алгоритм (рис. 2) является примером способа реализации полосового фильтра для удаления данных, которые могут отрицательно повлиять на последующие вычисления и операции, выполненные с оптоакустическими данными.
Синфазная полосовая фильтрация может быть выполнена с использованием анализа основных
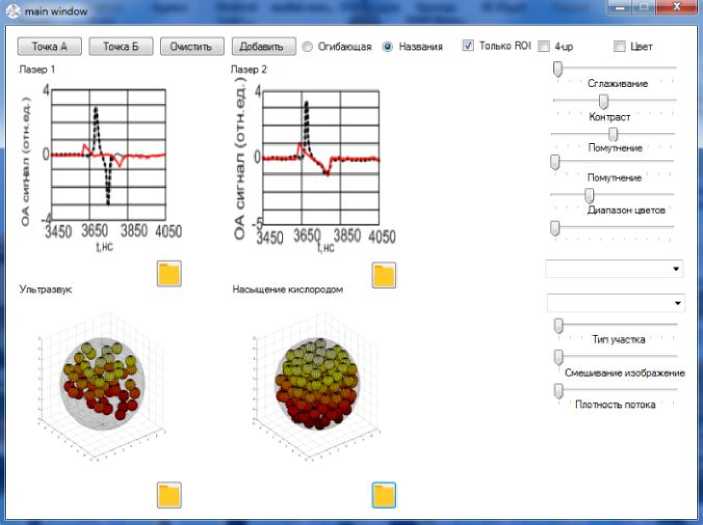
Рис. 3. Интерфейс программы визуализации оптоакустического сигнала и изображения
компонентов на каналах синограммы для удаления помех, общих для каждого канала.
Разработанные алгоритмы борьбы с шумами, появляющимися в результате работы оптоакустического цитомера [11–15], необходимы для проектирования функции оптоакустической визуализации на основе совмещенного датчика лазерного излучения и антенной решетки из пьезоэлектрических преобразователей для регистрации акустического сигнала. Приведенный в работе алгоритм применяется для обработки информации, получаемой от пьезоэлектрических датчиков в результате оптоакустического эффекта, для формирования изображения в жидких тканях.
Список литературы Метод повышения помехоустойчивости в оптоакустической системе визуализации
- Wang L.V., Hu S. Photoacoustic tomography: in vivo imaging from organelles to organs // Science. 2012. Vol. 335, is. 6075. P. 1458–1462. DOI: 10.1126/science.1216210
- Ermilov S.A., Khamapirad T., Conjusteau A., Leonard M.H., Lacewell R., Mehta K., Miller T., Oraevsky A.A. Laser optoacoustic imaging system for detection of breast cancer // J. Biomed. Opt. 2009. Vol. 14, no. 2. 024007. DOI: 10.1117/1.3086616
- Ke H., Liu C., Wang L.V., Erpelding T.N., Jankovic L. Performance characterization of an integrated ultrasound, photoacoustic, and thermoacoustic imaging system // J. Biomed. Opt. 2012. Vol. 17, no. 5. 056010. DOI: 10.1117/1.JBO.17.6.061208
- Yao D.-K., Maslov K., Shung K.K., Zhou Q., Wang L.V. In vivo label-free photoacoustic microscopy of cell nuclei by excitation of DNA and RNA // Opt. Lett. 2010. Vol. 35, is. 24. P. 4139–4141. DOI: 10.1364/OL.35.004139
- Zhang C., Maslov K., Wang L.V. Subwavelengthresolution label-free photoacoustic microscopy of optical absorption in vivo // Opt. Lett. 2010. Vol. 35, is. 19. P. 3195–3197. DOI: 10.1364/OL.35.003195
- Wang L.V. Tutorial on photoacoustic microscopy and computed tomography // IEEE J. Sel. Topics Quant. Electron. 2008. Vol. 14, is. 1. P. 171–179. DOI: 10.1109/JSTQE.2007.913398
- Yao J., Maslov K., Zhang Y., Xia Y., Wang L.V. Label-free oxygen-metabolic photoacoustic microscopy in vivo // J. Biomed. Opt. 2011. Vol. 16, no. 7. 076003. DOI: 10.1117/1.3594786
- Yeh C., Hu S., Maslov K., Wang L.V. Photoacoustic microscopy of blood pulse wave // J. Biomed. Opt. 2012. Vol. 17, is. 7. 070504. DOI: 10.1117/1.JBO.17.7.070504
- Zharov V.P. Ultrasharp nonlinear photothermal and photoacoustic resonances and holes beyond the spectral limit // Nat. Photonics. 2011. Vol. 5, is. 2. P. 110–116.
- Zhu L., Danielli A., et al. Cross-beam nonlinear photoacoustic microscopy // Proceedings of SPIE. 2014. DOI: 10.1364/BIOMED.2014.BS2A.2
- Starchenko I.B., Kravchuk D.A., Kirichenko I.A. An optoacoustic laser cytometer prototype // Biomedical Engineering. 2018. Vol. 51, no. 5. P. 308–312. DOI: 10.1007/s10527-018-9737-8
- Кравчук Д.А., Старченко И.Б. Теоретическая модель для диагностики эффекта кислородонасыщения эритроцитов с помощью оптоакустических сигналов // Прикладная физика. 2018. № 4. С. 89–94.
- Кравчук Д.А. Математическая модель обнаружения внутриэритроцитарных инфекций с помощью оптоакустического метода // Biomedical photonics. 2018. Т. 7, № 3. С. 36–42. DOI: 10.24931/2413-9432-2018-73-36-42
- Кравчук Д.А., Старченко И.Б. Модель формирования оптоакустического сигнала от эритроцитов для лазерного цитомера // Лазерная медицина. 2018. Т. 22, № 1. С. 57–61.
- Кравчук Д.А. Моделирование акустических сигналов при оптоакустическом преобразовании для осесимметричных несферических форм эритроцитов // Научное приборостроение. 2019. Т. 29, № 2. С. 83–89. URL: http://iairas.ru/mag/2019/full2/Art11.pdf


