Методические основы предупреждения лучевых реакций у пациентов при нейтронно-фотонной терапии злокачественных новообразований
Автор: Чойнзонов Евгений Лхамацыренович, Лисин Валерий Андреевич, Грибова Ольга Вячеславовна, Великая Виктория Валерьевна, Старцева Жанна Александровна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.18, 2019 года.
Бесплатный доступ
Все методы лучевой терапии направлены на разработку режимов облучения, при которых высокая эффективность поражения злокачественных опухолей сочетается с допустимой частотой лучевых реакций нормальной ткани. В нейтронной терапии к настоящему времени не выработаны режимы облучения, которые бы отвечали этому требованию. Цель исследования - разработать комплекс методических подходов, обеспечивающих допустимую частоту и выраженность лучевых реакций у пациентов при нейтронной и нейтронно-фотонной терапии (НФТ) злокачественных новообразований на циклотроне У-120. Материал и методы. Для решения задач, соответствующих заявленной цели, применена зависимость относительной биологической эффективности (ОБЭ) нейтронов от дозы и модель время - доза - фракционирование (ВДФ). Проанализированы особенности взаимодействия нейтронов с различными типами тканей, и разработан алгоритм суммирования нейтронных и фотонных доз при нейтронно-фотонной терапии. Результаты. Проведенные клинические исследования НФТ показали, что разработанные подходы позволяют с удовлетворительной точностью прогнозировать и предупреждать серьезные поражения нормальной ткани. Роль всех факторов, влияющих на характер лучевых реакций, учтена в компьютерной программе, позволяющей получить основные характеристики планируемых курсов НФТ.
Нейтронная терапия, обэ нейтронов, модель вдф, лучевые реакции, циклотрон у-120, режим облучения, радиоустойчивость опухолей, прогнозирование, радиорезистентность
Короткий адрес: https://sciup.org/140254251
IDR: 140254251 | УДК: 616-006.04-08-06:615.849.5 | DOI: 10.21294/1814-4861-2019-18-2-44-51
Текст научной статьи Методические основы предупреждения лучевых реакций у пациентов при нейтронно-фотонной терапии злокачественных новообразований
Нейтронная терапия (НТ) является эффектив‑ ным методом лечения пациентов с опухолями, ре‑ зистентными к редкоионизирующему излучению [1–4]. Все методы лучевой терапии, в том числе и нейтронной, направлены на разработку таких режимов облучения, при которых высокая эффек‑ тивность поражения злокачественных опухолей со‑ четается с допустимой частотой и выраженностью лучевых реакций нормальной ткани. Для решения первой части задачи необходимо знать основные характеристики облучаемой опухоли: ее радиочув‑ ствительность, скорость роста и закономерности восстановления опухолевых клеток в интервалах между сеансами терапии. Невозможно прогнози‑ ровать результат воздействия излучения на объект, не зная с высокой точностью его характеристик. Задача усложняется тем, что под воздействием излучения в опухоли происходит процесс реокси‑ генации, который изменяет ее радиобиологические свойства. На современном этапе развития лучевой терапии на практике не удается получить информа‑ цию, необходимую для определения оптимального режима фракционирования дозы по критерию уничтожения максимального числа опухолевых клеток. Поэтому тактика лучевой терапии выража‑ ется, как правило, в стремлении дать максимально возможную дозу на опухолевый очаг. Ограниче‑ нием в подобном подходе к достижению высокой эффективности лучевой терапии является степень толерантности нормальных тканей, попадающих в зону облучения. Максимально возможной суммар‑ ной очаговой дозе (СОД) должны соответствовать такие дозы в подвергаемой облучению области тела пациента, которые приводили бы к прием‑ лемым лучевым реакциям нормальных тканей. В терапии редкоионизирующим излучением (ТРИ) режим фракционирования дозы, удовлетворяю‑ щий сформулированному условию, выверялся в течение нескольких десятилетий. В результате исследований за стандартный, приводящий к до‑ пустимой степени поражения нормальной ткани, принят режим, при котором облучение проводят в однократной дозе 2 Гр 5 раз в нед, СОД 60 Гр. При полях облучения площадью S≤100 см2 такой способ терапии обеспечивает частоту лучевых осложнений на уровне ~5 % [5]. Существенно меньший исторический опыт применения НТ, ее ограниченное распространение в мире, а также более сложные механизмы взаимодействия ней‑ тронов с облучаемыми тканями не позволили к на‑ стоящему времени выработать режимы облучения, соответствующие критериям стандартного режима в ТРИ. Кроме того, зачастую НТ сочетают с фотон‑ ной терапией (ФТ). Следовательно, поиск мер и критериев, обеспечивающих допустимую степень поражения нормальной ткани при нейтронной и нейтронно‑фотонной терапии (НФТ), является актуальной проблемой. Нейтронная терапия мо‑ жет быть проведена на реакторе [6], нейтронном генераторе [7] и ускорителях заряженных частиц. Терапевтические нейтронные пучки, полученные на перечисленных источниках, существенно от‑ личаются по своему биологическому действию и энергии [8]. Поэтому к проведению НТ на каждом из перечисленных источников необходим спец‑ ифический подход. В данной работе рассмотрен вариант, когда в качестве источника нейтронов применен циклотрон У‑120.
Цель исследования – разработать комплекс ме‑ тодических подходов, обеспечивающих допусти‑ мую частоту и выраженность лучевых реакций у пациентов при нейтронной и нейтронно‑фотонной терапии злокачественных новообразований на циклотроне У‑120.
Материал и методы
При использовании в качестве источника ней‑ тронов циклотрона У‑120 распределение дозы в облучаемых тканях таково, что с наибольшей вероятностью ранние лучевые реакции (РЛР) про‑ являются на коже в области облучаемых полей [9]. В НИИ онкологии разработаны способы лечения лучевых повреждений с применением озоновых технологий [10] и магнитолазерной терапии [11]. Разработанные методы позволяют уменьшить выраженность лучевых реакций и осложнений, однако их предупреждение остается первостепен‑ ной задачей. Характер поражения кожи в основном определяется значением поглощенной дозы и в то же время зависит от ряда факторов, которые и рассмотрены в данной работе.
Известно, что нейтроны при равных погло‑ щенных дозах в большей степени поражают биологические объекты по сравнению с редкоио‑ низирующим излучением. В первых работах по исследованию НТ были применены способы облу‑ чения, разработанные ранее для гамма‑терапии. В результате пациенты получили серьезные лучевые осложнения, что поставило исследователей перед необходимостью изучить особенности реакций биологических объектов на облучение нейтронами. В связи с этим в данных исследованиях проана‑ лизирована зависимость относительной биологи‑ ческой эффективности (ОБЭ) нейтронов от дозы для терапевтического пучка циклотрона У‑120, по‑ лученная на основе многомишенной модели (ММ) клеточной выживаемости, и определена ее роль в предупреждении лучевых реакций кожи.
К началу исследований НТ на циклотроне У‑120 радиобиологическое планирование ФТ осуществлялось на основе концепции Эллиса, которая получила наибольшее распространение в виде модификации, называемой моделью время – доза – фракционирование (ВДФ). Представляет ин‑ терес создание аналогичного подхода и в НТ. При разработке модели ВДФ для НТ в качестве базового курса, полностью исчерпывающего толерантность нормальной ткани, взят курс длительностью Tн=28 сут с числом сеансов Nн=12 и разовой оча‑ говой дозой (РОД)=1,3 Гр [12]. Дополнительно рассмотрена роль коррегирующих факторов, свя‑ занных с укрупнением РОД и с учетом типа ткани в зоне облучения. При построении зависимостей ча‑ стоты лучевых реакций от значений фактора ВДФ использованы результаты НТ опухолей головы и шеи. Следует отметить, что в последние годы для планирования режимов облучения в ТРИ все чаще применяют линейно‑квадратичную модель (ЛКМ) [13]. Однако применение ЛКМ для планирования НТ встречает существенные трудности из‑за от‑ сутствия необходимой информации о параметрах этой модели для нейтронов.
Нейтронную терапию применяют как в само‑ стоятельном варианте, так и в сочетании с ФТ. Во втором случае необходим алгоритм суммирования поглощенных доз нейтронов и фотонов, не приво‑ дящий к превышению допустимых суммарных доз для облучаемых тканей. При решении этой задачи использовано универсальное свойство фактора ВДФ, заключающееся в том, что при равных зна‑ чениях факторов ВДФ для обоих видов излучений достигается одинаковая степень поражения нор‑ мальной ткани.
Результаты и обсуждение
Учет относительной биологической эффективности нейтронов. В нейтронной терапии информация о значениях ОБЭ нейтронов является важной составляющей для формирования режимов облучения, обеспечивающих допустимый уровень лучевых реакций кожи. Поскольку в НТ могут применяться разнообразные дозовые режимы, соз‑ даваемые методы дозиметрического планирования должны учитывать зависимость ОБЭ нейтронов от дозы, поэтому необходимо математическое описание такой зависимости. Нами на основе ММ клеточной выживаемости для терапевтического пучка нейтронов со средней энергией 6,3 МэВ по‑
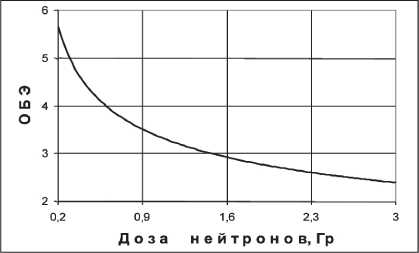
Рис. 1. Зависимость ОБЭ нейтронов от дозы, рассчитанная по (1)
лучена зависимость ОБЭ от дозы для кожи, которая выражена уравнением
ОБЭ^ = -^ln[l - (1 - ехрН,22О°’43] , (1)
где dн – однократная поглощенная доза нейтро‑ нов.
Функция (1) отражена в графике рис. 1. Вид‑ но, что с уменьшением дозы значения ОБЭ возрастают.
Знание зависимости ОБЭн=f(dн) позволяет пере‑ вести любое значение разовой дозы нейтронов в дозу фотонов и по апробированной модели ВДФ для фотонов [13] оценить степень опасности при‑ меняемого режима фракционирования нейтронной терапии. Рассмотрим конкретный пример. Фор‑ мула для ВДФ в терапии редкоионизирующим излучением имеет вид:
1 о J 1,538 ут 0,17
вДфФ = ^хмфхаф хнф ,
где Nф – число сеансов ФТ; dф – разовая доза фотонов, Гр; Hф – временной интервал между сеансами, сут.
Оценим для данного режима нейтронной те‑ рапии фактор ВДФ по (2) путем перевода разовой дозы нейтронов 1,3 Гр в разовую дозу фотонов. Согласно формуле (1) и графику, представленному на рис. 1, ОБЭн (d=1,3 Гр) ≈3, поэтому доза фото‑ нов, эквивалентная нейтронной дозе в 1,3 Гр, равна ~3,9 Гр. При указанных характеристиках курса НТ фактор ВДФ, рассчитанный по (2), оказывается равным ~100 ед., что свидетельствует о полном исчерпании толерантности облучаемой ткани и согласуется с данными [12].
Найденная зависимость ОБЭ нейтронов от дозы позволяет с привлечением уже известного в фотон‑ ной терапии метода планирования на основе фак‑ тора ВДФ в первом приближении контролировать степень поражения нормальной ткани, облучаемой нейтронами.
Фактор ВДФ как инструмент для прогнозирования РЛР нормальной ткани. В основу раз‑ работки модели ВДФ для НТ положена концепция Эллиса – Фильда, выражаемая формулой:
DCH = 1 O’2 x NSDH x Т;0’11 x N®’04 , (3)
где D c н – суммарная доза нейтронов за проводимый курс т , ерапии, Гр; NSD н – номинальная стандартная доза для нейтронов; T н и N н – длительность курса и число сеансов НТ соответственно.
При любых значениях параметров D сн , T н и N н , удовлетворяющих выражению (3), курс Н , Т приво‑ дит к предельно допустимой степени поражения нормальной ткани. Значение номинальной стан‑ дартной дозы NSD н определено из (3) с исполь‑ зованием параметров указанного выше базового курса НТ и равно ~980 ед.
При однократной дозе облучения dн суммар‑ ная доза нейтронов за весь курс терапии равна: Dс.н=dн×Nн, а связь между длительностью курса и ч. ислом сеансов терапии приближенно можно выразить соотношением Tн ≈ Hн×Nн, где Hн – вре‑ менной интервал между сеансами НТ. Если опреде‑ ляемые приведенными соотношениями величины
Tн и Dс,н подставить в (3) и выразить из него Nн в явном виде, то можно получить м [жвХ,п N = --- - н 100^
Степень использования полной толерантности нормальной ткани на различных этапах курса нейтронной терапии может быть охарактеризована так называемой частичной толерантностью (ЧТ), которую при равномерном фракционировании определяют формулой
ЧТ = NSDH
NH
где N н – число фракций, при котором полностью используется толерантность нормальной ткани, а m – число реализованных фракций.
Если выражение (4) подставим в формулу (5), то для ЧТ получим соотношение
ЧТ = 229 X №^J 8 X т х d" 8 х Н^л 3 . (6)
По аналогии с гамма‑терапией величину
называют фактором ВДФ для НТ опухолей. В вы‑ ражении (7) коэффициент g – это нормировочный множитель. Если параметры указанного выше базового курса НТ подставить в выражение (7) при условии ВДФ=100, то можно определить, что g= 6,9. Следовательно, выражение для фактора ВДФ в терапии пучком быстрых нейтронов цикло‑ трона У‑120 со средней энергией 6,3 МэВ в случае равномерного режима фракционирования дозы можно записать следующим образом:
ВДФн-6,9та^Н^лз
В формулу (8) дозу dн следует подставлять в грэях, а Hн – в сутках.
Из клинической практики известно, что при рав‑ ных поглощенных дозах степень лучевой реакции зависит от площади облучаемого поля. Поэтому для предельно допустимого значения фактора ВДФ в нейтронной терапии нами получена следующая эмпирическая формула:
ВДФпред = 400 xS-013, (9) где S – площадь поля облучения, см2.
Планирование лучевой терапии на основе радиобиологических моделей является важной со‑ ставляющей в обеспечении допустимых уровней и частоты лучевых реакций. Оно позволяет избежать произвола при выборе однократных и суммарных доз, выявить закономерности фракционирования дозы для радиочувствительных и радиоустойчивых опухолей, однако дает все‑таки лишь приблизи‑ тельный прогноз развития тех или иных лучевых повреждений. В методическом руководстве [14] справедливо заключают, что при выборе тактики лечения всегда следует ориентироваться на кли‑ нический опыт, накопленный в данном лечебном учреждении. Поэтому апробацию разработанной модели ВДФ для планирования нейтронной те‑ рапии проводили методом последовательного приближения: при постепенном наращивании суммарной дозы постоянно оценивали фактор ВДФ и контролировали соответствующие ему лучевые реакции.
Особенности эксплуатации циклотрона по‑ зволяют проводить НТ два раза в неделю, то есть средний временной интервал между сеансами составляет X≈3,5 сут, в то время как для базового режима фракционирования [12] эта величина равна ~2,5 сут. Данное обстоятельство учтено при рас‑ чете фактора ВДФ. На рис. 2 показана зависимость частоты острых лучевых реакций от фактора ВДФ, найденного по формуле (8), у больных опухолями головы и шеи. Нейтронная терапия проведена при РОД=1,3 Гр и площади поля облучения 48 см2. При заданной РОД доза на коже при расчете фактора ВДФ определена с учетом ослабления нейтронного пучка в облучаемой ткани. Предельно допустимое
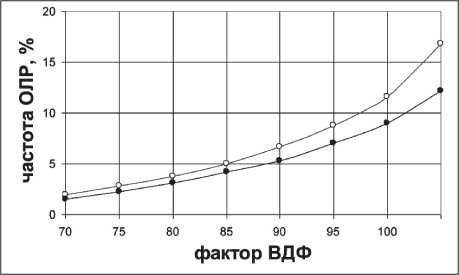
Рис. 2. Зависимость частоты ЛР от фактора ВДФ без учета (°) и с учетом (•) поправки на укрупнение дозы
значение фактора ВДФ для поля S=48 см2, согласно формуле (9), равно 125 ед. По графику видно, что с ростом фактора ВДФ частота лучевых реакций быстро нарастает, и уже при ВДФ=100 доля лу‑ чевых реакций достигает ~12 %. Следовательно, стремление обеспечить предельное значение ВДФ=125 привело бы к очень высокой частоте острых лучевых реакций или даже к серьезным лучевым осложнениям. Полученный результат был ожидаем, поскольку классическая концепция Эллис, на основе которой получена широко при‑ меняемая формула (2), для фактора ВДФ в ТРИ хорошо работает при однократных дозах, близких к дозе стандартного курса. При переходе к крупному фракционированию дозы, то есть при увеличении однократной дозы, в ТРИ рекомендовано вво‑ дить поправку на укрупнение разовой дозы [15]. Однократные дозы в приведенном выше режиме фракционирования в НТ также относятся к режиму крупного фракционирования и требуют введения соответствующих поправок. Введение такой по‑ правки при равномерном фракционировании дозы позволило получить следующее выражение для фактора ВДФн:
ВДФн = 6,9w[(7,8X1 о 2 х^ +0,96H]U8 X я 0’13. (10)
Зависимость частоты РЛР от фактора ВДФ, най‑ денного по выражению (10), отражена в нижнем графике рис. 2. Из сравнения графиков следует, что учет укрупнения РОД дозы приводит к уменьше‑ нию частоты РЛР.
Учет неоднородности ткани в зоне облучения. В ТРИ учет гетерогенности тканей служит важным обстоятельством, влияющим на распре‑ деление поглощенной дозы [16]. В НТ ситуация является еще более сложной, поскольку, в отличие от редкоионизирующего излучения, поглощенная доза нейтронов в существенно большей степени зависит от атомного состава облучаемой ткани. В качестве характеристики взаимодействия нейтро‑ нов с материалами и тканями различного атомного состава применяют удельную керму, которая равна энергии, переданной единице массы облучаемого вещества и отнесенной к потоку нейтронов, падаю‑ щему на элементарный объем единичной массы. Нами рассчитаны значения удельной кермы для ряда тканей и материалов, применяемых в качестве фантомных при НТ. Расчет выполнен с учетом энергетического спектра нейтронов циклотрона У‑120, атомного состава исследуемых тканей и материалов с использованием данных об удельной керме для единичного флюенса нейтронов, которая табулирована [17].
На рис. 3 приведены данные об удельной керме нейтронов для некоторых тканей и материалов. По‑ скольку в данном случае рассматривается методика предупреждения РЛР кожи, то наибольший интерес представляет соотношение данных об удельной

Рис. 3. Значения удельной кермы нейтронов в фГр×м2 для различных тканей и материалов
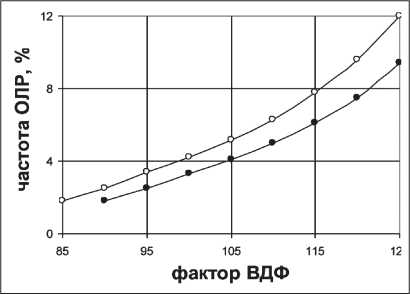
Рис. 4. Зависимость частоты ОЛР от фактора ВДФ с учетом гетерогенности (°) и с одновременным учетом укрупнения дозы и гетерогенности (•)
керме для жировой ткани и мышц. По рис. 3 видно, что удельная керма нейтронов для жировой ткани может в ~1,2 раза превосходить аналогичное зна‑ чение для мышечной ткани. Известно, что в таких анатомических зонах, как подчелюстная область, молочная железа, кожный слой содержит большое количество жира. Именно в этих областях наи‑ более часто наблюдали развитие фиброза кожи и подкожной клетчатки в отдаленном периоде. При калибровке нейтронного пучка циклотрона изначально определяют мощность поглощенной дозы, создаваемой в мышечной ткани. В условиях равновесия вторичных заряженных частиц (ВЗЧ) поглощенная доза равна керме. Следовательно, при расчете фактора ВДФ в условиях, когда кожный слой содержит большое количество жира, необхо‑ димо вводить поправку, учитывающую различие в значениях кермы, значит, и поглощенной дозы, для мышечной и жировой ткани. На рис. 4 (верх‑ ний график) показана зависимость частоты ЛР от фактора ВДФ, полученная с учетом поправки на высокую концентрацию жировой ткани в кожном слое, находящемся в поле облучения нейтронами. Нижний график на рис. 4 получен при одновре‑ менном учете укрупнения разовой дозы и высокой концентрации жира в облучаемом кожном слое. Сравнение графиков рис. 2 и рис. 4 позволяет за‑ ключить, что введение поправки на укрупнение разовой дозы и учет высокой концентрации жира в кожном слое ведут к существенному снижению частоты ЛР.
Алгоритм суммирования доз нейтронов и фотонов при нейтронно-фотонной терапии. Один из факторов, обеспечивающих преимуще‑ ство НТ по сравнению с ТРИ, – низкое значение коэффициента кислородного усиления (ККУ) для нейтронов. Следствием этой известной закономер‑ ности является практически одинаковая эффектив‑ ность воздействия нейтронов на оксигенированные и гипоксические клетки. Поэтому НТ применяют для лечения пациентов с опухолями, содержа‑ щими значительное количество гипоксических клеток, которые радиорезистентны к фотонному излучению. При определении последовательно‑ сти применения нейтронной и фотонной терапии учитывают, что изначально в опухоли содержится значительное количество гипоксических клеток, число которых при проведении нейтронной тера‑ пии уменьшается за счет процесса реоксигенации. В работе [18] при непосредственном измерении напряжения кислорода в опухоли показано, что наивысшая концентрация кислорода в опухоли достигается после 3–5 сеансов НТ, поэтому на первом этапе проводят нейтронную терапию, а на втором – фотонную. При проведении нейтронно‑ фотонной терапии возникает проблема определе‑ ния допустимых суммарных доз нейтронного и фотонного излучений, соответствующих толерант‑ ности облучаемых тканей. В основу решения этой задачи нами положено универсальное свойство фактора ВДФ, заключающееся в том, что при одинаковых его значениях достигается одинаковая степень поражения облучаемой ткани независимо от того, какой вид излучения применяется. На основании этой закономерности можно записать равенство
6,9[W -x)d^H^d^^
^IN^H^
где Nн – число реализованных сеансов нейтронной терапии; HΔ – временной интервал между оконча‑ нием НТ и началом ФТ.
При любых значениях параметров, характери‑ зующих курсы нейтронной и фотонной терапии и удовлетворяющих равенству (11), обеспечивается предельно допустимая степень поражения нор‑ мальной ткани. Отметим, что для пояснения при‑ меняемого метода при записи (11) фактор ВДФ в НТ определен по формуле (8).
Поскольку на первом этапе применяют ней‑ тронную терапию, причем практически всегда с фиксированным числом сеансов, то возникает задача определения числа сеансов ФТ, которыми необходимо дополнить НТ без переоблучения нор‑ мальной ткани. Формула для искомой величины найдена из выражения (11) в виде:
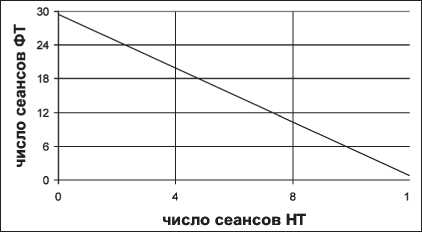
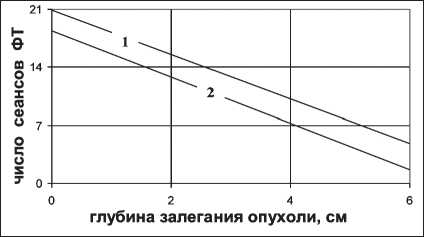
N4)=5^U,5-dTV< Для корректного использования уравнения (12) необходимо учитывать характер пространствен‑ ного распределения поглощенной дозы при НФТ. При проведении процедуры радиационные поля нейтронов и фотонов в области опухоли всегда совпадают. Однако соответствующие очаговые дозы излучений могут быть подведены к опухоли через один и тот же или разные участки кожи тела пациента. При облучении опухоли фотонами и ней‑ тронами через разные кожные поля риск серьезных лучевых поражений кожи практически отсутствует и необходимо найти количественное соотношение сеансов нейтронной и фотонной терапии с учетом обеспечения предельно допустимой очаговой дозы. Нейтронную терапию дополняют фотонной терапией, как правило, со стандартным режимом фракционирования, при котором dф=2 Гр, а Hф≈1,4 сут. С учетом этого формула (12) примет вид нф=1№-а^Чнн -iy/;0’13+/^-13]}, (13) По графику на рис. 5 и полученному на основе формулы (13) можно определить необходимое число сеансов ФТ при известном числе реализо‑ ванных сеансов НТ при условии, обеспечивающем предельно допустимую степень поражения нор‑ мальной ткани в зоне опухоли. Для примера рас‑ чет выполнен для РОД нейтронов, равной 1,3 Гр, и HΔ=10 сут. Очевидно, что наибольший риск лучевого поражения кожи возникает в случае, когда сум‑ марную очаговую дозу фотонов и нейтронов под‑ водят к опухоли через одно и то же кожное поле. В этом случае число сеансов ФТ при заданном числе сеансов НТ также можно определить по выражению (12), однако в этом случае величины dф и dн – это не однократные очаговые дозы, а дозы соответствующих излучений в кожном слое. Рис. 5. Зависимость числа дополнительных сеансов фотонной терапии от числа реализованных сеансов нейтронной терапии Рис. 6. Зависимость возможного числа сеансов фотонной терапии от глубины залегания опухоли Выше отмечено, что при Nн=3÷5 концентрация кислорода в опухоли достигает максимальных значений, поэтому зачастую ограничиваются указанным числом сеансов нейтронной терапии, дополняя ее фотонной терапией. При выборе dф и dн также следует принять во внимание, существует ли необходимость введения поправки на жировой слой. На рис. 6 показаны зависимости допустимого дополнительного числа сеансов фотонной тера‑ пии от глубины залегания опухоли при Nн=4 без учета (зависимость «1») и с учетом (зависимость «2») поправки на жировой слой. Из графиков следует, что при наложении полей нейтронного и фотонного излучений радикальную или близкую к ней СОД можно обеспечить только при малых глубинах залегания опухолевого очага. По этой причине методику облучения с наложением полей фотонного и нейтронного излучений применяют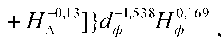
Список литературы Методические основы предупреждения лучевых реакций у пациентов при нейтронно-фотонной терапии злокачественных новообразований
- Musabaeva L.I., Startseva Z.A., Gribova O.V., Velikaya V.V., Lisin V.A. Novel technologies and theoretical models in radiation therapy of cancer patients using 6.3 MeV fast neutrons produced by U-120 cyclotron. AIP Conference Proceedings. 2016; 1760: 020050. DOI: 10.1063/1.4960269
- Gribova O.V., Musabaeva L.I., Choynzonov E.L., Lisin V.A., Novikov V.A. Neutron therapy for salivary and thyroid gland cancer. AIP Conference Proceedings. 2016; 1760: 020021. DOI: 10.1063/1.4960240
- Великая В.В., Мусабаева Л.И., Старцева Ж.А., Лисин В.А. Быстрые нейтроны 6,3 МэВ в комплексном лечении больных местными рецидивами рака молочной железы. Вопросы онкологии. 2015; 61 (4): 583-585.
- Великая В.В., Старцева Ж.А., Симонов К.А., Лисин В.А., Попова Н.О., Гольдберг В.Е. Отдаленные результаты комплексного лечения с применением нейтронной терапии у больных местно-распространенным раком молочной железы. Радиация и риск. 2018; 1: 107-114.
- Клеппер Л.Я. Формирование дозовых полей дистанционными источниками излучения. М., 1986. 220.


