Методические особенности изучения тубулинового цитоскелетав клубеньках бобовых растений
Автор: Китаева Анна Борисовна, Кусакин П.Г., Демченко К.н, Цыганов Виктор Евгеньевич
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Методы исследований
Статья в выпуске: 3 т.53, 2018 года.
Бесплатный доступ
Открытие микротрубочек в растениях, а также их последующее изучение было связано с использованием электронной микроскопии. В дальнейшем разрабатывались способы визуализации цитоскелета в растительной клетке посредством иммунолокализации с применением флуоресцентной и лазерной сканирующей конфокальной микроскопии (K. Celler с соавт., 2016). Все перечисленные методы предполагают фиксацию анализируемого биологического материала. Однако тубулиновый цитоскелет - крайне динамичная структура, поэтому в последние годы активно развиваются методики прижизненного наблюдения микротрубочек с помощью флуоресцентных белков (K. Celler с соавт., 2016). Тем не менее, иммуногистохимический анализ все еще остается востребованным (J. Dyachok с соавт., 2016) в силу ряда причин. Так, прижизненные наблюдения ограничены клетками поверхностных слоев органов и тканей (корневые волоски, эпидерма) (F.M. Perrine-Walker с соавт., 2014; J. Dyachok с соавт., 2016). Более того, у многих видов растений размеры их органов намного крупнее, чем у Arabidopsis thaliana, что делает невозможным проведение анализа изменений в организации цитоскелета in vivo (J...
Бобово-ризобиальный симбиоз, микротрубочки, иммунолокализация, количественный анализ
Короткий адрес: https://sciup.org/142216565
IDR: 142216565 | УДК: 31.461.52:576:576.086 | DOI: 10.15389/agrobiology.2018.3.634rus
Текст научной статьи Методические особенности изучения тубулинового цитоскелетав клубеньках бобовых растений
Изучение организации тубулинового цитоскелета началось с использования методов электронной микроскопии, которые позднее были дополнены иммуногистохимическим анализом с применением флуоресцентной и лазерной сканирующей конфокальной микроскопии (1). Все эти приемы предполагают фиксацию биологического материала. В то же время тубулиновый цитоскелет представляет собой динамичную структуру, поэтому широкое распространение получили подходы, основанные на изучении микротрубочек с использованием флуоресцентных белков in vivo (1). Тем не менее, иммунолокализация микротрубочек в растительных клетках остается востребованной (2). Это обстоятельство объясняется тем, что прижизненные наблюдения микротрубочек ограничены поверхностными слоями клеток (корневые волоски, эпидерма), размер многих орга-
∗ Работа выполнена на оборудовании ЦКП «Геномные технологии, протеомика и клеточная биология» ФГБНУ ВНИИСХМ и ЦКП «Клеточные и молекулярные технологии изучения растений и грибов» ФГБУН БИН РАН. Исследования поддержаны РНФ (грант ¹ 16-16-10035).
нов растений превышает таковой у Arabidopsis thaliana (2). Кроме того, существуют методические трудности с трансформацией многих растений (2). Так, до сих пор не разработан протокол эффективной трансформации для гороха (3). Немаловажен и тот факт, что фиксация позволяет визуализировать организацию элементов цитоскелета, которую не всегда удается выявить с помощью флуоресцентных белков в прижизненных наблюдениях (4).
Исследования тубулинового цитоскелета в симбиотических клубеньках также начинались с применения электронной микроскопии (5). В последующие годы с использованием иммунолокализации и флуоресцентной и лазерной сканирующей конфокальной микроскопии выявили организацию микротрубочек в корневых волосках при формировании инфекционных нитей, а также примордия симбиотического клубенька у Medicago sativa и M . truncatula (6). В дальнейшем было изучено изменение тубулинового цитоскелета при формировании и росте инфекционной нити в корневых волосках M . truncatula и Lotus japonicus с помощью флуоресцентных белков in vivo (7-10).
Методы иммуногистохимического анализа с флуоресцентной и лазерной сканирующей конфокальной микроскопией, а также электронная просвечивающая микроскопия использовались при исследованиях тубулинового цитоскелета в клубеньках разных видов бобовых растений. В результате были выявлены паттерны микротрубочек в зрелых клубеньках M . trun-catula (11), Glycine max (12), Pisum sativum (13), Lupinus albus (14). Тем не менее, в этих работах отсутствует детальное описание трехмерной организации микротрубочек, особенно вокруг инфекционных нитей и инфекционных капель (15).
В проведенных ранее исследованиях структурной организации микротрубочек в зрелых клубеньках один подход заключался в том, что толстые срезы получали вручную, фиксировали и проводили визуализацию тубулинового цитоскелета (12-14). Другой подход включал фиксацию клубеньков с последующим заключением их в воск Стидмана (16), приготовление серийных срезов, которые после регидратации использовали для иммунолокализации (6).
В настоящей работе мы впервые представили усовершенствованный способ фиксации клубеньков, сравнили возможность приготовления срезов с использованием заключающих сред и срезов фиксированных клубеньков, получаемых с применением микротома с вибрирующим лезвием, оптимизировали методику иммунолокализации и метод количественного анализа тубулинового цитоскелета.
Наша цель состояла в разработке подхода для исследования тубулинового цитоскелета в клубеньках бобовых растений.
Описание методики . Оптимизация способа фиксации клубеньков. Для изучения организации тубулинового цитоскелета в клубеньках гороха за основу брали модифицированную методику фиксации корней кукурузы (17). Нами предложена новая методика фиксации симбиотических клубеньков (18). Клубеньки гороха инкубировали 7 мин под вакуумом и 15 мин без вакуума в фиксирующем растворе (3 % формальдегид («Ted Pella», США), 0,25 % глутаральдегид («Ted Pella», США), 0,3 % Tween 20 («Sigma-Aldrich», США), 0,3 % Triton X-100 («Хеликон», Россия) в 1/3 концентрации буфера MTSB (50 мМ пиперазин-N,N'-бис(2-этансуль-фоновая кислота («AMRESCO, Inc.», США), 5 мM MgSO 4 и 5 мM эти-ленгликоль-бис(2-аминоэтиловый эфир)-N,N,N',N'-тетрауксусная кислота («GERBU Biotechnik GmbH», Германия), pH 6,9), процедуру повторяли 67 раз. После этого клубеньки оставляли на ночь при 4 °С.
Оптимизация методики заключения в воск Стидмана. После фиксации клубеньки промывали в буфере 1/3 MTSB 3 раза по 20 мин и заключали в воск Стидмана (16) по M. Stumpe с соавт. (19) с модификациями. Для дегидратации материала использовали серию последовательных концентраций этанола (10, 20, 30, 40, 50, 60, 70, 80, 90 и 96 %), длительность обработки первыми четырьмя концентрациями — соответственно 10, 20, 30 и 40 мин, для последующих — 50 мин. Окрашивание образцов 0,1 % толуидиновым синим в этаноле выполняли в течение ночи. После 2-кратной отмывки (1 ч, 96 % этанол) клубеньки проводили через возрастающие концентрации воска Стидмана (10, 20, 35, 50, 65 и 80 %) в смеси с этанолом (40 °С, время инкубации на каждом этапе — 2 ч). Далее материал погружали на ночь в 100 % воск Стидмана при 40 °С, затем переносили в свежий 100 % воск Стидмана, после 2 ч инкубации в котором клубеньки раскладывали в формы, заливали 100 % воском Стидмана. Полученные блоки с клубеньками выдерживали при 4 °С в течение 30 мин и готовили серийные срезы толщиной 16 мкм с помощью ротационного микротома HM360 («Microm», Германия).
Вместо заключения клубеньков в воск Стидмана также использовали толстые (50 мкм) срезы без заливки в среду. Для этого клубеньки после фиксации промывали в 1/3 MTSB, заключали в блоки 3 % агарозы («Хели-кон», Россия) и готовили серийные срезы толщиной 50 мкм на микротоме с вибрирующим лезвием HM650V («Microm», Германия), после чего препараты промывали в 1/3 MTSB.
Оптимизация метода иммунолокализации. С этой целью модифицировали соответствующие протоколы, описанные F. Balu s ka с со-авт. (17) и M. Stumpe с соавт. (19). Полученные срезы помещали на сила-низированные стекла, покрытые яичным белком, и расправляли добавлением дистиллированной воды. После высушивания препаратов при комнатной температуре заливочную среду удаляли 3-кратной обработкой в 96 % этаноле в течение 10 мин, затем в 70 и 40 % этаноле по 10 мин с завершающей 2-кратной инкубацией в 1/3 MTSB в течение 15 мин. Для предотвращения неспецифического связывания срезы инкубировали в блокирующем растворе (5 % бычий сывороточный альбумин, BSA), 0,5 % нормальная козья сыворотка («Sigma-Aldrich», США), 0,2 % рыбий желатин — cold water fish skin gelatin («Sigma-Aldrich», США) в 1 /3 MTSB) в течение 30 мин при 28 °С и в растворе ацетилированного BSA («Sigma-Aldrich», США) (2 мг/мл) в буфере TBS (50 мМ Tris-HCl, 150 мМ NaCl, pH 7,5) в течение 30 мин при 28 °С. Для визуализации тубулина срезы инкубировали в течение ночи при 4 °С с мышиными моноклональными первичными антителами к а-тубу-лину (клон DM1A) («Sigma-Aldrich», США) в разведении 1:1000 в 1 % BSA в TBS. Препараты промывали 5 раз по 10 мин в буфере TBS, блокировали в растворе 5 % BSA в TBS при 28 °С и инкубировали со вторичными козьими антителами к мышиному у-глобулину, конъюгированными с Alexa Fluor 488 («Life Technologies», США), в разведении 1:500 в TBS при 28 °С в течение 90 мин. Затем срезы промывали в TBS 3 раза по 10 мин, окрашивали йодидом пропидия (0,5 мкг/мл) в течение 7 мин для визуализации ядер и бактерий, еще раз промывали в TBS 3 раза по 10 мин и помещали под покровные стекла в заключающую среду ProLong Gold® antifade reagent («Thermo Fisher Scientific», США).
Паттерн микротрубочек в клетках клубенька изучали с помощью лазерный сканирующих конфокальных микроскопов LSM510 META и LSM780 («Carl Zeiss», Германия). Пространственную организацию микротрубочек в разных типах клеток клубенька анализировали с применением 636
3D реконструкции полученных изображений (программное обеспечение ZEN, «Carl Zeiss», Германия) (18).
Анализ тубулинового цитоскелета в клубеньках бобовых растений при различных методиках фиксации. Микротрубочки были выявлены во всех типах клеток клубенька гороха P. sativum , однако часто наблюдалась фрагментация и деполимеризация микротрубочек (рис. 1, А, Б). Для повышения качества визуализации микротрубочек вместо заключения клубеньков в воск Стидмана использовали толстые (50 мкм) срезы без заливки в среду. Эта методика позволила избежать длительных проводок в этаноле и этапов заключения в воск Стидмана.
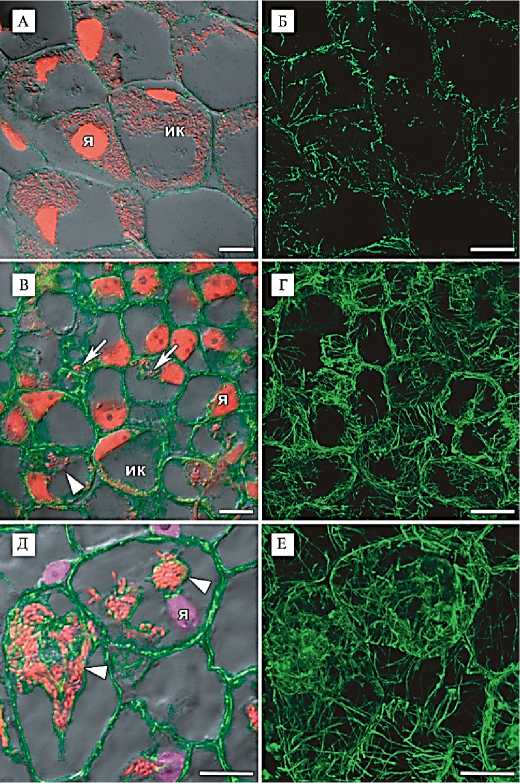
Рис. 1. Иммунолокализация тубулинового цитоскелета в симбиотических клубеньках гороха Pisum sativum L. дикого типа SGE (А-Д) и мутанта efd-1 Medicago truncatula Gaertn. (В, Г). Срезы получены при заключении в воск Стидмана (А, Б) или при заливке в 3 % агарозу (В-Е), конфокальная лазерная сканирующая микроскопия (микроскопы LSM510 META и LSM780, «Carl Zeiss», Германия). Микротрубочки фрагментированы (А, Б), кортикальные и эндоплазматические микротрубочки четко выявляются (В-Е).
А-Е: иммунолокализация тубулина, зеленый канал;
А, В: окрашивание ДНК ядер и бактерий йодистым про-пидием, красный канал;
Д: окрашивание ДНК ядер 4,6-диамидино-2-фенилиндол-дигидрохлоридом (DAPI), фиолетовый канал; локализация красного флуоресцентного белка (RFP) — визуализация бактерий, красный канал. Наложение единичного оптического среза, диф-ференциально-интерференци-онный контраст и проекции максимальной интенсивности оптических срезов в красном и зеленом каналах (А, В), зеленом, красном и фиолетовом каналах (Д). Проекции максимальной интенсивности оптических срезов в зеленом канале (Б, Г, Е). Обозначения: я — ядро, ик — инфицированная клетка; стрелка указывает на инфекционную нить, острие треугольника — на инфекционную каплю. Масштабная шкала 10 мкм.
Использование модифицированной методики на толстых срезах фиксированного материала позволило визуализировать тубулиновый цитоскелет с высоким качеством. При этом четко выявлялись как кортикальные, так и эндоплазматические микротрубочки (см. рис. 1, В, Г). При применении такого подхода стал возможен детальный анализ тубулинового цитоскелета в клетках различных гистологических зон клубеньков у гороха линий дикого типа SGE (20), Sprint-2 (21) и мутантов по симбиотиче- ским генам SGEFix--1 (sym40), SGEFix--2 (sym33) (22), Sprint-2Fix- (sym31) (23), а также изучение организации микротрубочек вокруг различных симбиотических структур — инфекционных нитей, инфекционных капель и симбиосом (18).
Однако разработанная нами методика не позволяла визуализировать тубулиновый цитоскелет с высоким качеством при изучении организации микротрубочек в симбиотических клубеньках M. truncatula . В зоне меристемы наблюдалась диффузная флуоресценция тубулина, что, возможно, связано с плохой проницаемостью клеток M. truncatula при фиксации. Для повышения проницаемости в состав фиксатора включили 10 % диметилсульфоксид (DMSO) и увеличили время откачивания воздуха до 30 мин, без вакуума клубеньки оставляли на 10 мин, всю процедуру повторяли 3 раза.
При анализе организации тубулинового цитоскелета в клубеньках M. truncatula использовали несколько генотипов: линию дикого типа А17 и полученные на ее основе мутантные линии dnf1-1 (24), efd-1 (25) и TR3 ( ipd3 ) (26, 27). Описанная выше модификация фиксатора была пригодной для клубеньков линий А17 и dnf1-1 . В то же время после фиксации клубеньки линий TR3 ( ipd3 ) и efd-1 становились слишком мягкими для приготовления срезов. Поэтому клубеньки efd-1 и TR3 ( ipd3 ) фиксировали без добавления DMSO, а в фиксирующем растворе для клубеньков TR3 ( ipd3 ) снизили концентрации Tween 20 и Triton X-100 до 0,05 %. Также было отмечено влияние концентрации солей буферного раствора, на основе которого приготовлен фиксатор. При фиксации клубеньков M. truncatula всех генотипов наблюдали сжатие клеток. Поэтому клубеньки линий А17 и dnf1-1 фиксировали с использованием буфера 1/ 6 MTSB, а клубеньки линий TR3 ( ipd3 ) и efd-1 — 1/10 MTSB. В результате высокое качество визуализации тубулинового цитоскелета было достигнуто для всех исследованных генотипов M. truncatula (18) (рис. 1, Д, Е).
Важным фактором при визуализации тубулинового цитоскелета служит возраст анализируемых клубеньков. Микротрубочки лучше сохранялись в 2-недельных клубеньках гороха и M. truncatula , чем в 4-недельных.
Анализ тубулинового цитоскелета в клетках из различных гистологических зон клубенька позволил выявить неодинаковые паттерны микротрубочек (18). Для подтверждения различий в наблюдаемых паттернах использовали количественный анализ.
Количественный анализ тубулинового цитоскелета. С этой целью мы использовали программу ImageJ (28, 29). Инструмент Angle Tool позволяет создать линию поверх анализируемого изображения, после чего формируется таблица со значениями углов наклона таких линий. Этот метод оказался крайне неудобен тем, что обрабатывается не вся клетка целиком, а лишь одна линия и, следовательно, получение данных для большого числа изображений с различно ориентированными микротрубочками в клубеньках занимает много времени. В дальнейшем мы использовали дополнительный модуль к программе ImageJ — FibrilTool (30) для определения среднего в ориентации микротрубочек в произвольно выбранной на изображении области. Примененный подход существенно сокращает время анализа микротрубочек, ориентированных сходным образом, но при их неупорядоченной ориентации (например, в азотфиксирующих клетках симбиотического клубенька) исследователь получает данные по среднему направлению, что в указанном случае не дает всей необходимой информации. Мы также использовали дополнительный программный модуль OrientedJ (31), который позволяет получить распределение ориентаций микротрубочек сразу на всем изображении, однако при этом становится невозможно разделить информацию об ориентации элементов в разных клетках. К несомненным 638
плюсам программного модуля OrientedJ следует отнести возможность получить «карту распределения» микротрубочек по частоте в зависимости от угла ориентации, каждому из которых соответствует свой цвет.
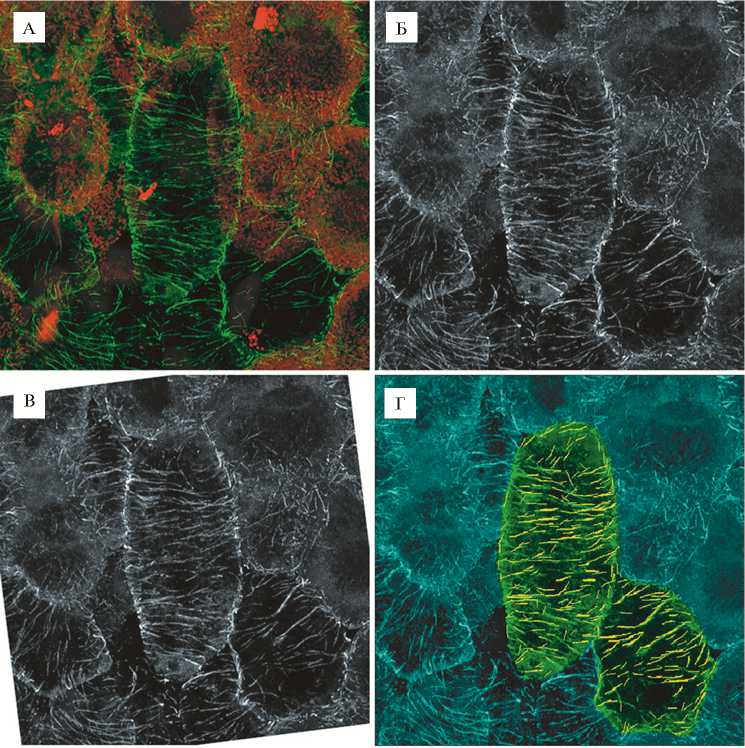
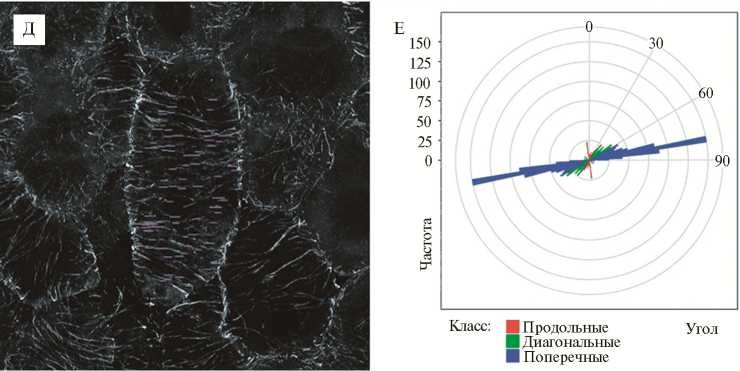
Рис. 2. Количественный анализ микротрубочек в неинфицированной клетке азотфиксирующего клубенька гороха Pisum sativum L. дикого типа SGE. Конфокальная лазерная сканирующая микроскопия (микроскоп LSM780 META, «Carl Zeiss», Германия).
А: иммунолокализация тубулина, зеленый канал, окрашивание ДНК ядер и бактерий йодистым пропидием, красный канал; проекции максимальной интенсивности оптических срезов в красном и зеленом каналах. Б: зеленый канал, переведенный в градации серо- го. В: повернутое изображение, в котором продольная ось клетки ориентирована вертикально. Г: анализ в MicroFilament Analyzer, зеленым цветом выделены проанализированные клетки, желтым — обнаруженные программой микротрубочки. Д: все микротрубочки с углом 90° (относительно продольной оси клетки), выявленные MicroFilament Analyzer в исследуемой клетке. Е: распределение обнаруженных в клетке микротрубочек по величине угла.
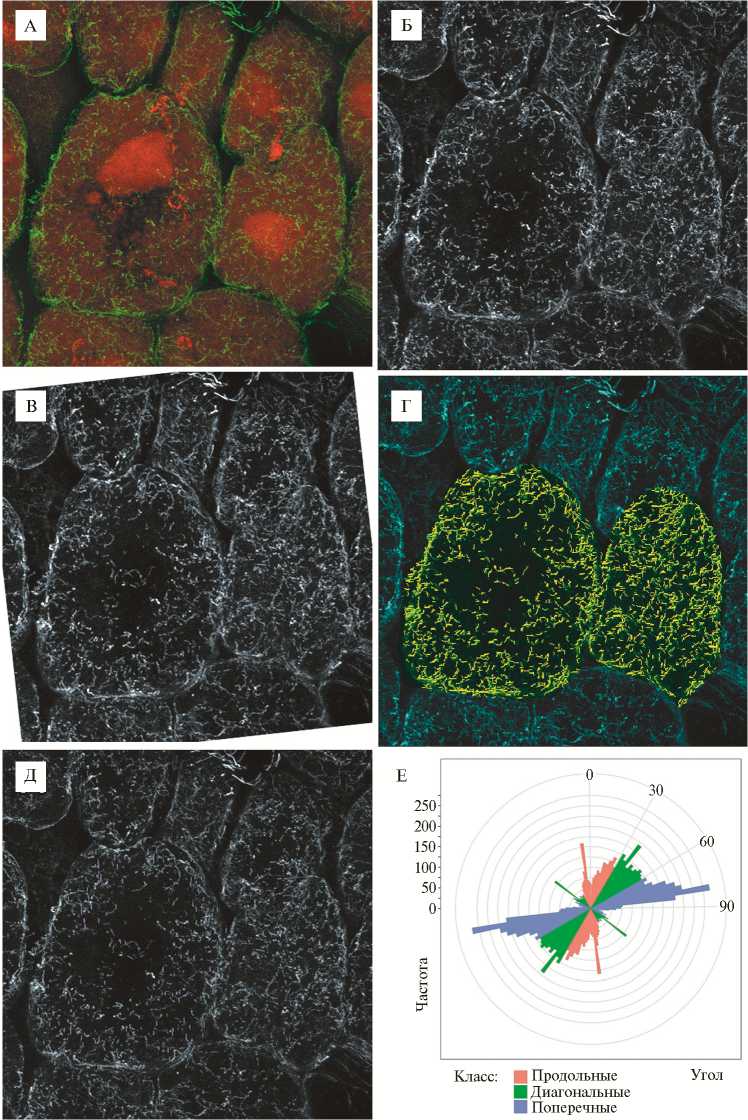
Рис. 3. Количественный анализ микротрубочек в инфицированной клетке азотфиксирующего клубенька гороха Pisum sativum L. дикого типа SGE . Конфокальная лазерная сканирующая микроскопия (микроскоп LSM510 META, «Carl Zeiss», Германия).
А: иммунолокализация тубулина, зеленый канал, окрашивание ДНК ядер и бакте- рий йодистым пропидием, красный канал; проекции максимальной интенсивности оптических срезов в красном и зеленом каналах. Б: зеленый канал, переведенный в градации серого. В: повернутое изображение, в котором продольная ось клетки ориентирована вертикально. Г: анализ в MicroFilament Analyzer, зеленым цветом выделены проанализированные клетки, желтым — обнаруженные программой микротрубочки. Д: все микротрубочки с углом 0° (относительно продольной оси клетки), выявленные MicroFilament Analyzer в исследуемой клетке. Е: распределение обнаруженных в клетке микротрубочек по величине угла.
Оптимальным оказалось использование программы MicroFilament Analyzer (32), функционал которой позволяет проводить анализ распределения микротрубочек в нескольких клетках, выделяемых на изображении как вручную, так и автоматически. На изображении детектировались отрезки микротрубочек с углом 0°, затем 1° и так далее до 179°. В результате была создана таблица, содержащая углы и координаты каждой линии, и получен график распределения частот углов.
Исходные трехмерные изображения были переведены нами в проекции максимальной интенсивности. Однако при использовании полноразмерных изображений (1024½1024 пикселя) детекция микротрубочек была затруднена. Размер изображений был уменьшен с использованием бикубической интерполяции до 512½512 пикселей. Затем выбирался канал, соответствующий тубулину, меченному антителами, который сохраняли в виде изображения в режиме градаций серого. Эти действия проводили при помощи программы ImageJ, поскольку она позволяет применять вышеизложенные операции на множестве изображений сразу благодаря встроенному языку макрокоманд. Полученные изображения далее анализировали в программе MicroFilament Analyzer. Поскольку неправильно детектированные отрезки приводили к увеличению значений частоты встречаемости некоторых углов, необходимо было минимизировать число таких отрезков. Для этого был подготовлен сценарий на языке R, который выбирал из таблицы отрезки с заданным углом (углами) и при помощи программы ImageMagick наносил линии, соответствующие им, на копию исходного изображения. Так была выполнена оценка достоверности обнаружения определенных углов программой MicroFilament Analyzer и при необходимости корректировались опции этой программы.
Для построения графиков, отображающих распределение отрезков с определенными углами в клетке, был написан сценарий на языке R, использующий пакет ggplot2 (33). Этим сценарием обрабатывалась электронная таблица, полученная в MicroFilament Analyzer. Углы пересчитывались таким образом, чтобы нулевой угол располагался на графике вертикально, а значения углов возрастали по часовой стрелке. Недостающую до полного круга половину углов добавляли и разбивали обнаруженные углы на три класса: продольные, диагональные и поперечные.
Разработанный подход мы использовали для количественного анализа тубулинового цитоскелета (распределения микротрубочек) в неинфи-цированной (рис. 2) и азотфиксирующей (рис. 3) клетках клубенька гороха. Полученные результаты подтвердили предполагаемые ранее (с использованием визуального анализа) различия в паттернах микротрубочек у клеток различных типов в симбиотическом клубеньке гороха (18).
Итак, полученные результаты убедительно демонстрируют, что изучение тубулинового цитоскелета с применением иммунолокализации в клубеньках бобовых растений характеризуется рядом особенностей. Критический фактор — состав фиксатора, который должен быть адаптирован как для каждого вида изучаемого бобового растения, так и для симбиотических мутантов этих видов. Необходимое условие — отказ от заключающих сред и получение срезов фиксированных клубеньков с помощью 641
микротома с вибрирующим лезвием, что значительно повышает сохранность структуры тубулинового цитоскелета. Также важен возраст анализируемых клубеньков. Следовательно, приступая к анализу организации тубулинового цитоскелета, нужно понимать, что такого рода исследование — нетривиальная задача, которая требует критического подхода к использованию ранее разработанных методик.
Список литературы Методические особенности изучения тубулинового цитоскелетав клубеньках бобовых растений
- Celler K., Fujita M., Kawamura E., Ambrose C., Herburger K., Holzinger A., Wasteneys G.O. Microtubules in plant cells: strategies and methods for immunofluorescence, transmission electron microscopy, and live cell imaging. In: Cytoskeleton methods and protocols. Methods in molecular biology/R.H. Gavin (ed.). Humana Press, New York, NY, 2016, V. 1365: 155-184 ( ) DOI: 10.1007/978-1-4939-3124-8_8
- Dyachok J., Paez-Garcia A., Yoo C.M., Palanichelvam K., Blancaflor E.B. Fluorescence imaging of the cytoskeleton in plant roots. In: Cytoskeleton methods and protocols: methods and protocols In: Cytoskeleton methods and protocols. Methods in molecular biology/R.H. Gavin (ed.). Humana Press, New York, NY, 2016, V. 1365: 139-153 ( ) DOI: 10.1007/978-1-4939-3124-8_7
- Iantcheva A., Mysore K.S., Ratet P. Transformation of leguminous plants to study symbiotic interactions. Int. J. Dev. Biol., 2013, 57(6-8): 577-586 ( ) DOI: 10.1387/ijdb.130239pr
- Collings D.A., Wasteneys G.O. Actin microfilament and microtubule distribution patterns in the expanding root of Arabidopsis thaliana. Can. J. Bot., 2005, 83(6): 579-590 ( ) DOI: 10.1139/b05-032
- Bakhuizen R. The plant cytoskeleton in the Rhizobium-Legume symbiosis. Ph.D. Dissertation. Leiden, The Netherlands: Leiden University, 1988.
- Timmers A.C.J., Auriac M.-C., Truchet G. Refined analysis of early symbiotic steps of the Rhizobium-Medicago interaction in relationship with microtubular cytoskeleton rearrangements. Development, 1999, 126(16): 3617-3628.
- Sieberer B.J., Timmers A.C.J., Emons A.M.C. Nod factors alter the microtubule cytoskeleton in Medicago truncatula root hairs to allow root hair orientation. Mol. Plant-Microbe Interact., 2005, 18(11): 1195-1204 ( ) DOI: 1094/MPMI-18-1195
- Vassileva V.N., Kouchi H., Ridge R.W. Microtubule dynamics in living root hairs: transient slowing by lipochitin oligosaccharide nodulation signals. Plant Cell, 2005, 17(6): 1777-1787 ( ) DOI: 10.1105/tpc.105.031641
- Timmers A.C.J., Vallotton P., Heym C., Menzel D. Microtubule dynamics in root hairs of Medicago truncatula. Eur. J. Cell Biol., 2007, 86(2): 69-83 ( ) DOI: 10.1016/j.ejcb.2006.11.001
- Perrine-Walker F.M., Lartaud M., Kouchi H., Ridge R.W. Microtubule array formation during root hair infection thread initiation and elongation in the Mesorhizobium-Lotus symbiosis. Protoplasma, 2014, 251(5): 1099-1111 ( ) DOI: 10.1007/s00709-014-0618-z
- Timmers A.C.J., Auriac M.-C., de Billy F., Truchet G. Nod factor internalization and microtubular cytoskeleton changes occur concomitantly during nodule differentiation in alfalfa. Development, 1998, 125(3): 339-349.
- Whitehead L.F., Day D.A., Hardham A.R. Cytoskeleton arrays in the cells of soybean root nodules: the role of actin microfilaments in the organisation of symbiosomes. Protoplasma, 1998, 203(3-4): 194-205 ( ) DOI: 10.1007/BF01279476
- Davidson A.L., Newcomb W. Organization of microtubules in developing pea root nodule cells. Can. J. Bot., 2001, 79(7): 777-786 ( ) DOI: 10.1139/b01-045
- Fedorova E.E., de Felipe M.R., Pueyo J.J., Lucas M. Conformation of cytoskeletal elements during the division of infected Lupinus albus L. nodule cells. J. Exp. Bot., 2007, 58(8): 2225-2236 ( ) DOI: 10.1093/jxb/erm083
- Timmers A.C.J. The role of the plant cytoskeleton in the interaction between legumes and rhizobia. Journal of Microscopy, 2008, 231(2): 247-256 ( ) DOI: 10.1111/j.1365-2818.2008.02040.x
- Norenburg J.L., Barrett J.M. Steedman's polyester wax embedment and de-embedment for combined light and scanning electron microscopy. J. Elec. Microsc. Tech., 1987, 6(1): 35-41 ( ) DOI: 10.1002/jemt.1060060106
- Baluška F., Parker J.S., Barlow P.W. Specific patterns of cortical and endoplasmic microtubules associated with cell growth and tissue differentiation in roots of maize (Zea mays L.). J. Cell Sci., 1992, 103(1): 191-200.
- Kitaeva A.B., Demchenko K.N., Tikhonovich I.A., Timmers A.C.J., Tsyganov V.E. Comparative analysis of the tubulin cytoskeleton organization in nodules of Medicago truncatula and Pisum sativum: bacterial release and bacteroid positioning correlate with characteristic microtubule rearrangements. New Phytol., 2016, 210(1): 168-183 ( ) DOI: 10.1111/nph.13792
- Stumpe M., Göbel C., Demchenko K., Hoffmann M., Klösgen R.B., Pawlowski K., Feussner I. Identification of an allene oxide synthase (CYP74C) that leads to formation of a-ketols from 9-hydroperoxides of linoleic and linolenic acid in below-ground organs of potato. Plant J., 2006, 47(6): 883-896 ( ) DOI: 10.1111/j.1365-313X.2006.02843.x
- Kosterin O.E., Rozov S.M. Mapping of the new mutation blb and the problem of integrity of linkage group I. Pisum Genetics, 1993, 25: 27-31.
- Бердников В.А., Розов С.М., Богданова B.C. Создание серии лабораторных линий гороха. Мат. конф. «Частная генетика растений» (23-25 мая 1989 года, г. Киев). Киев, 1989, т. 2: 47-51.
- Tsyganov V.E., Morzhina E.V., Stefanov S.Y., Borisov A.Y., Lebsky V.K., Tikhonovich I.A. The pea (Pisum sativum L.) genes sym33 and sym40 control infection thread formation and root nodule function. Mol. Gen. Genet., 1998, 256(5): 491-503 ( ) DOI: 10.1007/s004380050840
- Borisov A.Y., Rozov S.M., Tsyganov V.E., Kulikova O.A., Kolycheva A.N., Yakobi, L.M., Ovtsyna A.O., Tikhonovich I.A. Identification of symbiotic genes in pea (Pisum sativum L.) by means of experimental mutagenesis. Russ. J. Genet., 1994, 30(11): 1284-1292.
- Wang D., Griffitts J., Starker C., Fedorova E., Limpens E., Ivanov S., Bisseling T., Long S. Nodule-specific protein secretory pathway required for nitrogen-fixing symbiosis. Science, 2010, 327(5969): 1126-1129 ( ) DOI: 10.1126/science.1184096
- Vernié T., Moreau S., De Billy F., Plet J., Combier J.P., Rogers C., Oldroyd G., Frugier F., Niebel A., Gamas P. EFD is an ERF transcription factor involved in the control of nodule number and differentiation in Medicago truncatula. Plant Cell, 2008, 20(10): 2696-2713 ( ) DOI: 10.1105/tpc.108.059857
- Maunoury N., Redondo-Nieto M., Bourcy M., Van de Velde W., Alunni B., Laporte P., Durand P., Agier N., Marisa L., Vaubert D., Delacroix H., Duc G., Ratet P., Aggerbeck L., Kondorosi E., Mergaert P. Differentiation of symbiotic cells and endosymbionts in Medicago truncatula nodulation are coupled to two transcriptome-switches. PLoS ONE, 2010, 5(3): e9519 ( ) DOI: 10.1371/journal.pone.0009519
- Ovchinnikova E., Journet E.-P., Chabaud M., Cosson V., Ratet P., Duc G., Fedorova E., Liu W., den Camp R.O., Zhukov V., Tikhonovich I., Borisov A., Bisseling T., Limpens E. IPD3 controls the formation of nitrogen-fixing symbiosomes in pea and Medicago spp. Mol. Plant-Microbe Interact., 2011, 24(11): 1333-1344 ( ) DOI: 10.1094/MPMI-01-11-0013
- Schindelin J., Arganda-Carreras I., Frise E., Kaynig,V., Longair M., Pietzsch T., Preibisch S., Rueden C., Saalfeld S., Schmid B., Tinevez J.Y., White D.J., Hartenstein V., Eliceiri K., Tomancak P., Cardona A. Fiji: an open-source platform for biological-image analysis. Nat. Methods, 2012, 9(7): 676-682 ( ) DOI: 10.1038/nmeth.2019
- Sampathkumar A., Lindeboom J.J., Debolt S., Gutierrez R., Ehrhardt D.W., Ketelaar T., Persson S. Live cell imaging reveals structural associations between the actin and microtubule cytoskeleton in Arabidopsis. Plant Cell, 2011, 23(6): 2302-2313 ( ) DOI: 10.1105/tpc.111.087940
- Boudaoud A., Burian A., Borowska-Wykręt D., Uyttewaal M., Wrzalik R., Kwiatkowska D., Hamant O. FibrilTool, an ImageJ plug-in to quantify fibrillar structures in raw microscopy images. Nat. Protoc., 2014, 9(2): 457-463 ( ) DOI: 10.1038/nprot.2014.024
- Rezakhaniha R., Agianniotis A., Schrauwen J.T.C., Griffa A., Sage D., Bouten C.V.C., van de Vosse F.N., Unser M., Stergiopulos N. Experimental investigation of collagen waviness and orientation in the arterial adventitia using confocal laser scanning microscopy. Biomech. Model. Mechanobiol., 2012, 11(3-4): 461-473 ( ) DOI: 10.1007/s10237-011-0325-z
- Jacques E., Buytaert, J., Wells D.M., Lewandowski M., Bennett M.J., Dirckx J., Verbelen J.P., Vissenberg K. MicroFilament Analyzer, an image analysis tool for quantifying fibrillar orientation, reveals changes in microtubule organization during gravitropism. Plant J., 2013, 74(6): 1045-1058 ( ) DOI: 10.1111/tpj.12174
- Wickham H. ggplot2: Elegant graphics for data analysis. 2nd Edition. Springer International Publishing, 2016 ( ) DOI: 10.1007/978-3-319-24277-4


