Методические подходы к экспериментальному тестированию резистентности клеток опухоли человека к химиотерапии
Автор: Кирсанов Кирилл Игоревич, Кузин Константин Александрович, Фетисов Тимур Игоревич, Лесовая Екатерина Андреевна, Белицкий Геннадий Альтерович, Якубовская Марианна Геннадиевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 3 т.19, 2020 года.
Бесплатный доступ
Цель исследования - анализ существующих методических подходов к экспериментальному тестированию резистентности к химиотерапии и оценка перспектив их дальнейшего применения. Материал и методы. При подготовке обзора были проанализированы статьи по теме экспериментального тестирования резистентности опухоли к химиопрепаратам, имеющиеся в информационных базах биомедицинской литературы SciVerse Scopus (748), PubMed (1727), Web of Science (1025), РИНЦ (125). Для получения полнотекстовых документов были использованы электронные ресурсы Research Gate, РИНЦ, КиберЛенинка. В тексте обзора были процитированы 42 современные публикации (2012-19 гг.), а также 18 статей основоположников методик, анализируемых в обзоре, которые используются и в наши дни. Результаты. В обзоре рассмотрены особенности основных методов оценки резистентности/чувствительности опухолевых клеток, получаемых из биопсийного/операционного материала к различным химиопрепаратам при их культивировании in vitro в монослое и суспензионных культурах, в виде сфероидов, гисто- и органокультур, а также при получении in vivo ксенографтов опухоли на иммунодефицитных мышах. При тестировании в качестве основных оцениваемых характеристик опухолевых клеток рассматриваются пролиферативная и метаболическая активность, уровень клеточной гибели. При этом основными показателями выступают интенсивность синтеза ДНК, уровень белка или АТФ в клетке, активность NADН-дегидрогеназ, уровень апоптоза, целостность клеточных структур. Обсуждены преимущества и недостатки описываемых методов, а также перспективы их дальнейшего применения. Заключение. За прошедшие полвека использования экспериментального тестирования резистентности опухолевых клеток в целях персонализации химиотерапевтического лечения произошедшая эволюция методических подходов заключалась в повышении безопасности их проведения и чувствительности за счет использования флуоресцентных соединений. Общий вектор совершенствования экспериментов по персонализации химиотерапии опухолей направлен на приближение условий эксперимента к процессам, происходящим в организме человека. Каждый из этих методов имеет свой диапазон предсказательной силы и при адекватном использовании может дать полезный ориентир для лечения.
Опухоль, культура клеток, гистокультуры, сфероиды, ксенографты, цитостатики, таргетные препараты, резистентность
Короткий адрес: https://sciup.org/140254344
IDR: 140254344 | УДК: 616-006.04-08:615.28:615.015.8]-092 | DOI: 10.21294/1814-4861-2020-19-3-122-136
Текст обзорной статьи Методические подходы к экспериментальному тестированию резистентности клеток опухоли человека к химиотерапии
The purpose of the study was to analyze the existing methodological approaches to the experimental testing of resistance to chemotherapy and assess the prospects for their further application. Material and Methods. We analyzed publications regarding the experimental testing of tumor resistance to chemotherapy available in the databases, such as SciVerse Scopus (748), PubMed (1727), Web of Science (1025), RSCI (125). To obtain fulltext publications, the electronic resources of Research Gate, RSCI, CyberLenink were used. Forty-two modern publications (2012–19) including 18 articles of the founders of the methods analyzed in the review were cited. Results. The review discusses the characteristics of the main methods for assessing the resistance / sensitivity of tumor cells obtained from biopsy / surgical specimens to various chemotherapy drugs in vitro in monolayer and suspension cultures, in the form of spheroids, histo and organocultures, as well as in vivo xenografts of tumors in immunodeficient mice. During testing, the proliferative and metabolic activities as well as the level of cell death were considered as the main evaluated characteristics of tumor cells. The main indicators were the intensity of DNA synthesis, the level of protein or ATP in the cell, the activity of NADH-dehydrogenases, the level of apoptosis, and the integrity of cell structures. The advantages and disadvantages of the described methods, as well as the prospects for their further application were discussed. Conclusion. Over the past half century of using the experimental testing of tumor cell resistance in order to personalize chemotherapeutic treatment, the evolution of methodological approaches was based on the increase in their safety and sensitivity through the use of fluorescent compounds. The general vector for improving experiments on the personalization of tumor chemotherapy is aimed at approximating the experimental conditions to the processes occurring in the human body. Each of these methods has its own range of predictive power and, if used properly, can provide a useful guide for treatment.
Актуальность развития экспериментального тестирования резистентности опухолевых клеток пациента к химиотерапии
Прогресс двух последних десятилетий в лечении онкозаболеваний в основном обусловлен внедрением персонализированного подхода с использованием таргетных препаратов, позволивших существенно увеличить продолжительность жизни отдельным категориям пациентов. Однако таргетные препараты эффективны лишь при наличии определенных генетических и эпигенетических нарушений, которые выявляются лишь у небольшой части пациентов [1, 2]. Другим ограничением таргетной терапии является относительно быстрое развитие резистентности к лечению, что обусловлено гетерогенностью опухоли и нестабильностью генома опухолевой клетки [2]. Следует отметить, что даже в случае выявления нарушений, соответствующих мишени для таргет-ного препарата, дорогостоящее лечение не всегда оказывается эффективным. Так, при раке молочной железы в случае выявленной иммуногистохимически гиперэкспрессии HER-2/neu применение трастузумаба вызвало объективный эффект у 26 % больных [3]. При немелкоклеточном раке легкого и наличии мутации EGFR терапия гефатинибом оказалась эффективна у 62 % пациентов [4]. При лечении сарком мягких тканей, в патогенезе которых ангиогенез играет ключевую роль, одобрен для использования ингибитор VEGF бевацизумаб, который вызывает объективный терапевтический эффект у 12 % и стабилизирует процесс у 65 % пациентов [5]. Другим ограничением использования биомаркеров для персонализации химиотерапии является тот факт, что прогноз потенциальной резистентности дается лишь в отношении таргетных препаратов, а не возможных их комбинаций с цитостатиками.
При отсутствии биомаркеров, позволяющих использовать таргетную терапию, а также при развитии резистентности к таргетному препарату обычно применяют классические цитостатики. Для целого ряда онкозаболеваний цитостатики применяют в первой линии терапии. Клинические рекомендации к проведению химиотерапии с использованием цитостатиков основаны на эмпирических данных, полученных на больших когортах пациентов, свидетельствующих о потенциальном терапевтическом эффекте [6]. При этом в качестве основных характеристик групп пациентов рассматриваются гистологический тип опухоли и стадия заболевания. Персонализированный подход при проведении лечения цитостатиками практически не используется.
Тем не менее эффективность химиотерапии цитостатиками во многом обусловлена индивидуальной чувствительностью опухоли пациента к применяемым препаратам, что определяется специфическим профилем экспрессии генов и зависит от самых разнообразных параметров как опухолевой клетки, так и организма в целом. Наиболее важными показателями являются активность метаболизма препарата в действующее производное в организме больного, активность систем репарации и множественной лекарственной устойчивости, уровень апоптоза и воспаления. Теоретически прогноз потенциальной эффективности классической химиотерапии может быть сделан на основе молекулярно-генетического анализа опухолевых клеток, результатов молекулярно-биологических, иммуногистохимических, биохимических исследований. Так, наличие мутаций в генах BRCA1/2 , вовлеченных в процесс репарации ДНК, существенно повышает вероятность чувствительности опухолевых клеток к соединениям платины; наличие определенных изоформ цитохрома Р-450 и других ферментов, необходимых для активации препарата, повышает вероятность эффективного воздействия цитостатика, однако значимость таких прогнозов невысока [7].
В то же время химиотерапевтическое лечение онкозаболеваний с применением цитостатиков является высокотоксичным. Таргетные препараты при меньшем угнетающем действии на кроветворение также могут вызывать нежелательные побочные эффекты в виде кардиотоксичности, кожной сыпи, диареи, аллергических реакций, слабости, а в некоторых случаях приводить к гибели пациента [8]. Неоправданное применение как цитостатиков, так и таргетных препаратов приводит лишь к существенному ухудшению состояния пациента. В связи с вышеизложенным повышение эффективности прогноза резистентности к химиопрепаратам представляет собой актуальную задачу.
Активно развиваемым подходом для персонализации химиотерапии является экспериментальное выявление резистентности/чувствительности опухолевых клеток к потенциальным комбинациям пре- паратов. Этот подход впервые был предложен еще в 1950-е гг. [9]. К настоящему времени разработаны различные методические варианты экспериментального тестирования резистентности/чувствитель-ности к химиотерапии (CSR-тесты, Chemotherapy Sensitivity and Resistance assays) [10–12]. Экспериментальное выявление клона клеток, на который тестируемый препарат не оказывает цитотоксического, антипролиферативного и проапоптотического действия, позволяет дать прогноз о резистентности опухоли к химиотерапии с использованием тестируемых препаратов или их комбинаций. Теоретически прогностическая значимость выявления резистентности к химиотерапии, т.е. выявления клона опухолевых клеток, устойчивых к химиопрепарату, должна быть близка к 100 %. В то же время эффективность прогноза на основе выявленной чувствительности к препарату, несмотря на реципрокность понятий резистентности и чувствительности, должна быть существенно ниже из-за гетерогенности опухоли и возможности существования резистентного клона в опухолевой ткани, не попавшей в анализируемый образец. Кроме того, нередко опухолевая прогрессия приводит к быстрому развитию резистентности в силу нестабильности генома опухолевой клетки. Данные экспериментального тестирования о потенциальной резистентности опухоли к препарату позволяют избежать неоправданного (бесполезного) применения высокотоксичной химиотерапии, ухудшающей общее состояние больного.
Кроме того, данные экспериментального тестирования резистентности опухолевых клеток к цитостатикам потенциально могут быть также использованы при определении эффективной дозы препарата, поскольку для пациента повышение или понижение используемой дозы цитостатика отражается на степени развития побочных эффектов и возможности применения препарата в целом. В настоящее время ни один из методов экспериментального тестирования потенциальной резистентности опухоли к химиопрепарату не внедрен в клиническую практику, в то же время развитие этого направления рассматривается в качестве одной из приоритетных задач современной клинической онкологии [13].
Наиболее активно для экспериментального определения резистентности к химиотерапии используют тест-системы in vitro на основе первичных культур клеток опухоли пациента, растущих в монослое или образующих трехмерные сложные структуры. Кроме того, предложены методы исследования резистентности опухоли к цитостатическим препаратам in vivo , основанные на использовании ксенографтов опухолей, полученных от пациентов (patient-derived xenografts, PDX).
Целью исследования является анализ существующих методических подходов к экспериментальному тестированию резистентности к химиотерапии и оценка перспектив их дальнейшего применения.
Экспериментальное тестирование резистентности опухоли к химиопрепаратам на основе первичных культур опухолевых клеток
Использование первичных культур опухолевых клеток в CSR-тестах на резистентность и чувствительность к химиотерапии в настоящее время является перспективным подходом при выборе оптимального препарата для проведения химиотерапии злокачественных новообразований [10, 14]. В сочетании с биохимическими, гистологическими и генетическими исследованиями использование CSR-тестов делает возможным переход к персонифицированной медицине в онкологической практике, в частности, позволяет оценить чувствительность опухолевых клеток конкретного пациента к препарату/комби-нации препаратов по цитотоксическому эффекту на разных этапах химиотерапии и проанализировать in vitro характер взаимодействия фармакологических препаратов при их комбинировании с целью выявления типа взаимодействия: синергического, аддитивного или антагонистического.
В настоящее время используют несколько типов CSR-тестов, в основе которых лежит выделение клеток из опухоли или других биологических образцов пациента, их инкубация с исследуемыми препаратами и количественная оценка показателя, по которому судят о величине цитотоксического эффекта [12]. Выделение клеток для перевода в культуру является первой стадией теста, успех которой определяет количество жизнеспособных клеток в начале эксперимента и, соответственно, адекватность тестирования. При работе с эпителиальными опухолями с хорошо развитой системой плотных, адгезионных и щелевых межклеточных контактов, разделение клеток представляет собой довольно трудоемкий процесс. Разделение можно проводить механическим способом – гомогенизацией, однако данный способ дает малый выход жизнеспособных опухолевых клеток. Существует также ряд ферментов, способных расщеплять межклеточные контакты с различной степенью эффективности. К ферментам со слабой и средней эффективностью расщепления относят коллагеназы 1–4 типа со специфичностью к связям X-Gly, ДНКазы I и нейтральные протеазы. К ферментам с более высокой протеолитической активностью относят сериновые протеазы, трипсин и эластазы, а также сульфгидрильные протеазы папаина. В настоящее время не существует универсальных протоколов по разделению клеток конкретного типа ткани, и потому подбор ферментов или смеси ферментов для оптимального разделения клеток осуществляется эмпирически для каждого типа опухоли [15].
Условия культивирования полученных клеток опухоли с химиопрепаратами также могут существенно различаться. В большинстве случаев влияние исследуемых препаратов на клетки оценивают в терапевтических и околотерапевтических дозах. Однако высокой прогностической значимостью обладает тест на резистентность с использованием высоких доз лекарственного препарата (extreme drug resistance assay, EDRA/Kern assay), применяемый на практике уже более 30 лет, в котором образцы инкубируют с химиопрепаратами в дозах, в 10–100 раз превышающих терапевтические, и оценивают количество клеток с экстремальной устойчивостью к исследуемому препарату [16].
CSR-тесты можно условно разделить на двухмерные, в которых модельной системой является монослой клеток, и трехмерные, представляющие собой многослойные агрегаты клеток (табл. 1). В свою очередь, трехмерные клеточные системы могут быть получены: 1) при росте колоний в формообразующей матрице; 2) при расщеплении опухолевого материала пациента коллагеназой до кластеров в 50–100 клеток, которые при культивировании во флаконах с L-полилизином растут в виде сфероидов; 3) при культивировании фрагментов опухоли 1–2 мм на коллагеновой подложке или на границе раздела фаз (гисто- и органокультуры). Двухмерные культуры более просты в обращении, однако трехмерные модели обеспечивают более схожее биологическое микроокружение и некоторое моделирование структуры исходной опухоли [17, 18]. Отдельно следует выделить первичные суспензионные культуры, в которых клетки занимают весь объем среды. Это накладывает ряд методических ограничений, однако позволяет оценивать оптическую плотность суспензии и светорассеяние, служащие показателями жизнеспособности клеток или степени индукции в них апоптоза [19].
В качестве основных показателей в тестах на резистентность опухоли к тестируемым химиопрепаратам оценивают количественные показатели активности ряда процессов в опухолевых клетках при действии препаратов, в частности пролиферации, метаболизма и клеточной гибели. Для определения пролиферативной активности клеток проводят оценку уровня синтеза ДНК по включению 3[Н]-тимидина. Оцениваемым параметром является интенсивность радиоактивности в пересчете на количество клеток. Этот метод активно использовался в конце прошлого столетия при тестировании резистентности к химиопрепаратам опухолей различных нозологических форм, поскольку он быстр в выполнении и в ряде исследований показал высокую прогностическую значимость (97 %) при выявлении резистентности опухоли к препарату [20]. Метод используется и для определения пролиферативной активности опухолевых клеток гистокультур, полученных из образцов опухолей [21]. Однако использование радиоактивного 3[Н]-тимидина является существенным ограничением данного метода, и в настоящее время вместо 3[Н]-тимидина стал более активно использоваться 5-бром-2’-дезоксиуридин, детекция которого проводится с помощью BrdU-
Таблица 1/Table 1




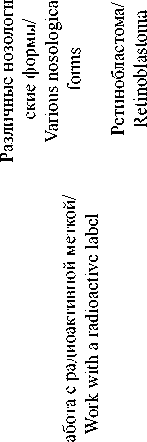


Рак яичников/ Ovarian cancer
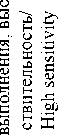
и 5
я _
s У ^
s 5 щ cc

юршвгед /diawBdBn
Xpupe о\цвр[ ipp /Ч1Э0ННИ1ЯВ квнниIвdэф^шodп
snaa jo Ajiaijob aipqBpjAi /solars чионнщяв квяэаышодв1ар\[
Глиома/ Glioma

s
- s к
у

с
О
>s
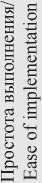

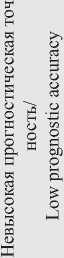

S
ш й о

spao jo Хцлтрр opoqppp\[
/ЯОХОКЯ ЧХЭ0Н8ИХЯВ К^ЛЭ0ЬИЕ0д^19]Д[ фвэр дао jo иорэпрщ /яохэкя ииэдил киПяХСнл
Трехмерные культуры опухолевых клеток – гистокультуры/Three-dimensional tumor cell cultures – histocultures
s
2 s у
s
СУ
Г
СУ
сУ ЕС S п S 5 S
К
еч
S




Д тлрэв MpBjajnoij /чхэонаих -Ж KEH8ИjLEd9фиU0dц
яцаэ jo Х)1лрэв Э1рдвр]Д[ /Я01Э1М Ч1эонни1яв квязэышодв1Эр\[
Х)тлрэв элдвдэррдд /Ч1эонни1яв квнниIвdэф^шodп
о


spaa лошщ щвэр + Лрлрэв элрвлэ^ролд
/яолают хннагохХпо чгэдил + члэоннишв квнниlвdaфиrodп
spaa дошщ щвэр + Лрлрэв aApBiajpojj /ЯО1Э1М хннэгохХпо чгэдил + члэонниляв квнниlвdэф^шodп антител [22]. Следует отметить, что при определении пролиферативной активности как с 3[Н]-тимидином, так и с 5-бром-2’-дезоксиуридином не учитывается тот факт, что стволовые клетки находятся в фазе G0, в которой не происходит синтез ДНК. Это может приводить к некоторой недооценке количества жизнеспособных клеток и, таким образом, недооценке уровня резистентности.
Оценка жизнеспособности клеток по их метаболической активности может проводиться в нескольких вариантах. Метаболическая активность может быть оценена по уровню белка в опухолевых клетках после экспозиции препарата, который прямо пропорционален количеству живых клеток [23]. Определение данного показателя проводят с помощью окрашивания клеток сульфородамином В (sulforodamine B assay, SRB), который способен связывать аминокислоты [23, 24].
Метаболическая активность в опухолевых клетках может быть также определена по интенсивности восстановления форм 3-4,5-диметилтиазол-2-ил-2,5-дифенилтетразола (МТТ-реагента) или других солей тетразолия (MTS, XTT, или WST) до голубого кристаллического формазана, растворимого в диметилсульфоксиде (ДМСО) и определяемого колориметрически. Оптическая плотность лизата клеток после инкубации с исследуемыми препаратами и МТТ-реагентом прямо пропорциональна количеству метаболически активных клеток. Процедура детекции является терминальной точкой эксперимента, поскольку для колориметрической оценки необходим лизис клеток [25–27]. Это обусловливает необходимость большого количества опухолевых клеток для изучения динамики влияния химиопрепарата. Данный метод получил широкое распространение, в том числе и при определении жизнеспособности опухолевых клеток в гистокультурах [28].
В последнее время большее распространение получил метод определения жизнеспособных клеток по уровню АТФ с использованием люциферина, превращение которого в оксилюциферин катализирует АТР. Уровень биолюминесценции оксилюциферина прямо пропорционален числу жизнеспособных клеток [29]. Этот метод обладает большей чувствительностью (позволяет выявить меньшее количество жизнеспособных клеток), чем МТТ, однако измерение уровня АТФ также является терминальной точкой эксперимента. Этот подход был апробирован в целом ряде исследований, выполненных на опухолевых клетках пациентов с различными нозологическими формами онкозаболеваний [30–35].
Еще одним вариантом определения метаболической активности клеток является метод, в котором основным показателем является степень восстановления голубого нефлуоресцирующего резазурина до флуоресцентного резоруфина розового цвета, что фиксируется колориметрически или флуори-метрически. Основным преимуществом данного метода является растворимость резоруфина в воде, что позволяет проводить оценку эффекта препарата в динамике путем многократного анализа одного и того же образца опухолевых клеток [36, 37]. Метод также применим в отношении трехмерных культур опухолевых клеток [38].
При определении жизнеспособности опухолевых клеток по их метаболической активности в число жизнеспособных клеток включается часть клеточной популяции, находящаяся в фазе G 0 , которая состоит из стволовых клеток и тех клеток, в которых под действием препарата произошел арест клеточного цикла. Оценка степени индукции гибели клеток также может быть проведена с использованием нескольких методических подходов. Наиболее распространенным подходом является анализ индукции наиболее важного механизма гибели клеток – апоптоза. Существует целый ряд методов определения индукции апоптоза. Достаточно распространен метод с использованием окрашивания опухолевых клеток аннексином 5, который взаимодействует с фосфатидилсерином, перемещающимся после запуска апоптоза на внешний слой плазматической мембраны [39]. Благодаря использованию флуоресцентно-меченного аннексина 5 данный метод обладает высокой чувствительностью.
Анализ степени индукции апоптоза можно проводить на основании оценки изменения оптической плотности (microculture kinetic (MiCK) assay) и светорассеяния клеточной суспензии [19, 40, 41]. В погибших клетках наблюдается нарушение проницаемости цитоплазматической мембраны, что позволяет дифференцировать живые и мертвые клетки путем окрашивания клеток соединениями типа нейтрального красного, нигрозина В, акридина оранжевого, трипанового синего и др. Используемые в нетоксических концентрациях, эти соединения в живых клетках откладываются в комплексе Гольджи в виде гранул, оставляя ядро и цитоплазму неокрашенными. Поврежденные клетки теряют способность образовывать гранулы и прокрашиваются диффузно. При оценке жизнеспособности клеток в трехмерных моделях применяют набор красителей. В частности, дифференцированное окрашивание клеток на цитотоксичность (differential staining cytotoxicity assay, DiSC) проводится после культивирования трехмерных кластеров свежих опухолевых клеток с испытуемыми препаратами, добавления красителя Fast Green, переноса на предметные стекла и окрашивания гематоксилин-эозином или раствором Гимза [42]. Мертвые клетки прокрашиваются диффузно в сине-зеленый цвет.
Методическим подходом, позволяющим одновременно оценивать как пролиферативную активность опухолевых клеток, так и индукцию их гибели в присутствии тестируемого препарата, является анализ способности опухолевых клеток формировать колонии. Принцип метода основан на одновременном подсчете как числа колоний, образованных опухолевыми клетками, так и числа погибших клеток, вы- являемых с помощью окрашивания гематоксилином и эозином и последующим анализом морфологии клеток. При этом тестирование можно проводить как в монослое, так и при культивировании клеток в мягком агаре [43–45]. При одном из вариантов данного теста опухолевые клетки помещают в коллагеновый гель (Collagen gel droplet embedded culture drug sensitivity test, CD-DST) и инкубируют полученные «капли» в культуральной среде, содержащей тестируемый препарат, а затем в течение 7 сут наблюдают способность клеток, инкорпорированных в коллаген, образовывать колонии [46, 47]. Дополнительным параметром, учитываемым при выполнении теста на образование колоний, можно рассматривать анализ динамики размеров колоний/ сфероидов после обработки тестируемыми химиопрепаратами [48].
При использовании методических подходов, при которых окраска погибших клеток происходит за счет нарушения целостности цитоплазматической мембраны, в качестве живых клеток учитываются как активно пролиферирующие, так и находящиеся в G0-фазе и на стадии инициации клеточной гибели, что приводит к несколько большему завышению резистентности, чем при определении жизнеспособности по метаболической активности [49]. Однако анализ динамики роста опухолевых клеток с постановкой соответствующих положительных и отрицательных контролей позволяет либо учесть эту ошибку, либо сделать ее незначительной. Измерения показателей клеток в динамике также позволяют проанализировать тип действия препарата, выбрать оптимальные временные интервалы инкубации с исследуемыми препаратами, а также зафиксировать гибель клетки непосредственно при ее наступлении, а не по окончании времени эксперимента. Методические подходы, позволяющие оценивать рост клеток в режиме реального времени, в настоящее время интенсивно развивают и вводят в лабораторную практику. Так, описан метод оценки жизнеспособности клеток в режиме реального времени, при котором основным показателем является восстановительный потенциал/метаболическая активность клеток, определяемая по высвобождению люминесцентного красителя из клеток во внеклеточную среду. Данный подход был описан не только для двумерных, но и для трехмерных клеточных моделей [50, 51]. Другим описанным в литературе показателем, используемым для оценки гибели клеток в динамике, является уровень потребления кислорода. Методика основана на инкубации клеток в камере, позволяющей измерять парциальное давление кислорода и вести расчет на основании полученных данных [52]. Другим исследовательским коллективом была разработана многоканальная система визуализации клеточной культуры, позволяющая наблюдать гибель клеток в режиме реального времени [53]. Наблюдение жизнеспособности трехмерных культур в динамике возможно с использованием электроимпедансной томографии, позволяющей визуализировать пространственное распределение проводимости внутри объекта [54, 55]. По измерению электрической емкости клеток возможно также оценить степень протекания эндоцитоза, напрямую зависящего от жизнеспособности клеток, что применимо также и к двумерным культурам [56]. Отдельными исследовательскими группами был предложен и апробирован подход с получением клеток, транс-дуцированных вектором, экспрессирующим ген люциферазы Metridia, активность которой возможно определить в культуральной среде [57]. Однако следует отметить, что в литературе к настоящему моменту не было описано применения подходов с измерением показателей клетки в динамике для изучения чувствительности опухолевых клеток конкретных пациентов с целью оптимизации получаемого ими лечения.
У методов, применяемых для оценки показателей, описанных выше, существует большое количество разновидностей, апробированных на выборках пациентов с определенной нозологической формой онкозаболевания. Несомненным достоинством большинства CSR-тестов является относительно короткий срок получения результатов, возможность полной или частичной автоматизации процесса, а также потенциал для оптимизации данных методов в отношении оценки жизнеспособности клеток в динамике в режиме реального времени.
Методы исследования чувствительности опухоли к цитостатикам in vivo
Микроокружение опухоли может существенно влиять на ее резистентность к химиотерапии. Трехмерные системы in vitro не являются в полной мере адекватной моделью опухолевого роста в организме. Кроме того, наблюдается отсутствие четкой корреляции между попадающими в опухолевые клетки дозами химиопрепаратов in vitro и in vivo .
Идея об имплантации опухолевых клеток пациента животному-хозяину была высказана еще в 40-х гг. XX в. В первых экспериментах по определению резистентности опухоли к химиопрепаратам in vivo использовали перевивку опухолевых клеток пациента в почечную капсулу иммунокомпетентных животных (SubRenal Capsule Assay, SRCA). В этом случае эффективность имплантации опухолевых клеток иммунокомпетентным мышам не отличалась от данного показателя у иммунодефицитных животных, и через 6 дней после перевивки ксенографты достигали размера, достаточного для проведения экспериментальных процедур [58].
С развитием технологий получения генетически модифицированных иммунодефицитных животных использование ксенографтов опухолей, полученных от пациентов (patientderived xenograft, PDX), стало более реальным. В настоящее время в экспериментах с PDX-моделями используют четыре типа иммунодефицитных мышей: 1) голые мыши Nude (Nu) с му- тацией в гене регулятора созревания Т-лимфоцитов FOXN1, что ведет к недоразвитому тимусу или его отсутствию; 2) мыши c острым комбинированным иммунодефицитом (severe combined immunodeficient mice, SCID), у которых не способны созревать как Т-, так и В-клетки иммунной системы; 3) мыши SCID с диабетом без ожирения (non-obese diabetic/ SCID mice, NOD/SCID), степень иммунодефицита у которых повышена по сравнению с мышами SCID; 4) мыши NOD/SCID с мутацией в гене IL2RG (NSG), характеризующиеся дефицитом Т-, В- и NK-клеток [59, 60]. Для мышей NSG эффективность имплантации наиболее высока и составляет до 85–90 %, что было показано, в частности, на модели немелкоклеточного рака легких [61] и рака яичников [62].
Индивидуальные методики подготовки опухолевых клеток к имплантации и непосредственно техника имплантации могут различаться у отдельных групп исследователей. Опухолевая ткань может быть получена из послеоперационных образцов, образцов биопсии, асцитной жидкости и циркулирующих опухолевых клеток [62]. Тканевые образцы могут измельчать до фрагментов 1–2 мм3 или до суспензии с единичными клетками с использованием механических гомогенизаторов или смеси ферментов. Имплантацию проводят в культуральной среде, физиологическом растворе, а в случае суспензионных клеток с низкой способностью к адгезии – в присутствии формообразующей матрицы Matrigel или стромальных фибробластов [63, 64]. Наиболее распространенным способом введения опухолевых клеток является подкожный, однако ортотопическая имплантация более эффективна. Время роста опухолевого узла может варьировать в зависимости от типа опухолевых клеток и их количества от нескольких дней до 1 года. По достижении опухолевым узлом размера порядка 15 мм3 допустимо проводить забор опухолевого материала для имплантации последующему поколению мышей и непосредственно для проведения экспериментальных процедур.
Оценку чувствительности/резистентности опухоли к исследуемым препаратам проводят, в первую очередь, по торможению роста опухолевого узла путем регулярного измерения его размеров, а также по гистологическим, морфологическим и генетическим характеристикам опухолевой ткани, определяемым после окончания эксперимента [65]. Недостатком данного подхода является отсутствие информации о специфике опухолевого роста в динамике. Альтернативным подходом к оценке жизнеспособности опухоли является использование магнитнорезонансной томографии, позволяющей отследить, помимо динамики опухолевого роста, определенные характеристики микроокружения опухоли (давление интерстициальной жидкости, плотность сосудов и др.) [66]. Получение ксенографтов, экспрессирующих специфический люминесцентный или флуоресцентный маркер, также предоставляет возможность оценки жизнеспособности опухолевых клеток и их способности к метастазированию в режиме реального времени [67].
Спорным моментом в использовании модельной системы PDX является взаимное влияние опухолевых клеток человека и микроокружения мыши. Биоинформатический анализ профилей экспрессии генов в более чем 1000 образцах ксенографтов 24 типов злокачественных новообразований показал, что в процессе роста опухолевого узла у животного-реципиента наблюдается эволюция опухолевых клонов, отличная от данного процесса в организме человека по ряду параметров, в частности, по изменению структуры хромосом и по профилю экспрессии ряда генов, что следует учитывать при проведении тестирования на резистентность опухоли к химиопрепаратам [68–70]. Выявленное влияние организма-хозяина иммунодефицитного животного на опухолевые клетки заставило экспериментаторов вновь обратиться к созданию трехмерных моделей на основе использования операционных образцов пациента как опухолевой, так и нормальной тканей [71]. Для использования модели PDX в клинической практике необходимы дальнейшие исследования и накопление данных как в области корреляции ответа пациентов и экспериментальных животных на терапию, так и в области молекулярных механизмов взаимодействия тканей и клеток человека и животного-реципиента.
Заключение
Как известно, злокачественный рост представляет собой динамичный процесс. Опухолевая прогрессия, связанная с нестабильностью генома и утратой основных механизмов контроля клеточной пролиферации, приводит к появлению большого числа клеточных вариантов, каждый из которых при определенных условиях отбора может дать начало активно растущему клону со специфическим фенотипом и функциями. Поскольку этот процесс идет постоянно, по определению, невозможен подбор одного универсального протокола лечения для любой опухоли, если он изначально не обеспечивает гибель всех ее клеток. Кроме того, опухоли одинаковой локализации и гистогенеза обладают, наряду с общим набором генетических и эпигенетических аномалий, индивидуальными особенностями, что делает их функционально разнородными и требует персонализации лечения.
Выбрать из ряда возможных вариантов лечения наиболее перспективные, а также избежать использования химиотерапии, к которой опухолевые клетки имеют резистентность, помогает экспериментальное тестирование резистентности опухолевых клеток к химиопрепаратам. Методические варианты такого экспериментального тестирования, приведенные в настоящем обзоре, различаются по своей направленности на процессы жизнедеятельности и гибели клеток, что обусловливает некоторые различия в результатах их одновременного применения на практике. За прошедшие полвека в использовании экспериментального тестирования резистентности опухолевых клеток для персонализации химиотерапии произошла эволюция методических подходов, которая заключалась в повышении безопасности проведения и повышении чувствительности за счет использования флуоресцентных соединений. Одним из перспективных методических подходов, позволяющих оценивать метаболическую активность клеток в динамике, является использование
Список литературы Методические подходы к экспериментальному тестированию резистентности клеток опухоли человека к химиотерапии
- Имянитов Е.Н. Фундаментальная онкология в 2017 году: обзор наиболее интересных открытий. Практическая онкология. 2018; 19(1): 1-15. [Imyanitov E.N. Basic science in oncology: year 2017 overview. Practical Oncology. 2018; 19(1): 1-15. (in Russian)].
- Моисеенко Ф.М. Эволюция резистентности рака легкого к терапии ингибиторами EGFR: новые аспекты. Практическая онкология. 2018; 19(2): 106-16. [MoiseenkoF.V. Evolution of tyrosine kinase resistance in egfr mutated non-small cell lung cancer. Practical Oncology. 2018; 19(2): 106-16. (in Russian)].
- Vogel C.L., Cobleigh M.A., TripathyD., GutheilJ.C, Harris L.N., FehrenbacherL., SlamonD.J., MurphyM, Novotny W.F., BurchmoreM, ShakS., Stewart S.J., PressM. Efficacy and safety oftrastuzumab as a single agent in first-line treatment of HER2-overexpressing metastatic breast cancer. J Clin Oncol. 2002 Feb 1; 20(3): 719-26. doi: 10.1200/JC0.2002.20.3.719.
- Mitsudomi T, Morita S., Yatabe Y, NegoroS., OkamotoI., Tsurutani J., Seto T., Satouchi M., Tada H., Hirashima T., Asami K., Katakami N., TakadaM, YoshiokaH., ShibataK., KudohS., ShimizuE., SaitoH., ToyookaS., Nakagawa K., Fukuoka M.; West Japan Oncology Group. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJT0G3405): an open label, randomised phase 3 trial. Lancet Oncol. 2010; 11(2): 121-8. doi: 10.1016/S1470-2045(09)70364-X.
- ФеденкоАА. Таргетная терапия в лечении сарком мягких тканей. Практическая онкология. 2013; 14(2): 122126. [Fedenko A.A. Targeted therapy in soft tissue sarcomas. Practical Oncology. 2013; 14(2): 122126. (in Russian).].
- Volm M., Efferth T. Prediction of Cancer Drug Resistance and Implications for Personalized Medicine. Front Oncol. 2015 Dec 17; 5: 282. doi: 10.3389/fonc.2015.00282.
- Abo-Bakr A., Mossallam G., El Azhary N., Hafez H., Badawy R. Impact of CYP1A1, GSTP1 and XRCC1 genes polymorphisms on toxicity and response to chemotherapy in childhood acute lymphoblastic leukemia. J Egypt Natl Canc Inst. 2017 Sep; 29(3): 127-133. doi: 10.1016/j. jnci.2017.07.002.
- Чубенко В.А. Осложнения таргетной терапии. Практическая онкология. 2010; 11(3): 192-202. [Chubenko VA. Complications oftargeted therapy. Practical Oncology. 2010; 11(3): 192-202. (in Russian)].
- BlackM.M., SpeerF.D. Further observations on the effects of cancer chemotherapeutic agents on the in vitro dehydrogenase activity of cancer tissue. J Natl Cancer Inst. 1954 Apr; 14(5): 1147-58.
- Schinkothe T., Haeger S., Gabri M.R. Practical guidelines for diagnostic use of in vitro chemosensitivity tests. Anticancer Res. 2007 May-Jun; 27(3A): 1365-7.
- Bussmann L., Busch C.J., Lorincz B.B., Rieckmann T., Block A., Knecht R. Perspectives in chemosensitivity and chemoresistance assays and their implementation in head and neck cancer. Eur Arch Otorhinolaryngol. 2016 Dec; 273(12): 4073-4080. doi: 10.1007/s00405-015-3893-1.
- Чернов А.Н., Калюнов В.Н., Конопля Н.Е. Разработка варианта метода оценки чувствительности клеток интракраниальных новообразований к химиотерапевтическим препаратам in vitro. Злокачественные опухоли. 2015; 3: 40-52. [ChernovA.N., Kaljunov V.N., Konoplja N.E. Developing options for method of assessing the sensitivity of cells intracranial neoplasms to chemotherapeutics in vitro. Malignant Tumoursis. 2015; 3: 40-52. (in Russian)].
- BursteinH.J., ManguP.B., Somerfield M.R., SchragD., SamsonD., Holt L., Zelman D., Ajani J.A.; American Society of Clinical Oncology. American Society of Clinical Oncology clinical practice guideline update on the use of chemotherapy sensitivity and resistance assays. J Clin Oncol. 2011 Aug 20; 29(24): 3328-30. doi: 10.1200/JCO.2011.36.0354.
- Свирновский А.И., Сергиенко Т. Ф., Алейникова О.В., Шман Т.В., Смирнова Л.А., Колбаско Л.В., Васюков В.В., Тарас И.Б., Бакун А.В., Василевич А.С., Стежкин А.В., ДрейчукНА. Скрининг лекарственной чувствительности лейкозных клеток как вариант персонификации терапии опухолевых заболеваний лимфоидной ткани. Здравоохранение (Минск). 2012; 7: 8-13. [Svirnovski A.I., Sergienko T.F., Aleinikova O.V., ShmanT.V, SmirnovaLA.,KolbascoL.V,PasiukovV.V., TarasI.B.,Bakun A.V, VasilevichA.S., StezhkinA.V.,DreichukN.A. Screening of leukemic cell drug sensitivity as variant of personification therapy for lymphoid tissue tumor diseases. Healthcare (Minsk). 2012; 7: 8-13. (in Russian)].
- Sueblinvong T., Ghebre R., Iizuka Y, Pambuccian S.E., Isaksson VogelR., Skubitz A.P., BazzaroM. Establishment, characterization and downstream application of primary ovarian cancer cells derived from solid tumors. PLoS One. 2012; 7(11): e50519. doi: 10.1371/journal.pone.0050519.
- Yoon Y.S., Kim J.C. Recent applications of chemosensitivity tests for colorectal cancer treatment. World J Gastroenterol. 2014 Nov 28; 20(44): 16398-408. doi: 10.3748/wjg.v20.i44.16398.
- Hsieh C.H., Chen Y.D., Huang S.F., WangH.M., WuM.H. The effect of primary cancer cell culture models on the results of drug chemosensitivity assays: the application of perfusion microbioreactor system as cell culture vessel. Biomed Res Int. 2015; 2015: 470283. doi: 10.1155/2015/470283.
- Kato R., Hasegawa K., Achiwa Y., Okamoto H., Torii Y., Oe S., Udagawa Y. Predicting nedaplatin sensitivity of cervical cancer using the his-toculture drug response assay. Eur J Gynaecol Oncol. 2011; 32(4): 381-6.
- Kravtsov V.D., Daniel T.O., Koury M.J. Comparative analysis of different methodological approaches to the in vitro study of drug-induced apoptosis. Am J Pathol. 1999 Oct; 155(4): 132739. doi: 10.1016/S0002-9440(10)65235-2.
- Kern D.H., Sondak V.K., Morgan C.R., Hildebrand-Zanki S.U. Clinical application of the thymidine incorporation assay. Ann Clin Lab Sci. 1987; 17(6): 383-8.
- Hoffman R.M. Clinical Correlation of the Histoculture Drug Response Assay for Head and Neck Cancer. Methods Mol Biol. 2018; 1760: 83-92. doi: 10.1007/978-1-4939-7745-1_9.
- Busch M., Papior D., Stephan H., Dünker N. Characterization of etoposide- and cisplatin-chemoresistant retinoblastoma cell lines. Oncol Rep. 2018 Jan; 39(1): 160-172. doi: 10.3892/or.2017.6100.
- Su Y.K., Bamodu O.A., Tzeng Y.M., HsiaoM., Yeh C.T., Lin C.M. Ovatodiolide inhibits the oncogenicity and cancer stem cell-like pheno-type of glioblastoma cells, as well as potentiate the anticancer effect of temozolomide. Phytomedicine. 2019 Aug; 61: 152840. doi: 10.1016/j. phymed.2019.152840.
- Arienti C., TeseiA., Verdecchia GM., FramariniM., Virzi S., GrassiA., Scarpi E., Turci L., Silvestrini R., Amadori D., Zoli W. Role of conventional chemosensitivity test and tissue biomarker expression in predicting response to treatment of peritoneal carcinomatosis from colon cancer. Clin Colorectal Cancer. 2013 Jun; 12(2): 122-7. doi: 10.1016/j.clcc.2012.11.006.
- Stepanenko A.A., Dmitrenko V.V. Pitfalls of the MTT assay: Direct and off-target effects of inhibitors can result in over/underestimation of cell viability. Gene. 2015 Dec 15; 574(2): 193-203. doi: 10.1016/j. gene.2015.08.009.
- Liu Z., Yang W., Long G., Wei C. Trace Elements and Chemotherapy Sensitivity. Biol Trace Elem Res. 2016 Oct; 173(2): 28390. doi: 10.1007/ s12011-016-0667-6.
- Xu X., Dai H., Zhao Y., Wang Y., Xu X., Qian Z., ChenX. In vitro chemosensitivity assay of ascites in epithelial ovarian cancer. Eur J Gy-naecol Oncol. 2013; 34(6): 559-64.
- Jung P.S., Kim D.Y., Kim M.B., Lee S.W., Kim J.H., Kim Y.M., Kim Y.T., Hoffman RM., Nam J.H. Progression-free survival is accurately predicted in patients treated with chemotherapy for epithelial ovarian cancer by the histoculture drug response assay in a prospective correlative clinical trial at a single institution. Anticancer Res. 2013 Mar; 33(3): 1029-34.
- Yu T., Lin J., Zhao J., Huang W., Zeng L., Fang Z., Xu N. A simple in vitro tumor chemosensitivity assay based on cell penetrating peptide tagged luciferase. PLoS One. 2017 Nov 10; 12(11): e0186184. doi: 10.1371/journal.pone.0186184.
- Ge W.Q., Pu J.X., Zheng S.Y. Clinical application of the adenosine triphosphate-based response assay in intravesical chemotherapy for superficial bladder cancer. Asian Pac J Cancer Prev. 2012; 13(2): 689-92. doi: 10.7314/ apjcp.2012.13.2.689.
- HetlandT.E., Kxrn J., SkredeM., SandstadB., Tropé C., DavidsonB., Fl0renes V.A. Predicting platinum resistance in primary advanced ovarian cancer patients with an in vitro resistance index. Cancer Chemother Pharmacol. 2012 May; 69(5): 1307-14. doi: 10.1007/s00280-012-1835-9.
- Linz U, Ulus B, Neuloh G., Clusmann H, Oertel M, Nolte K, Weis J., Heussen N., Gilsbach J.M. Can in-vitro chemoresponse assays help find new treatment regimens for malignant gliomas ? Anticancer Drugs. 2014 Apr; 25(4): 375-84. doi: 10.1097/CAD.0000000000000062.
- Kwon H.Y, Kim I.K, Kang J., Sohn S.K., Lee K.Y. In Vitro Adenosine Triphosphate-Based Chemotherapy Response Assay as a Predictor of Clinical Response to Fluorouracil-Based Adjuvant Chemotherapy in Stage II Colorectal Cancer. Cancer Res Treat. 2016 Jul; 48(3): 970-7. doi: 10.4143/crt.2015.140.
- Park J.S., Kim J.K., YoonD.S. Correlation of Early Recurrence With In Vitro Adenosine Triphosphate Based Chemotherapy Response Assay in Pancreas Cancer With Postoperative Gemcitabine Chemotherapy. J Clin Lab Anal. 2016 Nov; 30(6): 804-810. doi: 10.1002/jcla.21940.
- Chang J., Lee A., Lee J., Lim W., Sung S.H., Moon B.I. Correlation between the molecular subtype of breast cancer and the in vitro adenosine triphosphate-based chemosensitivity assay. J Korean Surg Soc. 2013 Jun; 84(6): 313-20. doi: 10.4174/jkss.2013.84.6.313.
- Rodríguez-CorralesJ.A., JosanJ.S. Resazurin Live Cell Assay: Setup and Fine-Tuning for Reliable Cytotoxicity Results. Methods Mol Biol. 2017; 1647: 207-219. doi: 10.1007/978-1-4939-7201-2_14.
- Präbst K., EngelhardtH., RinggelerS., HübnerH. Basic Colorimetric Proliferation Assays: MTT, WST, and Resazurin. Methods Mol Biol. 2017; 1601: 1-17. doi: 10.1007/978-1-4939-6960-9_1.
- Walzl A., Unger C., Kramer N., Unterleuthner D., Scherzer M., Hengstschläger M., Schwanzer-Pfeiffer D., Dolznig H. The Resazurin Reduction Assay Can Distinguish Cytotoxic from Cytostatic Compounds in Spheroid Screening Assays. J Biomol Screen. 2014 Aug; 19(7): 1047-59. doi: 10.1177/1087057114532352.
- Galderisi F., Stork L., Li J., Mori M., Mongoue-Tchokote S., Huang J. Flow cytometric chemosensitivity assay as a predictive tool of early clinical response in acute lymphoblastic leukemia. Pediatr Blood Cancer. 2009 Oct; 53(4): 543-50. doi: 10.1002/pbc.22119.
- Bosserman L., Prendergast F., Herbst R., Fleisher M., Salom E., Strickland S., Raptis A., Hallquist A., Perree M., Rajurkar S., Karimi M., Rogers K., Davidson D., Willis C., Penalver M., Homesley H., Burrell M., Garrett A., Rutledge J., ChernickM., Presant C.A. The microculture-kinetic (MiCK) assay: the role of a drug-induced apoptosis assay in drug development and clinical care. Cancer Res. 2012 Aug 15; 72(16): 3901-5. doi: 10.1158/0008-5472.CAN-12-0681.
- Strickland S.A., Raptis A., Hallquist A., Rutledge J., Chernick M., Perree M., Talbott M.S., Presant C.A. Correlation of the microculture-kinetic drug-induced apoptosis assay with patient outcomes in initial treatment of adult acute myelocytic leukemia. Leuk Lymphoma. 2013; 54(3): 528-34. doi: 10.3109/10428194.2012.722217.
- Weisenthal L.M. Differential Staining Cytotoxicity assay: a review. Methods Mol Biol. 2011; 731: 259-83. doi: 10.1007/978-1-61779-080-5_22.
- Chandrasekaran S., Giang U.B., Xu L., DeLouise L.A. In vitro assays for determining the metastatic potential of melanoma cell lines with characterized in vivo invasiveness. Biomed Microdevices. 2016 Oct; 18(5): 89. doi: 10.1007/s10544-016-0104-9.
- Fiebig H.H., Maier A., Burger A.M. Clonogenic assay with established human tumour xenografts: correlation of in vitro to in vivo activity as a basis for anticancer drug discovery. Eur J Cancer. 2004 Apr; 40(6): 802-20. doi: 10.1016/j.ejca.2004.01.009.
- Чернов А.Н., БаранцевичЕ.П., Калюнов В.Н., ГалагудзаМ.М. Методы подбора in vitro химиопрепаратов для индивидуальной химиотерапии злокачественных новообразований пациентов. Трансляционная медицина. 2018; 5(1): 45-65. [Chernov A.N., Ba-rantsevich E.P., Kalunov V.N., Galagudza M.M. The methods of in vitro selection of chemotherapeutic druds for individual chemotherapy of maligant tumors in patinets. Translational Medicine. 2018; 5(3): 45-65. (in Russian)]. doi: 10.18705/2311-4495-2018-5-3-45-65.
- Kawamura M., Gika M., Abiko T., Inoue Y., Oyama T., Izumi Y., Kobayashi H., Kobayashi K. Clinical evaluation of chemosensitivity testing for patients with unresectable non-small cell lung cancer (NSCLC) using collagen gel droplet embedded culture drug sensitivity test (CD-DST). Cancer Chemother Pharmacol. 2007 Mar; 59(4): 507-13. doi: 10.1007/ s00280-006-0292-8.
- HigashiyamaM., OdaK., Okami J., Maeda J., KodamaK., TakamiK., Morinaga K., Takano T., Kobayashi H. In vitro-chemosensitivity test using the collagen gel droplet embedded culture drug test (CD-DST) for malignant pleural mesothelioma: possibility of clinical application. Ann Thorac Cardiovasc Surg. 2008 Dec; 14(6): 355-62.
- NagourneyR.A. Ex vivo programmed cell death and the prediction of response to chemotherapy. Curr Treat Options Oncol. 2006 Mar; 7(2): 103-10. doi: 10.1007/s 11864-006-0045-2.
- Stengl A., Horl D., Leonhardt H., Helma J. A Simple and Sensitive High-Content Assay for the Characterization of Antiproliferative Therapeutic Antibodies. SLAS Discov. 2017 Mar; 22(3): 309-315. doi: 10.1177/1087057116677821.
- Duellman S.J., Zhou W., MeisenheimerP., Vidugiris G., Cali J.J., Gautam P., WennerbergK., Vidugiriene J. Bioluminescent, Nonlytic, RealTime Cell Viability Assay and Use in Inhibitor Screening. Assay Drug Dev Technol. 2015 Oct; 13(8): 456-65. doi: 10.1089/adt.2015.669.
- Hsieh J.H., Huang R, Lin J.A., Sedykh A., Zhao J., Tice R.R., Paules R.S., Xia M., Auerbach S.S. Real-time cell toxicity profiling of Tox21 10K compounds reveals cytotoxicity dependent toxicity pathway linkage. PLoS One. 2017 May 22; 12(5): e0177902. doi: 10.1371/journal. pone.0177902.
- Mahfouzi S.H., Amoabediny G., Doryab A., Safiabadi-Tali S.H., Ghanei M. Noninvasive Real-Time Assessment of Cell Viability in a Three-Dimensional Tissue. Tissue Eng Part C Methods. 2018 Apr; 24(4): 197-204. doi: 10.1089/ten.TEC.2017.0371.
- ChangK.T., Chang Y.J., Chen C.L., Wang Y.N. Multichannel lens-free CMOS sensors for real-time monitoring of cell growth. Electrophore-sis. 2015 Feb; 36(3): 413-9. doi: 10.1002/elps.201400272.
- Wu H., Yang Y., Bagnaninchi P.O., Jia J. Electrical impedance tomography for real-time and label-free cellular viability assays of 3D tumour spheroids. Analyst. 2018 Aug 20; 143(17): 4189-4198. doi: 10.1039/c8an00729b.
- Pan Y., Hu N., Wei X., Gong L., Zhang B., Wan H., Wang P. 3D cell-based biosensor for cell viability and drug assessment by 3D electric cell/matrigel-substrate impedance sensing. Biosens Bioelectron. 2019 Apr 1; 130: 344-351. doi: 10.1016/j.bios.2018.09.046.
- LeeR., Kim J., Kim S. Y., Jang S.M., Lee S.M., Choi I.H., Park S. W., Shin J.S., Yoo K.H. Capacitance-based assay for real-time monitoring of endocytosis and cell viability. Lab Chip. 2012 Jul; 12(13): 2377-84. doi: 10.1039/c2lc21236f.
- Lupold S.E., Johnson T., Chowdhury W.H., Rodriguez R. A real time Metridia luciferase based non-invasive reporter assay of mammalian cell viability and cytotoxicity via the p-actin promoter and enhancer. PLoS One. 2012; 7(5): e36535. doi: 10.1371/journal.pone.0036535.
- Suonio E., Lipponen P., Maenpaa J., Syrjanen K., Kangas L., Tuomisto L. Mitotic index in the subrenal capsule assay as an indicator of the chemosensitivity of ovarian cancer. Cancer Chemother Pharmacol. 1997; 41(1): 15-21. doi: 10.1007/s002800050702.
- Xu C., Li X., Liu P., Li M., Luo F. Patient-derived xenograft mouse models: A high fidelity tool for individualized medicine. Oncol Lett. 2019 Jan; 17(1): 3-10. doi: 10.3892/ol.2018.9583.
- ShultzL.D., LyonsB.L., BurzenskiL.M., GottB., ChenX., Chaleff S., KotbM., Gillies S.D., KingM., Mangada J., GreinerD.L., HandgretingerR. Human lymphoid and myeloid cell development in NOD/LtSz-scid IL2R gamma null mice engrafted with mobilized human hemopoietic stem cells. J Immunol. 2005 May 15; 174(10): 6477-89. doi: 10.4049/jimmu-nol.174.10.6477.
- MoroM., Bertolini G., TortoretoM., Pastorino U., Sozzi G., RozL. Patient-derived xenografts of non small cell lung cancer: resurgence of an old model for investigation of modern concepts of tailored therapy and cancer stem cells. J Biomed Biotechnol. 2012; 2012: 568567. doi: 10.1155/2012/568567.
- Bankert R.B., Balu-IyerS. V., OdunsiK., ShultzL.D., KelleherR.J.Jr., Barnas J.L., Simpson-AbelsonM., ParsonsR., YokotaS.J. Humanized mouse model of ovarian cancer recapitulates patient solid tumor progression, ascites formation, and metastasis. PLoS One. 2011; 6(9): e24420. doi: 10.1371/ journal.pone.0024420.
- Aparicio S., HidalgoM., KungA.L. Examining the utility of patient-derived xenograft mouse models. Nat Rev Cancer. 2015 May; 15(5): 311-6. doi: 10.1038/nrc3944.
- Xie B.Y., Wu A.W. Organoid Culture of Isolated Cells from Patient-derived Tissues with Colorectal Cancer. Chin Med J (Engl). 2016 Oct 20; 129(20): 2469-2475. doi: 10.4103/0366-6999.191782.
- Hoffman R.M. Patient-Derived Orthotopic Xenograft (PDOX) Models of Melanoma. Int J Mol Sci. 2017 Aug 31;18(9). doi: 10.3390/ ijms18091875.
- Hauge A., Wegner C.S., Gaustad J.V., Simonsen T.G., Andersen L.M.K., Rofstad E.K. DCE-MRI of patient-derived xenograft models of uterine cervix carcinoma: associations with parameters of the tumor microenvironment. J Transl Med. 2017 Nov 3; 15(1): 225. doi: 10.1186/ s12967-017-1331-4.
- Park J.H., Zhao M., Oshiro H., Miyake K., Higuchi T., Reynoso J., Razmjooei S., BouvetM., Clary B., Zhang Z., Sugisawa N., Yamamoto J., Singh S.R., HoffmanR.M. Peritoneal Metastases in a Patient-derived Orthotopic Xenograft (PDOX) Model of Colon Cancer Imaged Non-invasively via Red Fluorescent Protein Labeled Stromal Cells. Anticancer Res. 2019 Jul; 39(7): 3463-3467. doi: 10.21873/anticanres.13492.
- Blomme A., Van Simaeys G., Doumont G., Costanza B., Bellier J., Otaka Y., Sherer F., Lovinfosse P., Boutry S., Palacios A.P., De Pauw E., Hirano T., Yokobori T., Hustinx R., Bellahcene A., Delvenne P., Detry O., Goldman S., NishiyamaM, Castronovo V., Turtoi A. Murine stroma adopts a human-like metabolic phenotype in the PDX model of colorectal cancer and liver metastases. Oncogene. 2018 Mar; 37(9): 1237-1250. doi: 10.1038/ s41388-017-0018-x.
- Ben-David U, Ha G., Tseng Y.Y., GreenwaldN.F., Oh C, Shih J., McFarland JM, Wong B., Boehm J.S., Beroukhim R, Golub T.R. Patient-derived xenografts undergo mouse-specific tumor evolution. Nat Genet. 2017 Nov; 49(11): 1567-1575. doi: 10.1038/ng.3967.
- StewartE, FedericoSM., ChenX., Shelat AA., Bradley C., GordonB., Karlstrom A., Twarog N.R., Clay M.R., Bahrami A., Freeman B.B., Xu B., Zhou X., Wu J., Honnell V., OcarzM., Blankenship K., Dapper J., Mardis E.R., Wilson R.K., Downing J., Zhang J., Easton J., Pappo A., Dyer MA. Orthotopic patient-derived xenografts of paediatric solid tumours. Nature. 2017 Sep 7; 549(7670): 96-100. doi: 10.1038/nature23647.
- Mas C., BodaB., CaulFutyM., Huang S., WisniewskiL., Constant S. Establishment of a tumour-stroma airway model (OncoCilAir) to accelerate the development of human therapies against lung cancer. Altern Lab Anim. 2016 Oct; 44(5): 479-485. doi: 10.1177/026119291604400509.


