Методика магнитно-резонансной томографии для количественной оценки биомаркеров при хронических заболеваниях печени
Автор: Савченков Ю. Н., Труфанов Г. Е., Фокин В. А., Ефимцев А. Ю., Аракелов С. Э., Титова И. Ю., Мелтонян А. Р.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Медицинская визуализация
Статья в выпуске: 1 т.14, 2024 года.
Бесплатный доступ
Актуальность. В последнее время для стратификации клинически значимых изменений при хронических заболеваниях печени (ХЗП) разрабатываются методики мультипараметрической магнитно-резонансной томографии (МРТ). Преимуществом мультипараметрической МРТ является визуализация всего органа для исключения вариабельности результатов при биопсии и оценка количественных характеристик отдельных параметров паренхимы печени. Относительно новым направлением является применение мультипараметрической МРТ для диагностики ХЗП с количественным определением содержания жира, железа и фиброзных изменений в паренхиме печени.Цель: разработать методику мультипараметрической МРТ для количественной оценки биомаркеров при ХЗП.Объект и методы. Мультипараметрическое МР-исследование проведено 57 пациентам с ХЗП с использованием различных импульсных последовательностей.Заключение. В статье отражена разработанная методика мультипараметрической МРТ для количественной оценки биомаркеров при ХЗП, на основании данных которых возможно отказаться от инвазивных вмешательств в процессе установки диагноза и мониторинге ответа на проводимое лечение.
Хронические заболевания печени, магнитно-резонансная томография, биомаркер, протонная плотность жировой фракции, r2* воды, жировой гепатоз, фиброз, цирроз
Короткий адрес: https://sciup.org/143182242
IDR: 143182242 | УДК: 616.36-073.75 | DOI: 10.20340/vmi-rvz.2024.1.MIM.2
Текст научной статьи Методика магнитно-резонансной томографии для количественной оценки биомаркеров при хронических заболеваниях печени
Хронические болезни печени вызывают все большую озабоченность в мировой системе здравоохранения. Ежегодно от хронических заболеваниях печени (ХЗП) умирает два миллиона человек, на долю которых приходится 4% всех смертей, обусловленных в большинстве случаев осложнениями цирроза. Наиболее распространёнными формами ХЗП являются неалкогольная жировая болезнь печени и вирусные гепатиты [1, 2].
Растущая глобальная проблема ожирения, особенно у лиц молодого возраста, и ассоциированного с ним увеличения частоты встречаемости сердечно-сосудистых заболеваний и сахарного диабета 2 типа привели к росту заболеваемости неалкогольной жировой болезнью печени, которая является наиболее распространённым заболеванием печени во всём мире, а также ведущей причиной заболеваемости и смертности у данной группы пациентов [3, 4].
В последние годы удалось добиться значительных достижений в области профилактики распространения вирусных гепатитов, разработке вакцин и стратегий пассивной иммунизации, а также многообещающих и эффективных методов лечения. Тем не менее, вирусный гепатит по-прежнему представляет собой глобальную проблему, от которой страдают сотни миллионов людей с развитием острого и хронического гепатита, цирроза и рака печени [5, 6].
Другие этиологические факторы развития ХЗП, такие как аутоиммунные, генетические, лекарственные, сосудистые и идиопатические, хоть и составляют менее 1% от общего числа случаев заболеваемости, но в большинстве случаев манифестируют на более поздних стадиях и также приводят к развитию цирроза, что требует их своевременной диагностики и лечения [7, 8].
Объект и и методы исследования
Мультипараметрическое МР-исследование было проведено 57 пациентам с ХЗП – 18 мужчинам и 39 женщинам в возрасте от 19 до 70 лет (средний возраст 48,3±7,6 года). Постановка диагноза была основана на совокупности клинико-инструментальных данных. Распределение пациентов по этиологии ХЗП представлено в табл. 1.
Магнитно-резонансные исследования проводили на высокопольном томографе Magnetom Vida (Siemens, Германия) c индукцией магнитного поля 3 Тл. Всем пациентам заранее были даны рекомендации по подготовке к исследованию с целью ми- нимизации возникновения артефактов, затрудняющих интерпретацию изображений. Для стандартизации протокола исследования пациентам было рекомендовано воздержаться от приёма пищи за 4 часа и от приёма жидкости за 1 час до начала исследования. Для корректировки респираторных артефактов использовались алгоритмы программного обеспечения для постпроцессорной обработки.
В протокол мультипараметрической МРТ органов брюшной полости и забрюшинного пространства входило получение Т2-ВИ и Т1-ВИ, трёхмерной МР-холангиопанкреатографии (МРХПГ) с построением мультипланарных реконструкций, диффузионновзвешенных изображений (ДВИ), водородной од-новоксельной спектроскопии и динамического контрастного усиления. По результатам мультипара-метрической МРТ органов брюшной полости и забрюшинного пространства производили количественную оценку биомаркеров при ХЗП (табл. 2).
Таблица 1. Распределение пациентов с хроническими заболеваниями печени по этиологии
Table 1. Distribution of patients with chronic liver diseases by etiology
|
Хронические заболевания печени |
Число пациентов |
|
|
Абс. |
% |
|
|
Неалкогольная жировая болезнь печени |
41 |
71,9 |
|
Вирусный гепатит |
6 |
10,5 |
|
Аутоиммунный гепатит |
4 |
7, |
|
Первичный билиарный холангит |
3 |
5,3 |
|
Гемохроматоз |
2 |
3,5 |
|
Алкогольная болезнь печени |
1 |
1,8 |
|
Всего |
57 |
100 |
Таблица 2. Импульсные последовательности и биомаркеры для оценки хронических заболеваний печени
Table 2. Impulse sequences and biomarkers for assessing chronic
|
liver disease |
|
|
Импульсная последовательность |
Биомаркер |
|
3D VIBE q-DIXON с шестью эхо-сигналами |
Протонная плотность жировой фракции, R2* воды, Т2* |
|
HISTO (водородная одновоксельная спектроскопия) |
Протонная плотность жировой фракции, R2 воды |
|
ДВИ |
ИКД, коэффициент диффузии, коэффициент перфузии, фракция перфузии, коэффициент распределения диффузии, индекс гетерогенности диффузии |
Для сбора данных применяли 18-канальную матричную катушку для тела и 32-канальную матричную катушку для позвоночника для получения высокого соотношения сигнал/шум. Первичная поисковая импульсная последовательность «Localizer» для брюшной полости и забрюшинного пространства имела следующие параметры: TR (time to repetition, время повторения) – 7,8 мс, TE (time to echo, время эхо) – 3,7 мс, FA (flip angle, угол отклонения) – 20°, FoV (field of view, в поле обзора) - 430x430 мм, матрица - 256x179, толщина среза - 7 мм, количество срезов – 23, DF (distance factor, расстояние между срезами) – 150%, TA (time of acquisition, длительность сбора данных) – 19 сек. Полученные изображения использовали для позиционирования всех остальных импульсных последовательностей.
Результаты
Получение Т2-ВИ было основано на использовании импульсной последовательности HASTE (HalfFourier Acquisition Single-Shot Turbo-spin Echo). Первая серия изображений в корональной плоскости имела следующие параметры: толщина среза – 5 мм, количество срезов – 39, TR – 1320 мс, TE – 87 мс, FA - 160°, FoV - 400 x 400 мм, матрица -384 x 307, DF - 20%, число повторений - 1, ТА -1:37 мин. Для получения Т2-ВИ в двух остальных плоскостях импульсная последовательность имела следующие параметры: толщина среза – 5 мм, количество срезов – 45, TR – 1400 мс, TE – 96 мс, FA - 160°, FoV - 380 x 310 мм, матрица - 384 x 311, DF – 20%, число повторений – 1, ТА – 2:03 мин.
Определение отёка и ретикулярных изменений паренхимы печени при фиброзе и циррозе осуществляли при помощи импульсной последовательности Т2-ВИ с применением методики жироподавления на основе метода предварительного спектрального насыщения с инверсией-восстановлением (SPAIR, Spectral Adiabatic Inversion Recovery) со следующими параметрами сканирования: толщина среза – 5 мм, количество срезов – 45, TR - 1200 мс, TE - 70 мс, FA - 160°, FoV - 420 x 341 мм, матрица - 384 x 307, DF - 20%, число повторений - 1, ТА – 1:46 мин.
Оценка патологических изменений желчевыводящих путей основывалась на использовании трёхмерной магнитно-резонансной холангиопанкреатографии в корональной плоскости с изотропным вокселем 3D Т2 SPACE (Sampling Perfection with Application-optimized Contrasts using different flip angle Evolutions) с применением респираторного триггера со следующими параметрами сканирования: толщина среза – 1 мм, количество срезов – 72, TR – 4892 мс, TE – 703 мс, FA – 120°, FoV - 380 x 285 мм, матрица - 384 x 384, число повторений – 1, ТА – 4:01 мин.
Применение методики тонких срезов способствовало более точной визуализации изменений желчевыводящих протоков, таких как расширения и стриктуры, а также в выявлении полипов, конкрементов и опухолей. Построение 3D реконструкций на основе данных тонких срезов наглядно демонстрировало анатомические особенности и патологические изменения желчных протоков, а также главного панкреатического протока и его боковых ветвей.
Для получения Т1-ВИ использовали последовательность градиентного эхо-сигнала 3D VIBE (Three Dimension Volume Interpolated Breath-hold Examination). Импульсная последовательность 3D VIBE DIXON с применением двух эхо-сигналов, или двухточечный метод Диксона, позволяет за одну задержку дыхания получать четыре набора изображений в результате автоматической постобработки и реконструкций: изображения со сбором сигнала в фазе (Signal In Phase) и противофазе (Signal Out Of Phase), а также изображения жира с подавлением сигнала воды (Fat Image Only = Signal In Phase – Signal Out Of Phase) и изображения воды с подавлением сигнала жира (Water Image Only = Signal In Phase + Signal Out Of Phase) (рис. 1). Импульсная последовательность 3D VIBE с применением двух эхо-сигналов имела следующие параметры сканирования: толщина среза – 3 мм, количество срезов – 80, TR – 4 мс, TE - 1,3/2,5 мс, FA - 9°, FoV - 380 x 320 мм, матрица - 320 x 240, DF - 20%, число повторений - 1, ТА – 17 сек. На данных МР-томограммах визуализировались признаки стеатоза и гемохроматоза, а также наличие в структуре регенераторных и диспла-стических узлов белковых включений и внутриклеточного жира, жидкость с высоким содержанием белкового компонента и подострое кровоизлияние.
В дальнейшем для количественной оценки содержания внутриклеточных липидов и отложения железа использовали трёхмерную последовательность на основе градиентного эхо 3D VIBE q-DIXON с применением шести эхо-сигналов, или шеститочечный метод Диксона (Quantitative imaging, q-Dixon), которая позволяет за одну задержку дыхания в результате автоматической постобработки и реконструкций получать три биомаркера при ХЗП: протонную плотность жировой фракции, эффективные R2* и T2*, а также карту соответствия для контроля качества анализа полученных данных (хорошее соответствие = значение ROI умноженное на 10–1, значение <5% указывает на приемлемость качества изображений) (рис. 2). Преимущества мультиэхо метода Диксона заключаются в возможности пространственного определения и охвата всей паренхимы печени, коррекции эффектов поперечной релаксации за счёт низкого значения угла отклонения и одновременной оценке протонной плотности жировой фракции как биомаркера жирового гепа-тоза, а также определения значений R2* и Т2* как биомаркеров содержания железа.
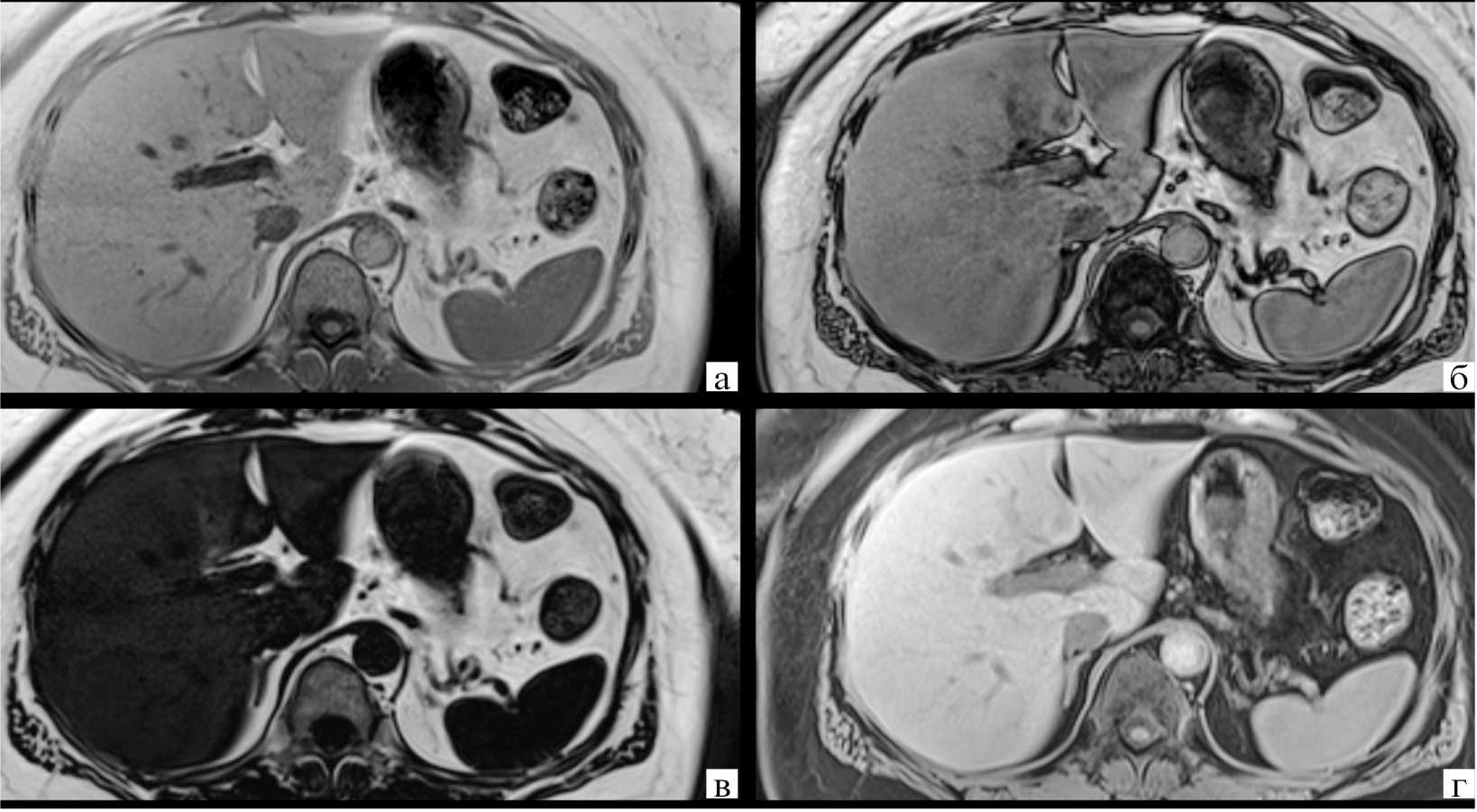
Рисунок 1. Пациентка С., 54 года. Жировой гепатоз 2 степени у пациентки с сахарным диабетом 2 типа. МР-исследование органов брюшной полости, импульсная последовательность 3D VIBE DIXON с применением двух эхо-сигналов: а – изображения со сбором сигнала в фазе (Signal In Phase); б – изображения со сбором сигнала в противофазе (Signal Out Of Phase); в –изображения жира с подавлением сигнала воды (Fat Image Only = Signal In Phase – Signal Out Of Phase); г – изображения воды с подавлением сигнала жира (Water Image Only = Signal In Phase + Signal Out Of Phase)
Figure 1. Patient S., 54 years old. Steatosis of the 2nd degree in a patient with type 2 diabetes mellitus. MR examination of the abdominal organs, 3D VIBE DIXON pulse sequence using two echo signals: a – images with signal collection in phase (Signal In Phase); б – images with signal collection in antiphase (Signal Out Of Phase); в – images of fat with suppression of the water signal (Fat Image Only = Signal In Phase – Signal Out Of Phase); г – water images with fat signal suppression (Water Image Only = Signal In Phase + Signal Out Of Phase)
Импульсная последовательность 3D VIBE q-DIXON с применением шести эхо-сигналов имела следующие параметры сканирования: толщина среза – 3 мм, количество срезов – 80, TR – 9 мс, TE – 1,05/2,46/3,69/4,92/6,15/7,38 мс, FA – 4°, FoV – 380 x 342 мм, матрица - 160 x 126, DF - 20%, число повторений – 1, ТА – 19 сек.
Во время постобработки значения протонной плотности жировой фракции и R2*/Т2* также могут быть измерены в любом участке паренхимы печени путём размещения ROI в сериях FF («Fat Fraction») и эффективных R2*/Т2*. Значение на серии Fat Fraction, умноженное на 10–1, соответствует значению протонной плотности жировой фракции в этом участке печени. Эффективное значение R2*/Т2* измеряется в герцах (или сек-1) и с помощью различных коэффициентов преобразования в зависимости от величины индукции магнитного поля, используемых для получения данных на МР-аппаратах 1,5 или 3 Тл, коррелирует со значением концентрации железа в печени (LIC, Liver Iron Concentration), представляющего собой соотношение внутрипечёноч- ного железа к сухому весу паренхимы, выраженному в мг/г сухого вещества. Таким образом, шеститочечный метод Диксона позволяет количественно определить степень стеатоза и отложения железа в произвольно выбранном участке паренхимы, каждом отдельно взятом сегменте, доле или всей печени. Для количественной оценки жировой фракции и R2 воды в отдельно взятом участке паренхимы печени использовали одновоксельную водородную магнитно-резонансную спектроскопию на основе импульсной последовательности HISTO в режиме получения стимулированного эха (STEAM, Stimulated Echo Acquisition Mode) с задержкой дыхания со следующими параметрами сканирования: размеры вокселя - 30x30x30 мм, TR - 3000 мс, TE -12, 24, 36, 48 и 72 мс, FA - 90°, количество измерений – 5, ТА – 15 сек. Для позиционирования вокселя спектроскопии использовали три плоскости Т2-ВИ, по которым в правой доле печени определяли участок в паренхиме печени с отсутствием крупных сосудов, желчных протоков и очаговых образований.
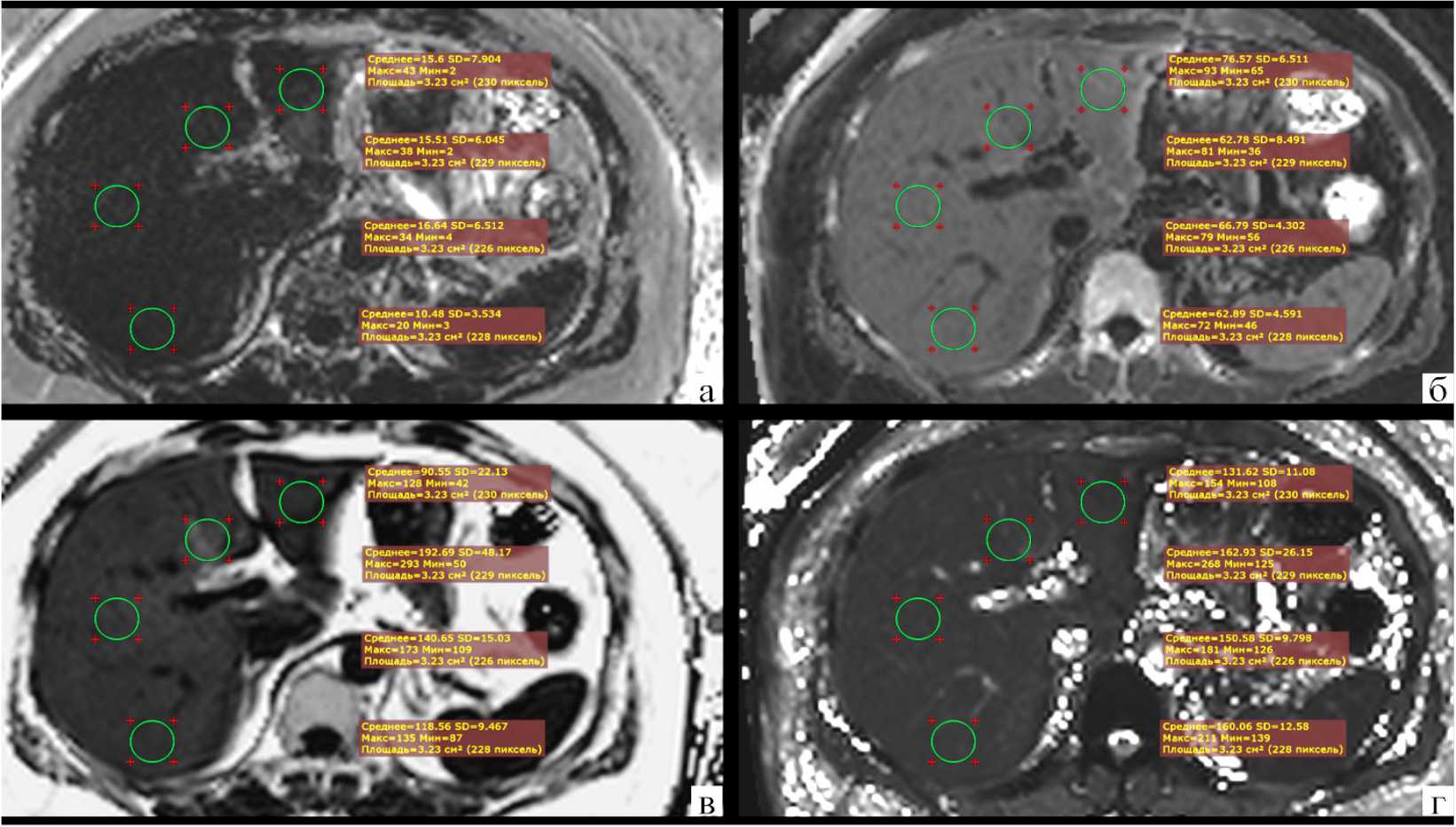
Рисунок 2. Пациентка С., 54 года. Жировой гепатоз 2 степени у пациентки с сахарным диабетом 2 типа. МР-исследование органов брюшной полости, импульсная последовательность 3D VIBE q-DIXON с применением шести эхо-сигналов: а – измерения на карте соответствия для контроля качества анализа полученных данных; б – измерения эффективной R2*; в – измерения протонной плотности жировой фракции; г – измерения эффективной Т2*
Figure 2. Patient S., 54 years old. Steatosis of the 2nd degree in a patient with type 2 diabetes mellitus. MR examination of the abdominal organs, 3D VIBE q-DIXON pulse sequence using six echo signals: a – measurements on the compliance card to control the quality ofthe analysis of the obtained data; б – measurements of effective R2*; в – measurements of proton density of the fat fraction; г – measurements of effective T2*
Импульсная последовательность HISTO для магнитно-резонансной спектроскопии представляет собой серию с пятью эхо-сигналами, скорректированными по T2 с высокой скоростью, полученных в одном вокселе. Импульсная последовательность HISTO основана на принципе, согласно которому существует сильная нелинейная корреляция между сигналом R2 воды и концентрацией железа вне зависимости от концентрации липидов. На основе алгоритма моноэкспоненциального метода наименьших квадратов интегрируются площади под пиками воды и жира для каждого TE, что, в конечном итоге, используется для получения значений протонной плотности жировой фракции и R2 воды всего объёма вокселя (рис. 3). Водородная магнитно-резонансная спектроскопия в режиме получения стимулированного эхо обеспечивает быстрое и точное измерение нескольких биомаркеров ХЗП, таких как протонной плотности жировой фракции и скорости релаксации R2 воды. Важно отметить, что магнитно-резонансная спектроскопия в режиме получения стимулированного эха даёт более точные и последовательные оценки по сравнению с локальной спектроскопией в выбранной точке (PRESS, Point-resolved Spectroscopy), поскольку первая менее чувствительна к эффектам J-связи, вследствие возможности использования более короткого времени эхо-сигнала.
Сбор данных ДВИ осуществляли с применением двумерной эхо-планарной импульсной последовательности с применением методики жироподавления на основе метода предварительного спектрального насыщения с инверсией-восстановлением (SPAIR) со следующими параметрами сканирования: толщина среза – 5 мм, количество срезов – 720, TR - 7300 мс, TE - 52 мс, FA - 9°, FoV - 430 x 350 мм, матрица - 138 x 138, DF - 20%, число повторений -3–5, количество направлений диффузии – 1, ТА – 7:55 мин. Также использовали параллельную визуализацию с коэффициентом ускорения 2 (GRAPPA, Generalized Autocalibrating Partial Parallel Acquisition), 32 опорными линиями и полосой пропускания приемника 2194 Гц/пиксель.
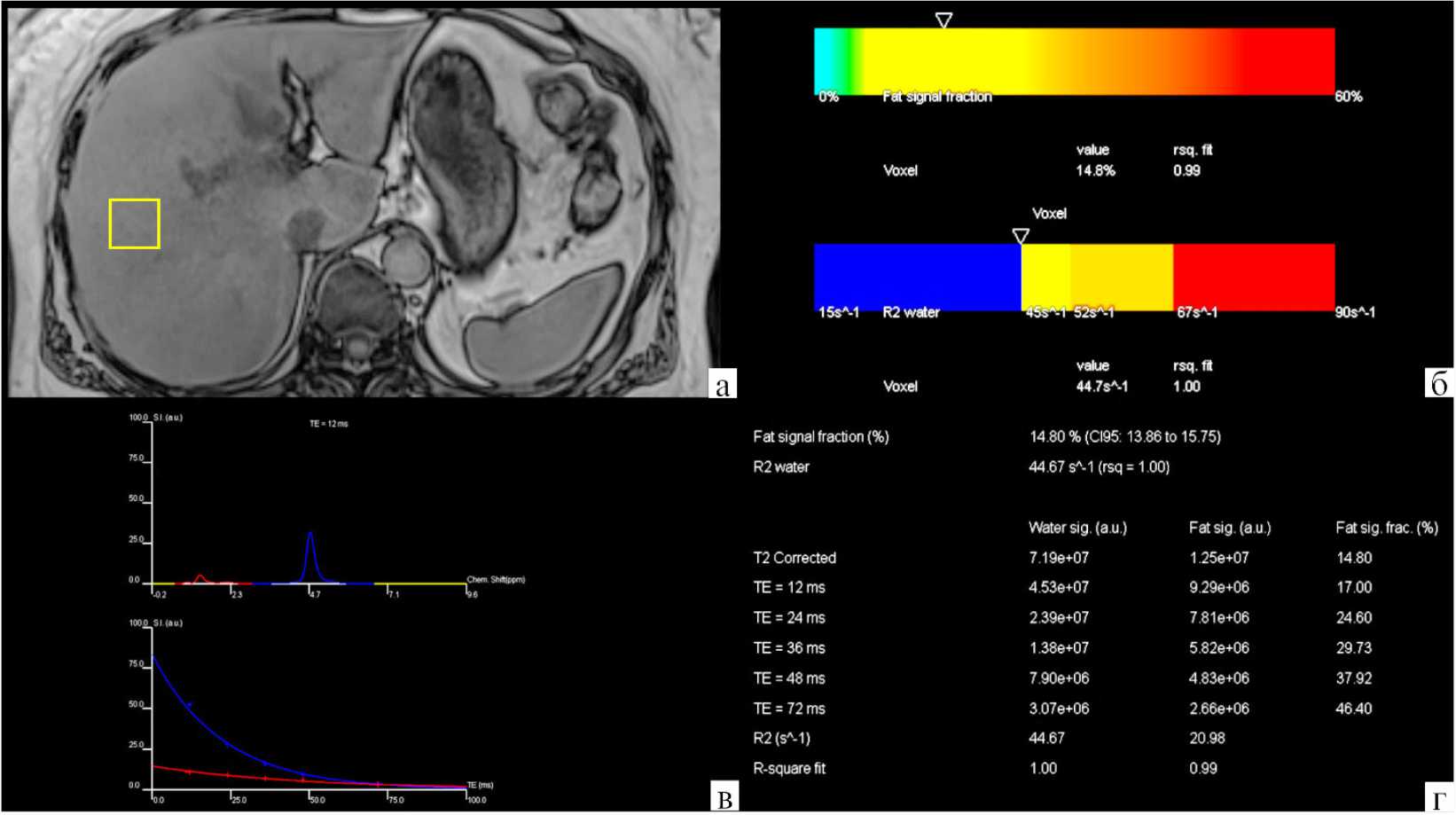
Рисунок 3. Пациентка С., 54 года. Жировой гепатоз 2 степени у пациентки с сахарным диабетом 2 типа. МР-исследование органов брюшной полости, одновоксельная водородная спектроскопия с применением импульсной последовательности HISTO: а – позиционирование вокселя; б – колориметрические карты протонной плотности жировой фракции и R2 воды; в – величина химического сдвига жира и воды при наиболее коротком TE (12 мс) и кривые моноэкспоненциального падения интенсивности сигнала жира и воды для контроля качества; г – таблица распределения протонной плотности жировой фракции и R2 воды для каждого эхо-сигнала с результирующей коррекцией по Т2
Figure 3. Patient S., 54 years old. Steatosis of the 2nd degree in a patient with type 2 diabetes mellitus. MR examination of the abdominal organs, single-voxel hydrogen spectroscopy using the HISTO pulse sequence: a – voxel positioning; б – colorimetric maps of proton density of the fat fraction and R2 of water; в – the value of the chemical shift of fat and water at the shortest TE (12 ms) and curves of the monoexponential decrease in signal intensity of fat and water for quality control; г – table of the distribution of proton density of the fat fraction and R2 of water for each echo signal with the resulting correction by T2
Также получали ДВИ с применением методики жироподавления на основе метода с коротким временем инверсии-восстановления спинового эха (STIR, Short Tau Inversion Recovery) со следующими параметрами сканирования: толщина среза – 5 мм, количество срезов – 90, TR – 7740 мс, TE – 59 мс, FA - 9°, FoV - 430 x 350 мм, матрица - 138 x 138, DF — 20%, число повторений – 6 и 26, количество направлений диффузии – 2, ТА – 4:47 мин.
В результате каждой импульсной программы получали несколько серий срезов с одинаковой локализацией и различными факторами взвешенности: b=0, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 400, 600 и 800, а также b=50 и 800 c/мм2 соответственно. В результате автоматической постпроцессинговой обработки для каждой серии ДВИ было выполнено построение карт измеряемого коэффициента диффузии (ИКД). Дополнительно в результате постпроцессинговой обработки данных ДВИ на базе биэкспоненциальной и растянутой экспоненциальной моделей внутривоксельного некогерент- ного движения получали пять дополнительных биомаркеров: коэффициент диффузии, коэффициент перфузии и фракцию перфузии для биэкспо-ненциальной модели, а также коэффициент распределения диффузии и индекс гетерогенности диффузии для растянутой экспоненциальной модели, которые позволяют определить степень выраженности фиброзных изменений печени.
Многофазное динамическое контрастное усиление проводили с использованием импульсной последовательности 3D VIBE с применением методики жироподавления на основе метода предварительного спектрального насыщения с инверсией-восстановлением и получением доминантной артериальной фазы со следующими параметрами сканирования: толщина среза – 3 мм, количество срезов – 80, TR – 3,3 мс, TE – 1,3 мс, FA – 9°, FoV – 380x309 мм, матрица - 320x240, DF - 20%, число повторений – 1, ТА – 17 сек. Использовали магнитнорезонансные контрастные средства разрешенные к клиническому применению в РФ, содержащие хе- латы гадолиния: гадобутрол, гадопентетовая кислота, гадодиамид. Всем пациентам магнитнорезонансные контрастные средства вводились мануально в дозировке 0,1 ммоль/кг со скоростью 1,5–2,5 мл/сек.
Для получения диагностически значимых изображений и оценки динамики распределения контрастного средства сбор данных постконтрастных изображений осуществлялся с получением доминантной артериальной (20–25 секунды), портовенозной (60–65 секунды), ранней (3–5 минуты) и поздней (10 минута) интерстициальным фазам. По результатам динамического контрастного усиления производили дополнительную оценку регенераторных и диспластических узлов при фиброзе и циррозе печени, а также очаговых образований печени по характеру накопления и вымывания контрастного вещества.
Обсуждение
Предложенная методика мультипараметриче-ского МР-исследования органов брюшной полости и забрюшинного пространства основывается на применении различных импульсных последовательностей и методик. На основании полученных данных возможно получить полноценную информацию о наличии патологических изменений и состоянии органов брюшной полости и забрюшинного пространства.
На основании Т2-ВИ определяется взаимоотношение органов брюшной полости и забрюшинного пространства, состояние клетчаточных пространств, а также лучше визуализируются патологические, особенно жидкостные, образования. Бесконтраст-ная МРХПГ по методике тонких срезов с построением ЗD MIP реконструкций выявляет минимальные изменения структуры стенок желчевыводящих протоков, различные дефекты наполнения, а также представляет трёхмерную модель внутри- и внепечёночных желчных и панкреатического протоков.
Применение Т1-ВИ с использованием различного количества эхо-сигналов выявляет признаки стеатоза, гемохроматоза, наличие в структуре регенераторных и диспластических узлов белковых включений и внутриклеточного жира, а также жидкость с высоким содержанием белкового компонента и подострое кровоизлияние.
Для получения количественных характеристик биомаркеров ХЗП используются различные импульсные последовательности с последующей мануальной или автоматической обработкой полученных данных. Распространённая методика количественной оценки фракции жира при использовании двухточечного метода Диксона требует компенсации множества переменных, включая эффекты релаксации T2* и Т1, спектральной сложности жира и со- держания железа, без которой возможна переоценка выраженности стеатоза [9]. Импульсная последовательность 3D VIBE q-DIXON с применением шести эхо-сигналов вследствие компенсации вышеописанных недостатков позволяет за короткое время получить данные о протонной плотности жировой фракции и R2* воды всего объёма паренхимы печени, по данным которых можно количественно определить выраженность жирового гепатоза и концентрацию железа, предварительно оценив на карте соответствия достоверность полученных данных [10].
Одновоксельная водородная спектроскопия на основе импульсной последовательности HISTO позволяет за одну задержку дыхания определить два биомаркера ХЗП: протонную плотность жировой фракции и R2 воды. Одновоксельная спектроскопия считается наиболее надежным и точным методом количественного определения жира [11]. Однако в литературе нет однозначной оценки относительно достоверности данных биомаркера R2 воды в диагностике содержания железа в паренхиме печени вследствие использования относительно длинных значений TE, в особенности при наличии высокой степени перегрузки и использовании МР-томографов с индукцией магнитного поля 3 Тл [12]. Недавно была предложена новая модификация последовательности одновоксельной спектроскопии (HISTOV), включающая восемь эхо-сигналов, для улучшения её способности обнаруживать и количественно определять железо [13]. Показатели R2 воды всегда имеет меньшие значения по сравнению с показателями R2* воды, потому что скорость релаксации при использовании спинового эхо-сигнала имеет криволинейный характер, а при использовании градиентного эхо-сигнала – линейный [14]. Поэтому необходимы дальнейшие исследования для определения возможностей более высокой точности диагностики с помощью комбинационного анализа значений R2 и R2* воды для выявления перегрузки железом. Существенным недостатком одновок-сельной спектроскопии помимо высокой чувствительной к двигательным артефактам является то, что она не отражает неоднородность распределения триглицеридов во всей паренхиме печени [15].
ДВИ играет важную роль в оценке очаговых и диффузных заболеваний печени [16, 17]). На количественные показатели параметров диффузии могут влиять параметры и тип используемой импульсной последовательности, а также такие факторы, как проницаемость, перфузия и клеточная структура. ИКД позволяет количественно оценить степень ограничения диффузии в тканях и может играть диагностическую роль при характеристике поражений печени. Развитие фиброза печени ограничивает внутривоксельное некогерентное движение, наиболее вероятно, из-за увеличения количества соединительной ткани [18]. Перспективные результаты в определении степени выраженности фиброзных изменений печени показывают биомаркеры, полученные в результате постпроцессинговой обработки данных ДВИ на базе биэкспоненциальной и растянутой экспоненциальной моделей [19, 20].
Количественные данные биомаркеров ХЗП, измеряемые с помощью мультипараметрической МРТ, становятся важными клиническими инструментами в диагностике и лечении ХЗП. При этом необходимо понимать физические особенности получения данных, осуществлять контроль качества, а также иметь представление о возможных ошибках, причинах возникновения и способах их устранения.
Однако, по данным литературы, нет единого мнения относительно параметров и типа используемых импульсных последовательностей, роли биомаркера R2 воды в определении содержания железа, возможностей ДВИ в оценке микроперфузии в капиллярной сети для стадирования фиброза, общепринятых рекомендаций по проведению измерений и интерпретации полученных данных для количественной оценки биомаркеров МРТ при ХЗП.
Разработанная методика мультипараметриче-ского МР-исследования с количественной оценкой параметров нескольких биомаркеров позволяет значительно увеличить возможности неинвазивной диагностики и отказаться в большинстве случаев от проведения биопсии печени при ХЗП. Переход от качественных характеристик к количественной оценке изменений снизит субъективность принятия решения и предоставит более точные данные при оценке ответа на проводимое лечение.
Заключение
Таким образом, мультипараметрическая МРТ органов брюшной полости и забрюшинного пространства была выполнено 57 пациентам с применением множества импульсных последовательностей и их последующей постпроцессорной обработкой. Общее время исследования составляло 35–40 минут в зависимости от выраженности патологических изменений и индивидуальных особенностей пациентов.
В результате проведённого исследования получили значения биомаркеров ХЗП, которые позволяют провести неинвазивную оценку степени выраженности изменений в паренхиме печени, а также осуществить контроль эффективности ответа в процессе проведения терапии.
Ряд групп были небольшими по количеству, и требуется продолжение работы для получения достоверных результатов. Однако уже сейчас можно сделать предварительный вывод, что протонная плотность жировой фракции, как биомаркер неалкогольной жировой болезни печени, является достоверным количественным показателем выраженности жировой дистрофии печени.


