Методика обработки данных при плавлении продуктов полимеразной цепной реакции в реальном времени
Автор: Белов Дмитрий Анатольевич, Белов Ю.В., Манойлов В.В.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение физико-химической биологии
Статья в выпуске: 3 т.26, 2016 года.
Бесплатный доступ
В статье изложены результаты разработки методики обработки данных для получения высокого разрешения при плавлении продуктов полимеразной цепной реакции (ПЦР) в реальном времени. В работе использован способ аппроксимации производной кривой плавления ДНК с помощью производной сигмоидальной функции (СФ) с одновременной компенсацией дрейфа нулевой линии и фильтрацией шума. Предлагаемая методика позволяет уменьшить шаг дискретности измерения температуры плавления Tm для экспериментальной кривой плавления с шагом 1 ºС до величины 0.1 ºС и менее, а также уменьшить влияние на погрешность измерения температуры плавления Tm шумов и дрейфа нулевой линии.
Пцр в реальном времени, кривая плавления, температура плавления днк, сигмоидальная функция
Короткий адрес: https://sciup.org/14265027
IDR: 14265027 | УДК: 543.426;
Текст научной статьи Методика обработки данных при плавлении продуктов полимеразной цепной реакции в реальном времени
В статье изложены результаты разработки методики обработки данных для получения высокого разрешения при плавлении продуктов полимеразной цепной реакции (ПЦР) в реальном времени. В работе использован способ аппроксимации производной кривой плавления ДНК с помощью производной сигмоидальной функции (СФ) с одновременной компенсацией дрейфа нулевой линии и фильтрацией шума. Предлагаемая методика позволяет уменьшить шаг дискретности измерения температуры плавления T m для экспериментальной кривой плавления с шагом 1 ºС до величины 0.1 ºС и менее, а также уменьшить влияние на погрешность измерения температуры плавления T m шумов и дрейфа нулевой линии.
Кл. сл. : ПЦР в реальном времени, кривая плавления, температура плавления ДНК, сигмоидальная функция
ВВЕДЕНИЕ способностью значительно уменьшить влияние на погрешность измерения дискретизации вход-
В основе метода полимеразной цепной реакции в реальном времени (ПЦР-РВ) лежит наблюдение интенсивности сигналов флуоресценции в ходе реакции [1, 2]. Избирательность ПЦР обеспечивается праймерами, ограничивающими участок исходной молекулы ДНК, который амплифицирует-ся в ходе ПЦР [3]. Полученные данные [4] используются для определения наличия фрагментов ДНК в исследуемом образце (качественный анализ) и для расчета значения порогового цикла C t — величины, позволяющей судить об исходном количестве копий ДНК и сравнивать образцы между собой (количественный анализ).
После завершения ПЦР накопленные в результате измерений фрагменты ДНК могут быть использованы для реализации методики плавления ДНК [5, 6].
Кривая плавления получается путем наблюдения интенсивности флуоресценции продуктов ПЦР (ампликонов) при ступенчатом изменении температуры. Традиционные методики вычисления величины Tm основаны на дифференцировании кривой плавления. Значение максимума первой производной обычно принимают за температуру плавления ампликона.
В статье [7] с целью уменьшения погрешности вычисления Tm использована усовершенствованная модель кривой плавления на базе нелинейной сигмоидальной функции (СФ). В этом случае величина Tm вычисляется как координата точки перегиба СФ. Преимущества аппроксимации сигмоидальной функцией определяются ее ных данных, шумов и дрейфа нулевой линии.
В настоящей статье изложена методика вычисления величины T m с помощью производной от СФ с одновременной компенсацией дрейфа нулевой линии и фильтрацией шума. Приведены результаты вычисления величины Tm , полученные в этой работе.
МЕТОДИКА ОПРЕДЕЛЕНИЯ ПАРАМЕТРОВ СФ ПРОИЗВОДНОЙ КРИВОЙ ПЛАВЛЕНИЯ
Исходные данные кривых плавления двух одинаковых проб в смежных пробирках получены в результате ПЦР в статье [3].
В таблице приведены значения параметров производной СФ для проб в двух смежных пробирках 1 и 2 ("Значения 1"). При этом производная СФ вычисляется по формуле
–dFс / dT = ((Fm · exp((Tm – T) / k)) / ((1 + + exp((Tm – T) / k))2) + f1 + 2f2 · T, где Fс — относительная величина интенсивности флуоресценции при температуре образца T (°C); Fm — относительная интенсивность (размах) участка плавления; Tm — значение температуры плавления (°C); k — коэффициент, который определяется наклоном кривой; слагаемые f1 + 2f2 · T учитывают смещение и линейную зависимость нулевой линии от температуры.
Значения параметров производной СФ были вычислены в среде MATLAB с помощью функции
Вычисленные параметры производной СФ
|
Пробы |
Параметры СФ |
Значения 1 |
Значения 2 |
Значения 3 |
|
1 |
Tm 1 |
74.51 |
74.48 |
74.48 |
|
1, 2 |
Fm |
153.83 |
121.51 |
119.07 |
|
1, 2 |
k |
1.27 |
1.23 |
1.26 |
|
2 |
т 1 m 2 |
74.45 |
74.44 |
74.46 |
|
1, 2 |
Т , - Тл m 1 m 2 |
0.06 |
0.04 |
0.02 |
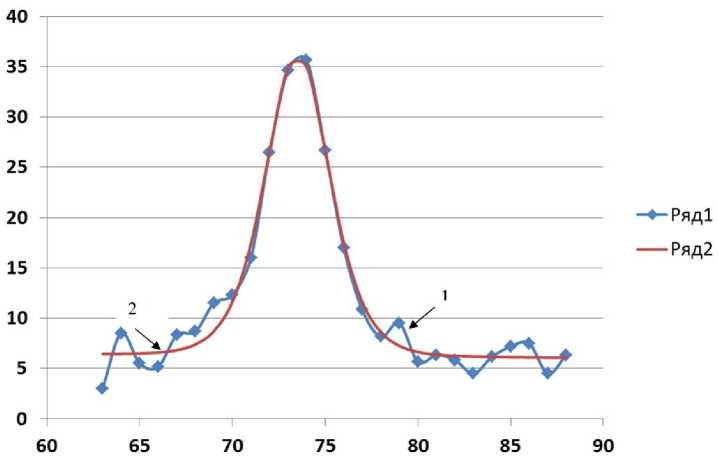
Рис. 1. Графики производной кривой плавления (ряд1, кривая с шумом) и производной СФ с вычисленными параметрами (ряд2, гладкая кривая). Вертикальная ось — относительная величина производной флуоресценции; горизонтальная ось — температура образца (°C)
lsqcurvefit . Основным результатом применения СФ являются величины температуры плавления.
В таблице приняты следующие обозначения: F m 1 , F m 2 — относительная интенсивность (размах) участка плавления для проб 1 и 2; T m 1 , T m 2 — значения температуры плавления (°C) для проб 1 и 2.
Графики зависимости производных кривой плавления и СФ d F / d T и d F с / d T приведены на рис. 1. Можно отметить хорошее совпадение графиков на участке вблизи температуры плавления.
Некоторым недостатком этой методики можно считать смещение нулевой линии кривой плавления, соответствующее "сырым" данным.
КОМПЕНСАЦИЯ ДРЕЙФА КРИВОЙ ПЛАВЛЕНИЯ. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ
Предлагается следующий алгоритм компенсации дрейфа кривой плавления и определения па- раметров производной СФ:
-
1) по методике, изложенной в статье [7], определяются параметры СФ;
-
2) на основе параметров f 0 , f 1 и f 2 выполняется построение нулевой линии;
-
3) построенная нулевая линия вычитается из исходной кривой плавления;
-
4) вычисляется производная уточненной кривой плавления – d F / d T ;
-
5) на основе параметров T m , F m и k вычисляется производная СФ – d F с / d T по вышеприведенной формуле без аддитивного члена f 1 + 2 f 2 · T ;
-
6) выполняется оптимизация параметров производной СФ, изменяя величины T m , F m и k , т. е. ищутся параметры, при которых достигается наименьшая ошибка различия кривых.
Определенная температура плавления и другие параметры производной СФ приведены в таблице как "Значения 2".
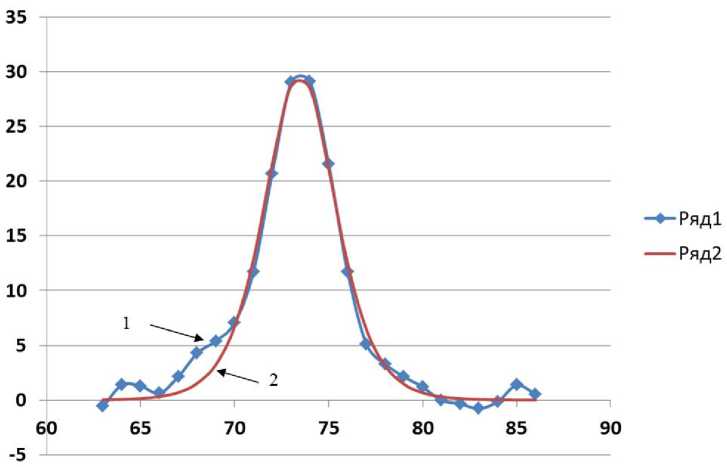
Рис. 2. Графики производной кривой плавления (ряд1, кривая с фильтрацией шума) и производной СФ с вычисленными параметрами (ряд2, гладкая кривая).
Вертикальная ось — относительная величина производной флуоресценции; горизонтальная ось — температура образца (°C).
Дрейф нулевой линии полностью компенсирован (начальные и конечные точки производной СФ имеют нулевые значения по вертикали)
ФИЛЬТРАЦИЯ ШУМА.
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ
Для фильтрации шума предлагается применить наиболее популярный метод Савицкого—Голея, основанный на методе наименьших квадратов.
График производной уточненной кривой плавления – d F / d T после фильтрации шума и график производной СФ с вычисленными параметрами приведены на рис. 2. Можно отметить значительное (приблизительно в 2 раза) снижение уровня шума. Вычисленные параметры производной СФ даны как "Значения 3" в таблице. В результате компенсации нулевой линии и фильтрации шума температуры плавления в столбцах таблицы "Значения 1/2/3" в двух смежных пробирках отличаются незначительно.
ОЦЕНКА ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
Фирма Kapabiosystems (США) опубликовала краткое рекламное руководство [8] по использованию недавно разработанной методики плавления высокого разрешения (High Resolution Melting Analysis, HRM or HRMA) для быстрого анализа генетических мутаций или изменений в последо- вательностях нуклеиновых кислот. Методика позволяет исследователям обнаруживать и классифицировать генетические мутации, например отличия последовательности ДНК размером в один нуклеотид (A, T, G или C) в геноме (single nucleotide polymorphisms SNPs), выявлять новые гены (gene scanning) или определять разновидности бактерий и вирусов. Повышение разрешения необходимо для уверенного определения малых изменений температуры плавления: при замене одного нуклеотида (C/T и G/A) температура плавления ДНК изменяется на величину не более 0.5 °C.
Для реализации методики плавления ДНК используется специализированный краситель, который имеет значительную флуоресценцию в связанном с двойной цепью ДНК состоянии. При медленном повышении температуры происходит плавление ДНК (процесс перехода регулярной двойной спирали молекулы ДНК в клубкообразное состояние), при этом краситель освобождается, что приводит к падению флуоресценции. Температура плавления T m соответствует максимальному значению производной кривой плавления от температуры. T m увеличивается с удлинением фрагментов ДНК и в случае более высокого процентного содержания нуклеотидов C и G.
В этом руководстве принято название "методики плавления низкого разрешения", если в течение анализа температура изменяется с шагом 0.5 °C. Для "методики плавления высокого разрешения HRM" шаг изменения температуры рекомендовано уменьшить до величины 0.008–0.2 °C. Однако при уменьшении шага значительно увеличивается время анализа, поскольку до получения отсчета интенсивности флуоресценции красителя при каждом шаге необходимо добиться точного установления температуры. При этом сокращается только погрешность дискретизации. Дополнительная погрешность измерения, обусловленная шумами и дрейфом нулевой линии флуоресцентного детектора, не компенсируется.
Предлагаемая в настоящей статье методика позволяет достигать параметров плавления высокого разрешения даже при изменении температуры с шагом 1 °C. Эта методика основана на аппроксимации производной кривой плавления с помощью производной СФ в виде непрерывной аналитической функции; таким образом значительно уменьшается влияние на погрешность измерения температуры плавления T m дискретизации входных данных, шумов и дрейфа нулевой линии. При этом величина T m может быть вычислена с дискретностью 0.1 или 0.01 °C.
ЗАКЛЮЧЕНИЕ
Предложенная методика аппроксимации производной кривой плавления с помощью производной СФ дает ряд преимуществ по сравнению с известными методиками такого типа. Методика дополнена компенсацией дрейфа нулевой линии кривой плавления и фильтрацией шума. Эта методика ближе к традиционным методикам вычисления величины T m , которые известны пользователям, поскольку в них используется производная кривой плавления. При построении производной СФ нестабильность нулевой линии полностью устранена. За счет фильтрации достигается значительное снижение уровня шума. Результаты применения методики представлены в табличном и графическом виде.
Сравнение предлагаемой методики определения температуры плавления Tm и традиционной методики выявило ряд ее преимуществ. При использовании традиционной методики шаг изменения температуры рекомендуется уменьшить до величины порядка 0.1 °C. При этом для анализа требуется значительное время, поскольку до получения отсчета интенсивности флуоресценции красителя при каждом шаге необходимо добиться точного установления температуры. Показано, что при использовании предлагаемой методики можно использовать шаг порядка 1 °C, при этом значительно экономится время анализа, а температура плавления может быть вычислена с дискретностью не хуже 0.1 °C.
Список литературы Методика обработки данных при плавлении продуктов полимеразной цепной реакции в реальном времени
- Алексеев Я.И., Белов Ю.В., Варламов Д.А. и др. Приборы для диагностики биологических объектов на основе метода полимеразной цепной реакции в реальном времени (ПЦР-РВ)//Научное приборостроение. 2006. Т. 16, № 3. С. 132-136. URL: http://213.170.69.26/mag/2006/full3/Art14.pdf.
- Ребриков Д.В., Саматов Г.А., Трофимов Д.Ю. и др. ПЦР в "реальном времени". М.: БИОМ. Лаборатория знаний, 2009. 223 с. URL: http://nashol.com/2014072579193/pcr-v-realnom-vremeni-rebrikov-d-v-samatov-g-a-trofimov-d-u-2009.html.
- Календарь Р.Н., Сиволап Ю.М. Полимеразная цепная реакция с произвольными праймерами//Биополимеры и клетка. 1996. Т. 11, № 3-4. С. 55-65. URL: http://www.biopolymers.org.ua/pdf/ru/11/3/055/biopolym.cell-1995-11-3-055-ru.pdf.
- Белов Ю.В., Петров А.И., Лавров В.В., Курочкин В.Е. Особенности количественных измерений содержания нуклеиновых кислот методом полимеразной цепной реакции в реальном времени//Научное приборостроение. 2011. Т. 21, № 1. С. 44-49. URL: http://213.170.69.26/mag/2011/full/Art4.pdf.
- Веденов А.А., Дыхне А.М., Франк-Каменецкий М.Д. Переход спираль -клубок в ДНК//Успехи физических наук. 1971. Т. 105, № 3. С. 479-519.
- ДНК плавление. URL: http://humbio.ru/humbio/dnastructure/0002a247.htm.
- Белов Д.А., Корнева Н.А., Альдекеева А.C., Белов Ю.В., Киселев И.Г. Повышение разрешающей способности генетических анализаторов при определении температуры плавления ДНК//Научное приборостроение. 2016. Т. 26, № 2. С. 17-22. URL: http://213.170.69.26/mag/2016/abst2.php#abst2.
- Introduction to High Resolution Melt Analysis. Application Guide. URL: http://www.kapabiosystems. com.


