Методика определения разброса температур по лункам анализаторов нуклеиновых кислот
Автор: Белов Дмитрий Анатольевич, Альдекеева А.C., Белов Ю.В., Киселев И.Г.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Системный анализ приборов и измерительных методик
Статья в выпуске: 4 т.27, 2017 года.
Бесплатный доступ
В работе предложена усовершенствованная методика определения разброса температур по лункам на основе нелинейной аппроксимации сигмоидальной функцией (СФ) сигналов флуоресценции при плавлении ДНК. Использованы флуоресцентные зонды с высокой температурной зависимостью (порядка 15 % К-1). Результаты представлены в табличном и графическом виде. Показано, что температура плавления ДНК во всех пробирках и их среднее значение соответствуют абсолютной шкале температуры в °С. Получены следующие результаты: разброс температур не более ±0.2 °С, среднее значение температур плавления ДНК всех пробирок равно T mс = 80.82 °С. Максимальное отклонение температуры по 6 группам по 16 пробирок (4 × 4) от среднего значения составляет 0.15 °С и не превосходит предельно допустимых значений ±0.2 °С. Предложено использовать полученные результаты для выравнивания каналов управления элементов Пельтье, настройки, калибровки и проверки тепловых параметров анализаторов нуклеиновых кислот.
Пцр в реальном времени, методика плавления днк, сигмоидальная функция
Короткий адрес: https://sciup.org/142214831
IDR: 142214831 | УДК: 543.426; | DOI: 10.18358/np-27-4-i3439
Текст научной статьи Методика определения разброса температур по лункам анализаторов нуклеиновых кислот
Полимеразная цепная реакция (ПЦР) — экспериментальный метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определенных фрагментов нуклеиновой кислоты в пробе. Метод полимеразной цепной реакции в реальном времени (ПЦР-РВ) позволяет провести качественный и количественный анализ пробы. Дополнительная информация может быть получена после проведения ПЦР за счет применения метода плавления ДНК, который основан на зависимости температуры плавления ДНК от состава и длины фрагмента [1, 2]. Описанные методы выполняются на анализаторах нуклеиновых кислот [3]. Основными тепловыми параметрами анализаторов являются: погрешность установки среднего значения температуры в лунках с пробирками и разброс температур по лункам. Для измерения этих параметров существуют различные контактные и бесконтактные методы.
Наиболее часто используемыми тепло-преобразователями при измерениях контактным методом являются термометры сопротивления и термоэлектрические преобразователи (термопары) [4].
Технические характеристики средств контактного измерения регламентируются стандартами ГОСТ 6651-78 для термометров сопротивления и ГОСТ 3044-77 для термопар.
Контактный метод обладает существенными недостатками. Метод обладает инертностью, вызванной массивностью датчика. В случае если масса датчика сравнима с массой измеряемого объекта, измерения в принципе становятся неинформативными. Также не всегда можно обеспечить контакт датчика с измеряемой средой, особенно в закрытых реакторах. Для решения задачи измерения температурного поля объекта необходимо большое количество датчиков.
Упомянутых недостатков лишены бесконтактные методы измерения. Существуют методы, основанные на измерении теплового излучения исследуемого объекта с помощью пирометров, тепловизоров и инфракрасных матричных камер [5, 6]. Эти методы неприменимы в условиях отсутствия визуального доступа, а также для определения температуры прозрачных тел.
Известны такие методы, как магниторезонансная (ЯМР) термометрия, СВЧ-радиотермометрия и акустотермометрия [7]. Эти методы имеют значения погрешностей ±0.2, ±0.2 и ±0.3 °C соответственно, но реализуются на дорогостоящих и громоздких приборах и применяются в основном для решения задач, в которых важно определить внутреннюю температуру объекта, а также пространственное распределение температур в объекте.
Также известны бесконтактные методы измерения температуры, основанные на применении флуоресцентных зондов, например флуоресцентных красителей родамина В (RhB)
или родамина 110 (Rh110) [8]. Эти методы позволяют определять температуру по зависимости уровня флуоресценции от температуры красителя и соответственно измеряемой среды. Погрешность измерений у этих методов составляет порядка ±1.25 °C. Существует метод на основе индодикарбоцианинового флуоресцентного красителя Су5, в котором погрешность измерения температуры на точку составила ±0.33 °C [9, 10]. Известны методы измерения температуры по флуоресцентному красителю сульфородамин-101 (SR101) в 2 диапазонах длин волны [11]. Такой метод позволяет добиться погрешности ±0.78–0.93 °C. При использовании метода измерения температуры по 2 флуоресцентным красителям RhB и SR101 достигается погрешность измерения ±0.48–0.59 °C [11].
Недостатком бесконтактных методов, основанных на применении этих флуоресцентных зондов, является отсутствие абсолютной шкалы температур, относительно низкая температурная зависимость (не более 2.3 % К–1), а также нежелательная зависимость от условий проведения эксперимента для каждой пробирки. Поэтому такие методы применимы предпочтительно для оценки скорости переходных тепловых процессов, а не для определения разброса температур по лункам анализатора нуклеиновых кислот.
Ранее была разработана методика для определения разброса температур по лункам на основе линейной аппроксимации сигналов флуоресценции с применением флуоресцентных зондов, входящих в состав реакционной смеси РС "АМТЕтест" (FAM-ROX) производства ЗАО "Синтол" (г. Москва) [12, Раздел 10: Методика поверки ]. Для флуоресцентного красителя ROX использовался шаблон с регистрацией сигналов флуоресценции при температурах 30, 79.5, 80.5, 81.5 и 85 °С, выдержка на каждой температуре до 160 с. Усредненные сигналы на температурах 30 и 85 °С использовались при нормировании сигналов флуоресценции соответственно по фону и по максимуму. Усредненные сигналы при температурах 79.5, 80.5 и 81.5 °С использовались для определения величины изменения сигналов флуоресценции при изменении температуры на 1 °С и последующего определения разброса температур по лункам. Преимуществом этой методики можно считать высокую температурную зависимость (порядка 15 % К–1) и сравнительно небоьшое время регистрации сигналов (порядка 15 мин).
Недостатком этой методики можно считать отсутствие шкалы абсолютной температуры лунок.
В статье приведена усовершенствованная методика определения разброса температур по лункам на основе аппроксимации сигмоидальной функцией сигналов плавления ДНК. Преимуществом предлагаемой методики является определение абсолютной температуры в каждой лунке анализатора нуклеиновых кислот при сохранении высокой температурной зависимости.
РАЗРАБОТКА МЕТОДИКИ ОПРЕДЕЛЕНИЯ РАЗБРОСА ТЕМПЕРАТУР ПО ЛУНКАМ НА ОСНОВЕ АППРОКСИМАЦИИ
СИГМОИДАЛЬНОЙ ФУНКЦИЕЙ СИГНАЛОВ ПЛАВЛЕНИЯ ДНК
В настоящее время в ИАП РАН разработан экспериментальный образец анализатора АНК-96 (96 образцов). Для анализатора АНК-96 требуется обеспечить погрешность установки среднего значения температуры в лунках с пробирками и разброс температур по лункам соответственно ±0.5 и ±0.2 °С. Аналогичные параметры имеет лучшие иностранные анализаторы, например 7500 Fast Real-Time PCR System, StepOne Plus фирмы "Life Technologies" [13] и др.
Предлагается использовать температуру плавления ДНК T m при использовании одинаковых образцов в качестве критерия оценки разброса температур по лункам.
Ранее в статье [14] была предложена методика определения величины температуры плавления ДНК T m , основанная на усовершенствованной модели сигналов кривой плавления ДНК и способа аппроксимации ее с помощью сигмоидальной функции, выраженной в виде формулы:
+ f 2 · T 2, (1)
где F с — относительная величина интенсивности флуоресценции при температуре образца T (°C); F m — относительная интенсивность (размах) участка плавления; T m.calc — дробное значение температуры плавления (°C); k — коэффициент, который определяется наклоном кривой; слагаемые f 0 + f 1 · T + f 2 · T 2 учитывают смещение, а также линейную и квадратичную зависимости нулевой линии от температуры.
Одним из вариантов устранения этого недостатка является определение температуры
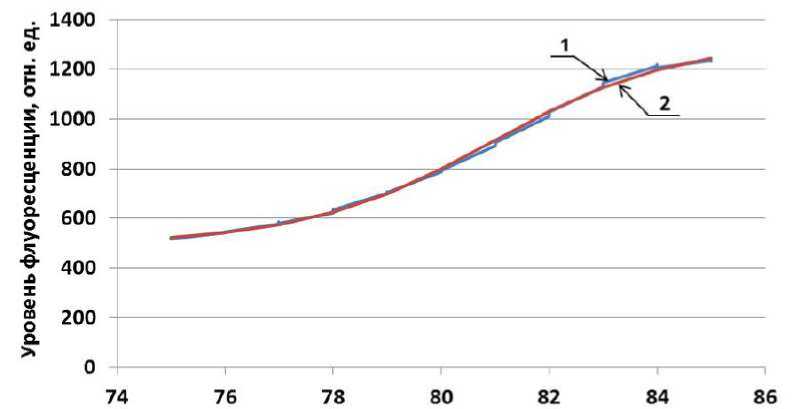
Температура пробирок, °C
Рис. 1. Кривая плавления реакционной смеси.
1 — ступенчатая кривая (измеренные данные); 2 — аппроксимирующая СФ с оптимизированными параметрами (гладкая кривая)
|
Табл. 1. Оптимизация параметров СФ |
Табл. 2. Оптимизированные параметры СФ |
|
T , °C F F с D = D 2 S = СУММА N = F с – F 1 75 517 521.93 4.93 24.36 4466.15 2 76 546 541.01 –4.98 24.87 — |
Значения Параметры СФ СФ T m 80.92 F m 818.92 k –1.72 |
|
11 85 1234 1244.48 10.48 110.01 — |
f 0 1315.11 |
плавления T m по значению максимума производной F с по температуре. При этом значение T m будет однозначно совпадать с точкой перегиба графика функции F с . Данный вариант требует дополнительных вычислений и является более трудоемким.
В предлагаемой методике исключены коэффициенты f 1 и f 2 из формулы (2). При этом упрощенная функция F u будет с достаточной степенью точности описывать исходные данные при условии уменьшения диапазона значений температур, что положительно скажется на времени проведения анализа. При этом полученное значение T m будет соответствовать точке перегиба СФ.
Усовершенствованная модель кривой плавления на базе упрощенной нелинейной сигмоидальной функции примет вид:
F u = F m / (1 + exp (( T m – T ) / k )) + f 0 . (2)
Исходные (сырые) данные кривой плавления ДНК от 8 пробирок были получены путем регистрации сигналов флуоресценции красителя ROX реакционной смеси РС "АМТЕтест" (FAM-ROX) при ступенчатом изменении температуры в диапазоне 75–85 °С с шагом 1 °С и с выдержкой на каждой ступени 30 с. Время регистрации сигналов — порядка 10 мин.
График исходных данных кривой плавления реакционной смеси одной из пробирок в качестве образца приведен на рис. 1 (кривая 1).
Оптимизированные параметры СФ определяются с помощью электронной таблицы Excel. В первом столбце табл. 1 приведены номера
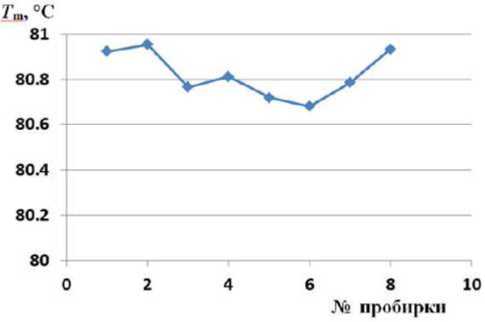
Рис. 2. Графики Tm для 8 пробирок в одном ряду теплового блока отсчетов N во времени, во втором столбце — значения температуры Т (от 75 до 85 °C). В третьем и четвертом столбцах приведены относительные значения интенсивности флуоресценции F пробы и значения интенсивности флуоресценции Fс модели СФ. В следующих столбцах табл. 1 приведены разность D = Fс – F, квадрат разности D2 и сумма квадратов разности S.
Нахождение параметров СФ выполняется в программе Excel средством анализа Поиск решения из меню Данные , при этом достигается минимальное значение величины S путем изменения параметров СФ. График сигмоидальной функции первой пробирки в качестве образца приведен на рис. 1 (кривая 2). Параметры СФ для этой пробирки приведены в табл. 2, при этом температура плавления T m1 = 80.92 °C.
Основными результатами применения СФ являются определенные величины температуры плавления T m . Графики, отражающие величины T m для 8 пробирок в одном ряду теплового блока, приведены на рис. 2.
Температура плавления ДНК всех пробирок и их среднее значение соответствуют абсолютной шкале температуры в °С. Разброс температур — не более ±0.2 °С. Среднее значение температур плавления ДНК 16 пробирок равно T mс = 80.82 °С.
Полученные результаты позволяют сделать вывод о том, что полученные температуры плавления ДНК в пробирках могут быть использованы при настройке, калибровке и проверке тепловых параметров анализаторов нуклеиновых кислот при их серийном выпуске.
Разброс температур соседних лунок во многом зависит от случайных погрешностей при измерении сигналов флуоресценции. Поэтому в качестве критерия для оценки разброса температур по лункам предлагается принять более достоверные результаты усреднения в пределах 6 групп по 16 пробирок (4 × 4).
Максимальное отклонение температуры по 6 группам от среднего значения составляет 0.15 °С и не превосходит предельно допустимых значений ±0.2 °С.
Особенностью анализатора АНК-96 является использование в тепловом блоке 6 элементов Пельтье, при этом каждый элемент имеет отдельный канал управления. Предварительная настройка была выполнена путем использования цифрового датчика температуры. Полученные результаты были использованы на завершающем этапе настройки анализатора АНК-96 и других анализаторов нуклеиновых кислот.
ЗАКЛЮЧЕНИЕ
Предложена усовершенствованная методика определения разброса температур на основе метода плавления ДНК . При этом использован способ аппроксимации кривой плавления ДНК с помощью сигмоидальной функции. Показано, что температуры плавления ДНК во всех пробирках и их среднее значение соответствуют абсолютной шкале температуры в °С Полученные результаты (разброс температур не более ±0.2 °С, среднее значение температур плавления ДНК во всех пробирках, равное T mс = 80.82 °С) можно принять в качестве контрольных параметров при настройке, калибровке и проверке тепловых параметров анализаторов нуклеиновых кислот.
Разброс температур соседних лунок во многом зависит от случайных погрешностей при измерении сигналов флуоресценции, поэтому в качестве критерия для оценки разброса температур по лункам предлагается принять более достоверные результаты усреднения в пределах 6 групп по 16 пробирок каждая (4 × 4). Максимальное отклонение температуры по 6 группам от среднего значения составляет 0.15 °С и не превосходит предельно допустимых значений ±0.2 °С.
Полученные результаты использовались для настройки анализаторов нуклеиновых кислот.
Список литературы Методика определения разброса температур по лункам анализаторов нуклеиновых кислот
- Веденов А.А., Дыхне А.М., Франк-Каменецкий М.Д. Переход спираль-клубок в ДНК//Успехи физических наук. 1971. Т. 105, № 11. С. 479-519 DOI: 10.3367/UFNr.0105.197111d.0479
- ДНК плавление. URL: http://humbio.ru/humbio/dnastructure/0002a247.htm.
- Алексеев Я.И., Белов Ю.В., Варламов Д.А. и др. Приборы для диагностики биологических объектов на основе метода полимеразной цепной реакции в реальном времени (ПЦР-РВ)//Научное приборостроение. 2006. Т. 16, № 3. С. 132-136. URL: http://213.170.69.26/mag/2006/abst3.php#abst15.
- Воробьев Д.В. Анализ и реализация методов измерения температуры//Теория и практика имитационного моделирования и создания тренажeров. Сборник статей Международной научно-практической конференции, г. Пенза, 14-15 декабря 2016 г. С. 42-47.
- Беленький А.М. Измерение температуры: теория, практика, эксперимент. Т. 2. Справочное издание в 3 томах. Москва: Теплотехник, 2007. 736 с.
- Битюков В.К., Петров В.А. Методы и средства бесконтактного контроля теплового состояния изделий. Учебное пособие. Московский государственный институт радиотехники, электроники и автоматики (технический университет). М., 1999. 94 с.
- Жорина Л.В. Методы неинвазивного измерения внутренней температуры тела//Вестник Тамбовского университета. Серия: Естественные и технические науки. Тамбов, 2017. Т. 22, вып. 2. С. 464-470 DOI: 10.20310/1810-0198-2017-22-2-464-470
- Chamarthy P., Garimella S.V., Wereley S.T. Measurement of the temperature non-uniformity in a microchannel heat sink using microscale laser-induced fluorescence//International Journal of Heat and Mass Transfer. 2010. Vol. 53, no. 15-16. P. 3275-3283. Doi: 10.1016/j.ijheatmasstransfer.2010.02.052.
- Варламов Д.А., Герасимов М.А., Савина Ж.А., Сочивко Д.Г., Федоров А.А. Неинвазивный анализ тепловых процессов в реакторах приборов для проведения полимеразной цепной реакции в реальном времени//Материалы конференции "Информационно-технологический и телекоммуникационный кластер наукограда Черноголовка: продукция, партнерство и перспективы развития". Черноголовка, "Богородский печатник", 2015. С. 55-57.
- Сочивко Д.Г., Варламов Д.А., Федоров А.А., Курочкин В.Е. Метод бесконтактного измерения температуры в реакторах полимеразной цепной реакции//Письма в ЖТФ. 2016. Т. 42, вып. 7. С. 53-58.
- Natrajan V.K., Christensen K.T. Development of fluorescent thermometry methods for microfluidic systems//14th Int Symp on Applications of Laser Techniques to Fluid Mechanics. Lisbon, Portugal, 07-10 July, 2008.
- ИАП РАН. Устройство для обнаружения специфической последовательности нуклеиновых кислот "АНК". Руководство по эксплуатации ПКДН.941417.003 РЭ, 2013.
- Thermo Fisher Scientific: Real-Time PCR (qPCR). URL: http://www.lifetechnologies.com/ru/ru/home/life-science/pcr/real-time-pcr.html.
- Белов Д.А., Корнева Н.А., Альдекеева А.C., Белов Ю.В., Киселев И.Г. Повышение разрешающей способности генетических анализаторов при определении температуры плавления ДНК//Научное приборостроение. 2016. Т. 26, № 2. С. 17-22. URL: http://213.170.69.26/mag/2016/abst2.php#abst2.


