Методика оптико-электрохимического микробиологического тестирования в применении к сравнительному анализу пребиотических и антимикробных свойств различных растительных экстрактов
Автор: Сибирцев В.С., Нечипоренко У.Ю.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 1, 2021 года.
Бесплатный доступ
Описана методика биотестирования. Представлены результаты сравнительного анализа антимикробной активности в отношении Staphylococcus aureus разных концентраций цельных докритических экстрактов, полученных с помощью сжиженного СО2 из 10 различных видов растительного сырья. Показано, что наиболее активные пролонгированные антимикробные свойства проявили экстракты из корней Chelidonium majus и цветков Calendula officinalis при их концентрации в тестовой среде больше 3 об.%. А наиболее активные пролонгированные пребиотические свойства проявили экстракты из побегов Viscum album и листьев Juglans regia при их концентрации в тестовой среде, равной 0.2 об.%. При этом биологическая активность образцов в отношении тестовых микроорганизмов в большинстве случаев монотонно уменьшалась с увеличением времени взаимодействия микроорганизмов и образцов. Однако точный характер этих зависимостей может быть установлен лишь с помощью тестовых испытаний, которые удобно проводить с помощью представленной в этой работе методике, позволяющей более экспрессно, объективно и информативно, а также существенно менее трудоёмко и материалоёмко, чем при использовании стандартных микробиологических методов, оценивать влияние на динамику жизненной активности микроорганизмов различных тестируемых образцов.
Биотестирование микробиологическое, антимикробные свойства, экстракты растительные
Короткий адрес: https://sciup.org/147235441
IDR: 147235441 | УДК: 57.083.1, | DOI: 10.17072/1994-9952-2021-1-26-38
Текст научной статьи Методика оптико-электрохимического микробиологического тестирования в применении к сравнительному анализу пребиотических и антимикробных свойств различных растительных экстрактов
большого количества образцов как новой, так и уже допущенной к применению продукции. Вышеупомянутые методы являются одной из важных составляющих системы мониторинга качества и безопасности продукции. При их реализации применяются как многоклеточные, так и одноклеточные тестовые живые организмы. Причем последние используются не только как наиболее дешевая, доступная и статистически достоверная модель живых организмов в целом, но и как модель полезной естественной микробиоты человека, а также природной микробиоты, способной вызывать различные инфекционные заболевания, токсикозы, аллергические реакции, способствовать порче пищевой и иной продукции, участвовать в различных биотехнологических процессах и т.д.
Однако принятые в настоящее время в качестве стандартных при микробиологическом тестировании процедуры визуальной оценки общей выживаемости микроорганизмов либо величины зоны задержки роста их колоний требуют для своего проведения значительных затрат времени, материалов и труда квалифицированного персонала, давая, в результате, лишь весьма неполную, субъективную и «статичную» информацию о нарушениях жизнедеятельности тестовых организмов [Sutherland et al., 2009; Das, Anjeza, Mandal, 2012; Al-Zubairi, Al-Mamary, Al-Ghasani, 2017]. Таким образом, перспективным представляется использование в микробиологическом тестировании инструментальных технологий, среди которых наиболее простыми в исполнении, достоверными и универсальными являются сейчас различные оптические и электрохимические методы.
Кроме того, в последнее время в фармацевтической, косметической, пищевой, кормовой и иной продукции, производимой и потребляемой человеческим обществом, ощущается всё больший недостаток биологически активных веществ (БАВ) природного происхождения, способствующих нормальному развитию и функционированию как самого человеческого организма (ослабленного стрессами, наличием различных физикохимических факторов загрязнения окружающей среды, недостатком природного освещения и физической активности, контактами с многочисленной посторонней микробиотой и т.п.), так и симбиотически связанной с ним полезной микробиоты, либо угнетению жизнедеятельности вредной для человека микробиоты.
Производство концентрированных синтетических аналогов БАВ при современном уровне развития технологий часто является затратным с экономической точки зрения, а также малоэффективным вследствие сложности достижения нужной степени чистоты, стереоспецифичности и других параметров, способных обеспечить достаточно вы- сокую степень биологической активности таких соединений. Кроме того, растительные экстракты по сравнению с синтетическими средствами, как правило, обладают существенно меньшими по широте спектра и интенсивности действия на человеческий и другие живые организмы побочными эффектами.
В результате этого экстракты из различного растительного сырья в настоящее время являются одним из наиболее приемлемых и распространенных источников БАВ, используемых в качестве функциональных добавок к фармацевтической, косметической, пищевой, кормовой и иной продукции. А из различных видов растительных экстрактов наиболее широкое распространение в настоящее время получили так называемые «эфирные масла», промышленно либо лабораторно получаемые из различного растительного сырья разными физико-химическими способами (такими, как холодный или горячий отжим, дистилляция, экстрагирование при нормальном либо повышенном давлении и/или температуре с помощью различных органических растворителей с последующим удалением этих растворителей при дополнительно повышенной температуре либо под вакуумом и т.п.) [Rodino, Butu, 2019]. Получаемые таким образом «эфирные масла» позволяют достичь существенно большей и стабильной во времени биологической активности конечного продукта по сравнению с водными, спиртовыми и иными растительными экстрактами, получаемыми без удаления экстрагентов. Вследствие этого «эфирные масла» в настоящее время наиболее широко среди других видов растительных экстрактов применяются в пищевой, фармацевтической, косметической и других отраслях промышленности в качестве добавок, обладающих избирательным либо малоспецифическим пребиотическим, антимикробным и т.п. действием; либо добавок, обладающих различными видами нормализирующего действия (используемого, в том числе, при лечении различных нервных, сердечно-сосудистых, диабетических, пищеварительных и иных заболеваний); либо консервирующих, антиоксидантных, ароматизирующих, вкусовых и иных видов добавок [Burt, 2004; Bakkali et al., 2008; Tripathi et al., 2011; Fatima et al., 2013; Alok et al., 2014; Radice et al., 2016; Merghni et al., 2016; Al-Zubairi, Al-Mamary, Al-Ghasani, 2017; Fani, Kohanteb, 2017; Kokina et al., 2018; Rodino, Butu,2019]. Кроме того, «эфирные масла» используются в качестве антисептиков, экологически безопасных инсектицидов и пестицидов, добавок к различным зуботерапевтическим, ранозаживляющим и другим медицинским и упаковочным материалам и т.п. [Burt, 2004; Atarés, Chiralt, 2016; Yuan, Chen, Li, 2016; Donsì, Ferrari, 2016; Pavela, Benelli, 2016; Ribeiro-Santos et al., 2017; Ju et al., 2019].
В последнее время, однако, в пищевой, кормовой, фармацевтической и иных отраслях промышленности всё большее применение вместо «эфирных масел» находят экстракты, получаемые из аналогичного растительного сырья, но с использованием, в качестве экстрагента, сжиженного углекислого газа (СО2РЭ), который затем за счёт изменения давления и температуры конечного продукта полностью удаляется из последнего [Routa, Naika, Raob, 2008; SahenaaI et al., 2009; Ibadullaeva et al., 2015; Valle et al., 2016; Lazarotto et al., 2018; Vieitez et al., 2018; Coelho et al., 2018]. Так, например, ООО «Биоцевтика», (РФ, Московская обл., г. Дедовск, к настоящему времени уже не только разработала, но и внедрила в производство с последующей достаточно широкой реализацией целую линейку йогуртов, майонезов, растительных и сливочных масел, пряных смесей (сухих, жиро- либо водорастворимых), соков, лимонадов и т.п. с добавками различных СО2РЭ (производимых этой же компанией).
При этом, как правило, такие СО 2 РЭ, по сравнению с «эфирными маслами», характеризуются существенно большим разнообразием входящих в их состав БАВ. Если экстрагирование проводится при давлении и температуре углекислого газа (СО 2 ) выше 7.6 МПа и ниже 31°С – то такие экстракты называются «докритическими» (поскольку СО 2 в них, находясь в докритическом состоянии, проявляет свойства «обычной» жидкости). В противном случае, экстракты, получаемые по описанной выше технологии, называются «сверхкритическими» (поскольку СО 2 в них, находясь в сверхкритическом состоянии, проявляет свойства как жидкости, так и газа). Кроме того, СО 2 РЭ делятся на «селективные» (получаемые при низких давлениях СО 2 и имеющие состав, близкий к «эфирным маслам») и «цельные» (получаемые при высоких давлениях СО 2 ). Причем наиболее богаты различными БАВ цельные докритические СО 2 РЭ, имеющие в своём составе помимо летучих компонентов, обычных для «эфирных масел», также более тяжёлые растительные смолы, парафины, пигменты и т.п. Они, как правило, обладают более вязкой пастообразной консистенцией, нежели «эфирные масла», но легко растворяются как эфирами, так и растительными маслами (хотя в ряде случаев для их растворения требуется небольшое нагревание).
В связи с вышесказанным, цель настоящего исследования – разработка экспрессной и объективной инструментальной методики оценки пребиоти-ческих либо антимикробных свойств различных образцов фармацевтической, косметической, пищевой, кормовой и иной продукции, а также отдельных ингредиентов и добавок к оной; с последующим сравнительным анализом с помощью разработанной методики влияния на динамику жизнедеятельности типичных представителей микробиоты человека различных растительных экстрактов.
Материалы и методы исследования
В качестве объекта исследования были взяты цельные докритические экстракты, произведенные ООО «Казанский завод экстрактов» (РФ, г. Казань) с помощью сжиженного СО 2 при давлении 7.3 МПа и температуре 20°С из следующих видов растительного сырья: корни солодки голой ( Glycyrrhiza glabra ) (№ 1), цветы мальвы лесной ( Malva sylvestris ) (№ 2), цветы календулы лекарственной (ноготки лекарственные, Calendula officinalis ) (№ 3), трава бессмертника песчаного ( Helichrysum arenarium ) (№ 4), корни чистотела большого ( Chelidonium majus ) (№ 5), листья берёзы повислой ( Betula pendula ) (№ 6), листья грецкого ореха ( Juglans regia ) (№ 7), молодые побеги омелы белой ( Viscum album ) (№ 8), плоды облепихи крушиновидной ( Hippophae rhamnoides ) (№ 9), семена перца чёрного ( Píper nígrum ) (№ 10). При этом данный завод был выбран потому, что он является в настоящее время крупнейшим в России производителем СО 2 РЭ.
Для анализа влияния различных концентраций тестируемых экстрактов (ТЭ) на динамику жизнедеятельности микроорганизмов, исходя из результатов уже имевшихся авторских наработок по различным способам инструментального биотестирования [Sibirtsev, Garabadzhiu, Ivanov, 1994; Sibirtsev, Garabadzhiu, Ivanov, 1995; Sibirtsev, Glibin, Ivanov, 2000; Sibirtsev, 2007; Sibirtsev, Gar-abadzhiu, 2007; Sibirtsev, Kulakov, Stroev, 2016; Sibirtsev, Olekhnovich, Samuylova, 2017; Sibirtsev, 2017; Sibirtsev, Maslova, 2019; Sibirtsev et al., 2019; Sibirtsev, Garabadgiu, Shvets, 2019], была разработана следующая методика.
Все тесты проводились в 4-х повторностях, перед началом каждой из которых готовилась питательная среда, представлявшая собой стерильный водный раствор с рН 7.2 ± 0.2, содержащий 5 г/л глюкозы, 20 г/л белкового гидролизата и 2 г/л NaCl.. Затем эта среда засевалась Staphylococcus aureus ATCC 29213 (был выбран в качестве типичного представителя условно патогенной микробиоты человека). После этого упомянутая питательная среда с тестовыми микроорганизмами в количестве 200 мл инкубировалась при 37±0.1 ºС в стеклянной колбе без перемешивания в течение примерно 10 ч., пока содержание жизнеспособных микроорганизмов в ней не достигало примерно 5×106 кл/мл (что удостоверялось нефелометрическим способом по бактериальному стандарту мутности [Смирнова, Дудник, Сивченко, 2014]).
Далее, полученная тестовая среда разливалась по 5 мл в каждую из измерительных емкостей
(ИЕ), представляющих собой стандартные стеклянные конические пробирки объемом 10 мл. При этом в «тестовые» ИЕ предварительно добавлялось (по 3 ИЕ в параллель) количество ТЭ, необходимое для достижения заданной его концентрации в тестовой среде. Аналогичным образом необходимое количество ТЭ добавлялось также в три «контрольных-2» ИЕ, содержащих стерильную питательную среду. В то время как три «контрольных-1» ИЕ содержали тестовую среду с жизнеспособными микроорганизмами без ТЭ.
Затем как «тестовые», так и все «контрольные» ИЕ инкубировались без перемешивания при 37±0.1ºС в течение 6 ч.
При этом у тестовых сред, содержащихся в каждой из ИЕ, последовательно, с интервалом 2 ч., регистрировались интенсивность упругого светорассеяния в видимой области спектра ( Iod ), рН и удельная, линейная, низкочастотная электропроводность ( Х , мСм/см). Причем Iod регистрировалась с помощью нефелометра «WGZ-2»; рН регистрировалось с помощью иономера «Эксперт-001» с комбинированным электродом «ЭСК-10601/7»; а Х – с помощью кондуктометра «Эксперт-002» (РФ) с погружным датчиком «УЭП-П-С», работающим на частоте 1.6 кГц. При этом измерительные кювета нефелометра, а также электрод и датчик иономера и кондуктометра перед каждым измерением промывались 0.05%-ным водным раствором хлоргексидина биклюконата, а затем ополаскивались свежеполученной дистиллированной водой.
После чего общие степени активирования (+) либо ингибирования (–) жизнедеятельности тестовых микроорганизмов заданными концентрациями ТЭ после k часов их совместного инкубирования в жидкой тестовой среде (ε V,k , %) рассчитывались по формуле
ε V,k = ( ε Iod,k + 0.7ε рH ,k + 0.7ε X,k ) /2.4. (1)
При этом величины ε Iod,k , ε рН,k и ε X,k определялись отдельно по результатам измерений Iod, pH и X у тестовых сред в ИЕ в ходе инкубации этих ИЕ по формуле
ε i,k = 100 × ( Δ Yt i,k –Δ Yc i,k )/ Δ Yc i,k . (2)
Индекс i показывал, измерения по какому параметру ( Iod , pH или X ) учитывались в формуле 2 (например ε рН ,k = 100 × ( Δ Yt рН ,k – Δ Yc рН ,k )/ Δ Yc рН ,k ). Величины Δ Yt i,k и Δ Yc i,k определялись как усредненные по выборке из M образцов с одинаковыми концентрациями экстрактов, приготовленных одинаковым способом из одного вида сырья (в нашем случае M = 3×4 = 12) изменения значений i -параметра тестовой среды ( Iod , pH или X ), произошедшие за k часов от начала инкубирования этой среды в присутствии заданной концентрации ТЭ (Δ Yt , наблюдаемое в тестовых ИЕ), либо в отсутствие ТЭ (Δ Yc , наблюдаемое в контрольных ИЕ, тестовые среды в которых не содержали ТЭ).
Например Δ Yt рН,2 = рН T,2 – рН T,0 , а Δ Yс Х ,4 = X С,4 – X С,0 (где рН T,0 – значение рН среды в «тестовой» ИЕ в начале её инкубирования, рН T,2 – значение рН среды в «тестовой» ИЕ через 2 ТЭ ч. после начала её инкубирования, X С,0 – значение X среды в «контрольной-1» ИЕ в начале её инкубирования, X С,4 – значение X среды в «контрольной-1» ИЕ через 4 ч. после начала её инкубирования ) и т.д.
При этом коэффициенты при ε i,k , указанные в формуле 1, были рассчитаны методами факторного анализа (аналогично тому, как описано в работах [Korn, Korn, 1968; Johnson, Jeffi, 1983; Sibirtsev, 2006]) по значениям, полученным нами для ε Iod,k , ε рН,k и ε X,kk в результате применения представленной здесь методики к оценке антибактериальной активности в отношении S. aureus разных концентраций таких известных антисептиков и антибиотиков широкого спектра действия, как хлоргексидин биглюконат, фурацилин и левомицетин.
Ошибка определения каждой из усредненных величин ε Iod,,k , ε рH ,k и ε X,k рассчитывалась стандартным образом [Korn, Korn, 1968; Johnson, Jeffi, 1983; Sibirtsev, 2006], как Δε Y = t α,N–1 σ Y , с использованием критерия Стьюдента (t α,N–1 для уровня достоверности α=0.95 и числа степеней свободы N–1), математического ожидания (ε Y,S = Σε Y,i /N) и его дисперсии (σ Y = [Σ(ε Y,i – ε Y,S )2 / (N–1)]1/2). После чего полученные значения Δε Iod,,k , Δε рH ,k и Δε X,k суммировались для величины ε V ,k по стандартной формуле Δz(x i ) = Σ i (Δx i δz / δ x i ) [Korn, Korn, 1968; Johnson, Jeffi, 1983; Sibirtsev, 2006], исходя из которой Δε V,k = ( Δε Iod,,k + 0,7Δε рH ,k + 0,7Δε X,k )/2,4 .
Параметры Iod, pH и X были выбраны для оценки общей степени активирования или ингибирования жизнедеятельности тестовых микроорганизмов заданными концентрациями ТЭ потому, что, во-первых, они наиболее надежно измеряются инструментально. И во-вторых, эти параметры достаточно чувствительно связаны с изменением количества и размера клеток микроорганизмов в единице объема тестовой среды (в случае Iod, вследствие того, что чем больше клеток микроорганизмов присутствует в среде, тем интенсивней они рассеивают видимый свет), либо с тем, на сколько процентов по отношению к контролю ускоряется или замедляется преобразование жизнеспособными микроорганизмами, присутствующими в тестовой среде, катаболитов, находящихся в той же среде, в анаболиты после k часов их инкубации при заданной температуре в присутствии заданной концентрации заданного экстракта по сравнению с теми же процессами, осуществляемыми теми же микроорганизмами в той же среде в отсутствие ТЭ (в случае pH и X, вследствие того, что преобразование микроорганизмами катаболитов, присутствующих в тестовой среде, в анаболи-ты существенно изменяет кислотность и электро- проводность последних).
Правомерность объединения в один параметр ε V трёх таких величин, как ε Iod , ε рH и ε X , можно объяснить тем, что каждая из этих величин независимо нормировалась на контрольные значения определяющего её показателя и, таким образом, единообразно (в процентах по отношению к контролю) отражала изменение метаболизма тестовых микроорганизмов в присутствии ТЭ, в то же время несколько по-разному характеризуя это изменение (поскольку изменение Iod , рН и Х в тестовой среде обусловливали разные метаболитические процессы, осуществляемые присутствующими там жизнеспособными микроорганизмами). В результате чего суммарная величина ε V более информативно и адекватно характеризовала изменения метаболической активности тестовых микроорганизмов, чем каждая из величин ε Iod , ε рH и ε X по-отдельности.
При этом микробная обсемененность (CM) тестируемых образцов могла быть рассчитана по формулам, аналогичным 1 и 2, но где ΔYt определялось не для «тестовых», а для «контрольных-1» ИЕ (содержащих те же микроорганизмы в той же среде, что и «тестовые» ИЕ, но в отсутствие ТЭ), в то время как ΔYc определялось для «контрольных-2» ИЕ (содержащих ТЭ в стерильной питательной среде). После чего полученное значение CM* дом-ножалось на калибровочный коэффициент, определяемый предварительно на основании сравнения результатов, полученных с помощью описанной выше методики, с результатами, полученными для тех же концентраций тех же ТЭ с помощью «стандартной» методики микробиологического тестирования. При этом CM показывало, сколько жизнеспособных микроорганизмов исходно присутствовало в тестируемых образцах. Причем, если вместо «общенакопительной» питательной среды, использованной в этой работе, тестируемые образцы инкубировать в селективных питательных средах, то указанным выше способом можно определять микробную обсемененность тестируемых образцов не только общую, но и применительно к отдельным видам и штаммам микроорганизмов.
Результаты и их обсуждение
Наиболее интересные данные, полученные описанным выше способом применительно к объектам настоящего исследования, представлены в таблице и на рисунке, исходя из которых можно сделать следующие выводы.
Общие степени активирования (+) либо ингибирования (–) жизнедеятельности Staphylococcus aureus, определявшиеся по стандартной визуальной (еs, %) и вновь разработанной инструментальной (еv, %) методикам при разной продолжительности инкубирования S. aureus в присутствии разных количеств различных растительных экстрактов
|
N |
С ТЕ |
k |
Номер экстракта |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|||
|
1 |
3 |
24 |
-32±18 |
-29±16 |
-36±21 |
-34±19 |
-43±24 |
-33±20 |
-36±20 |
-21±12 |
-29±18 |
-29±16 |
|
1.5 |
24 |
-11±6 |
-10±5 |
-10±7 |
-11±6 |
-15±8 |
-10±7 |
-12±7 |
-6±3 |
-9±5 |
-10±5 |
|
|
0.5 |
24 |
-6±3 |
-4±2 |
-5±3 |
-5±3 |
-7±4 |
-1±1 |
-5±3 |
-4±2 |
-5±2 |
-6±3 |
|
|
0.2 |
24 |
10±6 |
18±10 |
28±15 |
27±16 |
24±13 |
17±9 |
35±19 |
36±20 |
26±14 |
20±11 |
|
|
2 |
3 |
2* |
-67±9 |
-59±7 |
-78±9 |
-67±8 |
-77±9 |
-66±8 |
-69±9 |
-48±7 |
-56±7 |
-57±7 |
|
4* |
-58±7 |
-50±7 |
-71±9 |
-60±8 |
-69±8 |
-61±8 |
-57±7 |
-43±6 |
-50±7 |
-48±6 |
||
|
6** |
-45±7 |
-41±6 |
-55±7 |
-49±6 |
-62±9 |
-53±7 |
-52±7 |
-30±4 |
-46±6 |
-42±6 |
||
|
1.5 |
2* |
-21±3 |
-19±2 |
-24±3 |
-21±3 |
-25±3 |
-21±3 |
-22±3 |
-16±2 |
-17±2 |
-19±3 |
|
|
4* |
-19±3 |
-16±2 |
-22±3 |
-19±3 |
-23±3 |
-20±3 |
-18±2 |
-13±2 |
-15±2 |
-17±2 |
||
|
6** |
-15±2 |
-14±2 |
-18±2 |
-16±2 |
-21±3 |
-17±2 |
-17±2 |
-9±1 |
-13±2 |
-14±2 |
||
|
0.5 |
2* |
17±2 |
14±2 |
19±3 |
17±2 |
20±3 |
33±4 |
22±3 |
23±3 |
21±3 |
24±3 |
|
|
4* |
-2±0,3 |
-2±0,3 |
6±1 |
4±0,7 |
12±2 |
3±0,5 |
2±0,3 |
1±0,2 |
7±1 |
9±1 |
||
|
6** |
-8±1 |
-6±1 |
-10±1 |
-7±1 |
-11±2 |
-1±0,2 |
-7±1 |
-8±1 |
-7±1 |
-8±1 |
||
|
0.2 |
2* |
30±4 |
34±4 |
58±6 |
43±5 |
41±5 |
31±4 |
54±6 |
64±7 |
35±4 |
28±4 |
|
|
4* |
21±3 |
27±4 |
37±5 |
39±5 |
46±6 |
24±4 |
45±6 |
47±6 |
31±4 |
21±3 |
||
|
6** |
10±1 |
18±2 |
31±4 |
27±4 |
24±3 |
20±3 |
35±5 |
36±5 |
29±4 |
20±3 |
||
Примечания. Номера цельных докритических тестированных экстрактов, получаемых с помощью сжиженного углекислого газа (СО 2 ТЭ) соответствуют следующему растительному сырью, из которого их получали: 1 – Glycyrrhiza glabra , 2 – Malva sylvestris , 3 – Calendula officinalis , 4 – Helichrysum arenarium , 5 – Chelidonium majus , 6 – Betula pendula , 7 – Juglans regia , 8 – Viscum album , 9 – Hippophae rhamnoides , 10 – Píper nígrum . Значения N соответствуют «стандартной» визуальной (1) и вновь разработанной инструментальной (2) методикам расчёта ε. С ТE (об. %) – концентрация СО 2 ТЭ в тестовой среде; k (ч.) – продолжительность инкубирования тестовой среды. Индексы «*» и «**» обозначают строки значений ε V , с 90 и 95%-ной достоверностью парно, линейно коррелирующих [Korn, Korn, 1968; Johnson, Jeffi, 1983; Sibirtsev, 2006] со значениями ε S , определявшимися для тех же экстрактов при той же С ТЕ .
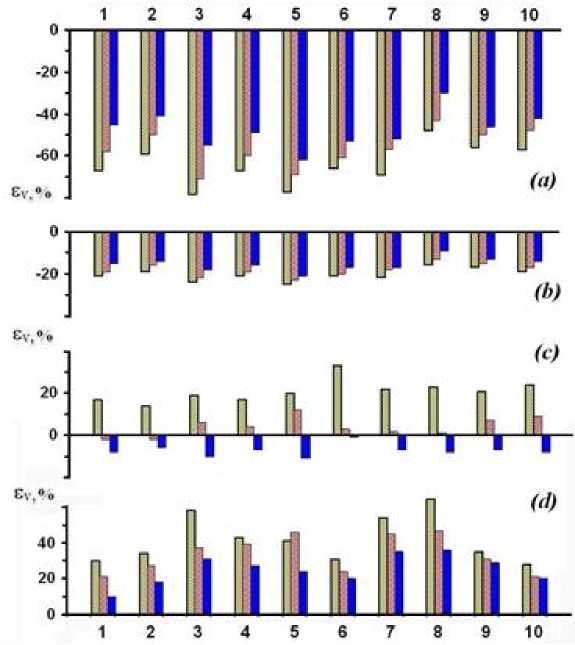
Сравнительная биологическая активность тестированных экстрактов (ТЭ; см. таблицу) в отношении S.aureus при разных концентрациях ТЭ в тестовой среде (а – 3, b – 1.5, c – 0.5%, d – 0.2 об.%).
По оси ординат отложены значения ε V (%), определявшиеся по формуле 1 через 2, 4 и 6 ч. инкубирования S.aureus в присутствии и в отсутствие ТЭ. По оси абсцисс отложены номера сырья, из которого получали ТЭ (см. примечания к таблице). Относительные ошибки определения величин ε V для всех приведенных на рисунке их значений находятся в диапазоне от 10 до 20%
С изменением концентраций ТЭ в тестовой среде (С ТЕ ) может меняться в некоторой степени и характер их как пребиотической, так и антимикробной активности относительно других тестируемых образцов (см. рисунок). Причем особенно отчетливо это было видно на примере С ТЕ < 1.5 об.%.
Также разную как пребиотическую, так и антимикробную активность имели ТЭ, полученные из разных частей разных растений. В частности, это отчетливо видно на примере сравнения антимикробной активности экстрактов, полученных из корней чистотела большого, побегов омелы белой и семян перца чёрного, для которых при С ТЕ = 3 об.% ε V ,6 составили -62±9, -30±4 и -42±5% (см. таблицу для экстрактов № 5, 8 и 10), либо на примере сравнения пребиотической активности тех же экстрактов и экстракта, полученного из корней солодки голой (см. таблицу для экстракта № 1), для которых при С ТЕ = 0.2 об.% ε V ,6 составили 24±3, 36±5, 20±3 и 10±1%.
В целом же, среди исследованных нами экстрактов наиболее активные пролонгированные (долгострочные) антимикробные свойства (количественно характеризуемые в таблице величиной εV,6, определяемой через 6 ч. инкубации тестовых микроорганизмов в присутствии ТЭ) проявили экстракты из корней чистотела большого (№ 5) и цветов календулы лекарственной (№ 3) при СТЕ ≥ 3 об.%. В то время как наиболее активные пролонгированные пребиотические свойства проявили экстракты из побегов омелы белой (№ 8) и листьев грецкого ореха (№ 7) при СТЕ = 0.2 об.%.
Начальная (краткосрочная) биологическая активность ТЭ (количественно характеризуемая в таблице величиной εV,2, определяемой через 2 ч. инкубации тестовых микроорганизмов в присутствии ТЭ) в большинстве случаев была достоверно больше их пролонгированной активности (см. рисунок и таблицу). Это объяснялось, вероятно, как адаптацией тестовых микроорганизмов к присутствию ТЭ, так и уменьшением с течением времени активности и общего количества БАВ, содержащихся в ТЭ, приходящегося на один тестовый микроорганизм. Причем последнее имело место потому, что общее количество микроорганизмов во время инкубации содержащей их тестовой среды, увеличивалось. Тогда как активность и общее количество БАВ, содержащихся в ТЭ, в ходе инкубации содержащей их тестовой среды уменьшались, вследствие биохимической и физико-химической денатурации и деструкции упомянутых БАВ.
Среднесрочная (по времени взаимодействия ТЭ с тестовыми микроорганизмами) биологическая активность ТЭ (количественно характеризуемая в таблице величиной ε V, 4 , определяемой через 4 ч. инкубации тестовых микроорганизмов в присутствии ТЭ) в большинстве случаев была промежуточной по величине между величинами ε V, 2 и ε V, 6 тех же ТЭ (см. таблицу и рисунок).
С уменьшением концентраций ТЭ в тестовой среде их антимикробная активность в отношении тестовых микроорганизмов монотонно уменьшалась, а пребиотическая активность, наоборот, увеличивалась. Так например, при С ТЕ = 3, 1.5 и 0.2 об.% величины ε V, 6 у экстракта из травы бессмертника песчаного были равны -49±6, -16±2 и 27±4%; аналогичные величины у экстракта из корней чистотела большого были равны -62±9, -21±3 и 24±3% соответственно (см. таблицу для экстрактов № 4 и 5).
При этом исследовавшиеся действующие концентрации ТЭ в диапазоне от 0.2 до 3 об.% оказались существенно большими, чем, например, у такого широко используемого синтетического антисептика широкого спектра действия, как хлоргексидин биглюконат, который уже при С ТЭ = 0.0001 и 0.001 об.% демонстрировал в отношении S.aureus величины ε V, 6 = -45±5 и -91±3%. Однако хлоргексидин биглюконат не предназначен для внутреннего применения, а преимущества растительных экстрактов перед антибиотиками уже были рассмотрены нами во введении к этой статье. Кроме того, исходя из этих данных, мы видим, что методика микробиологического тестирования, представленная в этой статье, может быть успешно использована для оценки пребиотических и антимикробных свойств не только растительных экстрактов, но и многих других препаратов и материалов (в том числе искусственно синтезированных).
Кроме того, в таблице представлены значения ε, полученные с помощью «стандартной» методики микробиологического тестирования [Sutherland et al., 2009; Das, Anjeza, Mandal, 2012; Al-Zubairi, Al-Mamary, Al-Ghasani, 2017; Luzhnova et al., 2018; Zhuravlev, Voronchikhina, 2018]. Последняя предусматривала визуальный подсчет колоний тестовых микроорганизмов, выросших после 24 ч. инкубации их при 37±0.1°С на плотной питательной среде (имеющей тот же состав, что и использовавшаяся нами жидкая питательная среда, но с добавлением 20 г/л микробиологического агар– агара) в присутствии и в отсутствие заданных количеств ТЭ с последующим расчетом величины εS по формуле 2. При этом высевание проводилось для нескольких последовательных разведений тестовой среды – каждое в несколько параллельных чашек Петри, после чего отбирались те разведения, при использовании которых на одной чашке Петри вырастало не менее 10 и не более 50 колоний тестовых микроорганизмов. И данные по этим разведениям соответствующим образом статистически обрабатывались [Korn, Korn, 1968; Johnson, Jeffi, 1983; Sibirtsev, 2006].
Из сопоставления значений величин ε S и ε V , полученных для одинаковых концентраций одних и тех же ТЭ, видно, что предлагаемый нами инструментальный метод микробиологического тестирования по сравнению с аналогичным «стандартным» визуальным методом имеет существенно меньшую длительность (требуя для своего проведения от 3 до 7 ч. вместо 26 ч. по «стандартному» методу), материалоёмкость и трудоёмкость (т.к. для проведения «стандартного» метода необходимо большое количество разведений тестовых сред, использование для каждого разведения значительных объемов плотных питательных сред, визуальный подсчет колоний микроорганизмов, выросших на этих средах и т.д.). Кроме того, для величины ε S , определяемой «стандартным» визуальным методом микробиологического тестирования, характерна существенно большая ошибка измерения, чем для величины ε V , определяемой предлагаемым нами инструментальным биотестовым методом. Помимо этого, для каждой концентрации каждого из ТЭ предлагаемым нами инструментальным методом можно было получить, как минимум, три (а при необходимости, и больше) значений ε V (отражающих временную динамику изменения ε ) вместо всего лишь одного значения ε S , получаемого «стандартным» визуальным методом. И наконец, представленная здесь инструментальная методика микробиологического тестирования даёт гораздо больше возможностей для автоматизации всего процесса анализа по сравнению с аналогичными «стандартными» визуальными методами его проведения.
Заключение
Таким образом, мы убедились, что с помощью представленной в настоящей работе методики можно существенно более экспрессно (в течение нескольких часов, а не суток), объективно (за счёт уменьшения роли субъективного человеческого фактора при замене в процессе измерений визуальных методов на инструментальные) и информативно, чем при использовании стандартных методов, оценивать влияние на динамику жизненной активности тестовых микроорганизмов различных образцов фармацевтической, косметической, пищевой, кормовой и иной продукции, а также отдельных ингредиентов и добавок к оной (включая разные растительные экстракты). При этом большая информативность предлагаемой методики до- стигается за счёт того, что, во-первых, инструментальные способы измерения чувствительней визуальных (применяемых в стандартных методах); во-вторых, предлагаемая методика даёт возможность оценивать динамику изменения жизненной активности микроорганизмов на множестве произвольно выбираемых временных отрезков (в отличие от стандартных процедур, где измерения производятся лишь один раз, в конце периода инкубации тестируемых образцов); и в-третьих, предлагаемая методика предполагает оценку изменения жизненной активности микроорганизмов сразу по нескольким независимым показателям (таким, как интенсивность упругого светорассеяния, рН и электропроводность тестовой среды), а не только по одному (мутности тестовой среды, числу колоний микроорганизмов или величине зоны задержки их роста), как в случае применения стандартных методик. Кроме того, представленная здесь методика существенно менее материалоёмка и трудоёмка по сравнению с аналогичными стандартными методами, а также даёт гораздо больше возможностей для автоматизации всего процесса анализа.
Всё это делает представленную методику более приемлемой для массового применения, чем ранее используемые стандартные методы микробиологического тестирования образцов различной продукции. Последнее же является весьма актуальным в свете того, что одним из важных условий обеспечения должного уровня безопасности и качества жизни людей является не только своевременное и качественное тестирование пребиотических и антимикробных свойств новой фармацевтической, косметической, пищевой, кормовой и иной продукции, а также отдельных ингредиентов и добавок к оной (ассортимент которых всё увеличивается, а сроки появления сокращаются); но и постоянный широкий мониторинг пребиотических и антимикробных свойств уже допущенной к массовому употреблению продукции с целью выявления недоброкачественных, либо успевших до окончательной реализации испортиться или претерпеть химическое или биологическое заражение её образцов.
В отношении же исследованных нами растительных экстрактов следует отметить следующее. Как мы убедились, экстракты, полученные из разных частей разных растений, имеют разную биологическую активность. С изменением концентраций растительных экстрактов может меняться в некоторой степени и характер их биологической активности относительно других тестируемых образцов. Среди исследованных экстрактов наиболее активные пролонгированные (долгострочные) антимикробные свойства проявили экстракты из корней чистотела большого (Chelidonium majus) и цветов календулы лекарственной (Calendula officinalis) при СТЕ > 3 об.%. А наиболее активные пролонгированные пребиотические свойства проявили экстракты из побегов омелы белой (Viscum album) и листьев грецкого ореха (Juglans regia) при СТЕ = 0.2 об.%.
Начальная биологическая активность ТЭ в большинстве случаев была достоверно больше их пролонгированной активности. В то время как среднесрочная (по времени взаимодействия ТЭ с тестовыми микроорганизмами) биологическая активность ТЭ, как правило, была промежуточной по величине и лишь иногда превышала не только пролонгированную, но и начальную биологическую активность тех же экстрактов. При этом с уменьшением концентраций ТЭ в тестовой среде их антимикробная активность монотонно уменьшалась, а пребиотическая активность увеличивалась.
Таким образом, очевидно, что характер биологической активности фармакологической, пищевой и иной продукции, а также отдельных ингредиентов и добавок к оной (таких, например, как растительные экстракты) в значительной степени определяется не только составом присутствующих в тестируемых образцах биологически активных веществ, но и их концентрацией, а также временем взаимодействия с живыми организмами (такими, как сам человек, его микробиота и т.п.). Причем, точный характер этих зависимостей в большинстве случаев может быть установлен лишь эмпирически, с помощью значительного числа тестовых испытаний. А последние удобно проводить, используя представленную в этой работе методику, которая позволяет существенно более экспрессно, объективно и информативно, а также менее трудоёмко и материалоёмко, чем при использовании стандартных визуальных микробиологических методов, оценивать влияние на динамику жизненной активности микроорганизмов различных тестируемых образцов.
Список литературы Методика оптико-электрохимического микробиологического тестирования в применении к сравнительному анализу пребиотических и антимикробных свойств различных растительных экстрактов
- Смирнова И.Р., Дудник Т.Л., Сивченко C.B. Контроль качества сырья и готовой продукции на предприятиях индустрии питания. М. : Логос, 2014. 151 с.
- Alok S. et al. Herbal antioxidant in clinical practice: a review // Asian Pacific Journal of Tropical Biomedicine. 2014. Vol. 4, № 1. P. 78-84.
- Al-Zubairi A., Al-Mamary M.A., Al-Ghasani E. The antibacterial, antifungal and antioxidant activities of essential oil from different aromatic plants // Global Advanced Research Journal of Medicine and Medical Sciences. 2017. Vol. 6, № 9. Р. 224233. http://garj.org/garjmms
- Atarés L., Chiralt A. Essential oils as additives in biodegradable films and coatings for active food packaging // Trends in Food Science & Technology. 2016. Vol. 48. P. 51-62. https://doi.org/10.1016Zj.tifs.2015.12.001
- Bakkali F. et al. Biological effects of essential oils - a review // Food and chemical toxicology. 2008. Vol. 46, № 2. P. 446-475. https://doi.org/ 10.1016/j.fct.2007.09.106
- Burt S. Essential oils: their antibacterial properties and potential applications in foods - a review // International journal of food microbiology. 2004. Vol. 94, № 3. P. 223-253. https://doi.org/10.1016/ j. ijfoodmicro.2004.03.022
- Coelho J. et al. Supercritical CO2 extracts and volatile oil of basil (Ocimum basilicum L.) comparison with conventional methods // Separations. 2018. Vol. 5, № 2. P. 21-33. https://doi.org/10.3390/ separations5020021
- Das S., Anjeza C., Mandal S. Synergistic or additive antimicrobial activities of Indian spice and herbal extracts against pathogenic, probiotic and food-spoiler microorganisms // International Food Research Journal. 2012. Vol. 19, № 3. P. 11851191.
- Donsi F., Ferrari G. Essential oil nanoemulsions as antimicrobial agents in food // Journal of Biotechnology. 2016. Vol. 233. P. 106-120. https://doi.org/10.1016/jjbiotec.2016.07.005
- Fani M., Kohanteb J. In vitro antimicrobial activity of thymus vulgaris essential oil against major oral pathogens // Journal of Evidence-Based Complementary & Alternative Medicine. 2017. Vol. 22, № 4. P. 660-666. https://doi.org/ 10.1177/2156587217700772
- Fatima A. et al. Benefits of herbal extracts in cosmetics: a review // International Journal of Pharmaceutical Sciences and Research. 2013. Vol. 4, № 10. P. 3746-3760. https://doi.org/10.13040/ ijpsr.0975-8232.4(10).3746-60
- Ibadullaeva G.S. et al. Chemical composition of the CO2-extract of Acorus Calamus obtained under subcritical conditions // Pharmaceutical Chemistry Journal. 2015. Vol. 49, № 6. P. 388-392.
- Johnson K., Jeffi V. Numerical Methods in Chemistry. New York: Cambridge University Press, 1983.
- Ju J. et al. Application of edible coating with essential oil in food preservation // Critical Reviews in Food Science and Nutrition. 2019. Vol. 59, № 15. P. 2467-2480. https://doi.org/10.1080/ 10408398.2018.1456402
- Lazarotto M. et al. Chemical composition and antibacterial activity of bergamot peel oil from supercritical CO2 and compressed propane extraction // Open Food Science Journal. 2018. Vol. 10, № 1. P. 16-23. https://doi.org/10.2174/ 1874256401810010016
- Luzhnova S.A. et al. Synthesis and antimicrobial activity of 5-(arylmethylidene)-2,4,6-pyrimidine-2,4,6(1H,3H,5H)-triones // Pharmaceutical Chemistry Journal. 2018. Vol. 52, № 6. P. 506-509.
- Kokina M.S. et al. Influence of pleurotus ostreatus beta-glucans on the growth and activity of certain lactic acid bacteria // Scientific Study and Research: Chemistry and Chemical Engineering, Biotechnology, Food Industry. 2018. Vol. 19, № 4. Р. 465-471.
- Korn G., Korn T. Mathematical Handbook for Scientists and Engineers: Definitions, Theorems and Formulas for Reference and Review. McGraw Hill Book Company, 1968. Merghni A. et al. Antibacterial and antibiofilm activities of Laurus nobilis L. essential oil against Staphylococcus aureus strains associated with oral infections // Current Research in Translational Medicine. 2016. Vol. 64, № 1. Р. 29-34. https://doi.org/10.1016/j.patbio.2015.10.003
- Pavela R., Benelli G. Essential Oils as Ecofriendly Biopesticides? Challenges and Constraints // Trends in Plant Science. 2016. Vol. 21, № 12. Р. 1000-1007. https://doi.org/10.1016/j.tplants. 2016.10.005
- Radice M. et al. Herbal extracts, lichens and biomolecules as natural photo-protection alternatives to synthetic UV filters. A systematic review // Fitoterapia. 2016. Vol. 114. Р. 144-162. https://doi.org/10.1016/j.fitote.2016.09.003
- Ribeiro-Santos R. et al. Use of essential oils in active food packaging: Recent advances and future trends // Trends in Food Science & Technology. 2017. Vol. 61. P. 132-140. https://doi.org/10.1016/ j.tifs.2016.11.021
- Rodino S., Butu M. Functional and Medicinal Beverages. Academic Press. 2019. Vol. 11: The Science of Beverages. P. 73-108. https://doi.org/ 10.1016/B978-0-12-816397-9.00003-0
- Routa P.K., Naika S.N., Raob Y.R. Subcritical CO2 extraction of floral fragrance from Quisqualis indica // Journal of Supercritical Fluids. 2008. Vol. 45, № 2. P. 200-205. https://doi.org/10.1016/j. supflu.2008.02.011
- Sahenaal F. et al. Application of supercritical CO2 in lipid extraction - a review // Journal of Food Engineering. 2009. Vol. 95, № 2. P. 240-253. https://doi.org/10.1016/j .jfoodeng.2009.06.026
- Sibirtsev V.S., Garabagiu A.V., Ivanov S.D. Mechanisms of interactions of some phenylbenzoimidazole and phenylindole dyes with DNA // Bioorganicheskaia Khimiia. 1994. Vol. 20, № 6. P. 650-668.
- Sibirtsev V.S., Garabadzhiu A.V., Ivanov S.D. Mechanisms of variation in fluorescent properties of bis-benzimidazole dyes // Bioorganicheskaya Khimiya. 1995. Vol. 21, № 9. С. 731-736.
- Sibirtsev V.S., Glibin E.N., Ivanov S.D. Variation of spectral properties of actinocin derivatives due to equilibrium transformations // Russian Journal of Organic Chemistry. 2000. Vol. 36, №.12. P. 1812-1818.
- Sibirtsev V.S. Analysis of benzo[a]pyrene deactivation mechanisms in rats // Biochemistry (Moscow). 2006. Vol. 71, №. 1. P. 90-98. https://doi.org/ 10.1134/S0006297906010147
- Sibirtsev V.S. Fluorescent DNA probes: study of mechanisms of changes in spectral properties and features of practical application // Biochemistry (Moscow). 2007. Vol. 72, № 8. P. 887-900. https://doi.org/10.1134/S0006297907080111
- Sibirtsev V.S., Garabadzhiu A.V. Spectral study of the interaction of DNA with benzothiazolyl-benz-a-chromene // Biochemistry (Moscow). 2007. Vol. 72, № 8. P. 901-909. https://doi.org/10.1134/ S0006297907080123
- Sibirtsev V.S., Kulakov A.Ju., Stroev S.A. Conduc-tometry biotesting as applied to valuation of the pro- and antibacterial properties of catolites and anolites // Scientific and Technical Journal of Information Technologies, Mechanics and Optics. 2016. Vol. 16, № 3. P. 573-576. https://doi.org/10.17586/2226-1494-2016-16-3-573-576
- Sibirtsev V.S., Olekhnovich R.O., Samuylova E.O. Assessment of integral toxicity of water resources by instrumental methods of analysis // International Multidisciplinary Scientific GeoConference Surveying Geology and Mining Ecology Management (SGEM) Conference Proceedings. 2017, Vol. 17, № 61. P. 507-514. https://doi.org/ 10.5593/sgem2017/61/S25.066
- Sibirtsev V.S. Biological test methods based on fluo-rometric genome analysis // Journal of Optical Technology. 2017. Vol. 84, № 11. P. 787-791. https://doi.org/10.1364/JOT.84.000787
- Sibirtsev V.S., Maslova A.Yu. Complex research of E.coli vital activity dynamics in presence of transition metal ions // Scientific and Technical Journal of Information Technologies, Mechanics and Optics, 2019. Vol. 19, № 2. P. 236-241. https://doi.org/10.17586/2226-1494-2019-19-2-236-241
- Sibirtsev V.S. et al. An integrated method of instrumental microbiotesting of environmental safety of various products, wastes, and territories // Doklady Biological Sciences. 2019. Vol. 485, № 1. P. 59-61. https://doi.org/10.1134/S001249661902011X
- Sibirtsev V.S., Garabadgiu A.V., Shvets V.I. Fluorescent DNA probes: study of properties and methods of application // Doklady Biochemistry and Biophysics. 2019. Vol. 489, № 5. P. 403-406. https://doi.org/10.1134/S1607672919060127
- Sutherland J. et al. Invitroeffects of food extracts on selected probiotic and pathogenic bacteria // International Journal of Food Sciences and Nutrition. 2009. Vol. 60, № 8. P. 717-727. https://doi.org/ 10.3109/09637480802165650
- Tripathi A.K. et al. Herbal antidiabetics: a review // International Journal of Research in Pharmaceutical Sciences. 2011. Vol. 2, № 1. P. 30-37.
- Valle Jr.D.L. et al. Antimicrobial activities of methanol, ethanol and supercritical CO2 extracts of Philippine Piper betle L. on clinical isolates of Gram positive and Gram negative bacteria with transferable multiple drug resistance // PLOS ONE. 2016. Vol. 11, № 1. https://doi.org/ 10.1371/journal.pone.0146349
- Vieitez I. et al. Antioxidant and antibacterial activity of different extracts from herbs obtained by maceration or supercritical technology // Journal of Supercritical Fluids. 2018. Vol. 133. P. 58-64. https://doi.org/10.1016/j.supflu.2017.09.025
- Yuan G., Chen X., Li D. Chitosan films and coatings containing essential oils: The antioxidant and antimicrobial activity, and application in food systems // Food Research International. 2016. Vol. 89. P. 117-128. https://doi.org/10.1016/ j.foodres.2016.10.004
- Zhuravlev O.E., Voronchikhina L.I. Synthesis and antimicrobial activity of n-decylpyridinium salts with inorganic anions // Pharmaceutical Chemistry Journal. 2018. Vol. 52, № 4. P. 312-315.


