Методы фиксации и шейного спондилодеза при шейной дискэктомии
Автор: Спирин О.А., Аганесов А.Г., Алексанян М.М., Седуш Н.Г.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Обзоры литературы
Статья в выпуске: 1 т.19, 2024 года.
Бесплатный доступ
Обоснование: По мировым данным корешковая симптоматика, вызывающая неврологические нарушения, составляет 83,2 случая на 100 тыс. населения в год, с последующим увеличением распространенности после 40 лет. При неэффективности консервативного лечения грыж межпозвонковых дисков шейного отдела позвоночника требуется оперативное лечение. Золотым стандартом хирургического лечения является передняя шейная дискэктомия с фиксацией (ACDF). Однако единого мнения о выборе оптимального материала для фиксации нет.Цель: Провести обзор литературы, посвященной межтеловой фиксации шейного сегмента при дискэктомии.Материалы и методы: для поиска соответствующих теме публикаций мы использовали базы данных PubMed (http://www.ncbi.nlm.nih.gov/pubmed), Еlibrary (http://elibrary.ru) и архивы журналов «Нейрохирургия» и «Хирургия позвоночника».Результаты: Проанализированы данные мировой литературы о методах и материалах для фиксации шейного отдела позвоночника при дискэктомии. Проведен обзор методик стабилизации шейного сегмента аутотранспланатом из гребня подвздошной кости, фиксацией сегмента пластиной, межтеловыми кейджами из титана и PEEK с заполнением и без заполнении остеокондуктивными материалами, рассмотрены ранние модели биодеградируемых кейджей из полимера лактида. Согласно полученным данным, выбор материала и метода для фиксации шейного сегмента остается открытым вопросом. Наиболее частые осложнения связаны с миграцией и проседанием трансплантата.Заключение: Учитывая полученные данные и актуальность проблемы, в РНЦХ им. Б.В. Петровского совместно с НИЦ Курчатовский институт ведется разработка биосовместимого биодеградируемого устройства/кейджа для стабилизации шейных позвонков при операциях на шейном отделе позвоночника. В настоящее время сформированы медико-технические требования к полимерному устройству, ведется поиск подходящих материалов.
Шейная дискэктомия, шейный кейдж, протез межпозвонкового диска, acdf complications, биодеградируемый кейдж
Короткий адрес: https://sciup.org/140307023
IDR: 140307023 | DOI: 10.25881/20728255_2024_19_1_115
Текст обзорной статьи Методы фиксации и шейного спондилодеза при шейной дискэктомии
Материалы и методы: для поиска соответствующих теме публикаций мы использовали базы данных PubMed , Еlibrary и архивы журналов «Нейрохирургия» и «Хирургия позвоночника» .
Materials and Methods: We used PubMed , Elibrary , and the archives of the journals “Neurosurgery” and “Spine Surgery” to search for relevant publications.
По мировым данным корешковая симптоматика, вызывающая неврологические нарушения, составляет 83,2 случая на 100 тыс. населения в год, с последующим увеличением распространенности после 40 лет [1]. Примерно 25% людей в возрасте до 40 лет, 50% людей старше 40 лет и 85% людей старше 60 лет имеют ту или иную степень дегенерации межпозвонковых дисков [2]. Напротив, американские исследования сообщают о 1,79 случаев на 1000 человек [3]. При неэффективности консервативного лечения самым распространенным способом оперативного лечения грыж шейного отдела позвоночника с корешковой симптоматикой является передняя шейная дискэктомия с межтеловой стабилизацией — «золотой стандарт», который наиболее распространен в мировой практике [4].
Однако вопрос выбора оптимального метода фиксации и материала, используемого для успешного формирования межтелового спондилодеза, остается открытым.
Материалы и методы: для поиска соответствующих теме публикаций мы использовали базы данных PubMed , Еlibrary и архивы журналов «Нейрохирургия» и «Хирургия позвоночника». Поиск производился по следующим ключевым словам: “шейная дискэктомия”, “межтеловой кейдж”, “протез межпозвонкового диска”, “ACDF complications”, “cervical discectomy”.
Результаты
В ранних литературных источниках в качестве метода фиксации при передней шейной дискэктомии исполь-

зовался аутотрансплантат из губчатой части гребня подвздошной кости с интраоперационным моделированим выделенного костного фрагмента [5]. После проведения замеров ширины, высоты и глубины аутотрансплантат устанавливается в область сформированного дефекта. В период наблюдения от 6 до 12 месяцев отмечалось проседание трансплантата, снижение угла шейного лордоза по данным рентгенограмм составила 5,89±2,90°, что было значительно больше (1,88±2,77°) чем в группе с установкой межтелового кейджа [2; 6; 7]. Частота осложнений, связанных с забором трансплантата, составляет около 12% [7]. Отмечаются гематомы в области забора трансплантата, нагноение раны, выраженный болевой синдром в подвздошной области и неврологические нарушения в нижних конечностях (гипестезии) [5–8].
В дальнейшем данный метод дополнился установкой передней шейной ригидной пластины с блокирующимися винтами. По данным разных авторов, у 1,3–15,4% больных происходит миграция пластины или винта, у 0,2–6,7% перелом пластины, в 0,2% до 21% случаев происходит дислокация межтелового костного трансплантата [9].
Для стабилизации позвоночного сегмента в хирургической практике, помимо ригидных шейных пластин, нередко используют динамические пластины [10; 11]. По данным литературы миграция винтов и динамических пластин, дислокация и перелом трансплантата встречается в 23% случаев [12]. В 16% отмечается формирование псевдоартроза. В 40,7% случаев встречаются дегенеративные изменения на смежных уровнях [13; 14]. В связи с этим в хирургической практике широкое распространение получили межтеловые кейджи. Для дополнительной стабилизации после установки кейджа нередко производят дополнительную фиксацию передней шейной пластиной (cage-with-plate). В исследованиях проведена оценка клинических и рентгенологических данных и описаны лучшие результаты формирования спондилодеза, в связи со снижением показателей проседания кейджей и частотой формирования локального кифоза при фиксации пластиной [15–18]. По данным авторов установка кейджа с пластиной и установка кейджа без нее (stand-alone cage) не имеет значимых статистических различий по частоте послеоперационных осложнений, частоте формирования спондилодеза и разницы в болевых ощущениях по шкале VAS, и NDI (индекс ограничения жизнедеятельности из-за боли в шее) [19]. По данным мета-анализа фиксация методом кейдж без пластины снижает интраоперационную кровопотерю и частоту послеоперационной дисфагии [20].
В качестве альтернативы шейному спондилодезу нередко используют протезы межпозвонковых дисков для динамической фиксации шейного сегмента. Эндопротез крепится к кости за счет фиксационных шипов, а также имеет пористую поверхность для дальнейшей остеоинтеграции. Одной из наиболее распространенных моделей является протез DISCOVER DePuy Synthes (Рис. 1).

Эндопротез межпозвонкового диска DISCOVER
Рис. 2. Цилиндрический титановый кейдж с резьбой (BAK-C).
Рис. 1.
Вопрос динамической фиксации позвоночного сегмента нередко является поводом для дискуссий в медицинском сообществе. В исследовании, проведенном Sheng Shi et al., сообщается, что миграция эндопротеза диска встречается в 16,7% случаев, проседание в 3,3%, дегенерация смежного сегмента — в 3,3% [21–23]. Полученные данные оценивались рентгенологически с периодом наблюдения от 12 до 24 месяцев.
Рассматривая спондилодез как безальтернативный метод фиксации, актуальным вопросом остается выбор материала для межтелового кейджа. В определенное время широкую распространенность получили межтеловые кейджи, изготовленные из сплава титана [24]. Одним из наиболее распространенных кейджей является BAK-C Zimmer (Рис. 2).
По данным авторов в период с 1997 по 2001 гг. пациентам была выполнена одноуровневая дискэктомия на шейном уровне с межтеловой фиксацией титановым кейджем с заполнением костной крошкой (полученной в месте операции). Средний период наблюдения составил 4 года и 8 месяцев. Спондилодез наблюдался у 98,9% пациентов, дооперационный угол лордоза сохранился у 93,8% [24]. В 2017 г. был проведен мета-анализ данных 875 исследований, где пациентам при дискэктомии фиксация выполнялась титановыми кейджами. Результаты оценивали при помощи КТ, минимум через 12 месяцев

Рис. 3. Кейдж HONOUR.

после оперативного лечения. По данным исследования определяется статистически значимая частота проседания кейджей из титана в сравнении с PEEK-кейджами. Частота формирования спондилодеза варьировалась от 46,51 до 100%. Частота проседания кейджа за тот же период наблюдения составила от 16 до 35% [25].
Заслуженную популярность в хирургической практике набирают вышеописанные межтеловые кейджи изготовленные из полиэфирэфиркетона (PEEK) [26].
Выбор данного материала обусловлен хорошей износостойкостью и резистентностью к динамическим и статическим нагрузкам [27]. Кейджи из PEEK прозрачны для рентгеновского излучения, что дает возможность точно визуализировать и оценивать состоятельность костного сращения. Также они могут иметь рентген-по-зитивные танталовые маркеры, что позволяет интраоперационно оценить правильность установки кейджа и при необходимости произвести коррекцию. Кейджи в зависимости от фирмы производителя отличаются методами фиксации в позвонке. Кейдж HONOUR (Рис. 3) и кейдж UM Cerv-X крепятся между телами позвонков за счет рельефной поверхности имплантата.
Кейджи Medtronic PEEK Prevail (Рис. 4) имеют 2 дополнительных отверстия для фиксации выше и нижележащих тел позвонков монокортикальными винтами, у кейджей Depuy Synthes ZERO-P (Рис. 5) их 4.
По данным мировой литературы при использовании PEEK-кейджей частота формирования спондилодеза (через 12 месяцев после операции) составила от 76 до 100%. Частота проседания кейджа составила от 0 до 28% [25]. По другим данным частота спондилодеза варьировалась от 94,3–100%, проседание кейджа происходило в 0–10% случаев [28]. Farrokhi et al., сообщают о 93,8% спондилодеза при заполнении кейджа остеокондуктивным ал-лотрасплантатом [29]. В двух когортных исследованиях сообщается о 100% формировании спондилодеза при сроках наблюдения от 6 до 12 месяцев [30; 31]. В каждом из вышеперечисленных исследований кейджи заполнялись костными ауто- или аллотрансплантатами.
Установка PEEK-кейджей без заполнения остео-кондуктивными материалами также достаточно распространена в хирургической практике, но показывает неоднозначные результаты. В 2017 г. было проведено многоцентровое проспективное исследование примене-
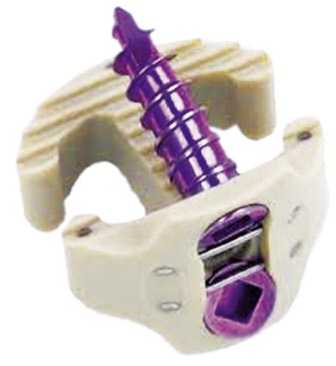
Рис. 4. Кейдж Medtronic Prevail.

Рис. 5. Кейдж Depuy Synthes ZERO-P.
ния «пустых» PEEK-кейджей, которое сообщает о том, что данная методика имеет низкие показатели рентгенографического сращения. Через 18 месяцев наблюдения спондилодез наблюдался в 83% [32]. Авторами данного исследования было рекомендовано не устанавливать кейджи без костного алло- аутотрансплатата. В трёх других проведенных ретроспективных исследованиях процент спондилодеза составил 81,3, 65 и 88,1%, соответственно. Частота проседания кейджа варьировалась от 14,3 до 48,3%. Средняя продолжительность наблюдения в вышеперечисленных исследованиях составила от 27,6 до 30 месяцев [33–35].
Применение титановых кейджей зачастую сопряжено с рядом недостатков: псевдоартроз (несрастание позвонков), проседание и смещение устройства, охрупчивание кости, сложности при анализе МРТ-снимков, необходимость проведения повторной операции. Например, в работе Laubach M. et al. описан случай несрастания позвонков у пациента после 2-х лет с момента установки титанового кейджа [36]. По данным рентгеновских исследований устройство не мигрировало и не проседало, что
указывает на срастание позвонков. Однако при анализе гистологической картины было выявлено несрастание тел позвонков. Наблюдалось врастание трабекулярной кости в кейдж с обеих сторон, при этом в центре кейджа сформировался слой фиброзно-хрящевой ткани. При более детальном рассмотрении эта зона демонстрировала процессы непрямого остеогенеза, что может указывать на возможное срастание в более отдаленном периоде. Хотя этот случай и не был признан клинически значимым дефектом, он демонстрирует недостатки металлических кейджей: они перекрывают зону срастания, вызывают адаптивную перестройку кости из-за эффекта экранирования напряжений, что приводит к замедлению срастания [36]. Актуальным направлением исследований и разработок является создание биодеградируемых кейджей, которые потенциально могут обеспечить полное сращение позвонков и разложение в заданный срок, тем самым исключая осложнения в долгосрочном периоде.
Биодеградируемые кейджи
В последнее время большое внимание уделяют биодеградируемым (биоразлагаемым) полимерам [37] в качестве основы для имплантатов. Изделия из таких полимерных материалов обычно используют для восстановления передней крестообразной связки (интерфе-рентные винты), а также для фиксации переломов [38]. Биодеградируемые имплантаты обычно демонстрируют хорошую эффективность во многих хирургических операциях. Для их создания, в основном, используют сополимеры на основе лактида, гликолида и ε -капролактона. Свойства этих материалов могут быть адаптированы для конкретных применений благодаря возможности менять их характеристики путем варьирования состава, молекулярной массы и надмолекулярной структуры.
В работе Dijk M. еt al. исследовали in vivo влияние жесткости кейджа на скорость поясничного межтелового спондилодеза при использовании биодеградируемых кейджей из PLLA (поли-L-лактид) и титановых кейджей одинаковой конструкции [39]. Скорость формирования спондилодеза оценивали путем слепого рентгенографического анализа с использованием трехточечной рентгенографической оценки со строгими критериями спондилодеза, разработанными для объективизации формирования кости. Были спроектированы титановые кейджи, а также кейджи на основе PLLA, обладающие различной жесткостью за счет различной толщины изделия. Изделия были спроектированы таким образом, чтобы в течение 6 месяцев их механические свойства сохранялись. В устройства помещали аутогенную губчатую кость из гребня подвздошной кости с использованием держателя кейджа для предотвращения изгиба стенок кейджа наружу [39]. Поясничный отдел позвоночника козы был использован в качестве модели межтелового сращения, поскольку теоретические данные показывают, что позвоночник четвероногих нагружен в основном вдоль своей длинной оси, как и позвоночник человека
-
[40 ]. При этом у четвероногих возникают даже более высокие напряжения осевого сжатия, что приводит к более высокой плотности костей, чем у людей. Это необходимо учитывать при переносе результатов на человеческий позвоночник. Результаты исследования через 6 месяцев показали, что уменьшенная жесткость изделий из PLLA значительно повышает скорость межтелового сращения по сравнению с титановыми каркасами. Таким образом, биодеградируемые кейджи, используемые для облегчения межтелового сращения, могут быть хорошей альтернативой существующим кейджам из титана и PEEK, поскольку позволяют избежать сопутствующих проблем, связанных с их высокой жесткостью [39].
В работе Laubach M. et al. представлены результаты исследования биодеградируемых кейджей из полимеров лактида различного состава, проведено сравнение с аналогичным изделием из титана. Полимерные биоразлагаемые кейджи были изготовлены из поли(L-лактида) PLLA и сополимера поли(L-лактид-со-D,L-лактид) P(LD)LLA с относительным составом 70:30 [36]. Молекулярная масса PLLA и P(LD)LLA в готовом изделии после стерилизации низкотемпературной плазмой составила Mw = 395 кДа и Mw = 172 кДа, соответственно. Степень кристалличность PLLA — 11 %, P(LD)LLA — 0 %. Прочность кейджей: 6,5–6,7 кН. Изделия устанавливали в крупных животных (козлов) между позвонками L3-L4 на сроки от 3 до 48 мес. В просвет кейджа помещали костный трансплантат. При установке титанового кейджа через 6 мес. на микрофотографиях гистологических срезов наблюдается врастание кости в просвет кейджа, а по центру остается зона хряща, в которой идет процесс непрямого остеогенеза. По всему периметру имплантат окружен капсулой из соединительной ткани. На сроке 12 мес. происходит полное срастание позвонков в 66% случаев [36]. При этом формируемая кость является более пористой, что связано с эффектом экранирования напряжений. Более жесткий, по сравнению с костью кейдж выступает армирующим элементом, который воспринимает на себя основную нагрузку. Через 3 мес. после установки полимерного PLLA кейджа, наблюдается врастание кости с двух сторон, при этом просвет изделия все еще наполовину заполнен плотным костным трансплантатом. Через 6 мес. во всех случаях наблюдалось полное срастание с формированием трабекулярной кости [36]. В отличие от непрямого остеогенеза, наблюдавшегося для титановых имплантатов, сращение позвонков при установке полимерного кейджа происходило посредством прямого остеогенеза. Через 2 года вновь образованная костная ткань сформировалась в ламеллярную кость, при этом изделие полностью разложилось без какой-либо отрицательной реакции со стороны окружающих тканей. Через 4 года плотность образованной в зоне операции кости соответствовала плотность кости соседних позвонков. Скорость формирования кости при использовании биодеградируемых полимерных кейджей из P(LD)LA была более высокой, чем в группе с PLLA кейджами — через 3 мес. около 80–90% костного трансплантата были заме-
щены трабекулярной костью [36]. Однако в зоне соприкосновения фронтов срастающихся тканей наблюдалась прослойка соединительной ткани, что указывает на непрямой остеогенез. Кроме того, через 3 мес. в изделии были видны трещины и разломы, по своим механическим характеристикам оно было недостаточно прочным. Через 6 мес. только три из шести образцов продемонстрировали полное срастание, несмотря на более быструю динамику формирования кости в первые 3 мес. В случаях несрастания образовалась прослойка фиброзно-хрящевой ткани, что предполагает появление псведоартроза. На сроке 12 мес. в группе P(LD)LA кейджей полное срастание демонстрировали только 3 из 8 образцов. При использовании дополнительной фиксации изделия из P(LD)LA проявили себя гораздо лучше — полное срастание через 6 мес. наблюдалось в 5 из 6 случаев, в одном случае срастание на 83%. P(LD)LA полностью резорбировались через 12 мес. Таким образом, изделия из полимеров проявили отличную биосовместимость, но кейдж из PLLA проявил себя лучше, поскольку дольше сохранял механические характеристики. Важность сохранения прочности на период до 6 мес. подтверждается экспериментом, где использовалась дополнительная фиксация при установке P(LD)LA-устройств. Она компенсировала более раннюю потерю механической стабильности изделием и приводила к полному сращению кости.
Выводы
Согласно полученным данным выбор материала и метода для фиксации шейного сегмента при передней шейной дискэктомии остается открытым и актуальным вопросом. Основные осложнения связаны с миграцией трансплантатов, винтов, кейджей, пластин. Реже отмечается уменьшение угла шейного лордоза и осложнения связанные с забором трансплатата (нагноение ран, неврологические нарушения). К сожалению, в литературе отсутствуют исследования обозревающие все возможные методики/материалы для фиксации и/или спондилодеза и сравнивающие их друг с другом, но учитывая высокий процент частых осложнений связанных с миграцией имплантатов и последующей нестабильностью сегмента. Возможным решением данной проблемы является создание биосовместимого биоразлагаемого шейного кейджа, данная разработка позволит снизить процент послеоперационных осложнений связанных миграцией и нестабильностью устанавливаемого импланта, за счёт полного разложения после наступления спондилодеза.
Заключение
Анализируя полученные данные, и актуальность проблемы в РНЦХ им. Б.В. Петровского совместно с НИЦ «Курчатовский институт» ведется разработка биосовме-стимого биодеградируемого устройства/кейджа для стабилизации шейных позвонков при операциях на шейном отделе позвоночника. В настоящее время сформированы медико-технические требования к кейджу (Табл. 1).
Табл. 1. Медико-технические требования к кейджу
Полная биодеградация в срок не более 2-х лет
Наличие в конструкции кейджа пористого элемента
Полное замещение кейджа на костную ткань
Прочность и жесткость при действии физиологических нагрузок
Рентген-контрастность
Биоактивность (для ускорения формирования спондилодеза)
Для оценки прочности и жесткости кейджа при действии физиологических нагрузок широко используют экспериментальные и численные методы. В первом случае образцы изделий испытывают на специальной оснастке в условиях статического и динамического сжатия, изгиба или кручения (ASTMF2077-22 [41]), импульсного силового воздействия (ISO 23089-2:2021 [42]), оценивают проседание кейджа при его фиксации между блоками, имитирующими костную ткань с последующей компрессией (ASTM F2267-22 [43]). Результаты натурных экспериментов дают достаточно полную картину механического поведения изделия при действии широкого спектра нагрузок. Первым этапом планируется поиск подходящих материалов, подходящий для создания устройства, разработка конструкции межпозвонкового кейджа. Требуемый материал должен обеспечивать механическую и статическую стабильность устройства. Вторым этапом планируется создание биоактивного покрытия и проведение опытов на животных в виварии.
Список литературы Методы фиксации и шейного спондилодеза при шейной дискэктомии
- Colombo C, Salvioli S, Gianola S, Castellini G, Testa M. Traction Therapy for Cervical Radicular Syndrome is Statistically Significant but not Clinically Relevant for Pain Relief. A Systematic Literature Review with Meta-Analysis and Trial Sequential Analysis. J Clin Med. 2020; 9(11): 3389. doi: 10.3390/jcm9113389.
- Sharma A, Kishore H, Singh V, Shawky Abdelgawaad A, Sinha S, Kamble PC, Jorule K, Agrawal R, Mathapati S, Deepak P. Comparative Study of Functional Outcome of Anterior Cervical Decompression and Interbody Fusion With Tricortical Stand-Alone Iliac Crest Autograft Versus Stand-Alone Polyetheretherketone Cage in Cervical Spondylotic Myelopathy. Global Spine J. 2018; 8(8): 860-865. doi: 10.1177/2192568218780345.
- Iyer S, Kim HJ. Cervical radiculopathy. Curr Rev Musculoskelet Med. 2016; 9(3): 272-80. doi: 10.1007/s12178-016-9349-4.
- Калинин А.А., Санжин Б.Б., Алиев М.А., Юсупов Б.Р., Аглаков Б.М., Шепелев В.В. Анализ результатов лечения пациентов с диско-радикулярным конфликтом шейного отдела позвоночника методом дискэктомии и переднего спондилодеза за четырехлетний период // Сибирский медицинский журнал. — 2019. — №2. doi: 10.34673/ismu.2019.156.1.003.
- Хирургия дегенеративных поражений позвоночника: национальное руководство / А.Г. Аганесов, С.О. Арестов, Д.С. Асютин и др. Под ред. А.О. Гущи, Н.А. Коновалова, А.А. Гриня. — Москва, 2019. — 478 с.
- Хирургия позвоночника. Оперативная техника: перевод второго издания А.Р. Ваккаро, И.М. Барон; под. ред. Ю.А. Щербука. — Москва, 2015. — C.422.
- Bohlman HH, Emery SE, Goodfellow DB, Jones PK. Robinson anterior cervical discectomy and arthrodesis for cervical radiculopathy. Long-term follow-up of one hundred and twenty-two patients. J Bone Joint Surg Am. 1993; 75(9): 1298-307. doi: 10.2106/00004623-199309000-00005.
- Emery SE, Bohlman HH, Bolesta MJ, Jones PK. Anterior cervical decompression and arthrodesis for the treatment of cervical spondylotic myelopathy. Two to seventeen-year follow-up. J Bone Joint Surg Am. 1998; 80(7): 941-51. doi: 10.2106/00004623-199807000-00002.
- Гринь А.А., Касаткин Д.С. Несостоятельная фиксация шейного отдела позвоночника при его травмах и заболеваниях // Клиническая практика. — 2017. — №2(30). — С.49-55.
- Rhee JM, Riew KD. Dynamic anterior cervical plates. J Am Acad Orthop Surg. 2007; 15(11): 640-6. doi: 10.5435/00124635-200711000-00002.
- Rhee JM, Park JB, Yang JY, Riew DK. Indications and techniques for anterior cervical plating. Neurol India. 2005; 53(4): 433-9. doi: 10.4103/ 0028-3886.22609.
- Барыш А.Е., Козырев С.А. Осложнения вентральной межтеловой фиксации шейных позвонков динамическими пластинами // Хирургия позвоночника. — 2014. — №3. — С.22-31. doi: 10.14531/ss2014.3.22-31.
- Chung DY, Cho DC, Lee SH, et al. Preliminary surgical result of cervical spine reconstruction with a dynamic plate and titanium mesh cage. J Korean Neurosurg Soc. 2007; 41: 111-117.
- Kristof RA, Kiefer T, Thudium M, et al. Comparison of ventral corpectomy and plate-screwinstrumented fusion with dorsal laminectomy and rod-screw-instrumented fusion for treatment of at least two vertebral-level spondylotic cervical myelopathy. Eur Spine J. 2009; 18:1951–1956. doi: 10.1007/ s00586-009-1110-x.
- Han SY, Kim HW, Lee CY, Kim HR, Park DH. Stand-alone cages for anterior cervical fusion: are there no problems? Korean J. Spine. 2016; 13(1): 13-19. doi: 10.14245/kjs.2016.13.1.13.
- Cheung ZB, Gidumal S, White S, et al. Comparison of anterior cervical discectomy and fusion with a stand-alone interbody cage versus a conventional cage-plate technique: a systematic review and meta-analysis, Glob. Spine J. 2019; 9: 446-455. doi: 10.1177/2192568218774576.
- Oh JK, Kim TY, Lee HS, et al. Stand-alone cervical cages versus anterior cervical plate in 2-level cervical anterior interbody fusion patients: clinical outcomes and radiologic changes. J Spinal Disord Tech. 2013; 26(8): 415-20. doi: 10.1097/BSD.0b013e31824c7d22.
- Ji GY, Oh CH, Shin DA, et al. Stand-alone Cervical Cages Versus Anterior Cervical Plates in 2-Level Cervical Anterior Interbody Fusion Patients: Analysis of Adjacent Segment Degeneration. J Spinal Disord Tech. 2015; 28(7): E433-8. doi: 10.1097/BSD.0b013e3182a355ad.
- Zawy Alsofy S, Nakamura M, Ewelt C, et al. Comparison of stand-alone cage and cage-with-plate for monosegmental cervical fusion and impact of virtual reality in evaluating surgical results. Clin Neurol Neurosurg. 2020; 191: 105685. doi: 10.1016/j.clineuro.2020.105685.
- Cheung ZB, Gidumal S, White S, et al. Comparison of Anterior Cervical Discectomy and Fusion With a Stand-Alone Interbody Cage Versus a Conventional Cage-Plate Technique: A Systematic Review and Meta-Analysis. Global Spine J. 2019; 9(4): 446-455. doi: 10.1177/2192568218774576.
- Shi S, Zheng S, Li XF, Yang LL, Liu ZD, Yuan W. Comparison of 2 Zero-Profile Implants in the Treatment of Single-Level Cervical Spondylotic Myelopathy: A Preliminary Clinical Study of Cervical Disc Arthroplasty versus Fusion. PLoS One. 2016; 11(7): e0159761. doi: 10.1371/journal.pone.0159761.
- Zhang X, Zhang X, Chen C, et al. Randomized, controlled, multicenter, clinical trial comparing BRYAN cervical disc arthroplasty with anterior cervical decompression and fusion in China. Spine. 2012; 37: 433-438. doi: 10.1097/BRS.0b013e31822699fa.
- Coric D, Kim PK, Clemente JD, Boltes MO, Nussbaum M, James S. Prospective randomized study of cervical arthroplasty and anterior cervical discectomy and fusion with long-term follow-up: results in 74 patients from a single site. J Neurosurg Spine. 2012; 18: 36-42. doi: 10.3171/ 2012.9.SPINE12555.
- Caroli E, Orlando ER, D’Andrea G, Ferrante L. Anterior cervical fusion with interbody titanium cage containing surgical bone site graft: our institution’s experience in 103 consecutive cases of degenerative spondylosis. J Spinal Disord Tech. 2007; 20(3): 216-20. doi: 10.1097/01.bsd.0000211272.97109.b8.
- : Seaman S, Kerezoudis P, Bydon M, Torner JC, Hitchon PW. Titanium vs. polyetheretherketone (PEEK) interbody fusion: Meta-analysis and review of the literature. J Clin Neurosci. 2017; 44: 23-29. doi: 10.1016/j.jocn. 2017.06.062.
- Park HW, Lee JK, Moon SJ, Seo SK, Lee JH, Kim SH. The efficacy of the synthetic interbody cage and Grafton for anterior cervical fusion. Spine (Phila Pa 1976). 2009; 34(17): E591-5. doi: 10.1097/BRS.0b013e3181ab8b9a.
- Chiang CJ, Kuo YJ, Chiang YF, Rau G, Tsuang YH. Anterior cervical fusion using a polyetheretherketone cage containing a bovine xenograftp: three to five-year follow-up. Spine (Phila Pa 1976). 2008; 33(23): 2524-428. doi: 10.1097/BRS.0b013e318185289c.
- Ahmed AF, Al Dosari MAA, Al Kuwari A, Khan NM. The outcomes of stand alone polyetheretherketone cages in anterior cervical discectomy and fusion. Int Orthop. 2021; 45(1): 173-180. doi: 10.1007/s00264-020-04760-1.
- Farrokhi MR, Nikoo Z, Gholami M, Hosseini K. Comparison between acrylic cage and polyetheretherketone (PEEK) cage in single-level anterior cervical discectomy and fusion: a randomized clinical trial. Clin Spine Surg. 2017; 30(1): 38-46.
- Cho DY, Liau WR, Lee WY, Liu JT, Chiu CL, Sheu PC. Preliminary experience using a polyetheretherketone (PEEK) cage in the treatment of cervical disc disease. Neurosurgery. 2002; 51(6): 1343-1349.
- Zhou J, Xia Q, Dong J, et al. Comparison of stand-alone polyetheretherketone cages and iliac crest autografts for the treatment of cervical degenerative disc diseases. Acta Neurochir. 2011; 153(1): 115-122.
- Suess O, Schomaker M, Cabraja M, Danne M, Kombos T, Hanna M. Empty polyetheretherketone (PEEK) cages in anterior cervical diskectomy and fusion (ACDF) show slow radiographic fusion that reduces clinical improvement: results from the prospective multicenter “PIERCE-PEEK” study. Patient Saf Surg. 2017: 1112.
- Klingler JH, Kruger MT, Sircar R, et al. PEEK cages versus PMMA spacers in anterior cervical discectomy: comparison of fusion, subsidence, sagittal alignment, and clinical outcome with a minimum 1-year follow-up. Scientific World Journal. 2014: 398396.
- Kim YS, Park JY, Moon BJ, Kim SD, Lee JK. Is stand alone PEEK cage the gold standard in multilevel anterior cervical discectomy and fusion (ACDF)? Results of a minimum 1-year follow up. J Clin Neurosci: 2018: 47341-47346.
- Cabraja M, Oezdemir S, Koeppen D, Kroppenstedt S. Anterior cervical discectomy and fusion: comparison of titanium and polyetheretherketone cages. BMC Musculoskelet Disord. 2012; 13: 172. doi: 10.1186/ 1471-2474-13-172.
- Laubach M, Kobbe P, Hutmacher DW. Biodegradable interbody cages for lumbar spine fusion: Current concepts and future directions. Biomaterials. 2022; 288: 121699. doi: 10.1016/j.biomaterials.2022.121699.
- Аржакова О.В., Аржаков М.С., Бадамшина Е.Р. и др. Полимеры будущего // Успехи Химии. — 2022. Т.91. — №12.
- Агаджанян В.В., Пронских А.А., Демина В.А., Гомзяк В.И., Седуш Н.Г., Чвалун С.Н. Биодеградируемые импланты в ортопедии и травматологии. Наш первый опыт // Политравма. — 2016. — №4. — С.85-93.
- Dijk M, et.al. The Effect of Cage Stiffness on the Rate of Lumbar Interbody Fusion. SPINE. 2002; 27(7): 682-688.
- Smit TH. The use of a quadruped as an in vivo model for the study of the spine — biomechanical considerations. Eur Spine J. 2002; 11(2): 137-44. doi: 10.1007/s005860100346.
- ASTM D F2077-22; Standard Test Methods for Intervertebral Body Fusion Devices. ASTM International: West Conshohocken, PA, USA, 2022.
- ISO 23089-2:2021; Implants for surgery — Pre-clinical mechanical assessment of spinal implants and particular requirements — Part 2: Spinal intervertebral body fusion devices. ISO: Geneva, Switzerland, 2021.
- ASTM D F2267-22; Standard Test Method for Measuring Load-Induced Subsidence of Intervertebral Body Fusion Device Under Static Axial Compression. ASTM International: West Conshohocken, PA, USA, 2022.


