Методы лечения пациентов с хроническим лучевым проктитом при помощи эндоскопических технологий
Автор: Гришина Е.А., Леонтьев А.В., Шишин К.В., Данилов М.А.
Журнал: Хирургическая практика @spractice
Рубрика: Хирургия
Статья в выпуске: 3 т.8, 2023 года.
Бесплатный доступ
Цель. Изучить эффективность аргоноплазменной коагуляции (АПК) и радиочастотной абляции (РЧА) в лечении пациентов с хроническим лучевым проктитом (ХЛП), осложненным рецидивирующим ректальным кровотечением.Материалы и методы. Проспективное, рандомизированное, одноцентровое исследование, проведенное на базе отделений колопроктологии и оперативной эндоскопии ГБУЗ МКНЦ им. А. С. Логинова ДЗМ. В исследование были включены 73 пациента, с 1-2-й степенью ХЛП по шкале RTOG/EORТC. Показанием к эндоскопическому лечению были рецидивирующие ректальные кровотечения. Эндоскопическое лечение было проведено в объеме АПК (36 пациентов) или РЧА (37 пациентов) в зависимости от рандомизации.Результаты. У 44 пациентов (60,2 %) (из них 18 (50 %) - в группе, проходящей лечение, АПК и 26 (70,2 %) - РЧА), выявлен полный регресс заболевания в виде отсутствия клинической симптоматики и наличия положительной динамики при эндоскопическом осмотре после одного этапа эндоскопического вмешательства. У 18 пациентов (50 %) в группе АПК и у 11 (29,7 %) в группе РЧА выявлены телеангиоэктазии, которые были продолжающимся источником кровотечения. После регрессии воспалительных изменений пациентам был проведен второй этап оперативного вмешательства, соответствующий группе рандомизации. После второго этапа оперативного вмешательства в группе АПК у 17 пациентов (94,4 %) и в группе РЧА у 11 пациентов (100 %) выявлен полный регресс заболевания. Болевой синдром в послеоперационном периоде встречается в двух группах, однако в группе РЧА прослеживается более высокая интенсивность и продолжительность болевого синдрома.Выводы. Радиочастотная абляция и аргоноплазменная коагуляция являются эффективными и безопасными методами эндоскопического лечения ректальных кровотечений при хроническом лучевом проктите, не осложненном эрозивно-язвенными поражениями кишки.
Хронический лучевой проктит, осложнения лучевой терапии, эндоскопическая хирургия, аргоноплазменная коагуляция, радиочастотная абляция
Короткий адрес: https://sciup.org/142239451
IDR: 142239451 | УДК: 616.345-002-07-08(07) | DOI: 10.38181/2223-2427-2023-3-1
Текст научной статьи Методы лечения пациентов с хроническим лучевым проктитом при помощи эндоскопических технологий
Хронический лучевой проктит (ХЛП) — одно из осложнений лучевой терапии, входящей в комплексное лечение злокачественных новообразований органов малого таза. ХЛП чаще всего развивается не ранее чем через 3 месяца после проведенного курса лечения [1]. При этом заболевании происходит перестройка микроциркуляторного русла за счет ионизирующего излучения на слизистую прямой кишки. В результате образуются патологически измененные сосуды — телеангиоэктазии, являющиеся источником кровотечения. Из клинических проявлений выделяют частую диарею, ложные позывы на дефекацию, боли в аноректальной области. Но наиболее значимое проявление — рецидивирующие ректальные кровотечения. Начальные проявления заболевания могут быть ограничены незначительным кровотечением из прямой кишки, которое с течением времени может усиливаться, приводя к тяжелой анемии. В некоторых случаях степень выраженности кровопотери становится основанием для неоднократных госпитализаций в стационар и переливания компонентов крови. При этом качество жизни у этих пациентов резко усугубляется [2]. Медикаментозная терапия является неэффективной при ее изолированном применении. Нередко пациентам предлагают выполнение хирургических вмешательств, направленных на резекцию или отключение кишки, что еще больше ухудшает качество жизни [3]. Эндоскопические методы, направленные на деструкцию сосудистых изменений, имеют приоритетное значение в лечении неосложненных форм ХЛП [4]. Несмотря на доступность и простоту методики, в мировой литературе описано большое количество осложнений с формированием длительно незаживающих язв или свищевых ходов, при этом альтернативой лечения осложнений также выступают хирургические вмешательства [5—7].
Цель исследования — изучить эффективность и сравнить методику аргоноплазменной коагуляции и радиочастотной абляции в лечении пациентов с хроническим лучевым проктитом, осложненным рецидивирующим ректальным кровотечением.
Материалы и методы
С 2020 по 2022 г. на базе ГБУЗ «Московский клинический научный центр им. А. С. Логинова ДЗМ» произведен проспективный анализ результатов хирургического лечения 73 пациентов с неосложненными формами ХЛП. У всех больных хронический лучевой проктит развился через 6 и более месяцев после окончания лучевой терапии по радикальной программе, проведенной по поводу злокачественных опухолей тазовой локализации (простата, шейка и тело матки, вульва). В исследование были включены пациенты с 1-2-й степенью ХЛП по шкале RTOG/EORTC. Показанием к эндоскопическому лечению было продолжительное рецидивирующее ректальное кровотечение. Среди других клинических проявлений у пациентов отмечалась выраженная диарея, а также боли в прямой кишке. Критериями невключения стали пациенты с наличием язвенных дефектов, фистул, перфораций, а также воспалительных заболеваний толстой кишки в стадии обострения. Протокол данного исследования был утвержден локальным этическим комитетом МКНЦ им. Логинова. Распределение по группам проводилось методом рандомизации. Пациенты были разделены на две группы, 36 пациентам выполнено оперативное вмешательство с применением аргоноплазменной коагуляции (АПК), 37 — с применением радиочастотной абляции (РЧА) слизистой прямой кишки. Пациенты были сопоставимы по полу, возрасту, проявлениям основного заболевания без существенной разницы в обеих группах.
На начальном этапе работы мы классифицировали степень поражения прямой кишки по шкале плотности ректальных телеангиоэктазий, разработанной в 2005 г. K. D. Chi.
В процессе работы стало ясно, что данная классификация неудобна в практическом применении. В результате этого мы создали более практичную шкалу. В усовершенство- 8 ванной классификации предложена балльная оценка по длине поражения ( Д ), распространенности поражения по окружности кишки ( О ) и по плотности телеангиоэктазий ( П ). Учитывая, что рецидивирующие ректальные кровотечения являются ведущим клиническим проявлением заболевания, а их устранение — основным критерием качества лечения, то в классификацию был введен клинический критерий — кровотечение ( К ), наличие или отсутствие которого указывалось «+» или «-». Аббревиатура полного названия классификации сосудистых изменений по первым буквам учитываемых характеристик получила название ДОПК. Предложенная шкала позволяет оценивать не только выраженность первичного поражения, но и контролировать эффективность выполненного оперативного вмешательства и при необходимости определять показания к повторному вмешательству (рис. 1).
Распространенность поражения по Окружности
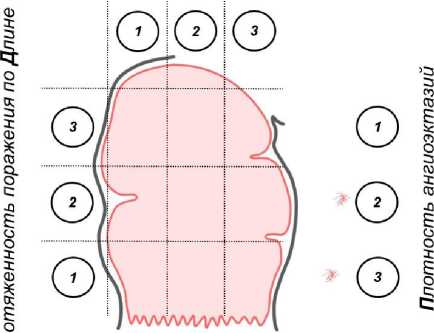
С Наличие Кровотечения М-
Рис. 1. Балльная шкала ДОПК эндоскопической оценки степени выраженности сосудистых изменений при хроническом лучевом проктите
Fig. 1. A LCDG scale for endoscopic assessment of the severity of vascular changes in chronic radiation proctitis
С учетом достаточно большой дисперсии пациентов мы выделили три группы пациентов с легкой (0, 3—4 балла), средней (5—7 баллов) и тяжелой (8—9 баллов) степенью выраженности сосудистых изменений прямой кишки.
Для клинической оценки степени выраженности кровотечения мы использовали собственную оригинальную шкалу балльной оценки, в которой учитывались жалобы и объективные показатели обследования, лабораторных анализов и характера медикаментозной поддержки.
В соответствии с предложенной шкалой мы выделяли четыре группы пациентов с кровотечениями клинически не значимыми (0—3 балла) и клинически значимыми легкой (4—6 баллов), умеренной (7—9 баллов) степени выраженности и выраженными (10—12 баллов) (табл. 1).
Таблица 1. Бальная шкала клинической оценки степени выраженности кровотечения
Table 1. A score scale for clinical evaluation of the severity of bleeding
|
Параметр оценки |
0 баллов |
1 балл |
2 балла |
3 балла |
|
Кровь в стуле |
Нет |
Периодически примесь |
Постоянная примесь |
Сгустки |
|
Гемоглобин, г/л |
В норме |
Снижение на 20 г/л |
Снижение на 21—40 г/л |
Снижение более 41 г/л |
|
Гемотрансфузии |
Не было |
СЗП |
Эритроцитная масса |
Эритроцитная масса и СЗП |
|
Медикаментозная поддержка |
Нет |
5-АСК |
Препараты железа |
Гемостатики |
У превалирующего числа пациентов до оперативного вмешательства было установлено поражение средней и тяжелой степени по шкале ДОПК. При этом у большинства выявлены клинически значимые кровотечения средней и тяжелой степени тяжести (рис. 2, 3) без статистически значимой разницы в двух группах.
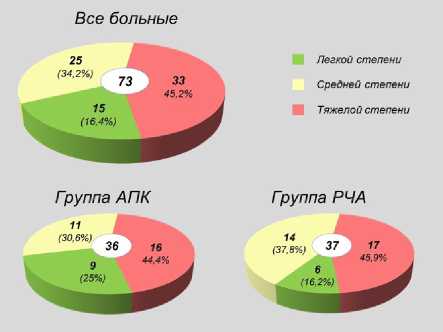
Рис. 2. Распределение пациентов по степени выраженности кровотечения
Fig. 2. Distribution of patients by severity of bleeding
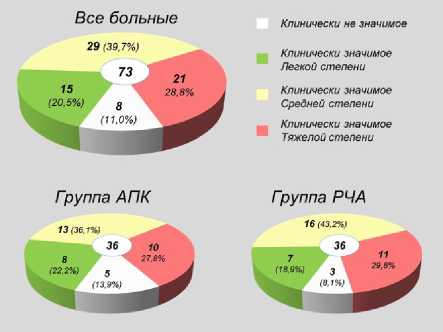
Рис. 3. Распределение по степени выраженности сосудистых изменений прямой кишки до лечения
Fig. 3. Distribution by severity of vascular changes of the rectum before treatment
Для проведения хирургических вмешательств нами были использованы оригинальные методики эндоскопического лечения хронического лучевого проктита.
Методика аргоноплазменной коагуляции
Для проведения вмешательства использовали гастроскоп с дистальным диссекци-онным колпачком для возможности реализации принципа бесконтактного воздействия аргоноплазменной коагуляции. Проводилась АПК участков слизистой с максимально выраженным поражением, а также телеангиоэктазий с признаками продолжающегося кровотечения на момент осмотра.
При осуществлении АПК придерживались принципа деликатной прецизионной коагуляции сосудистых изменений с максимально бережным отношением к неизмененным тканям. С целью профилактики осложнений избегали чрезмерной коагуляции, особенно образования участков карбонизации. Использовали минимальные значения мощности тока (начиная с 10 Вт) и потока газа (начиная с 0,5 м/мин) с приоритетом деликатных режимов АПК. Считали оптимальным визуализацию потока плазмы в виде рассеянных лучей белесоватого цвета или узкого «факела», вызывающих поверхностную коагуляцию. Обработка слизистой проводилась с проксимальных отделов кишки. С целью профилактики развития выраженного болевого синдрома в послеоперационном периоде слизистую в области зубчатой линии не обрабатывали (рис. 4).
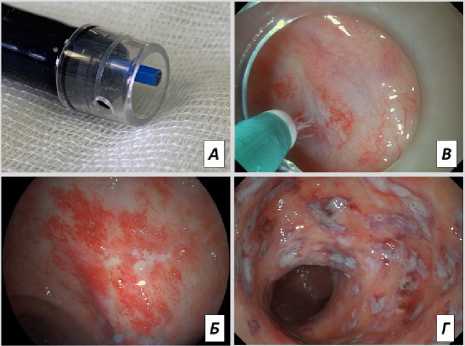
Рис. 4. Этапы оперативного вмешательства (АПК): а — дистальный конец эндоскопа с монтированным колпачком; б —вид слизистой до обработки АПК;
в — этап коагуляционного воздействия; г —вид после вмешательства
Fig. 4. Stages of surgical intervention (APC): а — the distal end of the endoscope with a mounted cap; б — the appearance of the mucosa before the treatment of the APC; в — the stage of coagulation effect; г — the view after the intervention
Методика радиочастотной абляции
Радиочастотная абляция слизистой прямой кишки проводилась с использованием электродов локального воздействия, которые закреплялись на дистальном конце эндоскопа с помощью мягкого силиконового колпачка. Для абляции слизистой прямой кишки устанавливали значение плотности на 12 Дж/см2.
Большая часть смонтированного электрода находится вне поля зрения, что требует особого внимания при работе в области переходной зоны эпителия, термическая обработ- ка которой может сопровождаться выраженным болевым эффектом в послеоперационном периоде. Рекомендуемая в литературе методика обработки слизистой нижней трети кишки под визуальным контролем в положении инверсии гастроскопа имела выраженные |Н технические ограничения вследствие сужения просвета и приводила к дополнительной травме слизистой. В настоящее время мы практически полностью отказались от работы в инверсионном положении и изменили рекомендуемую последовательность этапов выполнения операции (рис. 5).
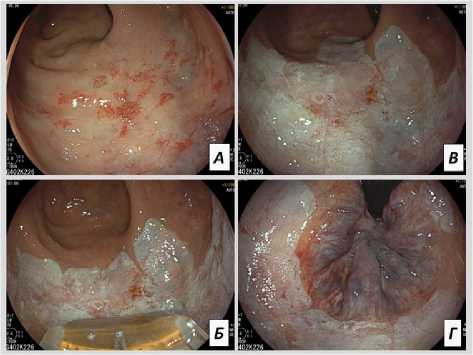
Рис. 5. Этапы проведения РЧА: а — эндоскопическая картина до начала лечения; б —этапы вмешательства; в , г —эндоскопическая картина после вмешательства
Fig. 5. Stages of RFA: а — endoscopic picture before the start of treatment; б — stages of intervention; в , г —endoscopic picture after the intervention
РЧА начинали делать с проксимальных отделов зоны видимых поражений, последовательно продвигаясь к уровню переходной линии эпителия. При этом зона коагуляционной обработки находилась в поле зрения эндоскопа, что позволяло контролировать полноту проведенной абляции, а также правильно позиционировать электрод для последующего воздействия. Преимущественно использовали однократный цикл воздействия. При сливном поражении перемещали электрод с небольшим перекрытием зоны воздействия. При очаговых изменениях проводили локальное воздействие с сохранением участков неизмененной слизистой.
Наблюдение за пациентами
Для определения сроков наблюдения пациентов после оперативного вмешательства мы оценили изменения слизистой в раннем и позднем послеоперационном периоде. Мы пришли к выводу, что выполнять контрольное исследование ранее чем через 3 месяца нецелесообразно. В течение этого периода уменьшается отек слизистой, улучшается визуализация тканей, подвергаются эпителизации большинство язвенных и эрозивных дефектов, а также редуцируются телеангиоэктазии. С наступлением этого срока решается вопрос о необходимости проведения второго этапа оперативного вмешательства при наличии клинической симптоматики. Важным моментом является отсутствие воспалительных изменений в прямой кишке. В том случае если эрозивные или язвенные дефекты полностью не эпителизировались, пациенту дополнительно назначались консервативная медикаментозная терапия и контрольный осмотр через 3 месяца с решением вопроса о дальнейшей тактике лечения.
Результаты исследования
Практически все пациенты в первые сутки после оперативного вмешательства отмечали уменьшение интенсивности кровотечения.
При сравнении результатов мы выявили, что болевой синдром в послеоперационном периоде встречается в двух группах, однако в группе РЧА прослеживается его более высокая интенсивность и продолжительность (p = 0,012) (рис. 6, 7).
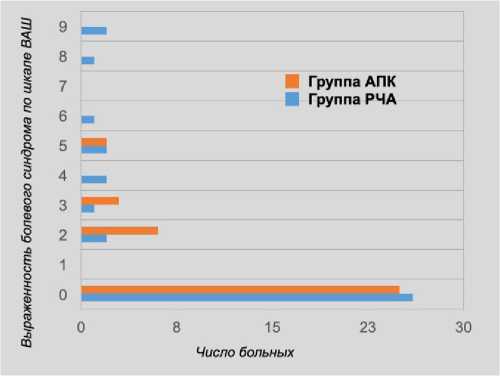
Рис. 6. Интенсивность болевого синдрома в двух группах
Fig. 6. The severity of the pain syndrome in two groups
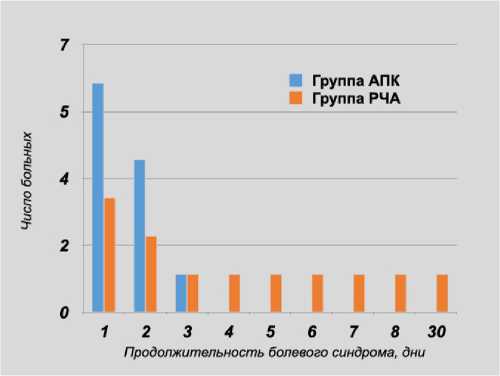
Рис. 7. Продолжительность болевого синдрома в двух группах, дней
Fig. 7. The duration of the pain syndrome in two groups, days
У 44 пациентов (60,2 %) (из них 18 (50 %) — в группе АПК и 26 (70,2 %) — в группе РЧА) выявлен полный регресс заболевания в виде отсутствия клинической симптоматики и наличия положительной динамики при эндоскопическом осмотре после одного этапа эндоскопического вмешательства (p < 0,001). У этих пациентов мы оценивали промежуточный результат через 6 месяцев и окончательный результат через 1 год. За время наблюдения в течение года мы не выявили прогрессию заболевания (табл. 2).
Таблица 2. Динамика степени выраженности сосудистых изменений прямой кишки по шкале ДОПК в обеих группах после первого этапа оперативного вмешательства
(осмотр через 3 месяца после операции)
Table 2. Dynamics of the severity of vascular changes of the rectum on a LCDG scale in both groups after the first stage of surgery (examination 3 months after surgery)
|
Группа |
Степень выраженности сосудистых изменений |
Этап наблюдения |
|
|
До лечения |
После 1-го этапа лечения |
||
|
АПК |
Легкая |
9 (25 %) |
30 (83,3 %) |
|
Средняя |
11 (30,6 %) |
6 (16,7 %) |
|
|
Тяжелая |
16 (44,4 %) |
0 (0 %) |
|
|
РЧА |
Легкая |
6 (16,2 %) |
27 (72,9 %) |
|
Средняя |
14 (37,9 %) |
4 (10,9 %) |
|
|
Тяжелая |
17 (45,9 %) |
6 (16,2 %) |
|
В группе АПК за один этап оперативного вмешательства удалось пролечить меньшее количество пациентов, однако репаративные процессы в группе РЧА продолжались несколько дольше.
Мы не проводили эндоскопическое лечение пациентов с любыми эрозивно-язвенными поражениями прямой кишки, даже с наличием крупных телеангиоэктазий, расположенных по краю язвенного дефекта, или эрозий, из которых на время осмотра определяется обильное поступление свежей крови. Дополнительная деструкция слизистой несет риски усугубления трофических изменений тканей и развития осложнений. В связи с этим данная группа получала медикаментозную терапию дополнительно до 6 месяцев, после чего проводился эндоскопический контроль. При отсутствии эрозивно-язвенных поражений, наличии телеангиоэктазий в прямой кишке и клинической симптоматики всем пациентам проводился второй этап эндоскопического лечения.
У 18 пациентов (50 %) в группе АПК и у 11 пациентов (29,7 %) в группе РЧА выявлены телеангиоэктазии, которые были продолжающимся источником кровотечения (p < 0,001). После регрессии воспалительных изменений пациентам был проведен второй этап оперативного вмешательства, соответствующий группе рандомизации.
После второго этапа оперативного вмешательства в группе АПК у 17 пациентов (94,4 %) и в группе РЧА у 11 пациентов (100 %) был выявлен полный регресс заболевания (p = 0,095 ) . Одному пациенту в группе АПК, принимающему пожизненную антиагрегантную терапию, потребовался третий этап оперативного вмешательства, несмотря на наличие единственной телеангиоэктазии.
Клинические симптомы уменьшились у всех пациентов, кровотечения после проведенных этапов лечения полностью отсутствовали, нормализовался стул, уровень гемоглобина в течение 6 месяцев достиг нормальных значений. Наблюдение пациентов в течение года не выявило прогрессию заболевания.
Эрозивно-язвенные изменения сохраняются более длительное время, в том числе и по истечении 3 месяцев после вмешательства у половины больных после проведения
РЧА и у 10 % больных после АПК (p = 0,012). По всей видимости, более длительные сроки эпителизации в группе РЧА обусловлены особенностью проведения вмешательства с осу- 14 ществлением коагуляции без сохранения участков неизмененной слизистой на большей площади (рис. 8, 9).
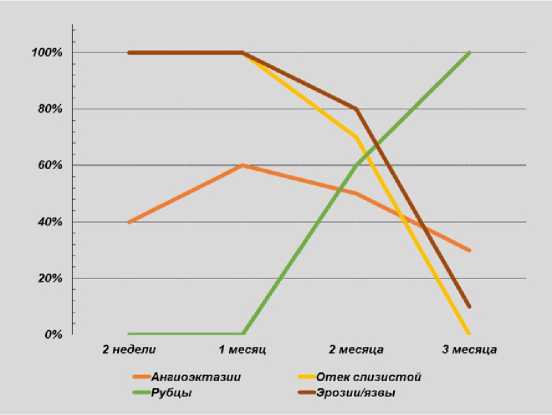
Рис. 8. Динамика ранних изменений слизистой после АПК
Fig. 8. Dynamics of early mucosal changes after APC
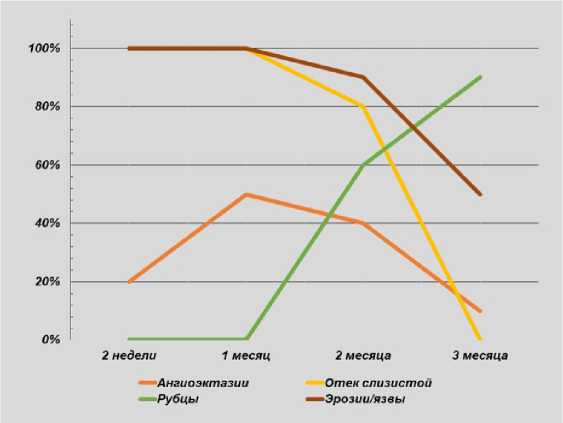
Рис. 9. Динамика ранних изменений слизистой после РЧА
Fig. 9. Dynamics of early mucosal changes after RFA
В результате проведенного исследования нами был разработан протокол эндоскопического лечения хронического лучевого проктита с определением приоритетов применения различных методов в зависимости от степени и распространенности поражения. Первоначальная степень выраженности сосудистых изменений оценивалась по шкале ДОПК. С учетом данных об эффективности различных методов лечения при ограниченном поражении слизистой (менее 6 баллов по шкале ДОПК) проводили аргоноплазменную деструкцию сосудистых изменений на всей площади поражения. По данным нашего исследования, при таком объеме поражения метод АПК позволяет добиться хороших результатов лечения за один этап. При этом немалое значение имеет не только эффективность вмешательства, но и его себестоимость.
При распространенном поражении (6 и более баллов по шкале ДОП) отдавали приоритет РЧА в качестве первичного метода лечения. При невозможности применения РЧА допускается использование АПК. Однако в большинстве наблюдений не следует рассчитывать на достижение положительного результата лечения за один этап (рис. 10).
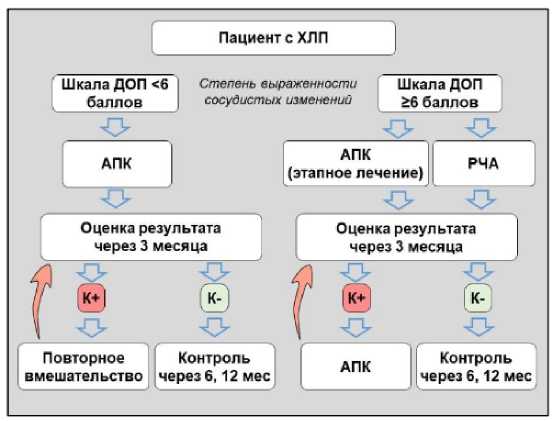
Рис. 10. Протокол эндоскопического лечения хронического лучевого проктита
Fig. 10. Protocol of endoscopic treatment of chronic radiation proctitis
Эндоскопический осмотр с целью оценки результатов лечения следует проводить не ранее 3 месяцев после оперативного вмешательства. При повторных вмешательствах независимо от метода первичного лечения следует отдавать предпочтение аргоноплазменной коагуляции. Редуцированные очаги телеангиоэктазии, как правило, носят изолированный характер и располагаются в разных отделах кишки. При этом АПК позволяет провести деструкцию с максимально бережным отношением к неизмененным тканям.
Выводы
Радиочастотная абляция и аргоноплазменная коагуляция — эффективные и безопасные методы эндоскопического лечения ректальных кровотечений при хроническом лучевом проктите, не осложненном эрозивно-язвенными поражениями кишки. Разработанный протокол лечения, с нашей точки зрения, является практическим результатом проведенного исследования, введен в стандарт лечения пациентов с ХЛП в ГБУЗ «МКНЦ им. А. С. Логинова ДЗМ» и рекомендуется для использования в других лечебных учреждениях.
Список литературы Методы лечения пациентов с хроническим лучевым проктитом при помощи эндоскопических технологий
- Lenz L, Rohr R, Nakao F, Libera E, Ferrari A. Chronic radiation proctopathy: A practical review of endoscopic treatment. World J Gastrointest Surg. 2016;8(2):151-160. DOI: 10.4240/wjgs.v8.i2.151
- Yuan ZX, Qin QY, Zhu MM, Zhong QH, Fichera A, Wang H, Wang HM, Huang XY, Cao WT, Zhao YB, Wang L, Ma TH. Diverting colostomy is an effective and reversible option for severe hemorrhagic radiation proctopathy. World J Gastroenterol. 2020 Feb 28;26(8):850-864. DOI: 10.3748/wjg.v26.i8.850
- Ma TH, Yuan ZX, Zhong QH, Wang HM, Qin QY, Chen XX, Wang JP, Wang L. Formalin irrigation for hemorrhagic chronic radiation proctitis. World J Gastroenterol. 2015 Mar 28;21(12):3593-8. DOI: 10.3748/wjg.v21.i12.3593
- Гришина Е. А., Шишин К. В., Недолужко И. Ю., Курушкина Н. А., Шумкина Л. В., Леонтьев А. В. Эндоскопические методы лечения хронического лучевого проктита. Тазовая хирургия и онкология. 2020;10(3-4):65-72. DOI: 10.17650/2686-9594-2020-10-3-4-65-72 EDN: OGFBCD
- Peng Y, Wang H, Feng J, Fang S, Zhang M, Wang F, Chang Y, Shi X, Zhao Q, Liu J. Effiacy and Safety of Argon Plasma Coagulation for Hemorrhagic Chronic Radiation Proctopathy: A Systematic Review. Gastroenterol Res Pract. 2018 Feb 25;2018:3087603. DOI: 10.1155/2018/3087603
- Леонтьев А. В., Гришина Е. А., Шишин К. В., Данилов М. А. Опыт применения аргоноплазменной коагуляции в лечении пациентов с хроническим лучевым проктитом. Доказательная гастроэнтерология. 2021;10(2):5-11. DOI: 10.17116/dokgastro2021100215 EDN: TQKTBQ
- Леонтьев А. В., Гришина Е. А., Шишин К. В., Данилов М. А., Хатьков И. Е. Применение эндоскопической радиочастотной абляции в лечении хронического лучевого проктита: опыт МКНЦ им. А. С. Логинова. Эндоскопическая хирургия. 2022;28(1):20-25. DOI: 10.17116/endoskop20222801120


