Методы обработки культи надпочечника
Автор: Пучков Константин Викторович, Евстратов Роман Михайлович
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные исследования
Статья в выпуске: 2, 2016 года.
Бесплатный доступ
Лапароскопическая адреналэктомия является золотым стандартом лечения объемных образований надпочечника. Учитывая богатую васкуляризацию органа необходим тщательный контроль гемостаза как при тотальной, так и при частичной его резекции. В арсенале хирургов имеется множество инновационных методик, обеспечивающих эффективную коагуляцию тканей и лигирование сосудов. В данной статье рассмотрены основные методы, применяемые в хирургии надпочечника: монополярные и биполярные коагуляторы, ультразвуковые скальпели, аппараты для спайки сосудов LigaSure, Thunderbeat.
Лапароскопическая адреналэктомия, ультразвуковой скальпель
Короткий адрес: https://sciup.org/142211672
IDR: 142211672
Текст научной статьи Методы обработки культи надпочечника
Частота выявляемости инциденталом надпочечника у пациентов до 30 лет составляет 0,2 %, тогда как у пациентов старше 70 она возрастает в 7 раз [1]. Согласно международным рекомендациям, показанием к оперативному вмешательству является наличие любого образования надпочечника, в котором нельзя исключить злокачественнную опухоль или феохромоцитому на основании рентгенологических данных, а также все образования более 4 см в диаметре [18]. Тяжелые, калечащие открытые адреналэктомии уходят в прошлое, уступая место миниинва-зивным технологиям. В настоящее время лапароскопическая методика является золотым стандартом хирургического лечения новообразований надпочечников [22, 34] и, согласно рекомендациям Американского Общества Гастроэнтерологов и эндоскопических хирургов (SAGES), является тактикой выбора при хирургическом лечении любых незлокачественных новообразований надпочечника [31]. Основной сложностью является обеспечение хирургического доступа к надпочечнику, в силу анатомии органа, взаиморасположения с другими органами и крупными анатомическими структурами (венами, артериями). Поэтому, актуальным остается вопрос обеспечения гемостаза при лапароскопических адреналэктомиях. В первую очередь это относиться к тотальным адреналэктомиям, при которых необходимо тщательное лигирование надпочечниковой вены. Во-вторых, учитывая то, что надпочечник является паренхиматозным органом, при частичных резекциях основное внимание должно уделяться мелкокалиберным сосудам в толще органа и, соответственно, правильной обработке резекционного края. Неправильный контроль интраоперационного гемостаза может приводить к значительной кровопотере в послеоперационном периоде, что в свою очередь повышает время госпитализации пациента и увеличивает длительность его пребывания на больничной койке. Несмотря на низкую встречаемость ранних послеоперационных осложнений (по данным зарубежных публикаций частота составляет до 10%), в том числе и гемопери-тонеума, вопрос оптимального выбора метода обработки надпочечниковой вены, а также способа резекции надпочечника остается особенно актуальным [12, 25].
Настоящая статья является обобщением накопленного опыта в отношении основных методов обработки ткани надпочечника при частичной его резекции и лигировании надпочечниковой вены, а также инструментария и новых технических возможностей, использующихся при адреналэктомии.
Лигирование надпочечниковой вены
Одним из основных этапов адреналэктомии является выделение и перевязка надпочечниковой вены. Ни ультразвуковой скальпель, ни ножницы с коагулятором не обеспечивают надежный гемостаз при ее лигировании. Вена должна быть перевязана лигатурой, клипирована или обработана сосудистым степлером (Ligasure) [21].
В последнее время в практику широко вошло клипирование вены. При данной манипуляции происходит наложение клипс, что обеспечивает хороший гемостаз. Одними из самых распространенных являются клипсы Hem-o-lok® (Weck-Teleflex, USA).
Полимерные клипсы успешно используются для лигирования сосудов различного калибра: от 10 до 16 мм. При адреналэктомии обычно используются 5 мм клипсы [23].
Однако, в настоящее время все чаще появляются сообщения о безклипсной резекции надпочечника, с использованием коагуляторов, ультразвуковых ножниц или сосудистых лигирующих аппаратов (Ligasure) [30, 35]. Согласно исследованию Arslan и соавторов, при использовании Ligasure отмечается значительное снижение интраоперационной кровопотери (5 мл вместо 100), уменьшение вдвое времени госпитализации пациента, по сравнению с использованием клипс [8]. Помимо адекватного гемостаза одним из преимуществ безклипсного метода является возможность проведения адреналэктомии через 5-мм порт, вместо 10-12 мм, как при обычной адреналэктомии. Это способствует лучшему косметическому эффекту, снижению интенсивности послеоперационного болевого синдрома, времени госпитализации. Однако следует иметь ввиду, что безклипсная адреналэктомия должна проводиться только в руках опытного хирурга [26].
Использование монополярных и биполярных коагуляторов
Для обеспечения адекватного гемостаза при лигировании надпочечниковой вены монополярные и биполярные коагуляторы не являются лучшим инструментом. Их применение ограничено калибром сосудов: более большие по диаметру сосуды могут быть неадекватно обработаны данным инструментом. Монополяры эффективно коагулируют сосуды менее 1,5 мм диаметром, биполяры – до 2 мм диаметром. Однако, они эффективно могут использоваться при частичной резекции для обработки резекционного края. При частичной резекции надпочечника нужно учитывать, что избыточные манипуляции с железой могут привести к нарушению кровоснабжения. Биполярный коагулятор в данном случае используется для определения краев резекции и минимизации кровотечения. В дальнейшем проводится резекция эндоножницами. В некоторых случая возможно предварительное наложение швов по краю резекции и коагуляции и дальнейшее использование эндоножниц [21].
Стоит отметить, что комбинация монополярных ножниц и биполярного коагулятора успешно используется при робо-тассистированной адреналэктомии. Монополярные ножницы используются для быстрого, точного и острого разделения опухоли и здоровой ткани, а биполярный коагулятор - для обеспечения гемостаза во время диссекции тканей. Это позволяет снизить время оперативного вмешательства и объем интраоперационной кровопотери на половину по сравнению с обычными лапароскопическими адреналэктомиями, без развития осложнений в послеоперационном периоде. Данная техника может сопровождаться наложением матрасных швов на резекционный край надпочечника [20, 27].
Аппараты для спайки сосудов – сосудистые степлеры
В 1999 году в ведущих клиниках США и Европы появился и получил быстрое распространение электрохирургический блок с компьютерным управлением (LigaSure® vessel sealing system (Covidien Health Care, USA). Принцип его работы основывается на дозированной подаче энергии в зависимости от свойств коагулируемой ткани (тканевый импеданс). При воздействии прибора на ткань выпаривается жидкая составляющая, происходит высушивание и денатурация коллагена и эластина до образования плотной гомогенной массы, надежно закрывающей просвет сосудов. LigaSure позволяет останавливать кровотечение и надежно закрывать сосуды диаметром до 7 мм.
При сравнении использования аппарата LigaSure с моно-полярными и биполярными коагуляторами в абдоминальной хирургии было установлено, что аппарат обеспечивает лучший гемостаз, снижает необходимость в инфузионной терапии и снижает время восстановления после операции [16].
Данный инструмент успешно используется при адреналэктомиях уже многие годы [33], в том числе и при частичных резекциях надпочечника. LigaSure хорошо разграничивает участок пораженной и здоровой ткани. В основном эффективность показана в отношении краевых образований небольшого размера, тогда как у пациентов с семейной феохромоцитомой и адренальной медуллярной гиперплазией резецируемая ткань надпочечника может быть слишком толстой для адекватного захвата аппаратом. Несмотря на успех прибора, имеются некоторые спорные моменты относительно большого размера инструментов LigaSure, которые не способны точно отделить здоровую ткань от больной [21].
Согласно международным исследованиям, применение LigaSure для обработки культи надпочечника при проведении адреналэктомии обеспечивает более короткое время проведения оперативного вмешательства и уменьшение объема кровопотери (до 100 мл) [14].
Ультразвуковые скальпели
Механизм воздействия ультразвука на ткани основан на механическом разрушении межклеточных связей при высокочастотной вибрации и на кавитационном эффекте. Он заключается в создание за короткий промежуток времени в тканях отрицательного давления, что приводит к закипанию внутри - и межклеточной жидкости при температуре тела. Образующийся пар приводит к разделению тканей. Также происходит коагуляция в связи с денатурацией белков. Образующаяся пленка коагуляции насколько прочна, что современные ультразвуковые скальпели позволяют пересекать даже крупные (до 7–8 мм) сосуды, без предварительного их лигирования. Электрическая энергия, исходящая из генератора, управляемого микропроцессорами, преобразуется в механические колебания системой пьезокерамических кристаллов, расположенных в лапароскопической рукоятке. Лезвие инструмента вибрирует в продольном направлении с частотой 55,5 кГц. Амплитуда продольных колебаний варьирует в пределах 30–100 мкм на 5 уровнях при помощи установки параметров на передней панели генератора. При контакте с тканями ультразвуковой скальпель оказывает три эффекта: диссекцию, коагуляцию, кавитацию.
Применение ультразвукового скальпеля в абдоминальной хирургии обеспечивает лучший гемостаз, чем применение коагуляторов, снижает необходимость в инфузионной терапии и снижает время восстановления пациента после операции [11].
Ультразвуковой скальпель широко и эффективно используется в адреналэктомии, в том числе и при проведении роботас-систированных операций [23]. Его использование минимизирует интраоперационные кровопотери [10, 17, 19]. Еще одним преимуществом использования ультразвукового скальпеля является снижение стоимости операции в связи с уменьшением количества необходимых клипс. Согласно клиническим наблюдениям даже лигирование надпочечниковой вены может производиться с помощью данного инструмента [13].
THUNDERBEAT – новая технология в лапароскопии
Несколько лет назад компания Olympus выпустила новый лапароскопический инструмент, сочетающий в себе ультразвуковую и электрическую энергию – THUNDERBEAT (ТВ). Данный инструмент обладает преимуществами коагулятора в надежности лигирования сосудов и ультразвуковых ножниц в быстроте создания разреза. Эффективность данного инструмента в сравнении с современными коагуляторами и режущими инструментами аналогична. Кроме того, TB создает большее давление на сосудах, обладает большей скоростью разрезания тканей [28]. При сравнении ТВ с ультразвуковым скальпелем и LigaSure было показано, что ТВ более быстр в разрезании тканей, создает адекватное давление на сосудах, а также температурное воздействие, что делает данный инструмент надежным в диссекции и коагуляции [24]. До настоящего времени опубликовано незначительное количество данных о применении данного инструмента в лапароскопической адреналэктомии [15]. Однако фирма Olympus позиционирует успешное применение данного прибора при проведении данного типа операций.
Обеспечение адекватного гемостаза в послеоперационном периоде
Со времени внедрения в практику лапароскопической резекции паренхиматозных органов (почек, надпочечников), ключевым является вопрос о возможном возобновлении кровотечения с поверхности резекции. Известно, что давление, создаваемое превмоперитонеумом в брюшной полости, снижает интраоперационную кровоточивость с резецированной поверхности надпочечника. Однако, при снижении давления после окончания операции возможно возобновление кровотечения. Для минимизации вероятности развития данного осложнения при проведении лапароскопической адреналэктомии многие авторы предлагают использование фибринового клея или Surgicel на поверхности органа перед снижением давления в брюшной полости и извлечением троакаров [26]. Аналогично, было предложено применение других гемостатических агентов, таких как TachoComb [32]. TachoComb представляет собой губку, основным действующим веществом которой является фибриноген и тромбин, апротинин и рибофлавин. Благодаря своим свойствам она хорошо адгезирует на раневой поверхности и обеспечивает гемостаз.
Другая инновационная полисахаридная гемостатическая система PerClot® предназначена для использования в качестве рассасывающегося гемостатического средства для контроля кровотечений во время хирургических вмешательств или после травм. Система состоит из сильфона с модифицированным полисахаридом AMP® и аппликатора для введения гемостатика.
Полисахарид AMP® — вещество растительного происхождения, является биосовместимым, апирогенным, нетоксичным. Полисахарид AMP® имеет молекулярную структуру, которая позволяет ему быстро поглощать жидкую составляющую крови. Процесс дегидратации приводит к повышению концентрации тромбоцитов, эритроцитов и белков (тромбоцитов, фибриногенов и т.д.), что запускает нормальный процесс каскадного тромбообразования. При контакте с кровью, частицы полисахарида AMP® приводят к формированию гелеобразного клейкого матрикса, который обеспечивает механический барьер, предотвращающий дальнейшее кровотечение. Рассасывание продукта занимает несколько дней, его скорость зависит от количества использованного вещества и места применения. Частицы полисахарида AMP® расщепляются амилазой и глюкоамилазой.
К сожалению до сих пор нет публикаций касательно применения данного препарата в хирургии надпочечника, однако данная система может быть очень эффективной в контроле гемостаза.
Материалы и методы
Впервые лапароскопическую адреналэктомию мы выполнили в 1997 г.
С 2009 г. на базе Рязанской областной больницы, Швейцарской университетской клинике, и клинике 1КБ Управ Делами Мэра и правительства Москвы было прооперировано свыше 87 пациентов с новообразованиями надпочечников различной этиологии, размеров и локализаций.
Из них в одном случае после выполнения диагностической лапароскопии и установлении данных за злокачественный характер роста опухоли в проекции правого надпочечника размерами 5×5×4см с признаками инвазии в НПВ.
По половой принадлежности: 45 женщин, мужчин – 42. Возраст пациентов варьировался от 18 до 67 лет. Средний возраст 43 года.
Средний индекс массы тела 26,3.
Всего выполнено операций по поводу образований правого надпочечника 54 (62,06%), левого – 33 (37,93%).
Показаниями к операции, в основном, были гормонпроду-цирующие опухоли надпочечника, первичный рак надпочечника (АКР), гормоннепродуцирующие аденомы надпочечника больших размеров или с тенденцией к быстрому росту, а так же, кисты надпочечников. Всем больным проводилось стандартное обследование, включающее ультразвуковое исследование и КТ брюшной полости, общую лабораторную диагностику, консультацию эндокринолога, терапевта, УЗДГ вен нижних конечностей, консультация флеболога, консультация терапевта, рентген органов грудной клетки, эзофагогастродуоденоскопию для выявления возможных противопоказаний к хирургическому лечению.
Операции выполнялись чрезбрюшинным доступом, в лате-ропозиции больного под 45 градусов [5].
При операциях на правом надпочечнике использовали 4 порта: 11 мм в умбиликальной области для лапароскопа, 5 мм в эпигастрии по срединной линии, 5мм в правом подреберье для инструментов и 10 мм порт в правой латеральной области для ретрактора. Редко вводился 10мм порт для зажима ЭндоБэбкок, для отведения 12п кишки. Давление газа в брюшной полости поддерживалось в автоматическом режиме на уровне 12–15 мм рт. ст. После лапароскопии, проводилась мобилизация печеночного угла толстой кишки и 12 п кишка (по Кохеру), печень отводилась краниально, визуализировалась нижняя полая вена. Проводилась мобилизация надпочечника и в дальнейшем запланированный объем операции.
При выполнении адреналэктомии производилось клипирование аппаратом LigaSure надпочечниковой вены артерий и его мобилизация из окружающих тканей используя прицизионную тактику, в пределах капсулы.
При выполнении парциальной адреналэктомии проводилось постепенное сдавление ткани надпочечника браншами и активация энергии аппарата для постепенной термической обработки ткани на границе с новообразованием [3]. Таким путем предотвращалось разрушение и адгезия ткани надпочечника к браншам аппарата. Удаленная ткань в пластиковом контейнере извлекалась из брюшной полости. При неадекватном гемостазе в ряде случаев использовалась биполярная энергия или полисахаридные гемостатические системы.
При операциях на левом надпочечнике, как правило, использовали 4 порта, расположение которых было практически зеркальным, однако порт для ретрактора устанавливался в правом подреберье. В некоторых случаях в правой латеральной области устанавливался дополнительный троакар для отведения селезеночного изгиба толстой кишки зажимом ЭндоБэбкок. Проводилась мобилизация толстой кишки по линии Тольда с пересечением селезеночно-кишечных и диафрагмально-кишечных связок. После инцизии фасции Герота визуализировали верхний полюс почки, далее проводя диссекцию, по ее медиальной поверхности, выделяли почечную вену и надпочечниковую вену. Проводилась мобилизация надпочечника и в дальнейшем запланированный объем операции.
Нами было определено что в случае расположения опухоли малых размеров в дистальной части надпочечника, при условии, что ткань надпочечника была не изменена, а толщена паренхимы минимальна, то для выполнения резекции органа достаточно монополярной энергии в сочетании с биполярной, и как в дополнении возможно применение дополнительных гемостатических систем (PerClot или Тахокомб). Однако вышеперечисленные условия встретились нам в 4 случаях. Время операции составляло в среднем 130 мин (90–160мин). Кровопотеря составляла 150мл (100 до 200мл). Активация пациента проводилась через сутки после операции. Продолжительность госпитализации 4–6 дней.
При необходимости выполнения резекции надпочечника с образованием в нем более 4 см, мы предпочитали использовать аппарат LigaSure 5 мм. Нами было выполнено 48 операций, причем дополнительное использование гемостатических систем (PerClot) понадобилось лишь в 12 случаях. Время операции составляло в среднем 60 мин (50–70мин). Кровопотеря составляла в среднем 50 мл (от 30 до 80 мл). Активация пациента проводилась через 6–7 часов после операции. Продолжительность госпитализации 2–3 дня.
В случаях образований надпочечника менее 4 см, или в случае операций по поводу кисты надпочечника (от 3 до 9см) мы проводили резекцию органа при помощи УЗ-скальпеля (Covidien, Ethicon) 5 мм.
В ряде случаев, в зависимости от топографии кисты к органу выполнялась резекция капсулы кисты. Оставшаяся стенка кисты расположенная интимно прилежащая к ткани надпочечника дополнительно обрабатывалась аргон-усиленной плазмой. Таким образом достигался максимальный органсохраняющий объем операции, что важно в дальнейшем, так как по нашим наблюдениям у 6 из наблюдавшихся пациентов возникал патологический процесс в течении нескольких лет в контрлатеральном надпочечнике.
Парциальная адреналэктомия выполнялась при помощи УЗ-скальпеля прецизионно вначале использую режим коагуляции, затем режим резки.
При помощи УЗ-скальпеля было выполнено 27 парциальных адреналэктомий. Время операции в среднем составляло 85 мин (75–90) мин, однако в большинстве случаев (12 пациентов – 60%) потребовалось дополнительное использование биполярной энергии и/или гемостатических систем (PerClot / TachoComb) для достижения адекватного гемостаза. Кровопотеря составляла в среднем 90 мл (от 60 до 120 мл). Активация пациентов проводилась через 6–8 часов. Продолжительность госпитализации 3–4 дня.
В 2015 г на базе Швейцарской университетской клиники выполнено 12 парциальных адреналэктомий аппаратом Thunderbeat (Япония) 5мм. Размеры образований составляли от 3,3 см до 7,3 см. Ни в одном из случав не пришлось использовать дополнительные меры для достижения гемостаза. Время операции составляло 50 мин (40–60мин). Кровопотеря составляла 50 мл (от 30 до 80 мл). Активация пациентов проводилась через 5–6 часов. Продолжительность госпитализации 2–3 дня.
Из 87 выполненных операций на надпочечнике в 2 случаях (3%) было повреждение капсулы селезенки и в одном случае капсулы печени (1,5%). Дополнительное использование биполярной энергии и гемостатической системы PerClot, что по-
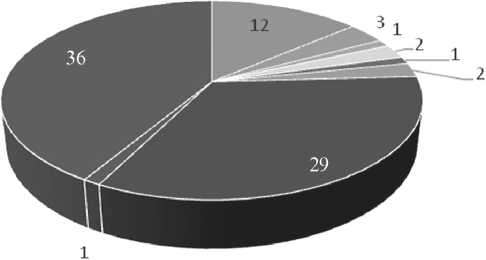
■ Феохромоцитома
■ Гомронпродуцирующая аденома
■ Злокачественная феохромоцитома саркома узелковая гиперплазия
АКР
Киста
Метастаз
Гормонально не активная аденома
Рис. 1. Морфологические виды новообразований надпочечников.
зволило остановить кровотечение и обойтись без расширения объема операции.
По данным наших наблюдений, размер новообразования надпочечника не повлиял на частоту возникновения осложнений. К такому же выводу пришли и другие авторы, например, R. Asari и соавт. [9], выполнив 37 ЛАЭ при новообразованиях, превышающих в размере 60 мм, и 252 — при неоплазиях менее 60 мм в диаметре, не обнаружили статистически значимых различий по частоте конверсии и развития осложнений. R. Sharma и соавт. [29] пришли к тем же выводам. Однако, по данным A. Agha и соавт. [7], частота возникновения осложнений при крупных опухолях возрастает (11,5% против 3%; p=0,022). При этом здесь следует отметить, что авторы использовали в своей работе не только трансабдоминальный, но и ретроперитонеальный доступ.
В качестве критериев оценки эффективности операций мы брали: общее время операции, количество осложнений, интра-и послеоперационных. Дополнительно были оценены различные виды энергий при рассечении ткани надпочечника и несколько видов гемостаза в области раны надпочечника. [4]
Выводы
-
1. Парциальная адреналэктомия – оптимальный объем хирургического лечения в случаях доброкачественных образований надпочечника, тем более в случае двухстороннего поражения.
-
2. Данный объем операции выполним, и имеет минимальное количество осложнений при наличии определенного опыта хирурга
-
3. Наличие современных аппаратов лигирования сосудов и обработки культи надпочечника заметно облегчает выполнение резекций надпочечника и адреналэктомии
-
4. В разных клинических случаях (размерах, характере новообразования) каждый из видов энергии имеет свои преимущества и недостатки.
-
5. Для достижения гемостаза оправдано комбинирование видов энергий и использование дополнительных средств для достижения гемостаза (гемостатических губок и полисахаридных систем)
Заключение
В настоящей статье были рассмотрены основные методики применяемые при резекции надпочечник для обеспечения эффективного гемостаза. Каждая из методик является успешной и эффективной и может применяться, как при адреналэктомии, так и при органсохраняющей операции. Однако следует отметить, что такие инструменты, как ультразвуковой скальпель, аппарат LigaSure и THUNDERBEAT имеют значительное преимущество в уменьшении времени оперативного вмешательства и интраоперационной кровопотере.
Применение гемостатических гелей, полисахаридных систем и губок также обосновано для обеспечения адекватного гемостаза культи надпочечника.
Список литературы Методы обработки культи надпочечника
- Беяьцевич Д.Г., Солдатова Т.В., Кузнецов Н.С. и др. Дифференциальная диагностика инциденталом надпочечников//Проблемы эндокринологии. 2011. № 6. C. 3-8.с.
- Калинин А.П., Майстренко Н.А. Хирургия надпочечников. М: Медицина, 2000. -С. 216.
- Пучков К.В., Иванов В.В. Технология дозированного лигирующего электротермического воздействия на этапах лапароскопических операций: монография. М.: ИД МЕДПРАКТИКА, 2005. 176 с.
- Пучков К.В., Пучков Д.К. Оценка эффективности лапароскопического метода при выполнении органосохраняющих операций на надпочечниках//Эндоскопическая хирургия. 2013. Выпуск №2. №1. С.184-185.
- Пучков К.В., Филимонов В.Б., Васин Р.В. Лапароскопический доступ в хирургическом лечении новообразований надпочечников//Эндоскопическая хирургия. 2006. Т.12, №1. С.48.
- Славин Л.Е., Батаев Т.А., Вагапова Г.Р., Зимагулов Р.Т. Осложнения при лапароскопической адреналэктомии//Тезисный доклад 15 московский международный конгресс по эндоскопической хирургии. Москва, 20-22 апреля 2011. С. 223-225.
- Agha A, Iesalnieks I, Hornung M, Phillip W, Schreyer A, Jung M, Schlitt HJ. Laparoscopic trans-and retroperitoneal adrenal surgery for large tumors. J Minim Access Surg. 2014;10(2):57-61
- Arslan M. et al. Comparison of Adrenal Vein Control Methods in Laparoscopic Adrenalectomy//Eur J Endosc Laparosc Surg. 2014. Vol. 1. №2. Р. 66-70
- Asari R, Koperek O, Niederle B. Endoscopic adrenalectomy in large adrenal tumors. Surgery. 2012;152(1):41-49.
- Brandao L.F. et al. Robot-assisted laparoscopic adrenalectomy: step-by-step technique and comparative outcomes.//Eur. Urol. 2014. Vol. 66. № 5. P. 898-905.
- Galketiya K.B. et al. Comparison of Ultra-Sonic Dissector with Scissor and Monopolar Diathermy in Complex Laparoscopic Surgeries for Tissue Dissection and Hemostasis//International Archives of Integrated Medicine. 2015. Vol. 2, №10. P 22-27.
- Gaujoux S. et al. Risk factors for conversion and complications after unilateral laparoscopic adrenalectomy.//Br. J. Surg. 2011. Vol. 98. № 10. P. 1392-9.
- Gill I.S., Ukimura O. Contemporary Interventional Ultrasonography in Urology.: Springer Science & Business Media, 2009. 205 с.
- Guerrieri M. et al. Use of the electrothermal bipolar vessel system (EBVS) in laparoscopic adrenalectomy: a prospective study.//Surg. Endosc. 2008. Vol. 22. № 1. P 141-5.
- Hora M. et al. Laparoendoscopic single-site surgery adrenalectomy -own experience and matched case-control study with standard laparoscopic adrenalectomy.//Wideochirurgia i inne Tech. maloinwazyjne = Videosurgery other miniinvasive Tech./Kwart. Pod patronatem Sekc. Wideochirurgii TChP oraz Sekc. Chir. Bariatrycznej TChP 2014. Vol. 9. № 4. P 596-602.
- Janssen P.F., Brolmann H.A.M., Huirne J.A.F. Effectiveness of electrothermal bipolar vessel-sealing devices versus other electrothermal and ultrasonic devices for abdominal surgical hemostasis: a systematic review.//Surg. Endosc. 2012. Vol. 26. № 10. P 2892-901.
- Kaouk J.H. et al. Laparoscopic bilateral partial adrenalectomy for pheochromocytoma//Urology. 2002. Vol. 60. № 6. P. 1100-1103.
- Kapoor A., Morris T., Rebello R. Guidelines for the management of the incidentally discovered adrenal mass//Can. Urol. Assoc. J. 2011. Vol. 5. № 4. P 241-247.
- Kasalicky M. et al. .//Rozhl. v Chir. mesicnik Ceskoslovenske Chir. spolecnosti. 2009. Vol. 88. № 8. P 439-43.
- Kumar A., Hyams E.S., Stifelman M.D. Robot-assisted partial adrenalectomy for isolated adrenal metastasis.//J. Endourol. 2009. Vol. 23. № 4. P 651-4.
- Linos DA, van Heerden JA (Eds). Adrenal Glands: Diagnostic Aspects and Surgical Therapy. Springer-Verlag Editions, Germany, 2005
- Lubikowski J. et al. From open to laparoscopic adrenalectomy: thirty years’ experience of one medical centre.//Endokrynol. Pol. Vol. 61. № 1. P. 94-101.
- Mellon M.J., Sethi A., Sundaram C.P. Laparoscopic adrenalectomy: Surgical techniques.//Indian J. Urol. 2008. Vol. 24. № 4. P 583-9.
- Milsom J. et al. Evaluation of the safety, efficacy, and versatility of a new surgical energy device (THUNDERBEAT) in comparison with Harmonic ACE, LigaSure V, and EnSeal devices in a porcine model.//J. Laparoendosc. Adv. Surg. Tech. A. 2012. Vol. 22. № 4. P 378-86.
- Oz B. et al. Laparoscopic surgery in functional and nonfunctional adrenal tumors: A single-center experience.//Asian J. Surg. 2015.
- Preminger G., Badlani G. Smith’s Textbook of Endourology, Volume 1: John Wiley & Sons, 2012. 1894 с.
- Rogers C.G. et al. Concurrent robotic partial adrenalectomy and extra-adrenal pheochromocytoma resection in a pediatric patient with von Hippel-Lindau disease.//J. Endourol. 2008. Vol. 22. № 7. P 1501-3.
- Seehofer D. et al. Safety and efficacy of new integrated bipolar and ultrasonic scissors compared to conventional laparoscopic 5-mm sealing and cutting instruments.//Surg. Endosc. 2012. Vol. 26. № 9. P 2541-9.
- Sharma R, Ganpule A, Veeramani M, Sabnis RB, Desai M. Laparoscopic management of adrenal lesions larger than 5 cm in diameter. Urol J. 2009;6(4):254-259.
- Soon P.S.H. et al. Use of the ligaSure vessel sealing system in laparoscopic adrenalectomy.//ANZ J. Surg. 2006. Vol. 76. № 9. P 850-2.
- Stefanidis D., Goldfarb M., Kercher K.W. et al. SAGES guidelines for minimally invasive treatment of adrenal pathology.//Surg. Endosc. 2013. Vol. 27. №11. P.3960-80.
- Suzuki Y. et al. The use of a new haemostatic agent for controlling adrenal bleeding during posterior retroperitoneoscopic partial adrenalectomy//BJU International. 2002. Vol. 90. №3cr. P.351
- Walther M.M. et al. Laparoscopic partial adrenalectomy in patients with hereditary forms of pheochromocytoma//J Urol. 2000. №164. Р 14-17
- Wang H.-S. et al. Comparison of laparoscopic adrenalectomy with open surgery for adrenal tumors.//Kaohsiung J. Med. Sci. 2009. Vol. 25. № 8. P 438-44.
- Yefimov D.A., Sundaram C.P. Bleeding after right laparo-scopic adrenalectomy.JSLS.2010;14:576-578.


