Межгодовые различия в скорости роста голотурий Eupentacta fraudatrix в зависимости от температуры среды
Автор: Долматова Л.С.
Журнал: Региональные проблемы @regionalnye-problemy
Рубрика: Геология. Биология. Геоэкология
Статья в выпуске: 4 т.19, 2016 года.
Бесплатный доступ
Приведены сравнительные данные о динамике длины и массы тела двух цветных форм (с оранжевой и розовой окраской стенки тела) голотурии Eupentacta fraudatrix, обитающих в бухте Алексеева (залив Петра Великого Японского моря), в 2011 и 2014 гг. Проведен анализ зависимости выявленных межгодовых различий от изменений температуры морской воды.
Голотурии, длина тела, масса тела, цветные варианты вида, температурная зависимость
Короткий адрес: https://sciup.org/14328994
IDR: 14328994 | УДК: 593.96:591.5
Текст научной статьи Межгодовые различия в скорости роста голотурий Eupentacta fraudatrix в зависимости от температуры среды
В условиях общего потепления климата представляется необходимым понимание и предсказание последствий его влияний на живые системы и отдельные виды [9]. Голотурия Eupentac-ta fraudatrix обитает в шельфовых водах Японского моря. Этот вид является перспективным для использования в качестве фармакологического сырья в связи с высоким содержанием в тканях биологически активных веществ с иммуномоду-лируюшими, антибактериальными, фунгицидными, ранозаживляющими свойствами [4]. Биология его, тем не менее, остается мало изученной. Исследованиями популяции голотурии в бухте Алексеева (залив Петра Великого) в 2008–2010 гг. было выявлено наличие двух цветных форм, различающихся оранжевой и розовой окраской тела и расселяющихся в биотопах с преимущественным преобладанием одной из форм [2], сходных с ранее описанными несколькими цветными формами Apostichopus japonicus (трепанг), отличающимися как по цвету, так и распределением и темпами роста [8, 15]. Для обоих цветных вариантов E. fraudatrix была отмечена идентичная тенденция сезонной динамики размерных показателей, однако средние длина и масса «оранжевых» и «розовых» животных существенно отличались [2]. Повышение среднегодовых температур в Приморье, отмечаемое в последнее время [14], диктует необходимость мониторинга состояния животных в меняющихся условиях среды. Для оценки состояния видов в экологических исследованиях в настоящее время широко используется показатель размера организма, поскольку он чувствителен к изменениям среды и является фундаментальной его характеристикой, связанной со многими свойствами экосистемы [12]. Целью данного исследования явилось изучение межгодовых различий (2011 и 2014 гг.) динамики длины и массы тела двух цветных форм голотурий в зависимости от температуры морской воды.
Материал и методы
Сбор голотурий E. fraudatrix производился в бухте Алексеева в июле–сентябре 2011 г. два раза в месяц и в июле–августе 2014 г. один–три раза в месяц. Отбор проводился с использованием легководолазного снаряжения на двух станциях на глубине 0,5–1 м (станция 1) и 1–2 м (станция 2) в местах компактного поселения животных розового и оранжевого варианта окраски соответственно (рис. 1). Для определения средних длины и массы отбирали 80–100 экземпляров.
Измерения длины животных проводили с точностью до 1 мм. Для измерения массы использовали весы электронные «CAS CUY 42OH» (Корея) с ценой деления 0,01 г. Температуру воды в придонном слое определяли с помощью гидрологического термометра с точностью до 0,1º С.
Результаты обрабатывали статистически, используя для определения достоверности различий между группами t-критерий Стьюдента.
Результаты и обсуждение
Согласно данным Крючковой [5], благоприятной для нереста голотурий поверхностной температурой морской воды являются 19–21º С. Учитывая небольшую разницу в температуре придонного и поверхностного слоев воды на исследуемых станциях (0,1–0,2º С), мы сфокусировались на сроках прогрева воды в придонном слое до
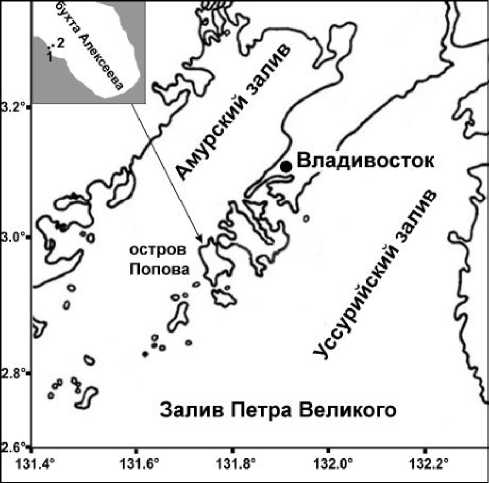
Рис. 1. Схема расположения исследуемых станций в бухте Алексеева
Fig. 1. Scheme of the studied stations location in the Alexeev Bay
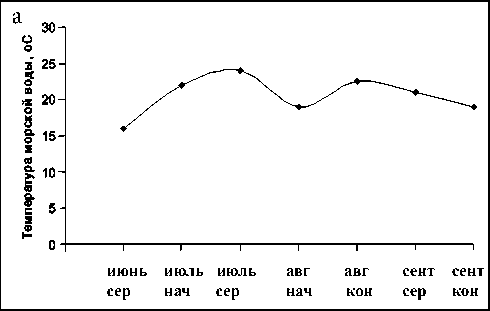
20º С как соответствующей границе температур, благоприятных для нереста. Как показано в предшествующие годы исследований (2007–2009 гг.), такая температура воды в бухте Алексеева достигалась не раньше конца июля – начала августа, охлаждение ниже этой отметки происходило не позже середины сентября, а максимальные температуры не превышали 23º С [1, 2]. Сравнение температуры морской воды в придонном слое в исследуемые годы показало, что в 2011 г. температура воды 20º С была достигнута уже к началу июля, а в 2014 г. – на две недели позже (рис. 2). При этом в 2011 г. максимальная температура 24º С была отмечена уже в середине июля, после чего началось постепенное ее снижение, даже кратковременно до значения ниже 20º С в августе. В 2014 г. максимальная температура 26,5º С отмечена к началу августа, и температура выше 20º С регистрировалась весь август.
В 2011 г. динамика длины тела голотурий розового цвета носила волнообразный характер, возрастая с середины июля до начала августа и с середины августа до начала сентября (рис. 3). Соответственно, минимумы длины наблюдали у «розовых» в середине июля и середине августа. В отличие от предыдущих лет (2008–2010 гг.), в которые длина оранжевых голотурий существенно превышала длину розовых [2], у представителей «розовых» длина тела в начале июля 2011 г. была на 32% выше, чем у «оранжевых», но к середине июля длины тел у представителей двух цветных форм сближались и в дальнейшей динамике длины тела «оранжевых» отслеживались те же пики, что и у «розовых». При этом минимумы были отмечены у «оранжевых» в начале июля и середине августа. Наличие не менее двух пиков и, соответственно, минимумов, было отмечено у обеих цветных форм и ранее (2008 г.), при этом сроки их появлений у розовых и оранжевых индивидуумов, в отличие от 2011 г., совпадали [1]. Появление нескольких минимумов средней длины тела, очевидно, связано с тем, что в период массового нереста активность последнего возрастает ежемесячно в периоды полнолуния [18]. Вхождение в последующие годы ювенильных особей, достигших определяемых размеров, в расчет для общей популяции вызывает появление минимумов средней длины тела.
б
Рис. 2. Динамика температуры морской воды в придонном слое на станции 1 в бухте Алексеева в 2011 (а) и 2014 (б) годах. Здесь и далее по оси абсцисс – декады месяцев
нач сер нач сер кон июнь июль авг авг авг
Fig. 2. Dynamics of the bottom seawater temperature in the Alexeev Bay, station 1, in 2011 (а) and 2014 (б). Hereinafter, along the x – decade of months axis
а
*
б
; ,3Гк О ri fin h45
। 12,,12355 I i 123 fl I I fl
0 ]— 11111 01
нач июля сер июля нач авг
сер авг
нач сент кон сент
нач июля
нач авг
сер авг
кон авг
Рис. 3. Динамика средней длины тела голотурий E. fraudatrix в 2011 (а) и 2014 (б) годах. Здесь и далее: белые столбики – «розовый» вариант животных, черные – «оранжевый».
* – P<0,05 по сравнению с «оранжевым» вариантом
Fig. 3. Dynamics of the holothurian E. fraudatrix average body length, in 2011 (а) and 2014 (б) Hereinafter, white bars designate «pink» species, and black bars – «orange» individuals
В 2014 г. разница в средней длине тела розовых и оранжевых животных в наблюдаемые периоды времени была недостоверной (рис. 4). При этом с начала июля до конца августа наблюдался только один пик средней длины в августе: у «розовых» в середине месяца, а у «оранжевых» – в начале, с соответствующими минимумами в начале августа у «розовых» и в середине августа – у «оранжевых».
При этом максимальная средняя длина «розовых» составила в 2011 г. 4,42±0,12 см (начало июля), «оранжевых» – 4,35±0,24 см (начало августа). Максимальные значения средней длины в начале августа 2014 г. составили 4,28± 0,12 см для «розовых» и 4,5±0,45 см для «оранжевых». Таким образом, рост голотурий в эти годы существенно не отличался друг от друга. При этом достижение максимальной длины розового, но не оранжевого, варианта голотурий в 2014 г. позднее, чем в 2011, связано, по-видимому, с более поздним прогревом морской воды в 2014 г. по сравнению с 2011 г. и большей чувствительностью «розового» вариан- та к температурному влиянию. Позитивное влияние температуры морской воды на скорость роста морских организмов показано также для рыб [9], на которых влияние потепления морской воды наиболее изучено среди гидробионтов.
Вместе с тем, обращает на себя внимание, что в более «холодные» 2007–2009 гг. средняя длина тела оранжевых голотурий в августе была выше, а розовых – ниже, чем в 2011 и 2014 гг. Так, в 2008 г. максимальная средняя длина тела оранжевых экземпляров составила 5,5 см, а розовых – 3,8 см (наши неопубликованные данные). Возможно, это связано с более ранним созреванием молодых особей оранжевого варианта при повышении температуры воды (фенотипически пластичный ответ, известный как «температурно-размерное правило» [10]), и как следствие, увеличением в популяции молодых особей c маленьким размером тела, что сказывается на снижении максимальной величины средней длины тела, как это показано на эктотермальных позвоночных [9, 16] и беспозвоночных [17].
а
0II I11
нач июля
сер июля
нач авг
кон авг
нач сент
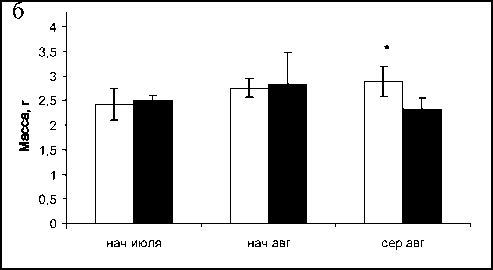
Рис. 4. Динамика средней массы голотурий E. fraudatrix в 2011 (а) и 2014 (б) гг.
Fig. 4. Dynamics of the E. fraudatrix average body mass, in 2011 (а) and 2014 (б)
Считается, что растворимый кислород является основным фактором, определяющим размерно-температурную зависимость [13], что связано со снижением аэробной метаболической активности при снижении растворения кислорода в морской воде при росте ее температуры. При этом, как подчеркивают Twomey et al. [19], различные виды обладают уникальными особенностями ответа на изменения среды. Эти особенности могут проявляться и внутри вида [10]. В частности, у особей рыб с повышенным содержанием каротиноидов показана более высокая устойчивость к температурному стрессу [6]. Различная окраска голотурий оранжевой и розовой форм, по-видимому, связанная с различным количеством каротиноидов в их тканях, также может лежать в основе их разных адаптивных возможностей, в пользу чего свидетельствуют данные о различиях в их способности накапливать тяжелые металлы (у «оранжевых» их накопление в гонадах было меньше, чем у «розовых») [3]).
Несмотря на отсутствие различий в длине тела, в 2011 г. масса оранжевых и розовых индивидуумов достоверно отличалась, особенно в конце периода наблюдений, а ее динамика была одинаковой для обоих цветных вариантов. В течение лета происходило накопление массы с 1,87±0,28 г и 2,22± 0,27 г соответственно для «розовых» и «оранжевых» в начале июля до 1,9±0,16 и 2,6±0,2 в начале сентября. В предыдущие годы наблюдений также выявлена существенная разница в массе «розовых» и «оранжевых». Возможно, что одной из причин, обусловливающих такую разницу, является большая пищевая доступность на станции 2, отличающейся значительным биоразнообразием и плотностью видов, а значит, и органического материала, по сравнению со станцией 1. Однако, по-видимо-му, это не единственная причина, поскольку в ряде случаев находили розовых голотурий и на станции 2, при этом сохранялась разница в массе розового и оранжевого вариантов. При этом снижение средней массы тела с начала июля до начала августа обусловлено, по-видимому, снижением массы гонад в результате массового нереста, наиболее интенсивно происходящего в июле, о чем свидетельствует динамика гонадного индекса [11]. Появление первого минимума массы в период, когда температура воды превысила 20º С, отмечено в середине июля, а полнолуние состоялось 15 июля, второго минимума – в начале–середине августа (полнолуние было 16 августа), что также свидетельствует в пользу зависимости активности нереста от фаз луны. Последующее возрастание средней массы обусловле- но, вероятно, интенсивным питанием в отсутствие нереста (конец августа – сентябрь).
Однако в 2014 г. средняя масса, как и длина тела, не отличалась существенно у оранжевых и розовых животных, составив максимально 2,89±0,31 г у «розовых» в середине августа и 2,83±0,65 см у «оранжевых» в начале августа. При этом появление минимумов массы у «розовых» (в начале августа) по времени опережало «оранжевых» (середина августа) на две недели. Это соответствует показанному нами так же различию сроков появления минимумов гонадного индекса у розовых и оранжевых голотурий соответственно в начале и середине августа, что, по-видимому, свидетельствует о том, что «розовые» массово отнерестились на две недели раньше «оранжевых», при том, что полнолуние было 10 августа [11]. Примечательно, что максимальная масса тела голотурий в 2014 г. достигала больших значений, чем в 2011 г.
Таким образом, более раннее достижение максимальных величин длин тела голотурий в 2011 г. по сравнению с 2014 г., вероятно, связано с более поздним прогревом морской воды в 2014 г. по сравнению с 2011 г. В свою очередь, более высокие значения температуры воды в 2014 г. по сравнению с 2011 г. способствовали более быстрому накоплению их массы в 2014 г. Полученные данные свидетельствуют о том, что длительный период сохранения температуры морской воды на уровне около 20º С оказывал позитивное влияние на рост и накопление массы голотурий и сближение этих показателей для двух цветных форм. Вместе с тем, ранее для дальневосточной голотурии Apostichopus japonicus было показано неблагоприятное воздействие температуры выше 25º С [7]. Достижение таких температур в бухте Алексеева происходило в 2014 г. и сопровождалось появлением минимумов массы розовых E. fraudatrix раньше, чем оранжевых. По-видимо-му, это отражает более ранний срок нереста розовых голотурий по сравнению с оранжевыми и, вероятно, связано с большей чувствительностью «розовых» к температурному стрессу, порог которого близок к таковому для трепанга. Вместе с тем, отмеченное снижение средней максимальной длины оранжевых голотурий дает основание для заключения о том, что прослеживающаяся тенденция к повышению температуры морской воды может оказать негативное влияние на оба цветных варианта. Механизмы, обеспечивающие адаптивные возможности двух цветных вариантов E. frau-datrix, нуждаются в дальнейшем изучении.
Список литературы Межгодовые различия в скорости роста голотурий Eupentacta fraudatrix в зависимости от температуры среды
- Долматова Л.С. Перспективы выращивания морских гидробионтов голотурий как источника фармакологического сырья//Современные проблемы регионального развития: материалы II междунар. науч. конф., 06-09 октября 2008 г., Кульдур, Биробиджан. Биробиджан: ИКАРП ДВО РАН, 2008. С. 111-112.
- Долматова Л.С. Исследование сезонной динамики роста голотурии Eupentacta fraudatrix//Морские прибрежные экосистемы. Водоросли, беспозвоночные и продукты их переработки: тезисы докладов IV междунар. науч. конф., 19-22 сентября 2011 г., Южно-Сахалинск. Южно-Сахалинск: СахНИРО, 2011. С. 26-27.
- Долматова Л.С., Слинько Е.Н., Колосова Л.Ф. Содержание тяжелых металлов в тканях голотурий Eupentacta fraudatrix в заливе Петра Великого//Известия Самарского научного центра Российской академии наук. 2010. Т. 12, № 1(5). С. 1287-1291.
- Долматова Л.С., Тимченко Н.Ф., Стасенко Н.Я. Характеристика состава и медико-биологические исследования комплекса биологически активных веществ из дальневосточных видов голотурий//Дальневосточные моря России. Кн. 2. Исследование морской экологии и биоресурсов. М.: Наука, 2007. С. 684-694.
- Крючкова Г.А. Краткий определитель личинок морских ежей, офиур и голотурий залива Петра Великого Японского моря: препринт № 22. Владивосток: ИБМ ДВНЦ АН СССР, 1987. 56 с.
- Лебедева О.А. Температурные адаптации эмбрионов сиговых//Природа и хозяйственное использование озер Псковской и прилегающих областей. Псков: ПГПИ, 1971. С. 122-126.
- Левин В.С. Дальневосточный трепанг. Биология, промысел, воспроизводство. СПб.: Голанд, 2000. 199 с.
- Селин Н.И., Черняев М.Ж. Особенности распределения, состав поселений и рост дальневосточного трепанга в заливе Восток Японского моря//Биология моря. 1994. Т. 20, № 1. С. 73-81.
- Baudron A.R., Needle C.L., Marshall C.T. Implications of a warming North Sea for the growth of haddock Melanogrammus aeglefinus//J. Fish. Biol. 2011. Vol. 78, N 7. P. 1874-1889.
- Carey N., Sigwart J.D. Size matters: plasticity in metabolic scaling shows body-size may modulate responses to climate change//Biol. Lett. 2014. Vol. 10, N 8. Pii: 20140408.
- Dolmatova L.S. Interannual and seasonal dynamics of gonad index of two color variants of the holothurian Eupentacta fraudatrix in Alexeev Bay (Peter the Great Bay, Sea of Japan)//The 8th Ocean Science Workshop: Program of the East Asian Cooperative Experiments (PEACE): Abstracts, 29-31 August 2016, Vladivostok. Vladivostok: FEB RAS, 2016. P. 14.
- Economo E.P., Kerkhoff A.J. Enquist B.J. Allometric growth, life-history invariants and population energetics//Ecol. Lett. 2005. Vol. 8. P. 353-360.
- Forster J., Hirst A.G., Atkinson D. Warming-induced reductions in body size are greater in aquatic than terrestrial species//Proc Natl Acad Sci USA. 2012. Vol. 109, N 47. P. 19310-19314.
- Gayko L.A. Recent temperature changes along the Russian coast of the Japan sea//The 8th Ocean Science Workshop: Program of the East Asian Cooperative Experiments (PEACE): Abstracts, 29-31 August 2016, Vladivostok. Vladivostok: FEB RAS, 2016. P. 15.
- Kan-no M., Kijima A. Genetic differentiation among three color variants of Japanese sea cucumber Stichopus japonicus//Fish. Sci. 2003. Vol. 69. P. 806-812.
- Martinez E., Porreca A.P., Colombo R.E., Menze M.A. Tradeoffs of warm adaptation in aquatic ectotherms: live fast, die young?//Comp. Biochem. Physiol. A. Mol. Integr. Physiol. 2016. Vol. 191. P. 209-215.
- Sheridan J.A., Bickford D. Shrinking body size as an ecological response to climate change//Nat. Clim. Change. 2011. Vol. 1. P. 401-406.
- Toral-Granda M.V., Martínez P.C. Reproductive biology and population structure of the sea cucumber Isostichopus fuscus (Ludwig, 1875) (Holothuroidea) in Caamaño, Galápagos Islands, Ecuador//Marine Biology. 2007. Vol. 151. P. 2091-2098.
- Twomey M., Brodte E., Jacob U. et al. Idiosyncratic species effects confound size-based predictions of responses to climate change//Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2012. Vol. 367. P. 2971-2978.


