Межорганная взаимосвязь субстратов энергообмена у мышей при скелетной травме
Автор: Стогов Максим Валерьевич, Лунва Светлана Николаевна, Ткачук Елена Анатольевна, Очеретина Руфина Юрьевна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2010 года.
Бесплатный доступ
Изучали содержание субстратов энергетического обмена (креатинфосфат, гликоген, липиды) в скелетных мышцах и печени мышей после моделирования перелома костей голени. Выявлено, что у интактных животных существуют четкие корреляты между содержанием в мышцах креатинфосфата и гликогена, а также между содержанием гликогена и липидов в мышцах и печени. У животных с переломом костей голени обнаружен феномен нарушения этих взаимоотношений.
Травма, скелетные мышцы, печень, гликоген, креатинфосфат, липиды
Короткий адрес: https://sciup.org/142121342
IDR: 142121342
Текст научной статьи Межорганная взаимосвязь субстратов энергообмена у мышей при скелетной травме
Известно, что восстановление функциональной активности скелетных мышц в посттравматический период зависит от интенсивности восстановления их структурно-метаболических характеристик и должно обеспечиваться достаточным количеством пластических и энергетических ресурсов в ткани [2]. Существование значительных изменений энергетического метаболизма, направленных в сторону активации анаэробного и снижения аэробного обмена в скелетных мышцах в посттравматический период, показано рядом исследований [3, 4, 7, 9]. Однако при оценке сдвигов энергетического обмена многие авторы не учитывают того об- стоятельства, что в экстремальных условиях снижение аэробного обмена в мышцах может компенсироваться активацией межорганного цикла Кори [1, 6], обеспечивающего перенос лактата из мышц в печень в обмен на глюкозу. Количественная оценка таких межорганных отношений между энергетическими субстратами проведена на модели гипокинезии [8], при скелетной травме подобного рода исследований нами не встречено. Цель настоящего исследования – оценить корреляционные взаимоотношения между уровнем энергетических субстратов в скелетных мышцах и печени у мышей в посттравматический период.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперимент выполнен на 34 мышах-самцах линии СВА весом 25-30 г. Перелом костей голени у мышей воспроизводили путем механического повреждения сегмента конечности в верхней трети под эфирным наркозом, иммобилизации травмированной конечности не проводилось. Животные получали обычный сбалансированный рацион вивария при свободном доступе к воде. Из эксперимента животных выводили декапитацией на 3-и, 7-е и 28-е сутки эксперимента, когда наблюдали полное сращение костных фрагментов.
На проведение исследования получено разрешение комитета по этике при ФГУ «РНЦ «ВТО» им. акад. Г.А. Илизарова Росмедтехнологий». Содержание животных, оперативные вмешательства и эвтаназию осуществляли в соответствии с требованиями Европейской конвенции по защите экспериментальных животных и «Правилами проведения работ с использованием экспериментальных животных» (приложение к приказу Минздрава СССР от 12.08.1977 № 755).
В скелетных мышцах травмированного сег- мента конечности определяли содержание креатина – по реакции с диацетилом, креатинфосфата (КрФ) – по содержанию фосфора в безбелковом экстракте [5]. Уровень гликогена в мышцах определяли непрямым антроновым методом, в печени прямым антроновым методом. Содержание общих липидов в мышцах и печени находили гравиметрическим методом, после их экстракции хлороформ/метаноловой смесью в отношении 2:1. Дополнительно рассчитывали соотношение креа-тинфосфат/креатин и их суммарное содержание (креатинфосфат+креатин) в ткани.
Результаты животных экспериментальной группы сравнивали с показателями животных интактной группы (n=16), для чего использовали непараметрический W-критерий Вилкоксона для независимых выборок. Корреляционную зависимость между выборками, подчиняющихся нормальному распределению, оценивали по критерию Пирсона, не подчиняющихся закону распределения – по критерию Спирмена. Результаты корреляционного анализа представляли в виде коэффициента корреляции с указанием уровня значимости (минимальные значения для р=0,05).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Статистически значимое снижение уровня креатина у мышей в мышцах травмированной конечностей нами обнаружено на 28-е сутки после нанесения травмы, в эти же сроки наблюдалась и тенденция к снижению уровня КрФ в ткани (табл. 1). В результате этого на 28-е сутки после травмы в скелетных мышцах статистически значимо снижалось суммарное содержание и соотношение креатинфосфата и креатина. Отмеченные изменения свидетельствовали о том, что в посттравматический период в скелетных мышцах мышей происходило снижение уровня как резервного энергетического субстрата – креатинфосфата, так и его предшественника – креатина. Снижение уровня КрФ в ткани, на наш взгляд, в большей мере было новным является гликоген.
Значимое снижение запасов гликогена в мышцах травмированной конечности мы обнаружили у животных на 3-и сутки после травмы (табл. 2). Восстановление уровня гликогена в скелетных мышцах у мышей происходило уже на 7-е сутки эксперимента. Содержание же гликогена в печени мышей экспериментальной группы было выше относительно значений интактных животных на всех сроках наблюдения. Содержание общих липидов в мышцах травмированного сегмента достоверно снижалось к 28-м суткам после перелома. Уровень липидов в печени наиболее значительно снижался на 3-и сутки эксперимента, к концу эксперимента содержание общих липидов в ткани связано с наличием и запасами энергетических субстратов в скелетных мышцах, из которых ос- экспериментальных животных оставалось ниже уровня интактных животных.
Таблица 1
Содержание креатинфосфата, креатина и их соотношения в скелетных мышцах мышей на сроках эксперимента (медиана; 25-й÷75-й персентиль)
|
Интактные животные |
3-и сутки эксперимента |
7-е сутки эксперимента |
28-е сутки эксперимента |
|
|
Креатинфосфат, мкмоль/г ткани |
22,7 21,1÷24,4 |
24,9 24,0÷25,7 |
23,6 22,7÷25,0 |
19,0 15,8÷28,6 |
|
Креатин, мкмоль/г ткани |
59,5 57,3÷61,9 |
61,6 58,0÷63,9 |
54,2 52,8÷59,9 |
52,70,01 52,1÷55,0 |
|
Креатинфосфат/креатин |
0,38 0,34÷0,43 |
0,40 0,39÷0,40 |
0,42 0,40÷0,43 |
0,300,05 0,30÷0,34 |
|
Креатинфосфат+креатин |
81,3 78,0÷85,9 |
85,4 81,4÷89,0 |
79,2 76,1÷82,8 |
78,30,04 67,9÷81,8 |
Примечание: верхний индекс – уровень значимости различий (р) по сравнению с интактными животными.
Таблица 2
Содержание гликогена и общих липидов в скелетных мышцах и печени мышей на сроках эксперимента (медиана; 25-й÷75-й персентиль)
|
Интактные животные |
3-и сутки эксперимента |
7-е сутки эксперимента |
28-е сутки эксперимента |
|
|
Гликоген мышц, мг, % |
0,34 0,26÷0,45 |
0,150,04 0,12÷0,23 |
0,28 0,15÷0,40 |
0,32 0,28÷0,34 |
|
Гликоген печени, мг, % |
14,3 11,9÷16,8 |
36,80,01 24,8÷38,7 |
30,00,01 26,8÷32,0 |
40,80,001 37,2÷44,6 |
|
Общие липиды мышц, % от массы ткани |
3,56 2,84÷4,16 |
4,34 2,88÷5,80 |
3,06 2,26÷4,37 |
3,100,04 2,18÷3,14 |
|
Общие липиды печени, % от массы ткани |
5,31 4,83÷6,00 |
0,001 2,9,5÷3,83 |
3,890,01 3,69÷4,46 |
4,110,01 3,76÷4,44 |
Примечание: верхний индекс – уровень значимости различий (р) по сравнению с интактными животными.
Для обнаружения причинно-следственных связей между содержанием энергетических субстратов в скелетных мышцах и печени у мышей интактной и экспериментальной группы мы провели оценку корреляционных отношений между содержанием КрФ и гиликогена в мышцах, уровнем гликогена и общих липидов в мышцах и печени. У интактных животных нами была обнаружена обратная зависимость между запасами гликогена и КрФ в скелетных мышцах:
r = -0,48 (р=0,03) (рис. 1, а), уровнем гликогена в мышцах и печени r = -0,52 (р=0,03) (рис. 1, б) и прямая между содержанием общих липидов в мышцах и печени r= +0,68 (р=0,006) (рис. 1, в).
У животных экспериментальной группы, которым моделировали перелом костей голени, такие корреляционные связи в посттравматический период нарушались, значимых зависимостей между уровнем энергетических субстратов в мышцах и печени обнаружено не было.
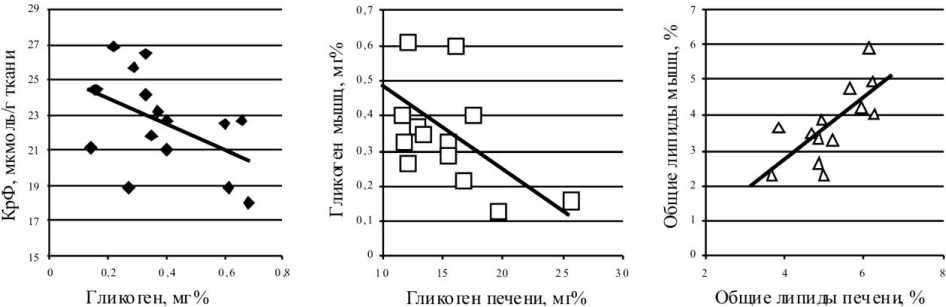
а б в
Рис. 1. Графики зависимости: концентрации креатинфосфата (КрФ) в скелетных мышцах от содержания гликогена в ткани (а); уровня гликогена в мышцах от его содержания в печени (б); содержание общих липидов в мышцах от их уровня в печени (в) интактных животных
ЗАКЛЮЧЕНИЕ
Таким образом, представленные данные позволяют заключить, что травма является фактором, нарушающим как внутритканевое соотношение энергетических субстратов в мышцах, так и их межорганные отношения между мышцами и печенью. Такие изменения говорят о том, что емкость цикла Кори при травмах оказывается недостаточной для возмещения «энергетического» дефицита в мышцах. Учитывая также и то, что уве- личение содержания в мышцах макроэргов (АТФ, КрФ) в посттравматический период возможно только при достаточном уровне энергетических субстратов в ткани (глюкоза, гликоген, и в меньшей степени липиды), можно заключить, что восстановление нарушенных межорганных взаимодействий может являться одним из факторов, способствующих нормализации энергетического обмена в мышцах в посттравматический период.


