Мезотелиома плевры, брюшины и других локализаций
Автор: Волков Н.М., Барболина Т.Д., Борисова Т.Н., Владимирова Л.Ю., Деньгина Н.В., Левченко Е.В., Пикин О.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Практические рекомендации
Статья в выпуске: 3S2-1 т.14, 2024 года.
Бесплатный доступ
Мезотелиома, химиотерапия, иммунотерапия, комбинированное лечение, опухолевые плевриты, тримодальная терапия, асцит, плеврит, плевродез, плевроцентез, лапароцентез
Короткий адрес: https://sciup.org/140307382
IDR: 140307382 | DOI: 10.18027/2224-5057-2024-14-3s2-1-1-06
Текст статьи Мезотелиома плевры, брюшины и других локализаций
1. ОПРЕДЕЛЕНИЕ СТАДИИ
Для стадирования мезотелиомы плевры (МП) используется классификация, предложенная Международной группой по изучению мезотелиомы (IMIG), (AJCC, 8 издание, 2017 г.). Стадирование по TNM применимо только к МП (табл. 1 и 2). Несмотря на то, что выпот в плевральной полости при МП встречается у 40–70% больных, при стадиро-вании наличие его не учитывается.
Таблица 1. Определение категорий TNM при мезотелиоме плевры
|
Первичная опухоль |
|
|
Тх |
Первичная опухоль не может быть оценена |
|
Т0 |
Первичная опухоль не определяется |
|
Т1 |
Опухоль ограничена париетальной плеврой на стороне поражения в сочетании или без вовлечения висцеральной, медиастинальной, диафрагмальной плевры |
|
Т2 |
Опухоль прорастает любую поверхность париетальной плевры на стороне поражения. Присутствует одна из следующих характеристик:
|
|
Т3 |
Опухоль локально распространенная, но потенциально резектабельна, прорастает любую поверхность париетальной плевры на стороне поражения. Присутствует одна из следующих характеристик:
|
|
Т4 |
Местно-распространенный, но технически не резектабельный процесс. Опухоль прорастает все поверхности париетальной плевры на стороне поражения. Присутствует одна из следующих характеристик:
|
|
Регионарные лимфатические узлы 1,2 |
|
|
Nх |
Региональные лимфатические узлы не могут быть оценены |
|
N0 |
Нет метастазов в региональных лимфатических узлах |
|
N1 |
Метастазы в бронхопульмональных лимфатических узлах (узле) и/или лимфатических узла (узле) корня легкого на стороне поражения, медиастинальных лимфатических узлов, включая внутренние маммарные, перидиафрагмальные, перикардиальной клетчатки и интеркостальные на стороне поражения |
|
N2 |
Метастазы в надключичных лимфатических узлах (узле) на стороне поражения или противоположной стороне, контралатеральных медиастинальных лимфатических узлах |
|
Отдаленные метастазы |
|
|
М0 |
Нет отдаленных метастазов |
|
М1 |
Есть отдаленные метастазы (печень, паренхима легких, кости, головной мозг) |
-
1 Для мезотелиомы брюшины регионарными являются забрюшинные лимфатические узлы.
-
2 Для мезотелиомы оболочек яичка регионарными являются паховые и подвздошные лимфатические узлы.
Таблица 2. Группировка мезотелиомы плевры по стадиям
|
Стадия |
T |
N |
M |
|
Ia |
Т1 |
N0 |
М0 |
|
Ib |
Т2–3 |
N0 |
М0 |
|
II |
Т1–2 |
N1 |
М0 |
|
IIIА |
Т3 |
N1 |
М0 |
|
IIIВ |
Т1–3 |
N2 |
М0 |
|
Т4 |
N любая |
М0 |
|
|
IV |
Т любая |
N любая |
М1 |
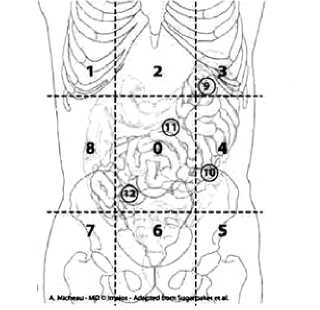
Для оценки распространенности поражения брюшины при мезотелиоме брюшины (МБ) и определения возможности хирургического лечения используют шкалу расчета индекса канцероматоза (PCI — Peritoneal Cancer Index), предложенную Sugarbaker PH в 1999 г. (рис. 1, табл. 3).
|
Баллы |
Определение |
|
LS0 |
Нет элементов опухоли |
|
LS1 |
Образования до 5 мм |
|
LS2 |
Образования до 25 мм |
|
LS3 |
Более 25 мм или сливные |
Рисунок 1. Схема условного деления брюшной полости на области для подсчета индекса перитонеального карциноматоза.
Таблица 3. Таблица расчета индекса перитонеального карциноматоза с описанием анатомических структур по областям брюшной полости.
Торакоскопия или лапароскопия предпочтительны в диагностическом алгоритме, т. к. помогают визуально оценить степень диссеминации, операбельность и выполнить биопсию с ИГХ исследованием для точного определения гистологического типа опухоли. Проведение трансторакальной бипсии следует ограничить случаями с большой опухолевой массой и ослабленным состоянием пациентов. Мезотелиальные клетки отличаются от фибробластических и эпителиальных только при электронной микроскопии и иммунофенотипировании. ИГХ исследование выполняется в позитивном и негативном окрашивании. Характерно наличие кальретинина, виментина, мезотелина и антигена WT-1. Не рекомендуется устанавливать диагноз только на основании цитологического исследования, так как при этом методе точный диагноз устанавливается только в 26% случаев.
Первичное обследование должно проводиться до начала лечения для определения распространенности болезни, стадирования и определения тактики лечения. План обследования больных мезотелиомой:
сбор анамнеза и физикальный осмотр;
общий анализ крови (гемоглобин, общее число лейкоцитов, лейкоцитарная формула, тромбоциты);
биохимический анализ крови (креатинин, мочевина, АЛТ, АСТ) и коагулограмма;
АФП, β-ХГЧ и ЛДГ — при поражении оболочек яичка;
КТ органов грудной клетки и брюшной полости с в/в контрастированием;
УЗИ шейно-надключичных, подключичных лимфатических узлов, паховых лимфатических узлов — при мезотелиоме оболочек яичка, органов брюшной полости, забрюшинного пространства и малого таза;
рентгенологическоеисследование органовгруднойклетки(лишьдля определенияуровня гидроторакса); диагнозМПне можетбытьустановленпо обычнойрентгенограмме; радиоизотопное исследование скелета (при подозрении на поражение костей);
КТ или МРТ головного мозга с контрастным усилением (при наличии неврологических симптомов или при ранней стадии для исключения поражения). МРТ является методом уточняющей диагностики при оценке местного распространения опухоли. КТ и МРТ играют важную роль в оценке распространенности опухоли по диафрагме, средостению, верхней части грудной клетки. При неинвазивной стадии очень трудно провести различия между Т1 и Т2;
УЗДГ сосудов шеи и нижних конечностей (при гиперкоагуляции);
ЭКГ и Эхо-КГ при поражении перикарда;
• торакоскопическая биопсия плевры или перикарда/ лапароскопическая биопсия брюшины, биопсия паховых лимфатических узлов при мезотелиоме оболочек яичка;
• ИГХ и/или ИЦХ исследование;
• ПЭТ-КТ с ФДГ с целью первичного стадирования не рекомендуется, но является дополнительным методом в диагностике поражения плевры, может использоваться в качестве контроля эффективности лечения, перед планированием ЛТ;
• молекулярное или ИГХ исследования для определения dMMR/ MSI (выявляется в 1–2% случаев) при МБ.
3. ЛЕЧЕНИЕ
3.1. I–IIIА стадии
3.1.1. Хирургическое лечение
Гистологические подтипы мезотелиомы включают в себя 3 формы: эпителиоидную, бифазную и саркоматоидную. Наиболее часто встречается эпителиоидная (50–70% случаев), реже — бифазная (20–25% случаев) и саркоматоидная (7–20% случаев) формы. У больных с эпителиоидной формой отмечаются лучшие отдаленные результаты лечения, чем у пациентов с бифазной и саркоматоидной формами.
Перитонеальная инклюзионная киста (ПИК) брюшины относится к опухолевоподобным заболеваниям (D20). Это доброкачественное кистозное образование брюшной полости или малого таза, возникающее в результате усиленной пролиферативной активности мезотелия. ПИК встречаются у женщин репродуктивного и пременопаузального возраста. Чаще всего лечением пациентов с ПИК занимаются хирурги общей практики и гинекологи. Поскольку ранее ПИК имела альтернативные названия, такие как доброкачественная МБ, мультикистозная мезотелиома, заболевание расценивалось как злокачественная МБ и ошибочно кодировалось как С45.1. ПИК не имеет злокачественного потенциала, но образование кист может носить рецидивирующий характер, поэтому пациентов направляют к онкологам. Именно поэтому лечение ПИК рассматривается в этих рекомендациях. Отдельного алгоритма диагностики ПИК нет, так как диагноз устанавливается после получения морфологического заключения чаще всего случайно в процессе лечения по поводу любой иной хирургической патологии в брюшной полости.
Хирургический метод лечения предпочтителен для ранних стадий. Объем операции при МП:
-
• экстраплевральная пневмонэктомия (ЭПП)
-
• плеврэктомия или декортикация (ПЭ, ПД)
-
• плевродез как метод лечения рецидивирующего плеврита.
Операция проводится в многопрофильном лечебном учреждении, опытным хирургом.
Требования, предъявляемые к пациентам до операции:
-
• удовлетворительное общее состояние
-
• сохранная легочно-сердечная функция
-
• эпителиоидный тип опухоли
-
• N0–1.
Целесообразность хирургического вмешательства при саркоматоидном гистологическом варианте опухоли и поражении лимфатических узлов N2 спорна.
ПЭ или декортикация в сравнении с ЭПП сопровождается лучшими показателями послеоперационной летальности (0–4% против 5–7% соответственно). Следует иметь ввиду, что не всем пациентам с МП возможно выполнение ПД из-за наличия массивной инвазии опухоли в паренхиму легкого или буллезной эмфиземы, при которых удаление висцеральной плевры сопряжено с трудноустранимым нарушением герметичности легкого.
Есть данные об эффективности адъювантных интраоперационных методов лечения, включая гипертермическую интраоперационную ХТ, экспозицию в течение 15 мин. подогретого до 40–41°С раствора бетадина (PVP-I) и ФДТ, нацеленных на микрометастазы и направленных на улучшение местного контроля. Решение о таких дополнительных методах воздействия принимается на междисциплинарном консилиуме.
Париетальная ПЭ или плевродез показаны для купирования рецидивирующего плеврита. ПЭ не увеличивает выживаемость по сравнению с ЭПП, но сокращает частоту рецидивов накопления плевральной жидкости лучше, чем плевродез тальком. При перикардите со значительным объемом жидкости (при ЭхоКГ в фазе диастолы расхождение листков перикарда > 20 мм) рекомендуется перикардиоцентез.
При МБ существует три основных типа внутрибрюшинной ХТ— это HIPEC, EPIC и NIPEC, которые направлены на усиление эффекта адъювантного лечения и увеличение ВБП и ОВ. HIPEC (Hyperthermic intraperitoneal chemotherapy) — интраперитонеальная гипертермическая
ХТ, которая проводится интраоперационно.
EPIC (Early postoperative intraperitoneal) — ранняя послеоперационная внутрибрюшинная ХТ, которая может проводиться сразу на 1–5 сутки после циторедуктивной операции.
NIPEC (Normothermic intraperitoneal chemotherapy) — нормотермическая внутрибрюшинная ХТ, которая проводится через 4–6 недель после операции.
Для лечения МБ рекомендуется комбинированный подход: циторедуктивная операция + HIPEC. На сегодняшний день нет общепринятой стандартизированной методики HIPEC. В качестве химиотерапевтических препаратов для нее могут использоваться в монорежиме цисплатин или карбоплатин, митомицин, доксорубицин, паклитаксел, оксалиплатин, фторурацил, иринотекан, доцетаксел. Доза и концентрация препарата рассчитываются в мг/м 2 ил/м 2 . Температура нагревания также различается — от 31 до 44 °C. Длительность перфузии составляет от 30 мин. до 2 ч. Этим обясняется большой диапазон данных по ОВ после использования HIPEC: от 30 до 92 мес., с показателями 5-летней ОВ от 41 до 67%.
Наиболее распространены режимы HIPEC, разработанные Shugabaker и Миланским национальным противораковым институтом.
Режим Shugabaker:
-
• доза цисплатина 50 мг / м 2 и доксорубицина 15 мг / м 2 на процедуру HIPEC длительностью 90 мин.
-
• цисплатин добавляют к 2 литрам 1.5 % раствору декстрозы для перитонеального диализа;
-
• доксорубицин добавляют в те же 2 литра 1.5% раствора декстрозы для перитонеального диализ;
-
• перфузия проводится раствором, нагретым до 42 °C.
Одновременно проводится в/в введение ифосфамида:
-
• ифосфамид в дозе 1300 мг/м 2 в 1 л физиологического раствора вводят в/в капельно в течение 90 мин. одновременно с интраперитонеальной перфузией;
-
• месна в дозе 260 мг / м 2 в 100 мл физиологического раствора вводится в / в болюсно
за 15 минут до и через 4 и 8 часов после инфузии ифосфамида.
Режим Миланского национального противоракового института:
-
• цисплатин 43 мг на 1 литр перфузата + доксорубицин 15,25 мг на 1 литр перфузата;
-
• раствор готовят в объеме 4–6 литров в зависимости от объема полости брюшины;
-
• перфузия проводится раствором, нагретым до 42 °C;
-
• процедура проводится в течение 90 мин.
-
3.1.2. Комбинированное лечение
При невозможности выполнения HIPEC проводится отсроченная нормотермическая внутрибрюшинная ХТ. EPIC и NIPEC проводятся в крупных центрах, выбор препаратов и режимов введения определяется мультидисциплинарным консилиумом.
При прогрессировании заболевания после комбинированного/комплексного лечения возможно рассмотрение вопроса о повторной циторедуктивной операции. Решение вопроса об этом вмешательстве принимается индивидуально мультидисциплинарным консилиумом.
При мезотелиоме оболочек яичка оптимальным объемом операции считается орхфуни-кулэктомия (ОФЭ) в сочетании или без паховой лимфодиссекции. Необходимость локальной резекции стенки оболочки яичка обусловлена локальной частотой рецидивов 36%, и для местного контроля часто требуется гемискротэктомия, тогда как местный рецидив после орхидэктомии отмечается у 10,5–11,5% пациентов. Поскольку в большинстве случаев злокачественная мезотелиома диагностируется интраоперационно или в результате патоморфологического исследования удаленных образцов, то в случае первоначально выполненной гемискротэктомии на втором этапе объем оперативного вмешательства расширяют до радикального. Вопрос о необходимости пахово-подвздошной лимфодис-секции остается дискутабельным.
Варианты лечения ПИК могут быть различными: наблюдение, симтоматическое лечение, ГТ, пункция кист с аспирацией содержимого, склеротерапия, лазерная абляция, хирургическое лечение как самый агрессивный и наиболее эффективный метод. Поскольку стандартных подходов не существует, то лечебная стратегия вырабатывается индивидуально мультидисциплинарной командой специалистов.
Хирургическое лечение может рассматриваться при эпителиоидной МП как компонент тримодальной терапии. Так как при МП операция R0 сомнительна, настоятельно рекомендуется проводить комбинированную терапию с ХТ в режимах, рекомендованных для I линии ХТ и/или ЛТ. В периоперационном режиме не применяются комбинации с включением бевацизумаба и иммунотерапия. Показания к трехкомпонентному лечению определяются индивидуально, исходя из общего состояния пациента, распространенности процесса, ожидаемой эффективности ХТ, технических и кадровых возможностей стационара. С учетом данных рандомизированного исследования MARS (2011 г.) оптимальным объемом хирургического этапа при комбинированном лечении считается декортикация плевры. Алгоритм диагностики и лечения ранних стадий МП представлен на рис. 2.
Адъювантная химиотерапия показана:
-
• после ЭПП и радикальной ПЭ при МП;
-
• после циторедуктивной перитонэктомии при МБ;
-
• после циторедуктивной перитонэктомии и HIPEC или NIPEC при МБ при наличии одного из неблагоприятных прогностических факторов:
– индекс полноты циторедукции > 1;
– саркоматоидный или бифазный гистотип;
– поражение лимфатических узлов,
– Ki67 > 9 %;
– индекс перитонеального карциноматоза > 17).
-
3.2. IIIB–IV стадия
-
3.2.1. Химиотерапия
-
После ОФЭ при мезотелиоме оболочек яичка и после перикардэктомии при мезотелиоме перикарда вопрос об адъювантной ХТ решается индивидуально.
При невозможном выполнении оперативного вмешательства при ранней стадии, бифазном или саркоматоидном подтипе, а также при распространенном опухолевом процессе применяется ХТ, таргетная терапия и иммунотерапия.
Выделяют два основных режима ХТ I линии: это платиносодержащие режимы в комбинации с пеметрекседом или гемцитабином. Таргетная антиангиогенная терапия при добавлении к пеметрексед-содержащему режиму — бевацизумаб. В качестве двойной иммунной блокады контрольных точек используется комбинация ниволумаба и ипилимумаба .
Комбинация ипилимумаба и ниволумаба у ранее не получавших лечение пациентов с неоперабальной МП показала преимущество по сравнению с ХТ пеметрекседом и препаратами платины в ОВ (медиана ОВ 18,1 мес. против 14,1 мес.). При этом различий в медиане ВБП и в частоте объективных ответов отмечено не было. При эпителиоидном типе опухоли медиана продолжительности жизни при проведении иммунотерапии составила 18,7 мес. против 16,5 мес. в группе ХТ. Не получено статистически значимой разницы между двумя лечебными подходами при PD-L1-негативном варианте (медиана продолжительности жизни при иммунотерапии составила 17,3 мес. против 16,5 мес. при ХТ). Эти пациенты не получили преимущества от комбинированной иммунотерапии, и, таким образом, ХТ пеметрекседом с препаратами платины, возможно, с добавлением бевацизумаба, пока остается основным вариантом I линии лечения у этой категории больных.
Согласно недавно опубликованным результатам исследования IND. 227, добавление пембролизумаба к ХТ комбинацией цисплатина и пеметрекседа в качестве I линии лечения больных МП позволило увеличить медиану продолжительности жизни с 16,1 мес. до 17,3 мес. Кроме того химио-иммунотерапия показала преимущество в частоте объективных ответов (63% против 40%). Наибольшее преимущество от добавления пембро-лизумаба наблюдалось у пациентов с саркоматоидной мезотелиомой.
Добавление бевацизумаба к ХТ пеметрекседом помогает получить максимально возможную эффективность и увеличить продолжительность жизни. (медианы ВБП составила 9,2 против 7,3 мес., медианы продолжительности жизни — 18,8 против 16,1 мес.). Но добавление бевацизумаба к режиму GP не улучшило эффективность лечения у больных МП.
Эффективность поддерживающей терапии пеметрекседом не доказана и не рекомендуется в настоящее время.
Рекомендуется проведение 6 курсов ХТ с последующим динамическим наблюдением (или поддерживающей терапией бевацизумабом, если он применялся в комбинации) или 2 года лечения в случае проведения иммунотерапии.
Смена режима терапии должна проводиться только при доказанном прогрессировании заболевания или в случае непереносимости лекарственного лечения. В случае прогрессирования болезни в течение ≥ 6 мес. от последнего курса ХТ желательна реиндукция режима I линии лечения. При раннем прогрессировании на фоне лечения или в ближайшие 6 мес. после завершения ХТ рекомендуется переход на II линию.
Стандартов II и последующих линий лечения нет. В качестве режима II линии должны быть в первую очередь использованы комбинации из вариантов I линии, которые ранее не применялись.
Режимы лекарственного лечения, рекомендуемые при мезотелиоме представлены в табл. 5.
Таблица 5. Режимы лекарственного лечения, рекомендуемые при мезотелиоме
|
Схема лечения |
Режим |
|
Предоперационная или адъювантная терапия |
|
|
PP |
Пеметрексед 500 мг/м 2 в 1-й день + цисплатин 75 мг/м 2 в 1-й день, каждый 21 день |
|
PC |
Пеметрексед 500 мг/м 2 в 1-й день + карбоплатин AUC5 (6) в 1-й день, каждый 21 день |
|
GP |
Гемцитабин 1000–1250 мг/м 2 в 1-й и 8-й дни + цисплатин 75 мг/м 2 в 1-й день, каждый 21 день |
|
GC |
Гемцитабин 1000–1250 мг/м 2 в 1-й и 8-й дни + карбоплатин AUC5 (6) в 1-й день, каждый 21 день |
|
I линия |
|
|
PP |
Пеметрексед 500 мг/м 2 в 1-й день + цисплатин 75 мг/м 2 в 1-й день, каждый 21 день |
|
PC |
Пеметрексед 500 мг/м 2 в 1-й день + карбоплатин AUC5 (6) в 1-й день, каждый 21 день |
|
Схема лечения |
Режим |
|
PP + бевацизумаб |
Пеметрексед 500 мг/м 2 в 1-й день + цисплатин 75 мг/м 2 в 1-й день + бевацизумаб 15 мг/кг в 1-й день, каждые 21 день |
|
PC + бевацизумаб |
Пеметрексед 500 мг/м 2 в 1-й день + карбоплатин AUC5 (6) в 1-й день + бевацизу-маб 15 мг/кг в 1-й день, каждый 21 день |
|
GP |
Гемцитабин 1000–1250 мг/м 2 в 1-й и 8-й дни + цисплатин 75 мг/м 2 в 1-й день, каждый 21 день |
|
GC |
Гемцитабин 1000–1250 мг/м 2 в 1-й и 8-й дни + карбоплатин AUC5 (6) в 1-й день, каждый 21 день |
|
Ниволумаб + ипилимумаб |
Ниволумаб 3 мг/кг или 240 мг в/в 1 раз в 14 дней или 360 мг в/в каждые 3 недели + ипилимумаб 1 мг/кг в/в 1 раз в 6 недель не более 2 лет |
|
PP + пембро-лизумаб |
Пеметрексед 500 мг/м2 в/в в 1-й день + цисплатин 75 мг/м2 в/в в 1-й день + пембролизумаб 200 мг в / в в 1-й день, каждый 21 день, до 6 циклов при отсутствии прогрессирования, далее пембролизумаб до прогрессирования или непереносимой токсичности |
|
PC + пембро-лизумаб |
Пеметрексед 500 мг/м2 в / в в 1-й день + карбоплатин AUC5 (6) в /в в 1-й день + пембролизумаб 200 мг в /в в 1-й день, каждый 21 день, до 6 циклов при отсутствии прогрессирования, далее пембролизумаб до прогрессирования или непереносимой токсичности |
|
II и последующие линии (или I линия при противопоказаниях к препаратам платины и комбинированной ХТ) |
|
|
Гемцитабин |
750–1200 мг/м² в 1-й, 8-й, 15-й дни, каждые 28 дней |
|
Винорелбин |
20 мг/м 2 в 1-й, 8-й, 15-й дни, каждые 28 дней |
|
Винорелбин |
25–30 мг/м 2 в 1-й и 8-й дни, каждый 21 день |
|
Пеметрексед |
500 мг/м 2 в 1-й день, каждый 21 день |
|
Пембролизумаб |
200 мг в/в 1 раз в 3 недели или 400 мг в/в 1 раз в 6 недель (только при MSI-high МБ) |
|
Ниволумаб |
3 мг кг в/в 1 раз в 14 дней или 240 мг в/в каждые 14 дней не более 2 лет |
|
Ниволумаб + ипилимумаб |
Ниволумаб 3 мг/кг в/в 1 раз в 14 дней или 360 мг в/в каждые 3 недели + ипилиму-маб 1 мг/кг в/в 1 раз в 6 недель не более 2 лет |
В качестве II–III линии лечения возможна иммунотерапия. Пембролизумаб зарегистрирован в РФ для лечения солидных опухолей при наличии MSI-H, а при мезотелиоме брюшины этот маркер встречается в 1–2% случаев. Пембролизумаб у больных без MSI-H не показал преимуществ по сравнению с ХТ.
В качестве II–III линии лечения возможно также использование иммунотерапии ниво-лумабом в сочетании или без ипилимумаба, независимо от уровня экспрессии PD-L1.
В исследовании III фазы CONFIRM у больных с МП или брюшины с прогрессированием после платиносодержащей ХТ терапия ниволумабом по сравнению с плацебо показала преимущество в медиане общей продолжительности жизни 10,2 мес. против 6,9 мес.
-
3.2.2. Плевроцентез или лапароцентез и плевродез как методы лечения рецидивирующего гидроторакса и накопления асцита
Для МП характерно развитие гидроторакса, который ухудшает качество жизни пациента и создает угрозу жизни. Эвакуация жидкости из плевральной полости проводится с помощью пункции — плевроцентеза, который представляет собой исключительно симптоматический метод лечения.
Показаниями для плевроцентеза являются:
-
• наличие жидкости в плевральной полости с уровнем выше 2–3 ребра при счете спереди;
-
• симптомы легочно-сердечной недостаточности: выраженная одышка в покое, приглушенный ритм сердца, распирающая боль в грудной клетке и т. д.
При отсутствии клинических симптомов выполнение плевроцентеза не показано.
У 70% больных отмечается повторное накопление жидкости. Показанием к проведению плевродеза является постоянное накопление жидкости, требующее повторных плевральных пункций с частотой 3 раза в месяц. Применение плевросклерозирующих средств приводит к облитерации плевральной полости за счет асептического воспаления плевральных листков, их склеивания и последующего сращения париетальной и висцеральной плевры с прекращением продукции плеврального выпота.
Наиболее эффективным склерозирующим агентом признан тальк. Введение его через плевральный катетер в виде суспензии (4–5 г стерильного талька + 20 мл 0,5% раствора лидокаина) эффективно у 90% больных. Возможна также инсуфляция порошка талька при торакоскопии. Препараты, рекомендуемые для проведения плевродеза, представлены в табл. 6.
Таблица 6. Препараты, рекомендуемые для проведения плевродеза или внутриплевральной ХТ
|
Препараты |
Доза, рекомендуемая на одно введение 1 |
|
Тальк |
2–5 г |
|
Блеомицин |
15–30 мг |
|
Цисплатин |
50 мг |
1 Выбор дозы зависит от массы тела пациента. Введение лекарственных средств внутриплеврально рекомендуется осуществлять не чаще 1 раза в неделю, не более 3 введений в общей сложности.
Осложнения внутриплеврального введения лекарственных средств:
-
• болевой синдром;
-
• усиление одышки;
-
• гипертермия;
-
• ателектаз легкого;
-
• миелосупрессия;
-
• пневмония;
-
• эмпиема плевры;
-
• легочная и сердечно-легочная недостаточность.
Показанием к лапароцентезу является значительное скопление асцитической жидкости в брюшной полости с формированием так называемого напряженного асцита.
Лапароцентез противопоказан при:
• нарушениях свертываемости крови ввиду риска кровотечения;
• тяжелой спаечной болезни брюшной полости;
• метеоризме;
• вентральной грыже после предыдущих оперативных вмешательств;
• риске травмы кишечника, крупной опухоли.
3.2.3. Лучевая терапия
4. НАБЛЮДЕНИЕ
Не рекомендуется проводить лапароцентез близко к области мочевого пузыря, пальпируемого опухолевого образования. Наличие спаек — относительное противопоказание, но сама по себе спаечная болезнь предполагает высокий риск повреждения сосудов и органов брюшной полости, поэтому показания к лапароцентезу в этом случае оцениваются индивидуально.
ЛТ как самостоятельный метод лечения не используется. При проведении адъювантной ЛТ поле облучения обязательно включает париетальную плевру при декортикации легкого, границы хирургических клипс после ЭПП и участки с возможными остаточными проявлениями. ЛТ лимфатических узлов средостения и надключичных зон не рекомендуется. Послеоперационная ЛТ возможна у пациентов в удовлетворительном состоянии (ECOG 0–1), с сохранной легочной функцией, при которой пациент не нуждается в кисло-родотерапии, без признаков почечной недостаточности, при отсутствии отдаленных метастазов. ЛТ проводится квалифицированными специалистами в специализированных центрах с применением методик IMRT, VMAT, TomoTherapy, которые исключают бóльшую часть легкого из облучения. Рекомендуемые дозы ЛТ указаны в табл. 7.
Таблица 7. Рекомендуемые дозы лучевой терапии при мезотелиоме плевры
|
Назначение |
СОД |
РД |
Длительность лечения |
|
После операции |
|||
|
После ЭПП |
50–60 Гр |
1,8–2 Гр |
6–7 нед. |
|
После ПЭ |
45–54 Гр |
1,8–2 Гр |
5–6 нед. |
|
После циторедуктивных (R2) резекций |
50–54 Гр |
1,8–2 Гр |
5–6 нед. |
|
Паллиативная |
|||
|
С обезболивающей целью на грудную клетку |
20–40 Гр |
3–4 Гр |
1–2 нед. |
|
На область асимптомного рецидива |
30–40 Гр |
3–4 Гр |
2 нед |
|
Метастазы в головном мозге или костях |
Возможны варианты |
||
При МБ ЛТ имеет ограниченные возможности. Данных об эффективности ЛТ при мезотелиоме перикарда или оболочек яичка нет.
Рекомендуемые алгоритмы лечения мезотелиомы в зависимости от локализации, морфологического варианта и стадии представлены на рис. 3, 4, 5, 6.
После завершения лечения динамическое наблюдение проводится каждые 3 мес. в течение первого года, далее — 1 раз в 6 мес. до продолжительности 5 лет. Обязательными диагностическими процедурами являются КТ грудной клетки или брюшной полости с контрастированием, в зависимости от того, где локализовалась первичная опухоль, УЗИ шейно-надключичных, подключичных, паховых лимфатических узлов, органов брюшной полости, забрюшинного пространства и малого таза.
ЛАБОРАТОРНО-ИНСТРУМЕН-
ПОДОЗРЕНИЕ ТАЛЬНОЕ И РЕНТГЕНОЛОГИЧЕСКОЕ
НА МЕЗОТЕЛИОМУ ОБСЛЕДОВАНИЕ
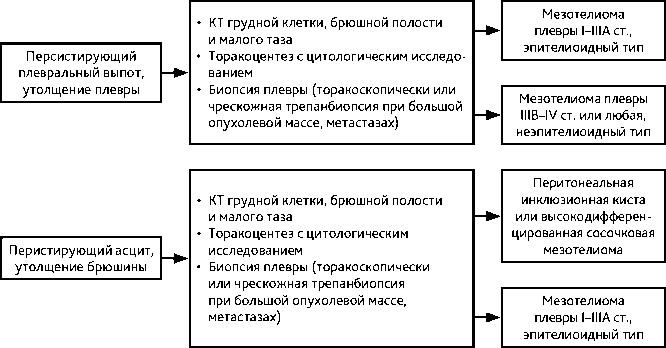
Рисунок 2. Алгоритм первичной диагностики при подозрении на мезотелиому
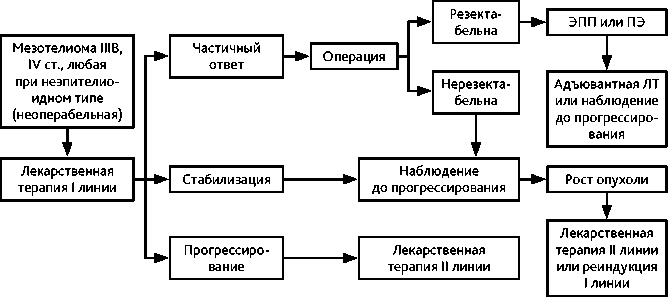
Рисунок 3. Рекомендуемый алгоритм лечения диссеминированной мезотелиомы плевры
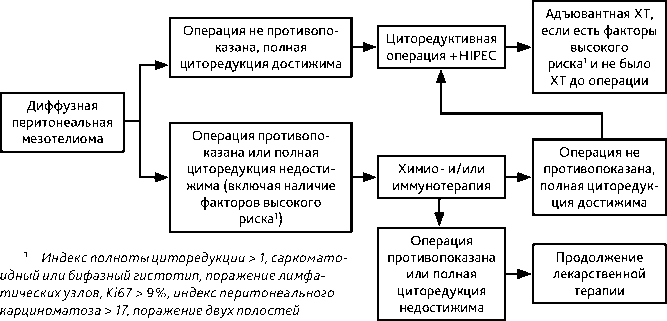
Рисунок 4. Рекомендуемый алгоритм лечения диффузной перитонеальной мезотелиомы
Перитонеальная инклюзионная киста или высокодифференцированная сосочковая мезотелиома
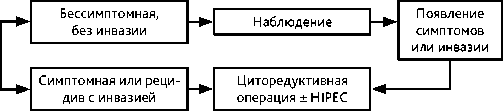
Рисунок 5. Рекомендуемый алгоритм лечения перитонеальной инклюзионной кисты или высокодифференцированной сосочковой мезотелиомы
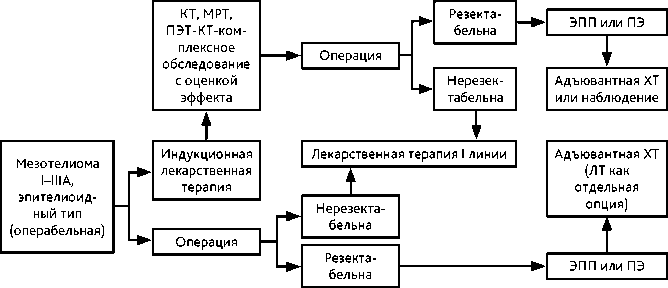
Рисунок 6. Рекомендуемый алгоритм лечения локализованной мезотелиомы плевры том /vol. 14(3s2) 2024
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


