Мезотелиома редких локализаций. Лучшее по материалам конференции iMig2023
Автор: Барболина Т.Д.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S1 т.14, 2024 года.
Бесплатный доступ
Редкость заболевания, трудности диагностики и стадирования мезотелиомы брюшины и влагалищной оболочки яичка оказывают влияние на формирование единого мнения в лечении этого заболевания. Пеметрексед остается наилучшим препаратом как для системной, так и для внутрибрюшинной химиотерапии. В данной статье коротко представлена наиболее интересная информация по лечению мезотелиомы редких локализаций, доложенная на конференции IMig2023 во Франции.
Мезотелиома брюшины, стадирование мезотелиомы, индекс канцероматоза, гипертермическая внутрибрюшинная химиотерапия (HIPEC), мезотелиома оболочек яичка
Короткий адрес: https://sciup.org/140307165
IDR: 140307165 | DOI: 10.18027/2224-5057-2024-14-3s1-26-34
Текст научной статьи Мезотелиома редких локализаций. Лучшее по материалам конференции iMig2023
Мезотелиома брюшины (МБ) — это неопластический процесс, который возникает из серозной оболочки, выстилающей брюшную полость. Поражение брюшины составляет около 20% всех мезотелиом. В отличие от мезотелиомы плевры, которая чаще возникает у мужчин, распределение перитонеальной мезотелиомы по полу примерно одинаково. Связи с асбестом в отличие от мезотелиомы плевры не прослеживается.
Точных данных по заболеваемости нет. Представлены на конгрессе мировые данные по учету всех мезотелиом. На рис 1. показано распределение мезотелиом по возрасту за 2020 г [1].
Стандартизированный по возрасту уровень заболеваемости мезотелиомой составил 0,30 на 100000 человек, при этом самые высокие показатели заболеваемости были зарегистрированы в Северной Европе. Общая тенденция заболеваемости мезотелиомой снижалась, что связано с запретом использования асбеста в некоторых странах, хотя рост наблюдался в Болгарии (среднегодовое процентное изменение: 5,56, 95% ДИ: 2,94–8,24, p = 0,001) и Корее (3,24, 95% ДИ: 0,08–6,49, p = 0,045).
Помимо влияния асбеста на возникновение мезотелиом так же выявлен ген-супрессор опухоли BRCA, ассоциированный с белком-1 (BAP-1), который встречается примерно в 60–70% образцов опухолей мезотелиомы брюшины. Кроме того, примерно у 10% пациентов он является частью наследственного семейного ракового синдрома, при котором у пациента имеется мутация зародышевой линии BAP1 (рис. 2) [2,3,4].
Изменения CDKN2A/B редко встречаются при мезотелиоме брюшины, тогда как BAP1, NF2, TP53, SETD2 и LATS2 весьма распространены. Изменение/потеря BAP1 ассоциируются с плохими показателями выживаемости (рис. 3А, 3В).
Одной из поразительных особенностей мезотелиомы брюшины является значительная биологическая непредсказуемость в ее поведении. У некоторых пациентов заболевание будет быстро и неуклонно прогрессировать, и не поддаваться никакому терапевтическому воздействию, тогда как у других пациентов течение заболевания носит почти доброкачественный характер с крайне медленным ростом с десятилетней продолжительностью жизни. Прогрессирование болезни чаще всего проявляется ростом очагов по брюшине, поэтому основной задачей лечения является контроль за перитонеальным канцероматозом.
Основным методом лечения мезотелиомы брюшины является радикальная резекция (CRS) с гипертермической интраперитонеальной химиотерапией (HIPEC), а самыми главными предикторами длительной выживаемости является эпителиоидный тип опухоли и полное хирургическое
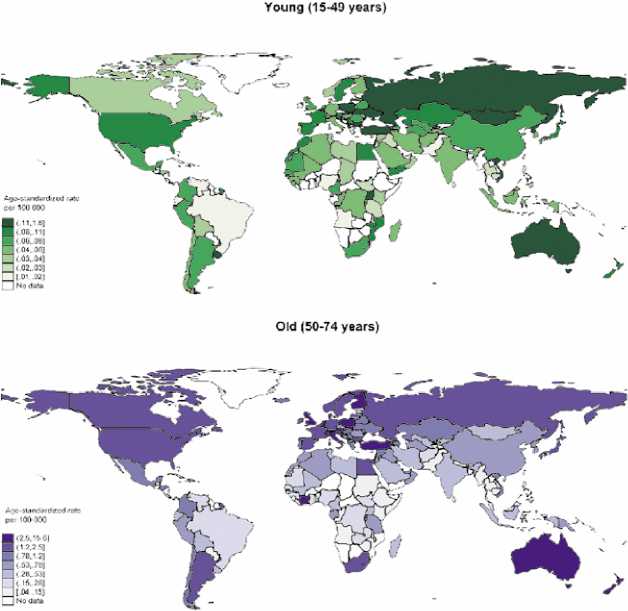
Рисунок 1. Глобальная заболеваемость мезотелиомой по возрасту, оба пола, в 2020 году
| гН9 .,________с
EGA eie< ,B ■ ■.■ ■■_■■■_ ■_■ .■■ ■..! ■__■ ■ [1
• NH Status IIIIIH |H| HU HU Hlllllllll || | Ilin ° Smoking Status llllllllinnilllllllllllllllllllllllinnillllllHistology IIIIIIIIIIIIIIIIIIIIIIIIIIHIIIIIIIIIIinillllllll
I Deep defeteion
-
■ |п*эте moation (unknown sgnficance)
-
■ Missense mutation (outative cover)
I Fusion
* МСОСПСО rtuUbOn ( jnbnOATt ognifconcc)
-
■ Fronctef nutation
-
■ Truncating nutation jpaatvedriven
No ateraticns or not evaluable
I Epithelioid
| Ntm-eptne od
| Never Smokers
| Smokers
| GMHNwatve
I GMH PocibvO
Рисунок 2. Онкопринт пациентов с мезотелиомой брюшины. Процент изменений по генам среди всех пациентов (N = 50) указан справа. TMB выражен в мутациях на мегабазу. FGA — фракция измененного генома; GNH-геномная близкая гаплоидизация; TMB — мутационная нагрузка.
удаление всех видимых очагов, называемое полной циторедукцией. У хорошо отобранных пациентов 5-летняя общая выживаемость (ОВ) приближается к 50–65% [5,6,7,8].
Из-за редкости встречаемости мезотелиомы брюшины не существует достаточно убедительных данных об эффективности того или другого лечебного подхода.
A
B
BAP1 alteration/loss vs wildtype/retained in all patients with epithelioid MReM
BAP1 alteration/loss vs wildtype/retained in all patients with MReM
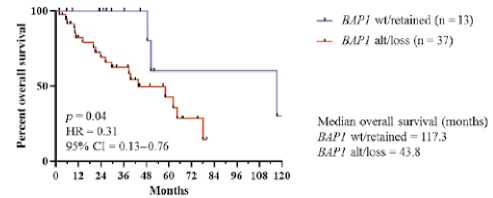
alt — измененный (мутация или делеция);
CI — доверительный интервал; HR — отношение рисков;
IHC — иммуногистохимия;
потеря — потеря окрашивания BAP1 по данным IHC;
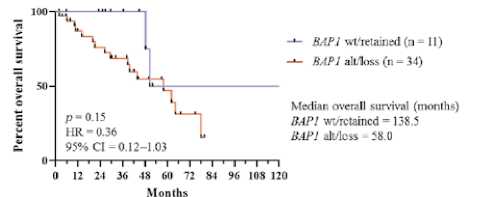
MPeM — злокачественная мезотелиома брюшины;
сохраненный — сохраненное окрашивание BAP1 по данным ИГХ.
Рисунок 3. Общая выживаемость пациентов с мезотелиомой брюшины, имеющих изменение BAP1 и/или потерю BAP1 по данным иммуногистохимии (ИГХ) по сравнению с диким типом/сохраненным A) у всех пациентов (n = 50) и B) у подгруппы с эпителиоидной гистологией (n = 45)
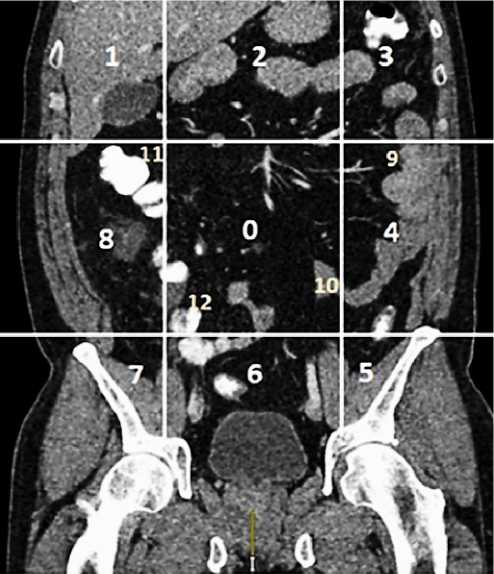
Рисунок 4. Радиологический и хирургический индекс канцероматоза Shugabacker PH и Jacquet P. для оценки распространенности поражения брюшины
|
0 |
Central |
Greater omentum, transverse colon |
|
1 |
Right upper |
Right subphrenic space |
|
2 |
Epigastrium |
Left lobe of liver, lesser omentum, falciform ligament |
|
3 |
Left upper |
Left subphrenic space, spleen, tail of pancreas, anterior and posterior stomach surfaces |
|
4 |
Left flank |
Left paracolic gutter, descending colon |
|
5 |
Left lower |
Pelvic side wall lateral to sigmoid colon, sigmoid colon |
|
6 |
Pelvis |
Ovaries, tubes, uterus in female; prostate and seminal vesicles in males, bladder, pouch of Douglas, recto-sigmoid colon |
|
7 |
Right lower |
Right pelvic side wall, caecum, appendix |
|
8 |
Right flank |
Right paracolic gutter, ascending colon |
|
9 |
Upper jejunum |
Upperjejunum and its mesentery |
|
10 |
Lower jejunum |
Lower jejunum and its mesentery |
|
11 |
Upper ileum |
Upper ileum and its mesentery |
|
12 |
Lower ileum |
Lower ileum and its mesentery |
|
Баллы |
Определение |
|
LS0 |
Нет элементов опухоли |
|
LS1 |
Образования до 5 мм |
|
LS2 |
Образования до 25 мм |
|
LS3 |
Более 25 мм или сливные |
ОТБОР ПАЦИЕНТОВ ДЛЯ ЦИТОРЕДУКЦИИ С ВНУТРИБРЮШИННОЙГИПЕРТЕРМИЧЕСКОЙ ХИМИОТЕРАПИЕЙ
Помимо очевидных факторов таких как гистотип опухоли, пол, возраст и ECOG, влияющих на выбор лечения, существует большая проблема в оценке распространенности опухоли в брюшной полости и стадировании заболевания.
Известная шкала расчета индекса канцероматоза брюшины (PCI) предложена Jacquet P. и Shugabacker PH. в 1996 г. Эта оценка объединяет размер опухолевых узлов по брюшине (в балах от 0 до 3) с распределением опухоли в брюшной полости по условным анатомическим зонам (от 0 до 13 зон) для определения опухолевой нагрузки в виде числового показателя (PCI от 0 до 39) (рис. 4).
Но она не в полной мере отражает распространенность заболевания, так как в ней не учитываются экстраабдо-
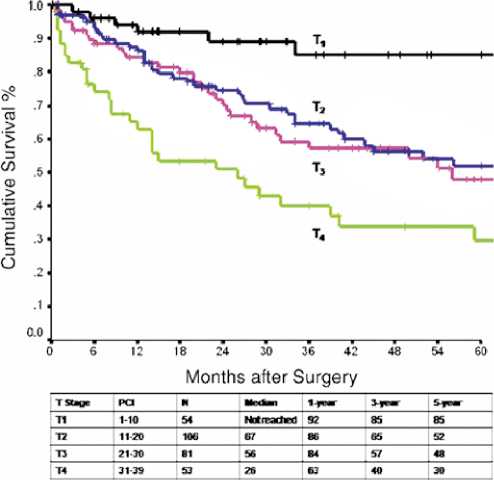
Рисунок 5. Общая выживаемость, стратифицированная по индексу канцероматоза брюшины и стадии “T” (n = 294)
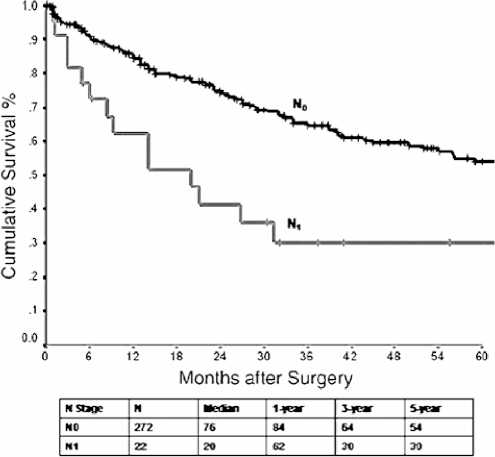
Рисунок 6. Общая выживаемость, стратифицированная по статусу метастатического поражения лимфатических узлов (n = 294)
минальные очаги и пораженные лимфатические узлы, которые играют большую прогностическую роль [9].
Предложена более «удобная» и перспективная, хотя еще и не общепринятая, система стадирования от Tristan D. Yan от 2011 г., где символ Т говорит о степени распространенности заболевания в брюшной полости согласно радиологической оценке PCI [10,11].
Стадия «Т» будет соответствовать индексу канцеро-матоза: Т1 — 1–10 баллов, Т2 — 11–20 баллов, Т3 — 21– 30 баллов и Т4 — 31–36 баллов.
У 294 пациентов с мезотелиомой брюшины, которым была проведена CRS + HIPC за период с октября 1989 года по февраль 2009 года, был применен данным способ ста-дирования и пациенты распределены на 3 стадии мезотелиомы брюшины, исходя из возможностей лечения и их влияния на выживаемость: I стадия — T1N0M0, II стадия — T2-T3N0M0 и III стадия — T1-T4N0-N1M1. Стадии IV мезотелиомы брюшины не существует.
На рис. 5 наглядно представлены данные 1-, 3- и 5-летней общей выживаемости в зависимости от степени поражения брюшины, оцениваемое как символ «Т».
Поражение лимфатических узлов и наличие экстрааб-доминальных проявлений болезни значительно повлияли на показатели выживаемости (рис. 6 и 7).
Предложенная система стадирования TNM (рис. 8) в полной мере отразила влияние стадии на показатель общей выживаемости.
В дискуссиях на конференции были подчёркнуты определяющие факты того, что предлагаемая система стади-рования TNM включает в себя различные клинические и патологические параметры, где фактор “T” оценивается только интраоперационно во время диагностической лапароскопии и лапаротомии, фактор “N” подтверждается
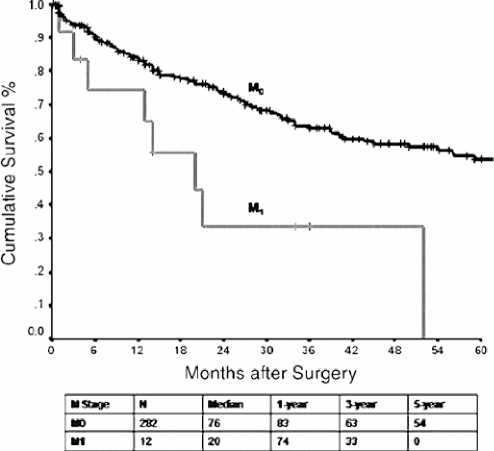
Рисунок 7. Общая выживаемость, стратифицированная по экстраабдоминальным метастазам (n = 294)
только после операции во время гистологического исследования хирургических образцов, а фактор “M” должен быть оценен до операции с использованием различных методов рентгенологической визуализации. Именно эти методы очень важны на дооперационном этапе при отборе пациентов для CRS + HIPEC.
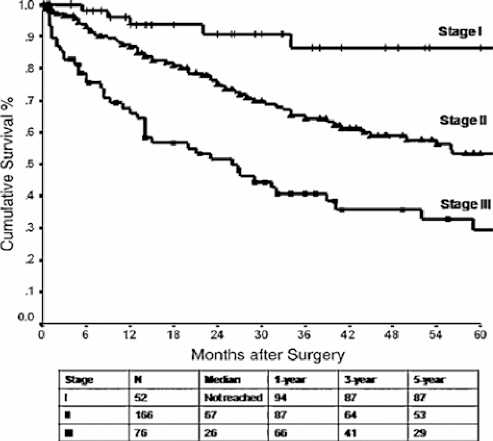
Рисунок 8. Общая выживаемость, стратифицированная по предложенной системе стадирования TNM (n = 294)
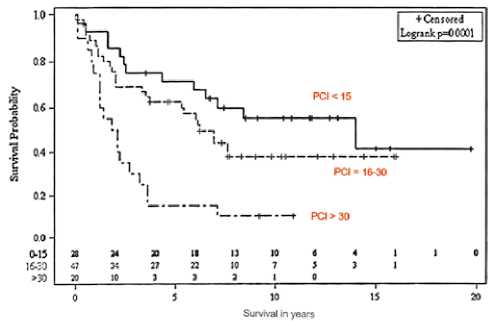
Рисунок 9. Общая выживаемость в зависимости от PCI
ВАЖНОСТЬ КТ-ВИЗУАЛИЗАЦИИДЛЯ ПРЕДОПЕРАЦИОННОГО ПЛАНИРОВАНИЯ
Оценивая данные КТ или МРТ, необходимо обратить внимание на 10 основополагающих факторов, влияющих на отбор пациентов для хирургического лечения [12]. Непроходимость тонкой кишки, наличие спаек и опухолевая инфильтрация брыжейки тонкой кишки, массивное поражение малого таза с очагами более 5 см, значительный асцит, вовлечение ворот печени и малого сальника в опухолевый процесс, а также наличие плеврита значительно препятствуют проведению циторедуктивной операции, делая ее радикальность практически недостижимой, что сказывается на выживаемости (табл. 1).
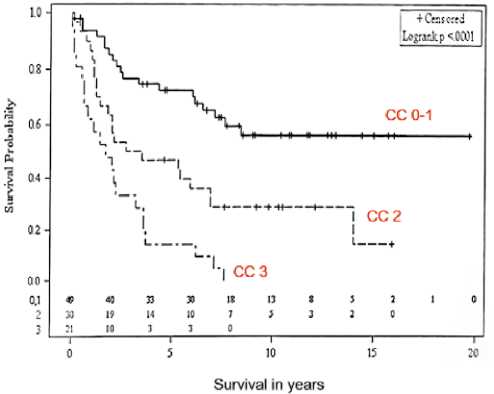
Рисунок 10. Общая выживаемость в зависимости от полноты циторедукции
Таблица 1. КТ-признаки и их предоперационная оценка у 100 пациентов с мезотелиомой брюшины
Table 1
Ten concerning CT features (CCTF) and their preoperative evaluation In 100 patients with malignant peritoneal mesothelioma
|
Concerning CT feature |
Incidence w |
Median survival (months) present/not present |
Hazard ratio (95% Cl) |
P value |
|
Obstructed small bowel |
7 |
23/74 |
3 93 (1 73.8 9 5) |
00011 |
|
Clumped small bowel mesentery |
16 |
17/82 |
3 13(1 69.5.80) |
0.0003 |
|
Mesentery infiltrated |
41 |
25/101 |
2.74 (1 65.4.55) |
0.0001 |
|
Deep zelvis invaded |
21 |
17/74 |
2 04(1 14. 3 68) |
0 0173 |
|
Infiltrated porta hepatis and/or >5 cm mass in lesser omentum |
15 |
25/74 |
2 04 (1 10.3.79) |
0.0230 |
|
Mass >5 cm adjacent jejunum |
15 |
38/82 |
2 88(1 58. 5 2 5) |
0 0006 |
|
Pleural effusion |
16 |
13/82 |
3 32(1 86. 5 92) |
<0.0001 |
|
Omental infiltration 2* and 3* |
29 |
24/85 |
2.35(1 40.3.93) |
0.0012 |
|
Ascites 2+ or 3+ |
43 |
25/101 |
2 66(1 60.4.42) |
0.0002 |
|
Abdominal mass >5 cm |
5 |
39/72 |
1 64 (0 59.4 53) |
0 3391 |
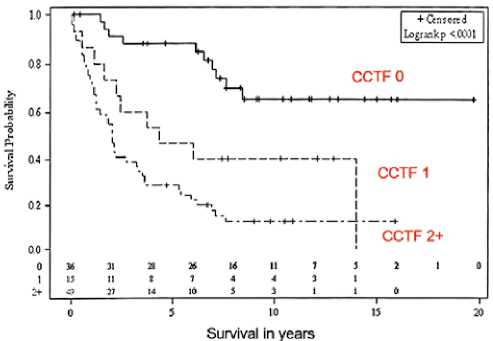
Рисунок 11. Общая выживаемость в зависимости от КТ-признаков: 0 — нет, 1 — один признак, 2+ — более 2
Именно на основании КТ-критериев до операции, индекса канцероматоза, оцениваемого интраоперационно, и полноты циторедукции можно распределить пациентов в группы плохого, промежуточного и хорошего прогноза (рис. 9, 10, 11).
ВЫБОР МЕТОДА ВНУТРИБРЮШИННОЙ (В/Б) ХИМИОТЕРАПИИ
Споры не утихают именно в отношении наилучшего химиотерапевтического компонента для HIPEC. Ранее Шугарбейкер и Чанг опубликовали ретроспективный анализ 129 пациентов с МБ, которым было проведено CRS + HIPEC на основе паклитаксела в течение 5 дней каждые 5 недель после операции. Показатель 5-летней общей выживаемости составил 75% [13]. На конференции в 2023 г. вновь вернулись к обсуждению наилучших комбинаций лекарственных препаратов для CRS + HIPEC.
Проанализированы результаты лечения 74 пациентов с мезотелиомой брюшины, которым была проведена CRS + HIPEC, а также ранняя послеоперационная нормотермическая в/б (EPIC) химиотерапия и отсроченная сочетанная (bidirection, двунаправленная) химиотерапия: внутрибрюшинная (NIPEC) и внутривенная. Выживаемость оценивалась в двух группах: с NIPEC (n=35) и без нее (n=39).
Сразу после проведения этапа циторедукции начинался этап адъювантной сочетанной химиотерапии. Внутривенно вводился ифосфамид и месна, а для гипертермической интраперитонеальной химиоперфузии использовались доксорубицин и цисплатин (рис. 12).
После операции на 1–5 сутки всем пациентам проводилась дополнительная нормотермическая в/б химиотерапия паклитакселом 30 мг/м2 (максимально 80 мг) + 1000 мл 6% гидроксиэтилрахмала HESPAN. Именно этот растворитель помогал избежать развитие химического перитонита и формирования спаек.
На этом лечение в контрольной группе завершалось.
Далее в экспериментальной группе пациенты дополнительно через установленный лапаропорт получали
Sugar baker regimen for hyperthermic intraperitoneal shorn ^therapy (Hl PEC i for malignant peritoneal mennlhe li опа
I 'Oaiwiitcnial chemot *er?py
(I)Add ar claim to 3 . i.Sh аокгоао poiturKdi dialysis raiuitoi
(11} Ard 'inxntuhicin In Ihn mnin Pi I 1 5’6 pnri опт! "inlysis .s~lulinn
(Illi Dose of cLdulin is 50 rg'm2 and donoubfoin is 16 “K/im for f»rirjte HIPEC iitxtUrcnl
I 'travorcui chrnnotteraw
Рисунок 12. Режим Shugabacker для гипертермической интраперитонеальной химиотерапии при мезотелиоме брюшины пеметрексед 500 мг/м2 внутрибрюшинно + 1000 мл 5 % декстрозы в течение 60 мин и в/в введения цисплатина 75 мг/м2 + 250 мл физиологического раствора в течение 120 мин. Премедикация фолиевой кислотой, цианокобаламином и гипергидратация являлись обязательными. Курсы отсроченной сочетанной химиотерапии проводились каждые 3 недели до 6 курсов.
Такое локо-региональное лечение продолжается в течение 6 месяцев или любого времени, необходимого для завершения 6 циклов.
Проведены подгрупповые анализы (табл. 2). Факторы, которые имеют прогностическое значение в плане увеличения ОВ — это циторедукция R0–1 (мОВ составила 87,2% по сравнению с 76,9% при R2) и интенсификация лечения (мОВ в группе без NIPEC — 76,9%, тогда как в экспериментальной группе не достигнута). Пол, возраст, пред-
Таблица 2. Влияние различных клинических и терапевтических факторов на показатели 5-летней общей выживаемости у 74 пациентов с перитонеальной мезотелиомой
Univariant analysis of clinical- and treatment-related features and their impact on OS of 74 pt with malignant peritoneal mesothelioma
Feature N (%) mOS UK Avahre
(% at Syean)
(iender 0.4471
Male 37(50) 16 2(85 0%) 0.748
(0 354, 1382)
Femak 37(50) 152(81.74) Reference
Age 0.0766
<50 43(58) 21.1(82 3%) Reference
>50 31(42) 9.0(85.2%) 1.99(0.929.4.238)
Prior surgery score 0.8860
0.1 51(69) 14 7(84 4%) Reference
2.3 23(31) 211(81 0%) 0.943(0.421,2.111)
PCI 0.4424
<20 36(49) (86.6%) Reference
>20 38(51) 16 2(80 6%) 1.341(0.634.2 837)
Completeness of cytorediKtioii 0.0251
0-1 48(65) -(87.2%) Reference
2 26(35) 12.7(76.9%) 2356(1.113.4 989)
Control (ШРЕС+ЕИС) 39(53) 12.7(76.9%) 3.497(1.1199. 1020) 0.0219
Experimental (HIPEC-EPIC’NIPEC) 35(47) (92.7%) Reference
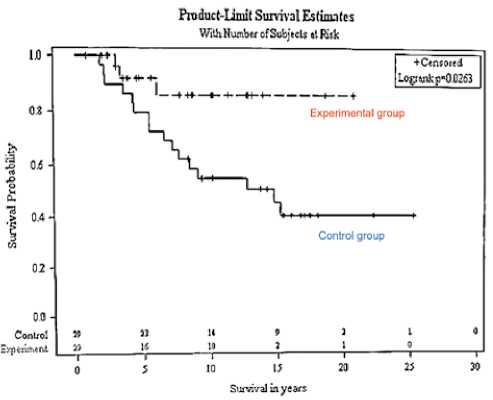
Рисунок 13. Кривые Каплан-Майера показателей общей выживаемости в контрольной и экспериментальной группах
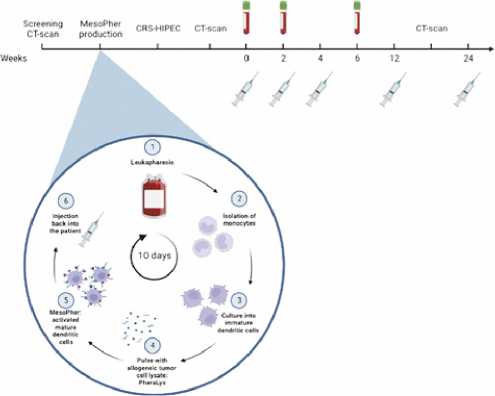
Рисунок 14. Дизайн исследования MESOPEC
шествующее хирургическое лечение не оказали явного влияния на отдаленные результаты. Индекс перитонеального канцероматоза не показал значимости в выборе объема лечения.
Медиана общей выживаемости в экспериментальной группе не была достигнута, 5-летная ОВ составила 92,7%, что на сегодняшний день является самым высоким показателем по сравнению с другими методами лечения (рис. 13).
И если все дело в правильном выборе лекарственного компонента для в/б и в/в введений, то почему не коснуться вопроса о клеточной терапии в этом направлении?
АДЪЮВАНТНАЯ ИММУНОТЕРАПИЯ ДЕНДРИТНЫМИ КЛЕТКАМИ:ИССЛЕДОВАНИЕ MESOPEC
Иммунотерапия дендритными клетками — это относительно новое направление в онкологии, когда создается индивидуальная вакцина, которая учитывает генетические особенности опухоли у конкретного человека. Представлены результаты исследования из Нидерландов открытого одноцетрового исследования II фазы по изучению адъювантной дендритноклеточно-основанной иммунотерапии после циторедукции с внутрибрюшинной гипертермической химиотерапией у пациентов с мезотелиомой брюшины. Дизайн исследования представлен на рис. 14.
В исследование вошло 18 пациентов в возрасте от 30 до 75 лет (средний возраст 59 лет), мужчин 14 (78%), женщин 8 (22%), только с эпителиоидным гистотипом и уровнем ki67 от 1 до 70 (средний показатель 8%).
За 4–6 недель до планируемой операции проводился лейкоферез с забором моноцитов для дифференцировки в дендритные клетки с использованием специфических цитокинов. Аутологичные дендритные клетки (ДК), обработанные опухолевым лизатом (МезоФер) в виде вакцины
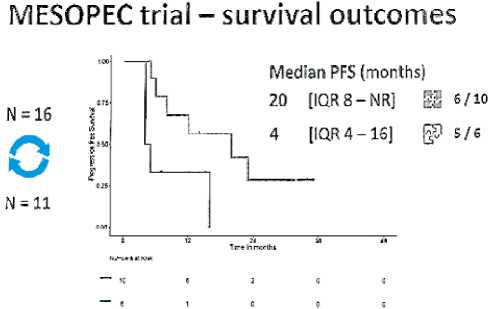
Рисунок 15. Кривые Каплан-Майера выживаемости без прогрессирования в исследовании MESOPEC в зависимости от радикальности операции
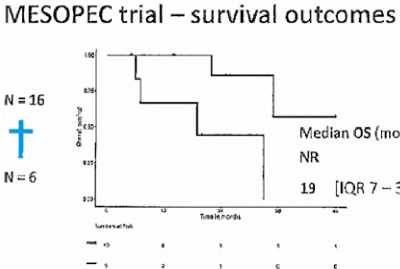
Рисунок 16. Кривые Каплан-Майера общей выживаемости в исследовании MESOPEC в зависимости от радикальности операции
2/10
вводили подкожно через 8–10 недель после операции с интервалом каждые две недели. После третьей инъекции МезоФера лечение завершалось. Ревакцинация проводилась через 3 и 6 месяцев.
Провести CRS + HIPEC удалось 16 пациентам, в 2 случаях интраоперационно заболевание признано нерезекта-бельным. В 10 случаях из 16 удалось выполнить радикальную операцию в объеме R0–1. Всем 16 пациентам после операции удалось провести адъювантную иммунотерапию ДК. За период наблюдения 48 мес удалось оценить результаты лечения у 11 пациентов из 16. Медиана выживаемости без прогрессирования составила 20 мес в случае радикальной операции и 4 мес — при нерадикальной, а медиана общей выживаемости составила 19 мес в группе пациентов при нерадикальной операции и еще не достигнута в группе полной циторедукции (рис. 15 и 16). Исследование продолжается.
РЕДКОЕ ИЗ РЕДКОГО: МЕЗОТЕЛИОМА TUNICA VAGINALIS TESTIS
Мезотелиома влагалищной оболочки яичка — одна из самых редких форм мезотелиом, менее 1 % всех локализаций. В настоящее время нет опубликованных рекомендаций по ее лечению, так как сложно изучать и разрабатывать методы лечения из-за редкости наблюдений. В медицинской литературе описано всего несколько сотен клинических случаев. Обобщенные данные наблюдений свидетельствуют, что средний возраст заболевших мужчин составляет 60 лет, медиана ОВ около 6 лет, 5-летняя ОВ 58%, а 10-летняя ОВ 45% [14].
Майкл Оффин из Мемориального онкологического центра имени Слоуна-Кеттеринга, Нью-Йорк, представил результаты своих наблюдений. За период с 1996 г. по 2023 г. было отобрано 33 пациента с морфологически подтвержденной тестикулярной мезотелиомой с целью анализа клинико-морфологических характеристик, особенностей лечебной тактики и оценки выживаемости. Характеристика пациентов представлена в табл. 3.
Наиболее частыми симптомами болезни были гидроцеле (n=11), боль и отек мошонки (n=16). Хирургическое
Таблица 3. Характеристика пациентов с мезотелиомой влагалищной оболочки яичка из Мемориального онкологического центра им. Слоуна-Кеттеринга, Нью-Йорк
Характеристика пациентов с мезотелиомой яичка (п-33)
Средний возраст (диапазон) 62 (24-93)
[ Статус курения
Курят/ бывшие курильщики (медиана 17 (20) начка/лет)
Никогда не курили 16
Связь с асбестом (по мнению пациента) 9
Гистологический тип
Эпителиоидный 16
Бифазный 11
Саркомэтоидный 2
Нс ясен тип 4
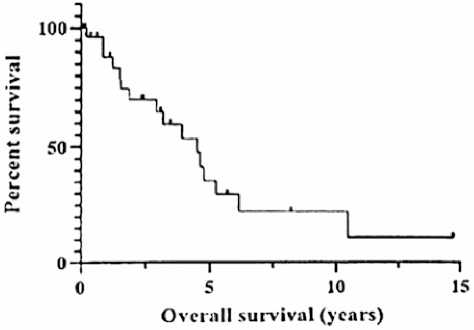
Median OS: 4.5yrs (range 0.1-14.7yrs)
Median follow up: 5.7yrs
Рисунок 17. Общая выживаемость 33 пациентов с мезотелиомой влагалищной оболочки яичка лечение в объеме орхиэктомии получили 91 % пациентов (n=30), у 2 пациентов диагностирован диссеминированный опухолевый процесс и 1 пациент потерян для наблюдения. Дополнительная паховая или забрюшинная лимфодис-секция была выполнена в 42% случаев (n=14), 4 пациента от предложенного удаления лимфоузлов отказались.
Медиана наблюдения составила 5,7 лет. Не смотря на радикальную операцию в 61 % случаев (20/33) в различные сроки отмечено прогрессирование болезни в виде отдаленных метастазов: легкие, печень, паховые и забрюшинные л/у. В дальнейшем пациенты получали различные режимы лекарственной терапии в 1–6 линиях. Схемы лекарственной терапии были таким же как при лечении мезотелиомы плевры. Медиана общей выживаемости составила 4,5 года (диапазон 0,1–14,7 лет) (рис. 17)
К сожалению, не представлены данные о пациентах с первоначально метастатическим заболеванием, об адъювантной лимфодиссекции или лучевой терапии на регионарные лимфоузлы и, конечно, об адъювантной системной химиотерапии. Это предмет для дальнейших дискуссий.
Выводы: результаты лечения МБ и мезотелиомы яичка остаются неудовлетворительными. Полнота циторедукции при МБ с дополнительной гипертермической внутрибрюшинной химиотерапией с дополнительной сочетанной в/в и в/б химиотерапией остаются наилучшим подходом, однако пациенты для этого ультрарадикального метода лечения должны быть тщательно отобраны.
Пемерексед на сегодняшний день является наилучшим препаратом как для в/в, так и для внутрибрюшинного введения, но особенности его фармакокинетики требуют многократного повторения его внутрибрюшинного введения. К сожалению, технология интраперитонеального доступа сложна и не является рутинной для большинства практикующих врачей, поэтому должна проводиться только в крупных центрах, имеющих опыт подобных процедур.
Список литературы Мезотелиома редких локализаций. Лучшее по материалам конференции iMig2023
- Huang J., Chan S.C., Pang W.S., et al. Global Incidence, Risk Factors, and Temporal Trends of Mesothelioma: A Population-Based Study. J Thorac Oncol 2023;18(6):792-802. https://doi.org/10.1016/j.jtho.2023.01.095
- Offin M., Yang S-R., Egger J., et al. Molecular Characterization of Peritoneal Mesotheliomas. J Thorac Oncol 2022;17(3):455-460. https://doi.org/10.1016/j.jtho.2021.09.012
- Leblay N., Lepretre F., Le Stang N., et al. BAP1 Is Altered by Copy Number Loss, Mutation, and/or Loss of Protein Expression in More Than 70% of Malignant Peritoneal Mesotheliomas. J Thorac Oncol 2017;12:724-733. https://doi.org/10.1016/j.jtho.2016.12.019
- Testa J.R., Cheung M., Pei J., et al. Germline BAP1 mutations predispose to malignant mesothelioma. Nat Genet 2012;43(10):1022-1025. https://doi.org/10.1038/ng.912
- Valenzuela C.D., Solsky I.B., Erali R.A., et al. Long-term survival in patients treated with cytoreduction and heated intraperitoneal chemotherapy for peritoneal mesothelioma at a single high-volume center. Ann Surg Oncol 2023;30(5):2666-2675. https://doi.org/10.1245/s10434-022-13061-3
- Beal E.W., Srinivas S., Shen C., et al. Conditional survival following cytoreductive surgery with hyperthermic intraperitoneal chemotherapy for peritoneal surface malignancies: an analysis from the US HIPEC Collaborative. Ann Surg Oncol 2023;30(3):1840-1849. https://doi.org/10.1245/s10434-022-12753-0
- Ettinger D.S., Wood D.E., Stevenson J., et al. NCCN Clinical Practice Guidelines in Oncology: Mesothelioma: Peritoneal. Version 1.2023. Accessed May 1, 2023. To view the most recent version, visit https://www.nccn.org
- Kusamura S., Kepenekian V., Villeneuve L., et al. Peritoneal mesothelioma: PSOGI/EURACAN clinical practice guidelines for diagnosis, treatment and follow-up. Eur J Surg Oncol 2021;47(1):36-59. https://doi.org/10.1016/j.ejso.2020.02.011
- Jacquet P., Sugarbaker P.H. Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis. In: Sugarbaker PH, editor. Peritoneal carcinomatosis: principle s of management. Boston, MA: Springer; 1996. pp. 359-374.
- Yan T.D., Deraco M., Elias D., et al. A novel tumor-node metastasis (TNM) staging system of diffuse malignant peritoneal mesothelioma using outcome analysis of a multi-institutional database. Cancer 2011;117(9):1855-63. https://doi.org/10.1002/cncr.25640
- Morris M.C., Cloyd J.M., Hays J., Patel S.H. The Role of Hyperthermic Intraperitoneal Chemotherapy for Non-colorectal Peritoneal Surface Malignancies. J Gastrointest Surg 2021;25(1):303-318. https://doi.org/10.1007/s11605-020-04771-8
- Sugarbaker P.H., Chang D., Jelinek J.S. In 100 patients with malignant peritoneal mesothelioma, concerning CT features predicted outcome of treatment. Eur J Surg Oncol 2021;47(9):2212-2219. https://doi.org/10.1016/j-ejso.2021.04.012
- Sugarbaker P.H., Chang D. Long-term regional chemotherapy for patients with epithelial malignant peritoneal mesothelioma results in improved survival. Eur J Surg Oncol 2017;43(7):1228-35. https://doi.org/10.1016/j.ejso.2017.01.009
- Nazemi A., Nassiri N., Pearce S., Daneshmand S. Testicular Mesothelioma: An Analysis of Epidemiology, Patient Outcomes, and Prognostic Factors. Urology 2019;126:140-144. https://doi.org/10.1016/j.urology.2019.01.009


