Миастения с ранним и поздним началом заболевания
Автор: Романова Т.В., Повереннова И.Е.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Неврология
Статья в выпуске: 2 т.12, 2016 года.
Бесплатный доступ
Цель: проверка гипотезы о существовании двух клинически различных групп больных миастенией с разным возрастом начала заболевания на большой популяции пациентов с помощью методов многомерной группировки. Материал и методы. Анализировали показатели 444 пациентов, включенных в регистр больных миастенией Самарской области, длительность заболевания которых составила более 1 года. Статистическая обработка результатов исследования проводилась с использованием многомерной группировки методом кластерного анализа. Проверка качества классификации осуществлялась с использованием дискриминантного анализа. Результаты. Переходный возраст между двумя группами был определен в 40 лет. Наиболее существенные критерии различия групп пациентов с началом до 40 лет и после 40 лет: пол пациента и наличие гиперплазии тимуса. Заключение. Полученные клинико-иммунологические паттерны миастении с ранним и поздним началом заболевания могут служить основой формирования модели прогноза течения миастении и создания алгоритма ведения пациентов.
Возраст начала, гиперплазия тимуса, клинико-иммунологический паттерн, миастения
Короткий адрес: https://sciup.org/14918308
IDR: 14918308
Текст научной статьи Миастения с ранним и поздним началом заболевания
-
1Введение. Миастения относится к аутоиммунным болезням нервной системы. При этом заболевании нарушается нервно-мышечная передача. Патогенез болезни связан с образованием аутоантител к целому ряду антигенных мишеней нейромоторного аппарата [1–3]. В последние годы отмечен рост числа больных миастенией во всех возрастных группах [4, 5]. Число больных миастенией в мире ежегодно увеличивается на 5-10% [4]. Распространенность миастении в популяции колеблется от 4 до 39,5 случаz на 100000 населения [5, 6].
На протяжении последних десятилетий ведется активный разнонаправленный поиск новых подходов к лечению миастении, основанный на углубленном изучении различных аспектов этиологии, патогенеза и клинико-эпидемиологических особенностей заболевания [2, 6, 7]. В настоящее время доказана патогенетическая неоднородность миастении [2, 6, 8].
В литературе, посвященной классификационным подходам к миастении, утвердилось разделение на миастению с ранним началом и миастению с поздним началом [7, 9, 10]. Два варианта заболевания, по мнению большинства авторов, имеют различные клинико-иммунологические паттерны и, возможно, отличаются ответом на терапию. Ранний и поздний варианты заболевания отличаются по гендерному составу, частоте встречаемости глазных форм миастении, степени тяжести генерализованной формы, преобладанию бульбарных симптомов, распространенности серонегативной по антителам к ацетилхолиновым рецепторам (АХР) формы болезни, наличию изменений тимуса [9–11]. Однако среди исследователей до сих пор нет единой точки зрения по поводу возрастной границы раннего и позднего варианта течения болезни. Большинство ученых склоняются к мнению, что граница дебюта заболевания должна определяться возрастом 40–50 лет [9, 11].
Цель : проверка гипотезы о существовании двух клинических групп больных миастенией с ранним и поздним возрастом начала заболевания на большой популяции пациентов с помощью методов многомерной группировки.
Материал и методы. В Самарской области на базе областной клинической больницы им. В. Д. Се-
редавина с 1999 г. работает областной миастенический центр. К 2009 г. был создан электронный регистр больных миастенией Самарской области. Данный регистр позволяет быстро вносить, изменять и обрабатывать информацию, а также осуществлять длительное наблюдение за большой группой больных. К настоящему моменту база данных содержит информацию более чем о 500 пациентах. Данное исследование основано на анализе показателей 444 пациентов, включенных в регистр, длительность заболевания которых составила более одного года.
Среди обследованных больных было 317 женщин (71,4%) и 127 мужчин (28,6%). Длительность заболевания к моменту анализа составила от 1 года до 45 лет, средняя продолжительность 8,8±7,6 года; для мужчин 7,3±6,3; для женщин 9,4±8,0 года.
Верификация диагноза осуществлялась на основании клинического обследования, прозериновой пробы, исследования нервно-мышечной передачи, определения титра антител к АХР, компьютерной или магнитно-резонансной томографии средостения и гистологического исследования вилочковой железы в случаях проведения тимэктомии.
Статистическая обработка результатов исследования проводилась в операционной системе Windows XP с использованием программы Microsoft Excel, Statistica 10.0 и SPSS 16.0. Проверка выборки на нормальность распределения осуществлялась несколькими способами с использованием критериев, включенных в пакет Statistica 10.0 и SPSS 16.0. Распределение выборки соответствует нормальному.
Средние значения показателей представлены co стандартными ошибками (М±m). Предположение о существенности различий пациентов по «возрасту начала» проверяли с помощью многомерной группировки методом кластерного анализа (мера близости — евклидова метрика; иерархическое объединение кластеров проводили методом Уорда). Проверка качества классификации осуществлялась с использованием дискриминантного анализа.
Результаты. Первоначально проверялась гипотеза о существовании двух групп пациентов, различающихся по возрасту начала заболевания, и определялся «переходный» возраст. Была построена гистограмма распределения всей популяции больных по возрасту начала заболевания (рис. 1).
Как демонстрирует график, популяция больных разделилась на две подгруппы с пиками заболева-
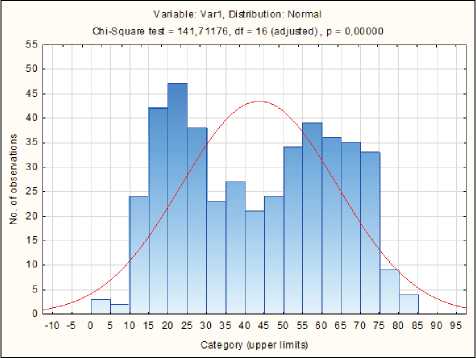
Рис. 1. Гистограмма распределения пациентов по возрасту начала заболевания емости в 20–25 лет и 55–60 лет. В период от 40 до 45 лет отмечается значительный спад частот, причем наибольшее снижение приходится на возраст 40 лет. Таким образом, было получено предварительное подтверждение гипотезы о том, что возраст 40 лет является границей разделения двух клинических форм болезни. Проверка гипотезы была проведена с помощью статистических методов: кластерного и дискриминантного анализа, методов непараметрической статистики.
Сложность кластерного анализа заключается в том, что реальные объекты (в данном случае пациенты) являются многомерными, то есть описываются не одним, а несколькими параметрами. В нашем исследовании мы выбрали следующие параметры, которые могут иметь значение для кластеризации пациентов: возраст начала заболевания, пол, форма заболевания (глазная, генерализованная), первые симптомы болезни, изменения тимуса, максимальная тяжесть заболевания, выраженность бульбарных симптомов. Общий объем выборки 444 человека; кластеризация включила 416 пациентов, имеющих все данные по анализируемым параметрам. Параметр «антитела к ацетилхолиновым рецепторам» исключен из критериев кластеризации, поскольку данный показатель имелся не у всех пациентов, но в дальнейшем мы добавили его в описание кластеров.
Логика кластерного анализа состоит в том, что число кластеров заранее не задается, а определяется эмпирическим путем, исходя из представления о мере близости объектов друг к другу. В решении этой задачи помогает графическое представление классификации в виде дендрограммы (дерева объединения). В результате расчетов и анализа дендрограммы выборка оказалась разбита на два больших кластера. Данные кластеры имели наибольшие различия по средним характеристикам и показали са-
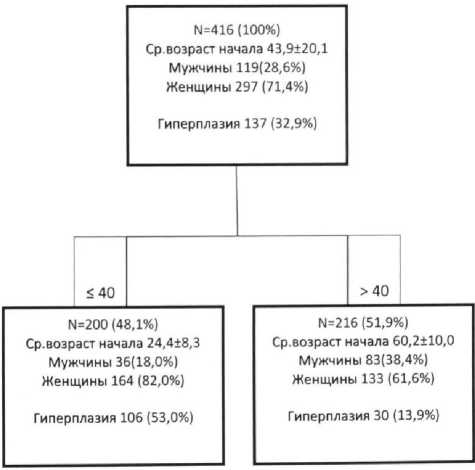
Рис. 2. Классификация пациентов по возрасту начала миастении мые важные факторы, по которым произошло разделение на кластеры.
Для более детальной проверки качества классификации и выявления «вклада» отдельных факторов в различия пациентов по возрасту применен дискриминантный анализ. В анализ были введены основные параметры, относящиеся к состоянию больного, чтобы выяснить, какие из них наиболее различаются у пациентов указанных групп. Результаты дискриминации представлены в табл. 1.
В первом столбце итоговой таблицы приведены значения статистики «лямбда» Уилкса, являющиеся важным результатом включения данной переменной в модель (интервал возможных значений от 0 до 1). Чем больше значение λ, тем более желательно присутствие этой переменной в процедуре дискриминации. В результате построения дискриминационной функции значимыми оказались два параметра: пол пациента и гиперплазия тимуса. Это означает, что именно они являются решающими факторами различий возраста начала миастении до 40 лет и после 40 лет.
Рассмотрены характеристики полученных кластеров. На рис. 2 показана классификация пациентов по возрасту начала миастении.
Кластер 1 вместил в себя 200 больных с возрастом начала до 40 лет включительно. Средний возраст начала миастении составил 24,4±8,3 года. Кластер 2 состоял из 216 пациентов, заболевших в возрасте 41 года и старше. Средний возраст начала заболевания был 60,2±10,0 лет.
Таблица 1
Итоговые показатели дискриминантного анализа пациентов по возрасту начала заболевания
|
N = 416 |
Discriminant Function Analysis Summary 2 grps Wills’s Lambda: 77332 approx. F (2,413) = 60,530 p < 0,0000 |
|||||
|
Wills’s Lambda |
Partial Lambda |
F-remove (1,413) |
p-valid |
Toler |
1-Toler (R-Sqr) |
|
|
Пол |
0,82468 |
0,93771 |
27,4328 |
0,00000 |
0,99326 |
0,00673 |
|
Гиперплазия |
0,94337 |
0,81937 |
90,8192 |
0,00000 |
0,99326 |
0,00673 |
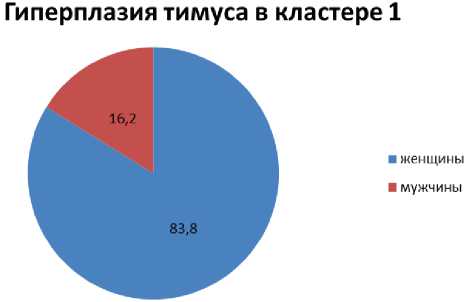
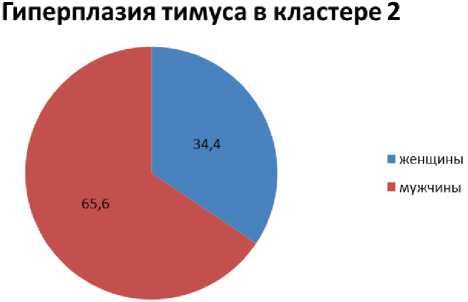
Рис. 3. Соотношение пациентов с гиперплазией тимуса по полу в кластерах
Первым значимым фактором разделения кластеров явилось соотношение пациентов по полу внутри кластера. У пациентов с ранним началом заболевания соотношение М:Ж составило 1:4,6, а в группе пациентов с поздним началом 1:1,6.
Вторым значимым фактором явился характер изменений тимуса. В группе с ранним началом заболевания изменения тимуса выявлены у 71,5% больных. Гиперплазия тимуса встречается более чем у половины пациентов (в три раза чаще, чем тимомы). В группе с поздним началом миастении изменения тимуса выявлены только у 39,8% больных, при этом тимома встречалась в два раза чаще, чем гиперплазия тимуса.
Представляет интерес распределение по полу среди пациентов с гиперплазией вилочковой железы в каждом кластере (рис. 3).
При раннем начале миастении гиперплазия тимуса встречалась почти исключительно у женщин, в то время как при начале заболевания после 40 лет большую часть пациентов с гиперплазией тимуса представляли лица мужского пола. При рассмотрении соотношения пола пациентов с наличием тимомы обнаруживается сходная закономерность в обоих кластерах, характерная для всей популяции больных миастенией: соотношение женщин и мужчин представлено как 3:1.
Количество пациентов с глазной формой миастении в кластере 1 составило 12,5%, в кластере 2-13,9%. В отношении генерализованной формы заболевания между кластерами существовали расхождения по максимальной тяжести проявлений миастении. Кластер 1 — это более легкая по тяжести течения заболевания группа. В ней преобладают легкая и среднетяжелая формы заболевания (72,1 %). В кластере 2 преобладают среднетяжелая и тяжелая формы, доля которых составила 61,8%. Средневзвешенная степень максимальной тяжести в кластерах заметно отличается (соответственно 2,75 и 3,28). Тем не менее, модальным значением в обоих кластерах является среднетяжелая миастения (37,2% в кластере 1 и 38,2% в кластере 2). Выраженность бульбарных симптомов в кластерах также существенно различается. Так, в кластере 1 клинически значимые бульбарные симптомы отмечены у 46,9% больных, в кластере 2 — у 69,3%.
По характеру первых симптомов кластеры также имеют существенные различия. Доминирующий удельный вес принадлежит глазным, бульбарным и скелетным симптомам. Во втором кластере значительно выше удельный вес дебюта, проявляющегося глазными симптомами. В первом кластере значимо чаще, чем во втором, отмечено начало заболевания с общей слабостью и утомляемостью.
Редкие варианты дебютных симптомов, такие как миастенический криз, внезапные падения, изолированные дыхательные расстройства и слабость мышц шеи, значительно чаще отмечены в кластере 1. Здесь их общая доля составляет 9,0%, а в кластере 2-1,9%. Во втором кластере вообще не были отмечены такие варианты дебюта, как внезапные падения и изолированная слабость мышц шеи.
По характеру течения и темпам нарастания симптомов также можно отметить различия. У пациентов с ранним началом по сравнению с группой позднего начала заболевания отмечено больше эпизодических форм (9,5 и 2,8% соответственно), меньше прогрессирующих и злокачественных форм миастении (25,0 и 36,3%), чаще представлено течение по типу «обострение — ремиссия» (24,0 и 18,5%). К моменту
Таблица 2
Клинико-иммунологические паттерны миастении с ранним и поздним началом заболевания
|
Показатель / группа |
Начало до 40 лет |
Начало после 40 лет |
|
М: Ж |
1: 4,6 |
1: 1,6 |
|
Изменения тимуса (%) |
71,5 |
39,8 |
|
Гиперплазия: тимома |
3:1 |
1: 2 |
|
Начальные симптомы |
Общая слабость и утомляемость |
Поражение экстраокулярных мышц |
|
Бульбарные нарушения (%) |
46,9 |
69,3 |
|
Доминирующая тяжесть заболевания (%) |
Легкая + среднетяжелая 72,1 |
Среднетяжелая + тяжелая 61,8 |
|
Ср. титры АТ к АХР (нмоль/л) |
13,7 |
15,8 |
|
Ремиссия заболевания (%) |
33,0 |
10,6 |
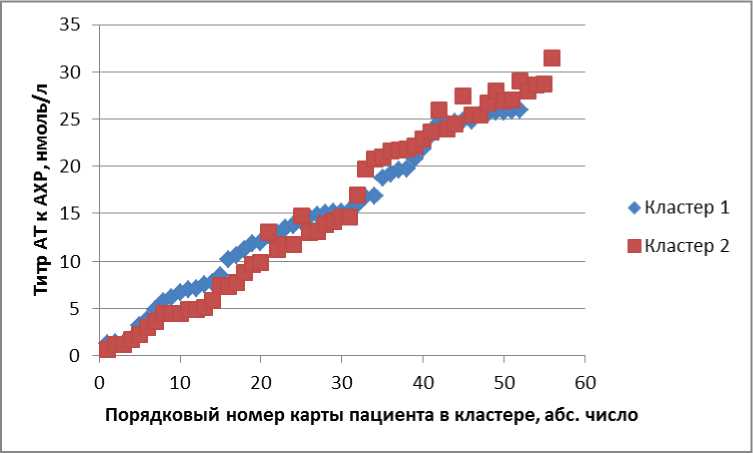
Рис. 4. Распределение пациентов по титрам антител к АХР в кластерах
анализа пациенты из группы с ранним началом в три раза чаше находились в состоянии ремиссии (33,0 и 10,6%), в два раз реже находились в состоянии декомпенсации и прогрессирования заболевания (6,0 и 15,3%). Различия кластеров по основным клиникоиммунологическим характеристикам представлены в табл. 2.
Последний параметр — титр антител к АХР — был исключен из классификации, но добавлен в описание кластеров. В кластере 2 его значения в среднем больше, чем в кластере 1: половина пациентов имеют антитела к АХР выше 15,2 нмоль/л. Во втором кластере 12,5% пациентов имеют значения титра антител к АХР больше, чем максимальное значение в кластере 1. Среднее значение в кластере 2 составило 15,8±8,6 нмоль/л, в кластере 1–13,7±8,1 нмоль/л. Также во втором кластере разброс значений данного показателя более широкий: от 0,6 до 31,5 (в первом кластере от 1,3 до 26,1), как это видно на рис. 4.
Серонегативные по антителам к АХР формы миастении в первом кластере составили 9,6%, во втором 5,4%.
Обсуждение. Предположение о существовании двух клинически различающихся групп пациентов с ранним и поздним началом заболевания проверено на нашей популяции больных с помощью методов многомерной группировки. Переходный возраст между двумя группами определен в 40 лет. Наиболее существенными критериями различия группы пациентов с началом до 40 лет и после 40 лет являлись пол пациента и наличие гиперплазии тимуса. Получены клинико-иммунологические паттерны раннего и позднего вариантов заболевания с возрастной границей дебюта в 40 лет.
Для миастении с началом заболевания до 40 лет характерны следующие особенности: женский пол; гиперплазия тимуса; начало заболевания со слабости и утомляемости любой группы мышц, но чаще с общей скелетной слабости; более легкое доброкачественное течение; меньшая представленность бульбарных нарушений и частоты глазной формы миастении; средние титры антител к АХР; меньшая вероятность злокачественного прогрессирующего течения; большее число благоприятных исходов лечения и достижения ремиссии.
Миастения с началом после 40 лет имеет сглаженные гендерные особенности, изменения тимуса встречаются у трети пациентов, при этом гиперплазия тимуса характерна для мужчин; начало болезни чаще всего с глазных и бульбарных симптомов; доминирование бульбарных нарушений у большинства больных; высокие титры антител; часто прогрессирующее, достаточно тяжелое течение; во многих случаях недостаточная эффективность терапии.
Заключение. Полученные клинико-иммунологические паттерны миастении с ранним и поздним началом заболевания могут служить основой формирования модели прогноза течения миастении и создания алгоритма ведения пациентов с целью достижения наилучшего результата в каждом конкретном случае.
Список литературы Миастения с ранним и поздним началом заболевания
- Ланцова В.Б., Сепп Е.К. Антигенные мишени при миастении. Иммунология и аллергия 2004; 5 (1): 196-198
- Meriggioli MN, Sanders DB. Autoimmune myasthenia gravis: emerging clinical and biological heterogeneity. Lancet Neurol 2009; 8 (5): 475-490
- Vincent A. Autoantibodies at the neuromuscular junction -link to the central nervous system. Re Neurol (Paris) 2014; 170 (10): 584-586
- Пономарева E.H. Миастения: Клиника, патогенез, дифференциальная диагностика, тактика ведения. Минск: МЕТ, 2002; 175 с.
- Романова Т.В. Эпидемиологическое исследование миастении гравис в Самарской области. Саратовский научно-медицинский журнал 2012; 1 (08): 91-95
- Romi F, Gilhus NE, Aarli JA. Myasthenia gravis: clinical, immunological and therapeutic advances. Acta Neurol Scand 2005; 111 (2): 134-141
- Санадзе А.Г. Миастения и миастенические синдромы. М: Литтерра, 2012; 255 с.
- Санадзе А.Г. Миастения. В кн.: Аутоиммунные заболевания в неврологии: клин. рук. М.: РООИ Здоровье человека, 2014; с. 101-128
- Akaishi Т, Yamaguchi Т, Suzuki Y, et al. In sightsinto the classification of myasthenia gravis. PLoS One 2014; 9 (9):e106757.
- Barbaud A, Carlander B, Pagns M. Late onset forms of myasthenia gravis. Comparison with early-onset myasthenia gravis. Rev Neurol 2006; 162 (10): 990-996
- Chan KH, Cheung RT, Mak W, et al. Nonthymoma early-onset-and late-onset-generalized myasthenia gravis: a retrospective hospital-based study. Clin Neurol Neurosurg 2007; 109 (8): 686-691.


