Миелопротективная эффективность комбинации производных пиримидина и 3-ги-дроксипиридина при антибластомной химиотерапии в эксперименте
Автор: Сипров А.В., Масягин В.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Фармакология
Статья в выпуске: 3 т.11, 2015 года.
Бесплатный доступ
Цель: сравнительный анализ влияния раздельного и комбинированного использования производных пиримидина и 3-гидроксипиридина — ксимедона и мексидола на количественные показатели костномозгового кроветворения и периферической крови у крыс с карциномой Walker-256 при химиотерапии доксорубицином и паклитакселом. Материал и методы. Эксперименты выполнены на 83 крысах-самках линии Wistar массой 150-250 г. Доксорубицин в дозе 4 мг/кг и паклитаксел в дозе 6 мг/кг вводили внутрибрюшинно на 11-е сутки эксперимента. Ксимедон и мексидол вводились раздельно и в комбинации друг с другом в дозах 100 и 50 мг/ кг соответственно, начиная с 11-х суток опыта, в течение 10 дней. Оценивали изменения в миелограммах и периферической крови на 14-е и 22-е сутки эксперимента. Результаты. Ксимедон эффективнее мексидола восстанавливал дифференцировку клеток гранулоцитопоэза и снижал выраженность эритроцитопении на 14-е сутки опыта. Комбинация ксимедона и мексидола эффективнее их раздельного применения ускоряла дифференцировку гранулоцитов, что сопровождалось более эффективным увеличением числа нейтрофилов в периферической крови. К 22-м суткам, несмотря на рост числа полихроматофильных нормоцитов в костном мозге, количество эритроцитов в крови не отличалось от такового при раздельном применении препаратов. Заключение. Миелопротективный эффект ксимедона превосходит таковой у мексидола. Комбинация ксимедона и мексидола эффективнее их раздельного применения ускоряет дифференцировку гранулоцитов.
Доксорубицин, ксимедон, мексидол, миелопротективный эффект, паклитаксел
Короткий адрес: https://sciup.org/14918131
IDR: 14918131
Текст научной статьи Миелопротективная эффективность комбинации производных пиримидина и 3-ги-дроксипиридина при антибластомной химиотерапии в эксперименте
1Введение. Современная высокодозная противоопухолевая химиотерапия практически всегда сопровождается развитием токсических осложнений, среди которых наиболее частым является миелосупрессия. Частота миелотоксичности увеличивается по мере проведения курсов антибластомной химиотерапии [1], что требует системы обеспечения их переносимости путем применения препаратов сопровождения [2]. Для купирования нейтропении при проведении антибластомной химиотерапии применяются препараты колониестимулирующих факторов. Однако они приводят к выбросу в периферическую кровь большого числа клеток миелоидного ряда, в том числе незрелых, что вызывает опустошение костного мозга в течение 2–3 дней после инъекции [3]. Кроме того, применение этих препаратов сопровождается осложнениями в виде гипертермических реакций, гриппоподобного синдрома и болей в костях [4]. Существенным фактором, сдерживающим применение препаратов колониестимулирующих факторов, является их высокая стоимость. В качестве препарата сопровождения химиотерапии применяют дикарба-мин, уменьшающий нейтропению и сокращающий сроки восстановления лейкопоэза [5], однако не корригирующий анемию и тромбоцитопению. Доказано уменьшение глубины и постлучевой лейкопении при использовании дикарбамина в эксперименте [6]. В борьбе с анемией у онкологических больных, получающих противоопухолевую химиотерапию, используют препараты рекомбинантного эритропоэтина. Однако существует определенная настороженность в отношении безопасности их использования в связи с данными, свидетельствующими об уменьшении выживаемости больных, получавших такие препараты, а также увеличением риска тромбоэмболических осложнений [7]. Использование препаратов железа при анемии может быть ассоциировано с активацией свободнорадикальных реакций с усилением ток- щитного действия одновременно на разные ростки кроветворения. Известно, что в значительной мере миелотоксичность цитостатиков связана с активацией свободнорадикальных реакций, поэтому изучение миелопротекторной эффективности средств с антиоксидантной активностью патогенетически обосновано. В проведенных ранее исследованиях показано миелопротекторное действие производных 3-гидрок-сипиридина в отношении разных ростков кроветворения при введении алкилирующих цитостатиков и доксорубицина [9]. Возможности ксимедона, обладающего антиоксидантной активностью и способностью стимулировать регенераторные процессы как миелопротектора при антибластомной химиотерапии остаются малоизученными. Наличие у ксимедона антиоксидантного эффекта в сочетании с регенераторным позволяет считать включение данного препарата в схему лечения патогенетически обоснованным. Не изучена миелопротективная эффективность комбинированного применения ксимедона и мексидола.
Цель: сравнительный анализ влияния раздельного и комбинированного использования производных пиримидина и 3-гидроксипиридина — ксимедона и мексидола на количественные показатели костномозгового кроветворения и периферической крови у крыс с карциномой Walker-256 при химиотерапии доксорубицином и паклитакселом.
Материал и методы. Эксперименты выполнены на 83 крысах-самках линии Wistar массой 150–250 г разводки питомника НЦБМТ «Столбовая». Экспериментальные животные содержались в стандартных условиях вивария Мордовского государственного университета при естественном световом режиме на стандартной диете, свободном доступе к воде и пище. Все манипуляции с животными проводились в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страс-
Таблица 1
Дизайн исследований
бург, 1986). Суспензию клеток карциномы Walker-256 (W-256) (106 клеток в растворе Хенкса) перевивали под кожу хвоста. Животные были распределены на 7 групп. Дизайн исследований представлен в табл. 1.
Исследование проводили на 14-е и 22-е сутки эксперимента. По 6–7 животных из каждой группы в указанные сроки выводили из опыта под общей анестезией тиопенталом натрия (50 мг/кг). В пери- ферической крови при помощи гематологического анализатора PCE-90Vet (High Technology Inc., США) оценивали количество эритроцитов и лейкоцитов. У животных выделяли костный мозг из бедренной кости и на предметном стекле готовили мазок костного мозга. Фиксацию, окраску препаратов проводили по Паппенгейму — Крюкову. Исследование миелограмм проводилось методом световой микроскопии. Все показатели выражались в процентах.
При статистической обработке результатов исследования определяли показатели средних арифметических значений (М), стандартных ошибок средних арифметических (m). Нормальность распределения проверяли с использованием теста Колмогорова — Смирнова. При условии соответствия нормальности распределения достоверность полученных различий сопоставляемых величин оценивали с использованием t-критерия Стьюдента. При несоответствии нормальности распределения достоверность различий оценивали с использованием U-критерия Манна — Уитни. Различия считали достоверными при p<0,05.
Результаты. У животных 1-й (контрольной) группы в клеточном составе костного мозга к 14-м суткам эксперимента отмечалось уменьшение содержания сегментоядерных нейтрофилов на 43% по отношению к исходному показателю интактных крыс (р<0,05). У животных 2-й группы (с ДР) отмечалось достоверное снижение содержания метамиелоцитов на 53% и полихроматофильных нормоцитов на 89% в сравнении с интактными крысами (табл. 2).
При этом в периферической крови развивалась лейкопения за счет лимфопении и моноцитопении и эритроцитопения (табл. 3).
В 3-й группе (с ДР+ПТ) в костном мозге крыс регистрировалось статистически значимое увеличение уровня бластных форм в 8,5 раза и уменьшение содержания метамиелоцитов на 81 %, а также палочкоядерных и сегментоядерных нейтрофилов на 77,5 и 79% соответственно по отношению к интактным крысам. Содержание полихроматофильных нормоцитов уменьшалось на 74%, количество лимфоцитов возрастало в 4,7 раза в сравнении с интактными животными (р<0,05, табл. 2). При этом в периферической крови усиливалась лейкопения: содержание нейтрофилов и лимфоцитов снижалось на 76 и 33% соответственно по отношению ко 2-й группе (р<0,01), количество моноцитов — на 80% по отношению к интактным крысам (см. табл. 3). Содержание эритроцитов также снижалось в большей степени (на 18,5%), чем в группе с монотерапией ДР.
В 4-й группе (с ксимедоном) в костном мозге крыс количество бластов в 3,4 раза достоверно превышало соответствующий показатель у интактных животных, содержание метамиелоцитов увеличивалось в 2 раза, а палочкоядерных и сегментоядерных нейтрофилов в 3,6 и 3,2 раза по отношению к 3-й группе животных. Содержание полихроматофильных нормоцитов сохранялось на уровне такового в 3-й группе животных. Количество лимфоцитов превышало исходный уровень в 3,8 раза (см. табл. 2). Со стороны периферической крови это сопровождалось достоверным увеличением числа нейтрофилов (в 2,5 раза), лимфоцитов (в 1,9 раза), моноцитов (в 3 раза) и эритроцитов (в 1,25 раза) по отношению к 3-й группе животных (см. табл. 3).
При введении мексидола (в 5-й группе животных) в костном мозге количество бластов превышало данный показатель интактных крыс в 4 раза, содержание метамиелоцитов увеличивалось в 2,9 раза в сравнении с 3-й группой (р<0,05). При этом количе-
Таблица 2
Изменения количественных показателей костномозгового кроветворения у крыс с карциномой Walker-256 при химиотерапии доксорубицином и паклитакселом в сочетании с ксимедоном и мексидолом
(14-е сутки опыта) (M±m)
|
Показатели, % |
Группы |
||||||
|
Интактные животные |
1-W-256 |
2-W-256 +ДР |
3-W-256 +ДР+ПТ |
4-W-256+ +ДР+ПТ+ +ксимедон |
5-W-256+ +ДР+ПТ+ +мексидол |
6-W-256+ +ДР+ПТ+ +мексидол+ +ксимедон |
|
|
Бласты |
0,7±0,1 |
1,0±0,2 |
1,5±0,5 |
6,0±1,7 р1,2,3<0,05 |
2,4±0,7 р1<0,05 |
2,8±0,8 р1<0,05 |
3,6±1,3 р1<0,05 |
|
Миелоциты |
7,6±0,9 |
7,8±1,3 |
6,8±2,0 |
5,8±2,1 |
6,1±1,5 |
9,6±1,0 |
9,8±2,5 |
|
Метамиелоциты |
8,1±1,1 |
6,8±1,2 |
3,8±0,6 р 1,2 <0,05 |
1,5±0,4 р1,2,3<0,05 |
3,0±0,3 р1,2,4<0,05 |
4,4±1,2 р 1,4 <0,05 |
6,5±1,5 р4<0,01 |
|
Палочкоядерные нейтрофилы |
11,6±0,8 |
9,8±1,2 |
12,2±1,6 |
2,6±1,0 р1,2,3<0,01 |
9,5±1,8 р4<0,01 |
5,5±1,1 р1,2,3<0,05 |
14,4±2,5 р 4,5 <0,05 |
|
Сегментоядерные нейтрофилы |
34,1±4,1 |
19,5±4,9 р1<0,05 |
47,4±3,8 р 1,2 <0,05 |
7,0±3,6 р 1,3 <0,01 |
22,8±4,0 р 3,4 <0,05 |
22,4±6,3 р3<0,01 |
32,4±4,2 р 3,4 <0,05 |
|
Нормоциты базофильные |
2,5±0,7 |
3,2±0,9 |
1,1±0,4 |
2,0±0,6 |
3,1±1,1 |
1,8±0,9 |
1,1±0,2 |
|
Нормоциты полих-ромато-фильные |
14,3±3,5 |
25,2±3,8 |
1,6±0,4 р 1,2 <0,01 |
3,7±0,5 р 1,2,3 <0,05 |
3,1±1,1 р 1,2 <0,05 |
6,2±2,7 р2<0,01 |
7,0±4,9 р2<0,05 |
|
Нормоциты оксифильные |
3,9±1,4 |
4,0±0,7 |
1,76±1,0 |
5,0±1,5 |
5,5±1,3 |
6,1±1,0 р3<0,05 |
2,1±0,8 р5<0,05 |
|
Моноциты |
2,1±0,4 |
2,0±0,2 |
6,6±1,5 |
2,1±0,5 р3<0,05 |
3,5±0,7 |
4,0±0,4 р 1,2,4 <0,05 |
5,5±0,9 р 1,2,4 <0,01 |
|
Лимфоциты |
7,1±2,9 |
6,6±1,1 |
6,0±1,2 |
33,6±9,1 р 1,2,3 <0,05 |
27,1±4,5 р 1,2,3 <0,01 |
23,8±6,2 р 1,2,3 <0,05 |
6,9±2,0 |
Примечание:р1 — достоверность различий рассчитана по отношению к интактным животным; р2 — к группе 1; р3 — к группе 2; р4 — к группе 3; р5 — к группе 4.
Таблица 3
Изменения количественных показателей периферической крови у крыс с карциномой Walker-256 при химиотерапии доксорубицином и паклитакселом в сочетании с ксимедоном и мексидолом (14-е сутки опыта) (M±m)
|
Показатели |
Группы |
||||||
|
Интактныежи-вотные |
1-W-256 |
2-W-256+ДР |
3-W-256+ +ДР+ПТ |
4-W-256+ +ДР+ПТ+ +ксимедон |
5-W-256+ +ДР+ПТ+ +мексидол |
6-W-256+ ДР+ПТ+ +мексидол+ +ксимедон |
|
|
Эритроциты (×1012) |
7,6±0,1 |
6,9±0,5 |
6,5±0,2 р1<0,01 |
5,3±0,3 р1,2,3<0,05 |
6,6±0,4 р 1,4 <0,05 |
6,1±0,3 р1<0,01 |
6,2±0,4 р1<0,01 |
|
Лейкоциты (×109) |
5,31±0,7 |
9,9±1,5 р1<0,05 |
4,0±0,3 р2<0,01 |
1,8±0,3 р1,2,3<0,01 |
3,7±0,5 р 2,4 <0,05 |
3,75±0,5 р 2,4 <0,01 |
5,1±0,7 р 2,4 <0,05 |
|
Нейтрофилы (×109) |
1,86±0,3 |
3,1±0,7 |
1,53±0,2 |
0,37±0,1 р1,2,3<0,01 |
0,95±0,2 р1,2,4<0,01 |
1,0±0,2 р 2,4 <0,05 |
1,9±0,3 р4,5,6<0,05 |
|
Лимфоциты (×109) |
3,3±0,5 |
6,5±1,1 р1<0,05 |
2,4±0,19 р2<0,01 |
1,4±0,2 р1,2,3<0,01 |
2,65±0,3 р 2,4 <0,05 |
2,7±0,3 р 2,4 <0,01 |
3,1±0,5 р 2,4 <0,05 |
|
Моноциты (×109) |
0,15±0,02 |
0,3±0,06 р1<0,05 |
0,07±0,02 р 1,2 <0,05 |
0,03±0,01 р 1,2 <0,01 |
0,1±0,03 р 2,4 <0,05 |
0,05±0,02 р 1,2 <0,05 |
0,1±0,03 р 2,4 <0,05 |
Примечание:р1 — достоверность различий рассчитана по отношению к интактным животным; р2 — к группе 1; р3 — к группе 2; р4 — к группе 3; р5 — к группе 4; р6 — к группе 5.
ство палочкоядерных нейтрофилов не отличалось от такового у животных 3-й группы и сохранялось ниже интактного показателя на 52%. Содержание сегментоядерных нейтрофилов, а также полихроматофильных нормоцитов не отличалось от такового как в 3-й группе крыс, так и у интактных животных (см. табл. 2). Количество моноцитов увеличивалось на 90%, лимфоцитов в 3,3 раза в сравнении с интактными крысами. При этом в периферической крови достоверно увеличивалось только число нейтрофилов (в 2,7 раза) и лимфоцитов (в 1,9 раза) в сравнении с 3-й группой крыс (см. табл. 3).
У животных 6-й группы (при комбинированном применении ксимедона и мексидола) количество бластов достоверно превышало таковое у интактных крыс в 5 раз, содержание метамиелоцитов, палочкоядерных и сегментоядерных нейтрофилов увеличивалось в 4, 5,5 и 4,6 раза по отношению к животным 3-й группы. Количество полихроматофильных нормоцитов не отличалось от такового как в 3-й группе крыс, так и у интактных животных (см. табл. 2). Содержание моноцитов увеличивалось в 2,6 раза. В периферической крови достоверно увеличивалось число нейтрофилов по отношению не только к 3-й группе, но и к группе с мексидолом (в 1,9 раза). Количество лимфоцитов и моноцитов возрастало в 2,2 и 3,3 раза по отношению к 3-й группе животных (см. табл. 3).
К 22-м суткам эксперимента в костном мозге животных всех экспериментальных групп количество бластных форм снижалось до исходного показателя интактных крыс. Содержание метамиелоцитов ниже исходного показателя интактных животных регистрировалось во 2-й группе (4,5±0,8%) и 4-й группе (с кси-медоном) (4,2±0,5%) (рисунок). Количество палочкоядерных нейтрофилов во всех экспериментальных группах не отличалось от такового у интактных крыс, равно как и сегментоядерных нейтрофилов, за исключением 1-й группы (содержание снижено на 58% в сравнении с интактными и составило 14,3±1,9) и 6-й группы (с ксимедоном в сочетании с мексидолом — содержание снижено на 52% в сравнении с интактными и составило 16,3±3,5) (р<0,05) (см. рисунок).
Содержание полихроматофильных нормоцитов в экспериментальных группах не отличалось от та- кового у интактных крыс, кроме 6-й группы: их количество увеличивалось по сравнению с интактными животными в 2 раза и достигало 31,4±4,2% (р<0,01). Одновременно с этим у животных в 3-й группе отмечалось достоверное уменьшение содержания количества оксифильных нормоцитов с 3,9±1,4 (у интактных) до 0,4±0,1 % (на 90%). В группах с ксимедоном, мексидолом и сочетанным введением ксимедона и мексидола содержание оксифильных нормоцитов достоверно увеличивалось в сравнении с 3-й группой и не отличалось от интактного показателя.
В периферической крови во всех экспериментальных группах развивался лейкоцитоз с нейтро-филлезом, моноцитозом и лимфоцитозом (кроме 5-й группы с ксимедоном, в которой содержание лимфоцитов не отличалось от крыс интактной группы). Достоверное увеличение количества эритроцитов по сравнению с 3-й группой животных отмечалось только в группе с мексидолом. В группе с ксимедо-ном число эритроцитов не отличалось одновременно как от исходного показателя интактных крыс, так и от значения у животных, получавших ДР+ПТ.
Обсуждение. Монотерапия ДР (во 2-й группе) приводила к повреждению гранулоцитарного и эри-
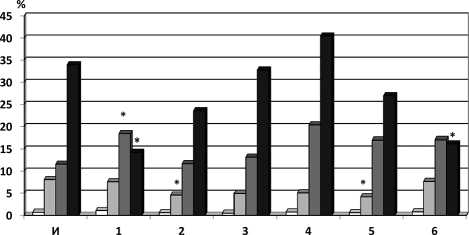
□ Бласты
□ Палочкоядерные нейтрофилы
□ Метамиелоциты
■ Сегментоядерные нейтрофилы
Изменения клеточного состава гранулоцитарного ростка кроветворения у крыс с W-256 при введении доксорубицина и паклитаксела в сочетании с ксимедоном и мексидолом Примечание: И — интактные; 1 — W-256 (контроль); 2 — W-256 +ДР, 3 — W-256 +ДР+ПТ; 4 — W-256+ДР+ПТ+ксимедон; 5 — W-256+ДР+ПТ+мексидол;
6 — W-256+ДР+ПТ+мексидол+ксимедон; * — достоверность различий при р<0,05 по отношению к интактным животным трокариоцитарного ростков кроветворения с развитием лейкопении и эритроцитопении, которые регистрировались уже на 14-е сутки эксперимента. Сочетанная химиотерапия ДР+ПТ (в 3-й группе) сопровождалась более выраженным угнетением дифференцировки молодых форм в зрелые в гранулоцитарном ростке кроветворения: достоверно более значимо снижалось количество метамиелоцитов, палочкоядерных и зрелых сегментоядерных нейтрофилов на фоне, вероятно, компенсаторного бластомогенного эффекта (в ответ на угнетение миелопоэза) и соответствующими изменениями в периферической крови. Угнетение эритропоэза, как и в группе с монотерапией ДР, регистрировалось на этапе образования полихроматофильных нормоцитов, а к 22-м суткам эксперимента — оксифильных нормоцитов. При этом на 14-е сутки эксперимента в периферической крови отмечалась более выраженная эритроцитопения, что может быть следствием повреждения самих эритроцитов.
Полноценным механизмом гемопоэтической репарации является ускорение деления кроветворных предшественников на фоне высокой интенсивности их созревания. Именно такие изменения на 14-е сутки эксперимента наблюдались в 4-й (с ксимедо-ном), 5-й (с мексидолом) и 6-й (с комбинацией кси-медона и мексидола) группах. При этом ксимедон эффективнее мексидола стимулировал дифференцировку созревающих клеток, хотя по коррекции общего содержания лейкоцитов в периферической крови оба препарата оказались сопоставимы. Однако максимальное ускорение процессов дифференцировки и более быстрое возвращение к исходным показателям миелопоэза отмечалось при сочетанном применении ксимедона и мексидола. Это сопровождалось и более эффективным увеличением содержания нейтрофилов в периферической крови по сравнению с раздельным применением препаратов. На фоне мексидола и его комбинированного применения с ксимедоном созревание эритроидных прекурсоров не отличалось от групп интактных крыс и животных, получавших ДР+ПТ (содержание полихроматофильных нормоцитов не отличалось от такового у интактных крыс и животных в 3-й группе), однако, вероятно, все же имел место неэффективный эритропоэз, поскольку в периферической крови сохранялась эритроцитопения, как и в 3-й группе. На фоне ксимедона, несмотря на сохранение снижения уровня полихроматофильных нормоцитов в костном мозге, количество эритроцитов периферической крови возрастало по сравнению с животными 3-ей группы, что согласуется с литературными данными о способности ксимедона увеличивать содержание эритроцитов в крови и повышать их устойчивость к разрушению [10].
К 22-м суткам в группах с ксимедоном, мексидо-лом и их комбинацией происходит восстановление основных параметров костномозгового кроветворения, увеличивается содержание эритроцитов в периферической крови, при этом нормализация числа лимфоцитов отмечена только в группе с ксимедоном. В остальных группах регистрировался лимфоцитоз.
Заключение. Таким образом, ксимедон эффективнее мексидола восстанавливал дифференцировку созревающих клеток гранулоцитарного ростка гемопоэза, а также более эффективно снижал выраженность эритроцитопении. Сочетанное применение ксимедона и мексидола эффективнее их раздельного применения ускоряло процессы дифференциров- ки гранулоцитарных элементов и восстанавливало миелопоэз, что сопровождалось и более эффективным увеличением содержания нейтрофилов в периферической крови, но не имело преимуществ в реализации цитопротекторных свойств в отношении эритропоэза.
Список литературы Миелопротективная эффективность комбинации производных пиримидина и 3-ги-дроксипиридина при антибластомной химиотерапии в эксперименте
- Солнцева Ю.В. Частота миелотоксических осложнений адъювантной полихимиотерапии при раке молочной железы. Тюменский медицинский журнал 2014; 16 (2): 47-48
- Кинзирский А.С, Кинзирская Ю.А., Зиновьев А.И. Изучение влияния дикарбамина на эффективность цитостатической терапии у мышей с карциномой легких Льюис. Известия высших учебных заведений: Поволжский регион: Медицинские науки 2010; 16 (4): 44-49
- Трещалин И.Д., Бодягин Д.А., Переверзева Э.Р. и др. Модификация миелосупрессивного действия противоопухолевых цитостатиков с помощью перорального гематокорректора дикарбамина (экспериментальное исследование). Вопросы онкологии 2009; 55 (6): 769-774
- Иванова О.В. Применение дикарбамина в качестве гематопротектора при лекарственном лечении гемо-бластозов. Вопросы онкологии 2012; 58 (3): 416-419
- Королева И.А., Мочалова А.С. Применение препарата дикарбамин у больных, получающих химиотерапию на основе таксансодержащих схем. Вопросы онкологии 2011; 57 (2): 250-254
- Моисеева И.Я., Зиновьев А.И., Никишин С.А. и др. Изучение гематопротекторной эффективности дикарбамина в условиях экспериментального пострадиационного костномозгового синдрома. Вопросы онкологии 2012; 58 (1): 81-84
- Жуков H.B. Кому не показано назначение эритропоэзстимулирующих препаратов. Клиническая онкогематология 2009; 2 (2): 176-184
- Кузин В. Б., Ловцова Л. В. Влияние препарата трехвалентного железа на перекисное окисление липидов в различных органах белых крыс. Казанский медицинский журнал 2011; 92 (2): 254-256
- Сипров А.В., Микуляк И.H., Кинзирская Ю.А. Антиоксиданты как средства снижения гематотоксичности химио-и лучевой терапии злокачественных опухолей. Пенза: Изд-во ПГУ, 2012. 298 с.
- Зобов В.В., Назаров Н.Г., Выштакалюк Г.Б. и др. Эффективность влияния новых производных пиримидина на физическую работоспособность крыс в условиях выполнения теста «плавание до отказа». Экология человека 2015; (1): 28-35


