Микробиоценозы приморских сообществ западного побережья Белого моря
Автор: Сидорова Наталья Анатольевна, Кравцова Алиса Денисовна, Сергиенко Людмила Александровна, Марковская Евгения Федоровна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 8 (161), 2016 года.
Бесплатный доступ
Обобщены результаты комплексных исследований микробиоценозов приливно-отливной зоны западного побережья Белого моря. Дана общая первичная характеристика микробиоты литорали: таксономическая характеристика наиболее распространенных видов микроорганизмов, численные характеристики их основных групп в зависимости от особенностей организации литорали и уровня загрязнения за счет стоков со стороны суши. Обосновано использование состояния прибрежной акватории (супралитораль и литораль) как перспективной территории для разработки системы мониторинга прибрежных экосистем.
Микробиоценозы, бактерии, литораль, мониторинг, белое море
Короткий адрес: https://sciup.org/14751127
IDR: 14751127 | УДК: 579.68
Текст научной статьи Микробиоценозы приморских сообществ западного побережья Белого моря
Всесторонний интерес к природным сообществам Белого моря продиктован многими причинами, в том числе возрастающим антропогенным прессом, меняющимся климатом и территориальной уникальностью. Белое море отличается от других полярных морей обширной зоной мелководий и специфическим гидрологическим режимом. Западное побережье имеет ряд особенностей, выделяющих его среди остальных территорий: заливы, бухты и заводи характеризуются специфической мезо- и микрогидродинамикой и формируют множество локальных ниш [2]. Несмотря на огромный фактический материал, накопленный к настоящему времени по состоянию морских и отчасти прибрежных экосистем Белого моря, отдельные компоненты природных сообществ Белого моря остаются сла-боизученными. Это касается фототрофного комплекса супралиторали и литорали и связанными с ними совокупностями популяций разных видов микроорганизмов, обитающих в этих биотопах. К особенностям прибрежной зоны как буфер- ной, экотонной зоны на стыке суша – море относится нестабильность условий: дважды в сутки происходит смена наземно-воздушной среды на водную, когда для обитающих в почвенном слое микроорганизмов аэробные условия сменяются на анаэробные. Известно, что на приморских территориях обитают разные формы микроорганизмов, как по типам метаболизма, так и по их экологическим особенностям [7]. Для прибрежной зоны особенно важно наличие факультативных микроорганизмов, сочетающих разные метаболические пути. Это свободноживущие в почвенном слое (ризосфера) или ассоциированные с корнями прибрежных растений микроорганизмы (ризоплана), которые являются неотъемлемым звеном любых экосистем, участвуют в процессах самоочищения водоема и имеют приоритетное значение для поддержания его гомеостаза. К настоящему времени известны работы, посвященные комплексу абиотических и биотических факторов, определяющих численность микроорганизмов в море [20], [25]. Согласно данным И. В. Перетрухиной [10], А. С. Саввичева,
И. И. Русанова, И. Т. Байрамова, С. А. Волошина [11], количество одноклеточных в Белом море может достигать 5 х 10 5 -6 х 10 6 кл/мл и более. Описана высокая биохимическая активность прокариот в условиях арктических территорий [9], доказана их способность к синтезу экзоферментов [24]. Изучены некоторые квантитативные показатели бактерий Белого моря [4], [14], обоснована их роль в аноксигенном и оксигенном фотосинтезе [7], а также в деструкции органического вещества морского и терригенного происхождения [11]. Имеются данные по характеристике эпифитиз-ма, свойственного микроорганизмам как наземных, так и водных растений [18], [21]. Однако при высокой значимости микроорганизмов для экосистемы Белого моря до сих пор отсутствуют единые методы учета свободноживущих и эпифитных бактерий, учитывающие специфику северных морей [10], [22], [23]. Остается открытым вопрос об их систематическом и метаболическом многообразии, экологической приуроченности и пространственном распределении на территориях, различающихся природными особенностями и антропогенной трансформацией биома.
Цель настоящей статьи заключается в первичной таксономической характеристике наиболее распространенных видов микроорганизмов, обитающих в составе микробиоценозов трех фрагментов западного побережья Белого моря.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Сбор проб для микробиологического анализа выполнялся в течение летних полевых сезонов 2013–2014 годов на прибрежной зоне в трех точках на западном побережье Белого моря, различающихся по геоморфологическому строению берега и его положению по отношению к открытой акватории моря, по экспозиции склона, литологическому составу основных пород, механическому составу почвогрунтов, степени загрязнения и размерам прибрежной зоны. На всех исследуемых территориях с разной степенью участия присутствовали доминантные виды прибрежных экотопов беломорского побережья – подорожник морской, триостренник морской, астра солончаковая, млечник морской. Во всех районах исследования были заложены разные по продолжительности трансекты, включающие зону литорали и супралиторали. На каждой трансекте выбраны 3 пробные площади (ПП): у линии уреза воды (ПП1), в средней части литорали (ПП2) и у коренного берега (ПП3) на супралиторали. На каждой пробной площади были взяты пробы грунта (по 3 повторности) в местах произрастания доминантных видов растений и в зоне их ризопланы.
1-я точка. Беломорский район, в черте города Беломорска. Место исследования расположено на первично расчлененном и мало измененном волновыми процессами берегу, с типичным послеледниковым характером сглаженности ландшафта. Скальными породами сложены супралитораль и верхний горизонт литорали. Микрорельеф неоднородный, с сильно затопляемым ваттовым участком литорали. На берегу выше супралиторали расположены хозяйственные строения, в радиусе 150–200 м есть грунтовые дороги, в 500 м от берега – асфальтированная дорога. Вблизи места исследования впадает городская речка с высоким уровнем загрязнения. Для гидрохимического режима реки отмечается незначительный дефицит насыщения кислородом, превышение содержания азота аммонийного (1,5 ПДК), ПДК по ХПК, Cu, Feобщ, БПК5, азоту аммонийному (см.: Государственный доклад о состоянии окружающей среды Республики Карелия в 2014 г. / Мин-во по природопользованию и экологии Республики Карелия. Петрозаводск, 2014. 272 с.). Пробы отобраны на трансекте длиной 30 м, которая включает илистую осушку с антропогенным загрязнением из стоков небольшого ручья, имеющего контакт со сточными водами городской больницы.
2-я точка. Беломорский район, поселок Расть-Наволок в 12 км к северо-западу от Беломорска, его окрестности характеризуются слабым антропогенным загрязнением. Побережье сложено монолитными выходами скальных пород (гранитогнейсов, гнейсогранитов) и характеризуется наличием заиленных и песчаных участков. Место исследования – эстуарная зона шириной 180 м, включает небольшое устье ручья, расширенное в сторону моря. Центральная часть марша – сла-бозаиленная депрессия, заросшая небольшими куртинами приморских растений. У уреза воды расположена песчано-илистая маршевая осушка, окаймленная каменисто-глыбовым валом, высотой до 40–60 см. Длина выбранной трансекты – 180 м.
3-я точка. Лоухский район, окрестности поселка Кереть, отличается минимальным антропогенным загрязнением. Керетская губа представляет собой небольшой залив, который также является эстуарием реки Кереть и характеризуется сложными гидрологическими явлениями. Основные работы были проведены на трансекте в губе Никольская. Губа Никольская является начальной стадией формирования меромиктического водоема, в котором практически отсутствует циркуляция воды между слоями различной минерализации, разделенными так называемым хемоклином, вследствие чего вода нижнего слоя более минерализованная и плотная, чем в верхнем слое. На восточном берегу губы Никольская с отмелым аккумулятивным берегом, субстрат – глина с песком и гравием, была заложена трансекта длиной 60 м.
Для изучения бактериального населения биоценозов в естественных условиях использовалось свойство микроорганизмов прикрепляться и расселяться по поверхности погруженных в почву и воду предметов [5]. Способность микроорганизмов к адгезии является основой метода обрастания стекол по Н. Г. Холодному, который применялся с целью определения распространения микроорганизмов, не растущих на обычных и даже на некоторых элективных питательных средах [8]. Стекла помещались в грунт литорали и непосредственно в зону корней прибрежных растений для учета ризосферных микроорганизмов на 1–7 суток в 3–4 повторностях. После окончания экспозиции до камеральной обработки пробы хранились в холодильнике.
Стекла обрастания для исследования микрофлоры закладывали на ПП всех трансект. Количественный учет бактерий, развивающихся в грунте на литорали в местах произрастания растений и на корнях растений в почве около корневой системы растения, проводился согласно рекомендациям Н. Красильникова и Е. Березовой, которые описаны в [16].
Камеральная обработка . Микробиологические исследования выполнялись в течение 2014–2016 годов на базе курса микробиологии и Института высоких биомедицинских технологий ПетрГУ. Бактериоскопический анализ заключался в определении доминирующих морфотипов, отдельные ассоциации фиксировались с использованием микрофотосъемок. Учитывая узкую норму реакции морской микрофлоры, большинство чистых культур выделялось с помощью элективных условий при концентрации NaCl от 2,5 до 3 % в двух модификациях: с добавлением и без добавления хлорида натрия. Бактериальный рост при концентрации NaCl, характерной для морской воды, служил маркером приуроченности микроорганизмов к морской среде обитания. Для изучения морфологических и цитологических особенностей микробных клеток готовили прижизненные и фиксированные препараты, окрашенные по Граму и Пешкову [15]. С помощью иммерсионного объектива микроскопа «Motic» при 90× увеличении проводилась первичная идентификация исследуемых видов бактерий. С использованием препарата «висячая капля» при 40 х увеличении микроскопа оценивалась способность клеток к движению.
В качестве диагностических признаков видов использовалась биохимическая активность микроорганизмов: наличие фосфолипаз, геминовых каталаз, протеаз и гемолизина. Лецито-витилазная активность бацилл учитывалась на желточно-солевом агаре (ЖСА) по феномену опалесценции питательной среды вокруг колоний Bacillus cereus, возникающему под действием фосфолипазы данного вида бацилл. Фосфолипаза контролирует расщепление лецитина яичного желтка до жирных кислот и фосфохолина и является важным диагностическим признаком Bacillus cereus [12]. Наличие каталаз учитывалось в реакции с 3 %-ным раствором Н2О2 по феномену газообразования. Способность гидролизовать крахмал оценивалась с помощью обработки агаровой пластинки раствором Люголя. Реакция считалась положительной, если среда, содержащая крахмал, окрашивалась в синий цвет, а зона гидролиза оставалась бесцветной [13]. На среде Хью-Лейфсона оценивалась способность бактерий окислять глюкозу до глюконовой кислоты в аэробных условиях. Для этого использовалось два пробирочных варианта среды: 1-й вариант содержал слой стерильного вазелинового масла («анаэробная пробирка»), 2-й вариант не содержал вазелинового масла («аэробная пробирка»). При положительной реакции наблюдалось изменение цвета среды во 2-м варианте [3]. Гемолитическая активность микроорганизмов оценивалась на 5 %-ном кровяном агаре (КА) по феномену гемолиза, который наблюдался через 24 ч. вокруг колоний бактерий, обладающих способностью к синтезу гемолизина. Для анализа таксономического разнообразия актиномицетов использовалась среда Гаузе, азотфиксаторов – среда Виноградского, протеолитических микроорганизмов – среда Ваксмана, а для выделения цел-люлозолитиков – среда Гетчинсона – Клейтона. Определение сульфатредукторов хемоорганогетеротрофов и хемолитогетеротрофов с механизмом окисления органических кислот до ацетата и окисления ацетата до СО2 осуществлялось на среде Ван-Дельдена. Культивирование проводилось в анаэробных условиях в высоких пробирках с резиновыми пробками. Использовалось три варианта среды с разными источниками углерода: ацетатом, цитратом и глюкозой. Фрагменты растений помещались в среду, которая термостатировалась при 21 °С в течении 48 ч. Присутствие сульфатредукторов учитывалось по почернению среды за счет накопления H2S. Таксономический анализ бактерий проводили с использованием определителя Берги [19], девятое издание.
Все данные по видовому составу микроорганизмов рассматривались в целом для трансекты и включались в общую статистическую обработку. При анализе количественного распределения видов в местах отбора проб рассчитывалась ошибка среднего. Статистическая обработка данных проводилась с использованием программ MS Excel и PAST3.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
Из 41 образца грунта литорали и корней макрофитов, отобранных в районе города Беломорска (17 проб), поселка Расть-Наволок (12 проб) и губы Никольской (12 проб), выделено и идентифицировано 5 родов микромицетов: Penicillium, Mucor, Fusarium, Alternaria, Trichoderma, – и 132 вида бактерий, отнесенных к 34 родам и 6 типам. Выделенные культуры соответствовали трем составляющим прибрежной экосистемы на литора- ли – водной микрофлоре, почвенной и эпифитной микрофлоре. На всех станциях отбора проб доминировали Proteobacteria, преимущественно классов α-, β- и γ-Proteobacteria, а также бактерии филогенетической группы CFB (Cytophaga – Flavobacterium – Bacteroidetes). Максимальное количество родов бактерий (20) отнесено к микрофлоре грунта литорали Беломорска (рис. 1), а минимальное (12) к микрофлоре грунта литорали Никольской губы (рис. 3). В составе микрофлоры грунта, отобранного в районе пос. Расть-Наво-лок, описано 19 родов бактерий (рис. 2). По совокупности морфофизиологических признаков доминировали сапротрофы с повышенным содержанием миколовых кислот в клеточной стенке (Arthrobacter, Corynebacterium, Nocardia). Близкое соотношение родов на 2 территориях Беломорского района может быть связано с антропогенной составляющей, которая и индуцировала дополнительный блок биоразнообразия. Доля ок-сигенных и аноксигенных фототрофов составила 9,2 %, хемолитотрофов – 9,7 %, целлюлозолити-ков – 13,9 %, протеолитиков – 8,9 %, углеводоро-докисляющих бактерий (в симбиозе с растениями) – 12,7 %, сульфатредукторов – 11,2 %, серных бактерий Beggiatoa, окисляющих восстановленные соединения S, – 9,3 %, свободноживущих и ризосферных азотфиксаторов – 11,4 % и 13,4 % соответственно (табл. 1–4). Все выделенные группы оказались почти равномерно представленными. Качественное и количественное разнообразие выделенных целлюлозолитических, протеолитических и углеводородокисляющих групп бактерий представлено в табл. 1. Более высокие значения численности по целлюлозолитическим и протеолитическим бактериям получены на приморской территории около Беломорска, что также может быть связано с уровнем загрязнения и большими значениями субстратов для жизнедеятельности этих бактерий. Их численность значительно меньше на двух других территориях, но около п. Расть-Наволок выше, чем в губе Никольской. Другая зависимость прослеживается для такой группы, как углеводородокисляющие бактерии, численность которых выше в губе Никольской, где основным субстратом их жизнедеятельности является естественный субстрат, вырабатываемый растениями приливно-отливной зоны, которые находятся с ними в симбиозе. Следует отметить, что углеводородокисляющие бактерии на всех станциях отбора проб формировали ассоциации исключительно в симбиозе с корнями прибрежных растений. Эти результаты дают основание для предположения, что высокий уровень загрязнения ингибирует симбиотические связи.
Количество бактерий рода Beggiatoa изменялось от 82 КОЕ/мл (Беломорск) до 274 КОЕ/мл (Расть-Наволок) (табл. 3). Представители рода способны синтезировать углеводы из углекис-
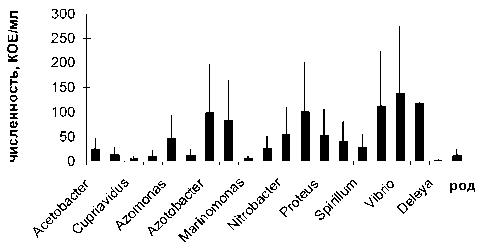
Рис. 1. Количественное и качественное разнообразие микробиоты на побережье (г. Беломорск)
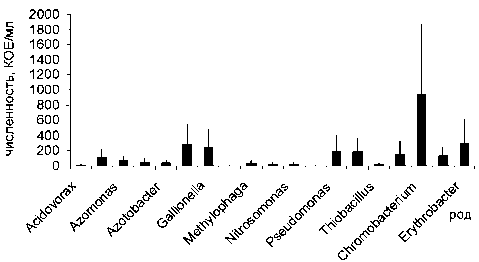
Рис. 2. Количественное и качественное разнообразие микробиоты на побережье (п. Расть-Наволок)
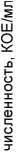
Рис. 3. Количественное и качественное разнообразие микробиоты на побережье (Никольская губа)
лого газа и воды с использованием энергии из неорганических соединений и, как правило, активно размножаются в загрязненных морских условиях, формируя белый нитевидный мат на поверхности воды. Эта группа бактерий оказалась с максимальными значениями численности на литорали около Расть-Наволока. Меньшие значения в губе Никольской можно связать с более низкими значениями антропогенного загрязнения, но еще более низкие значения в Беломорске свидетельствуют о существовании кроме загрязнения других факторов, которые участвуют в жизнедеятельности этой группы бактерий. Это может быть открытая акватория, где отмечаются более интенсивный обмен на литорали или низкие значения загрязнений, действующих на эту группу бактерий.
Таблица 1
Особенности выделенных групп целлюлозолитических, протеолитических и углеводородокисляющих бактерий
|
Культуральные признаки |
Численность, КОЕ/мл |
Наличие каталазы |
Подвижность |
Тип клеточной стенки/ Морфотип |
||
|
Беломорск |
Расть-Наволок |
Губа Никольская |
||||
Целлюлозолитические бактерии
|
1. Мелкие матовые колонии |
63 |
11 |
5 |
+ |
– |
Гр(–)/палочки |
|
2. Мелкие белые колонии |
47 |
16 |
13 |
– |
– |
Гр(–)/палочки |
Протеолитические бактерии
|
1. Крупные белые матовые колонии |
11 |
9 |
4 |
+ |
– |
Гр(–)/палочки |
|
2. Крупные белые глянцевые колонии |
53 |
7 |
3 |
+ |
– |
Гр(–)/палочки, эндоспоры |
|
3. Мелкие белые матовые колонии |
16 |
5 |
0 |
+ |
– |
Гр(–)/палочки |
|
4. Мелкие кремовые колонии |
23 |
3 |
0 |
+/– |
+ |
Гр(–)/палочки |
Углеводородокисляющие бактерии в симбиозе с макрофитами
|
1. Крупные матовые колонии |
17 |
6 |
39 |
+ |
– |
Гр(–)/палочки |
|
2. Крупные белые колонии |
42 |
12 |
27 |
+ |
– |
Гр(–)/палочки |
|
3. Точечные (карликовые) колонии |
59 |
36 |
42 |
+ |
– |
Гр(–)/палочки |
Таблица 2
Особенности роста сульфатредукторов на среде Ван-Дельдена
|
Состав среды Ван-Дельдена |
Численность, КОЕ/мл |
Морфотип |
||
|
Беломорск |
Расть-Наволок |
губа Никольская |
||
|
1. С цитратом |
34 |
54 |
26 |
Палочки |
|
2. С ацетатом |
11 |
27 |
11 |
Палочки, нити |
|
3. С глюкозой |
9 + СО 2 |
14 |
4 |
Палочки |
Таблица 3
Особенности бактерий рода Beggiatoa , окисляющих восстановленные соединения серы
|
Культуральные признаки |
Численность, КОЕ/мл |
Наличие каталазы |
Подвижность |
Морфотип |
||
|
Беломорск |
Расть-Наволок |
губа Никольская |
||||
|
Матовые слизистые образования на поверхности твердых субстратов |
82 |
274 |
147 |
+ |
Скользящее движение |
Гетерогенная группа, образуют трихомы до 30 мкм в длину и гормогонии |
Таблица 4
Особенности азотфиксаторов
|
Формы |
Численность, КОЕ/мл |
Морфотип |
||
|
Беломорск |
Расть-Наволок |
губа Никольская |
||
|
1. Свободноживущие |
41 |
27 |
12 |
Гр (+), эндоспоры клостридиального типа |
|
2. Ризосферные |
256 |
104 |
68 |
Гр (+), эндоспоры клостридиального типа |
В элективных условиях для азотфиксаторов выделены в чистую культуру две формы бактерий: свободноживущие – в количестве 80 КОЕ/ мл и ризосферные – в количестве 428 КОЕ/мл (табл. 4). По морфотипу и тинкториальным признакам выделенные микроорганизмы отнесены к анаэробным грамположительным палочкам, способным к спорообразованию клостридиального типа. Анализ показал, что ризосферных (симбиотических) азотфиксаторов почти в 4–5 раза больше, чем свободноживущих форм на всех исследуемых территориях. Эта закономерность хорошо известна и для наземных экосистем. Наибольшее количество азотфиксаторов (свободно-живущих и ризосферных) отмечено на пробных площадях приморской территории в Беломорске, в Расть-Наволоке их меньше в 2,3 раза, а в губе Никольской в 3,7. Соотношения ризосферных/ свободноживущих бактерий-азотфиксаторов показали, что в Беломорске симбиотических (ризосферных) организмов больше в 6,2 раза, в Расть-Наволоке в 4 раза, а в губе Никольской в 5,7 раза. Более высокий процент свободножи-вущей азотфиксирующей микробиоты в п. Расть-Наволок, возможно, связан с субстратом, который на литорали представлен заиленными участками – хороший субстрат для этой группы организмов. Согласно данным А. И. Коврижных [6], прижизненное выделение макрофитами большого количества легкоразлагаемых органических веществ и их освобождение в процессе отмирания растений создают оптимальные условия для обильного развития сапрофитной микрофлоры в составе ризосферы и обуславливают таксономическое разнообразие бактерий. В составе ризосферной микрофлоры описаны 3 группы микроорганизмов: аэробные гетеротрофы, суль-фатредукторы и азотфиксаторы, распространение которых зависело от вида растений. В этой группе организмов по морфологическим и тин-кториальным признакам доминировали граци-ликутные бактерии, которые на агаризованных средах давали матовые колонии различных форм и размеров. Однако в полевых условиях приливно-отливной зоны эти колонии неустойчивы, они могут легко и быстро перемещаться в пространстве и становиться субстратом не только для симбиотических, но и свободножи-вущих бактерий. Этот процесс активизируется при участии приливно-отливной динамики на приморских побережьях. В нашем исследовании было показано, что выделенные анаэробные азот-фиксаторы можно отнести к клостридиальному типу. Из литературы известно, что и в наземных экосистемах среди свободноживущих азотфикси-рующих микроорганизмов существенное место занимают анаэробные бактерии рода Clostridium [17]. В работах X. Зимни [27], [28] и И. Х. Войнова-Райкова [25] показано, что на численность и видовой состав бактерий рода Clostridium оказывает сильное влияние тип почвы.
ЗАКЛЮЧЕНИЕ
Проведенное исследование показало, что для западного побережья Белого моря характерно большое разнообразие микробиоты (бактерий, микромицет), которое имеет широкий спектр самых различных приспособлений. Этот результат отражает особенности побережья, которое имеет специфические ландшафтные и динамические гидрометеорологические характеристики и включает многочисленные эстуарные участки, которые связывают речные устья крупных рек Карелии (Выг, Кемь, Кереть) с открытым морем и водами Ледовитого океана. Особенностью этой территории является ее нестабильность, где «взаимодействие между живыми организмами и средой обитания изменяется в десятки, если не сотни раз быстрее, чем на остальном пространстве суши и воды» [1]. На приморских территориях дважды в сутки создаются анаэробные условия, при которых высокая активность анаэробных азотфиксаторов, поставляющих азот растениям, может стимулировать их функциональную активность. Однако и растения, имеющие подводный фотосинтез, высокая активность которого у высших сосудистых растений приливно-отливной зоны в период заливания сейчас активно обсуждается [22], могут стимулировать активность аэробной группы микробиоты. Эти взаимосвязи могут оказывать значимое корректирующее воздействие на жизнедеятельность биоты в условиях приливно-отливной динамики.
Указанные особенности дают основание для предположения, что в этих условиях могут доминировать не облигатные, а скорее факультативные микроорганизмы, активность которых может переключаться в ответ на контрастные изменения не только при смене сред (наземно-воздушная и водная), но и при ритмичных ежесуточных изменениях факторов среды. Сигнальные механизмы, включенные в ответные реакции этого ритмичного воздействия, могут представлять самостоятельный интерес.
Выявленное разнообразие и обилие бактерий и низших грибов в составе микробиоценозов приморских сообществ западного побережья Белого моря представляет большую теоретическую и практическую значимость. Полученные в настоящей работе данные о высокой чувствительности микробиоты приморской территории к антропогенному загрязнению (со стороны суши) свидетельствуют о перспективе использования этой территории для организации мониторинга загрязнения не только со стороны суши, но и со стороны моря. Выявленные закономерности в динамике и разнообразии свободноживущих и эпифитных микробных сообществ в последующих исследованиях позволят более точно прогнозировать изменения в структуре микробиоты, вызываемые как природными, так и антропогенными факторами окружающей среды.
* Работа выполнена при поддержке гранта Государственного задания Министерства образования и науки России (проект № 6.724.2014/к).
MARINE COMMUNITY MICROBIOCOENOSIS OF THE WHITE SEA WESTERN COAST
Список литературы Микробиоценозы приморских сообществ западного побережья Белого моря
- Адров Н. М. Климатологические основы концепции водных масс океаносферы//Вестник МГТУ. 2006. Т. 9. № 3. С. 458-462.
- Бек Т. А. Прибрежная зона в экосистеме Белого моря//Журнал общей биологии. 1990. Т. 51. № 1. С. 116-124.
- Быков А. С., Воробьёв А. А., Кривошеин Ю. С. Основы микробиологии, вирусологии и иммунологии. М.: Academia, 2001. 85 с.
- Галкина В. Н. Роль массовых видов животных в круговороте органических веществ в прибрежных водах северных морей: Автореф. дис.. канд. биол. наук. Л., 1985. 23 с.
- Инкина Г. А. Бактерии, ассоциированные с частицами взвеси, и бактериальные микроколонии в воде озер//Продукционно-гидробиологические исследования водных экосистем. Л.: Наука, 1987. С. 80-84.
- Коврижных А. И. Изучение процессов разложения остатков высшей водной растительности//Водные ресурсы. 1989. № 6. С. 110-115.
- Лунина О. Н., С авв ичев А. С., Ку знецов Б. Б., Пименов Н. В., Горленко В. М. Аноксигенные фототрофные бактерии стратифицированного озера Кисло-Сладкое (Кандалакшский залив Белого моря)//Микробиология. 2014. Т. 83. № 1. С. 90-108.
- Мельников В. Д., Жвачкина А. А. Водная микробиология/ПетрГУ Петрозаводск, 1975. С. 19-20.
- Мишустина И. Е., Щеглова И. К., Мицкевич И. Н. Морская микробиология: Учеб. пособие. Владивосток: Изд-во Дальневосточного ун-та, 1985. С. 179-181.
- Перетрухина И. В. Гетеротрофный бактериопланктон литорали Кольского залива и его роль в процессах естественного очищения вод от нефтяных углеводородов: Дис.. канд. биол. наук. Мурманск, 2006. 232 с.
- Саввичев А. С., Русанов И. И., Байрамов И. Т., Волошин С. А. Активность бактериальных процессов цикла серы в прибрежной полосе Кандалакшского залива Белого моря//V научная конференция Беломорской биологической станции МГУ: Материалы. М.: Изд. Беломорской биол. ст. Моск. ун-та, 1999. С. 52-54.
- Султанов З. З., Кулакова Л. С. Питательная среда для выделения Bacillus cereus. Патент № 2201965. 1965. 6 с.
- Султанов З. З., Кулакова Л. С., Перепелица Л. Г, Абдулганиева С. К. Селективная питательная среда для выделения Bacillus cereus//Микробиология. 2004. № 4. С. 74-76.
- Теплинская Н. Г. Бактериопланктон//Белое море. Биологические ресурсы и проблемы их рационального использования. Т. 1. СПб., 1995. С. 63-78.
- Теппер Е. З., Шильникова В. К., Переверзева Г И. Практикум по микробиологии. М.: Колос, 1972. С. 27-30.
- Федоров М. В. Руководство к практическим занятиям по микробиологии. М., 1951. С. 196-203.
- Шелли Шираджул Ислам. Почвенные анаэробные бактерии рода Clostridium: географическое распространение и азотфиксирующая активность: Автореф. дис.. канд. биол. наук. М., 1985. 24 с.
- Acinas S. G., Klepac-Cera j V., Hunt D. E. et. al. Fine -scale phylogenetic architecture of a complex bacterial community//Nature (G. Brit.). 2004. Vol. 430. № 6999. P. 551-554.
- Bergey’s manual of determinative bacteriology/Ed. by John G. Holt . 9th ed. Wiley, 1997.
- Carlucci A. F., Pramer D. Factors affecting the survival of bacteria in sea water//Appl. Microbiol. 1959. Vol. 7. № 6. P. 388-392.
- Hempel M., Blume M., Blindow I., Gross E. M. Epiphytic bacterial community composition on two common submerged macrophytes in brackish water and freshwater//BMC Microbiol. 2008. Vol. 8. № 58. P. 558-568.
- Мarkovskaya E. F., Kosobryukhov A. A., Morozova K. V., Gulyaeva E. N. Photosynthesis and anatomic-morphological characteristics of sea aster leaves on the Whyte Sea coast//Russian journal of plant physiology. 2015. Vol. 62. № 6. P. 830-836.
- Poindexter J. S. Oligotrophy: Feast and famine existence//Adv. Microbiol. Ecol. 1981. Vol. 5. P. 63-89.
- Semenov A. M. Physiological bases of oligotrophy of microorganisms and concept of microbial community//Microb. Ecol. 1991. Vol. 22. № 1. P. 239-247.
- Vognova-Raflkova J. In the specifity or rhizosphere microflore in Plant microbes relationships. Prague, Czechosi. Acad. Sci., 1963. P. 126-133.
- Zimny H. Badania nod wystepowanian Clostridium u globach lesnych//Ekol. Polska. 1960. Р. 311-321.
- Zimny Н. Badania nod wystepowenien Clostridium u globach lakowych//Ekol. Polska. 1961. Р. 303-311.


