Микробиологическая характеристика клинических штаммов бактерий рода Proteus, выделенных у больных хроническим остеомиелитом
Автор: Науменко З.С., Розова Л.В., Клюшин Н.М., Аранович А.М.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2003 года.
Бесплатный доступ
Проанализированы биологические особенности и частота выделения бактерий рода Proteus у больных хроническим остеомиелитом. В период 1982 - 2001 гг. у больных, лечившихся в отделении гнойной ортопедии РНЦ “ВТО”, выделено 1255 штаммов Proteus spp. В патологическом материале из остеомиелитического очага в начале 1980-х годов выделялись в основном “нероящиеся” О-формы протеев, составлявшие 92% от общего количества выделенных штаммов этих бактерий. С 1987 г. отмечается скачкообразное увеличение доли более вирулентных “роящихся” Н-форм и к настоящему времени 92-96,5% изолятов характеризуются феноменом “роения”. Происходит изменение структуры микроценоза, о чем свидетельствует смена доминирующего вида в грамотрицательном компоненте микрофлоры остеомиелитического очага. Установлено, что за указанный период частота выделения протея у больных снизилась на 29,7%, лидирующая позиция протея среди грамотрицательных микроорганизмов остеомиелитического очага сменилась преобладанием Pseudomonas aeruginosa. За указанный период не отмечено сокращения встречаемости протея у больных до начала лечения. Снижение частоты выделения протея, очевидно, обусловлено лечебными мероприятиями постоперационного ведения больных.
Хронический остеомиелит, микрофлора, феномен "роения"
Короткий адрес: https://sciup.org/142120638
IDR: 142120638
Текст научной статьи Микробиологическая характеристика клинических штаммов бактерий рода Proteus, выделенных у больных хроническим остеомиелитом
В результате селективного действия антибактериальных препаратов и других факторов происходят значительные изменения в структуре возбудителей гнойной хирургической инфекции. Возрос удельный вес различных грамотри-цательных бактерий – представителей семейства Enterobacteriaceae и группы неферментирующих бактерий [4, 8]. Среди грамотрицательных микроорганизмов большое значение имеют представители рода Proteus , которые в составе гноеродного бактериального сообщества усугубляют тяжесть гнойного процесса и способствуют отягощению инфекции, создавая условия для размножения одних возбудителей и подавления других [15].
Род Proteus – один из наиболее давно известных родов семейства Enterobacteriaceae. Первого представителя ( Bact. proteus vulgare ) выделил в 1885 г. Хаузер из гниющего мяса. Этот же исследователь предложил название рода, обусловленное способностью его представителей менять внешние проявления роста на твердых средах (в честь сына Посейдона – водяного божества Протея, способного менять свой облик).
Род образуют прямые подвижные палочки размерами 1-3х0,4-0,8 мкм. Протеям в наибольшей степени, по сравнению с прочими энтеробактериями, свойственен полиморфизм с образованием нитевидных и кокковидных (ин- волюционных) форм. Для бактерий характерен феномен “роения”, особенно выраженный на агаре меньшей плотности при температуре 20-22оС. При росте на плотных средах эти бактерии образуют концентрические круги, отражающие чередующиеся периоды роста и “роения”. У гигантских клеток (50-100 мкм) P. mirabilis, находящихся в стадии “роения”, число жгутиков возрастает в 50 раз и их количество на клетку достигает 1000. Характер работы жгутиков у гигантских клеток Proteus пока мало понятен. Такие протеи, по сравнению с другими жгутиковыми бактериями, плохо плавают, но хорошо перемещаются по влажной поверхности плотного субстрата [3].
Протеи широко распространены в природе. Их обнаруживают в кишечнике многих видов позвоночных и беспозвоночных животных, почве, сточных водах и разлагающихся органических остатках [7].
Все виды протеев относятся к группе условно-патогенных микроорганизмов, проявляющих негативное действие на организм при снижении противомикробной защиты. Для развития инфекции имеют значение вирулентные свойства бактерий. Важнейшими факторами патогенности протеев являются: фимбрии, бактериальные протеазы и уреаза, гемолизины, гемагглютинины и способность к “роению”.
Гемолизины, образующиеся у протеев в различные фазы роста, проявляют цитотоксическое действие на эпителий мочевого пузыря, моноциты человека. Са2+-зависимые гемолизины разрушают эритроциты, нейтрофилы, фибробласты человека.
Протеи образуют различные протеазы: одни разрушают структуру различных подклассов IgA и IgG, другие повышают проницаемость сосудов, третьи дезаминируют аминокислоты и действуют как сидерофоры. Способность к образованию уреазы является фактором патогенности, отличающим бактерии рода Proteus от других микроорганизмов. Бактерии разлагают мочевину в качестве источника энергии и образующийся хлорид аммония вызывает местное воспаление и повышение рН до значений, способствующих образованию кристаллов, камней и застою мочи.
У P. mirabilis выявлены фимбрии, вызаваю-щие агглютинацию эритроцитов человека и животных.
Способность к “роению” в разной степени характерна для всех видов Proteus. “Роящиеся” клетки характеризуются повышенным образованием протеаз, уреазы и гемолизинов. Счита- ется, что роящиеся бактерии – основная морфологическая форма, способная к адгезии (прилипанию) к паренхиме почечной ткани и эпителию мочевого пузыря, не “роящиеся”, палочковидные (так называемые “плавающие” клетки) обычно выделяют из различных гнойных и серозно-гнойных экссудатов [9].
В этиологии внутрибольничной инфекции основное значение имеют штаммы с множественной лекарственной устойчивостью. Кроме того, фактором, способствующим распространению протея при гнойных инфекциях, является не только его резистентность к антибактериальным препаратам, но и тормозящее влияние продуктов жизнедеятельности протея на другие бактерии и почти полная неспособность лейкоцитов крови фагоцитировать гноеродный протей [21].
По литературным данным, при бактериологическом обследовании ран у больных, оперированных по поводу хронических гнойных заболеваний, частота выделения представителей рода Proteus составляет 10-28% [5, 11, 19]. По наблюдениям Шляпникова и соавторов, P. mirabilis в 17% случаев является причиной генерализованных воспалительных процессов у больных в стационарах хирургического профиля [20]. Сведения о встречаемости протеев у больных хроническим остеомиелитом немногочисленны и противоречивы. По данным Тихо-деева и Маничевой, при гематогенном остеомиелите позвоночника протеи выделяются менее чем у 1% больных [16], при посттравматических гнойных ранах, по данным разных авторов, – у 19,6-27% [5, 11]. Никитин и соавторы [18], не указывая точных данных, отмечают, что в настоящее время из гнойных ран значительно чаще стал высеваться протей как в монокультуре, так и в ассоциации с другими микроорганизмами. Развитие остеомиелита приводит к увеличению по сравнению с нагноениями мягких тканей высеваемости Proteus spp. - в 11,5 раз (!), золотистого стафилококка – в 2 раза, синегнойной палочки – в 1,3 раза [14]. Данных многолетнего мониторинга частоты выделения протеев от больных хроническим остеомиелитом, леченных методом чрескостного остеосинтеза, в научной литературе нет.
В связи с изложенным выше цель настоящего исследования – характеристика частоты выделения и биологических особенностей клинических штаммов бактерий рода Proteus у больных хроническим остеомиелитом, леченных методом чрескостного остеосинтеза, за 20летний период наблюдений.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось на базе специализированного отделения гнойной травматоло- гии и ортопедии Российского научного центра “Восстановительная травматология и ортопе- дия” им. академика Г.А. Илизарова в 19822001 гг. Проанализировано 6464 пробы отделяемого из ран и свищей больных хроническим остеомиелитом. Выделено 1255 штаммов Proteus spp., которые послужили объектом исследования. Анализ микрофлоры проводили с использованием общепринятых методов. Выделение, родовую и видовую идентификацию бакте- риальных культур проводили согласно руководствам [6, 17]. Видовая идентификация в 2000 -2001 г.г. осуществлялась на бактериологическом анализаторе “ATB Expression” фирмы “Bio Merieux”. Спектр чувствительности к антибиотикам определяли методом диффузии в агар с использованием дисков и среды АГВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Из исследованных 6464 проб патологического материала в 671 пробе рост бактерий в аэробных условиях отсутствовал.
Поскольку среди представителей протея в гнойных ранах чаще встречается P. mirabilis , многие представители которого способны давать феномен «роения», возникла необходимость в усовершенствовании методики выделения бактерий. Это обусловлено тем, что протеи в “роящейся” Н-форме очень быстро распространяются по влажной поверхности агара, образуя налет (Hauch), который препятствует выделению и идентификации других микроорганизмов, вегетирующих в ране. Особенно актуальной эта проблема стала в середине 1980-х годов, когда наблюдалось резкое увеличение частоты выделения “роящихся” форм протея. Микробиологами были предложены различные питательные среды, подавляющие “роение” протея и обусловливающие их рост в неподвижной О- форме. В качестве ингибиторов “роения” применяют соли желчных кислот, высокие концентрации NaCl, мочевины [9].
Для выделения и получения чистых культур бактерий, обитающих в остеомиелитическом очаге вместе с протеем, нами были предложены две среды: 1) дифференциально-диагностическая среда (с использованием алкилсульфата, буры, глюкозы,основного фуксина, сернокислого натрия) для выделения при “роящейся” форме протея грамотрицательных бактерий семейства Ente-robacteriaceae и неферментирующих бактерий и 2) усовершенствованный кровяной агар (с добавлением хлорида натрия, этилового спирта и буры) для выделения грамположительных бактерий родов Streptococcus, Staphylococcus [17].
Использование предложенных питательных сред позволило выявить различные виды аэробных и факультативно-анаэробных микроорганизмов из остеомиелитического очага. Из 5793 проб было выделено 8977 штаммов бактерий. В микробном пейзаже ран и свищей превалировала кокковая микрофлора (57,8%), где культуры стафилококков составили 50,4% от общего числа выделенных штаммов. Реже выделялись гра-мотрицательные бактерии (37,2%), среди которых господствующее положение занимали протей и синегнойная палочка (14% и 13,4% соответственно).
По данным бактериологического обследования больных хроническим остеомиелитом, за 20 лет произошло значительное снижение частоты выделения бактерий рода Proteus . Так, если в 1982-1983 гг. протеи составляли 23,2% от всех выделенных штаммов микроорганизмов, то в
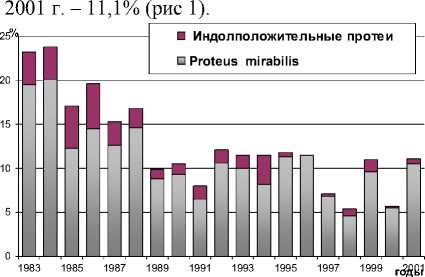
Рис. 1. Динамика выделения протеев из ран и свищей больных хроническим остеомиелитом относительно других микроорганизмов (в процентах от общего числа выделенных штаммов)
Подавляющее большинство культур (83,7%), выделявшихся в начале 1980-х годов, по комплексу признаков относилось к виду P. mirabilis . Кроме этого вида были выявлены индолполо-жительные протеи: P. morganii (7,6%), P. vulgaris (6,5%) и P. rettgeri (1,6%). Преобладание в патологическом материале P. mirabilis в этот период отмечалось и другими исследователями [2, 11, 12].
Наиболее низкий уровень выделения протеев относительно других микроорганизмов наблюдался в 1998 г. и 2000 г. (5,4% и 5,7% соответственно). Видовой спектр изолированных штаммов изменился незначительно: так же, как и 20 лет назад, среди выделенных штаммов преобладал P. mirabilis , однако удельный вес этого вида еще более возрос и составил 94%, одновременно снизилась частота встречаемости других видов ( P. vulgaris – 3% и P. penneri – 3%).
Сокращение протеус-инфекции в обследованном отделении гнойной ортопедии подтверждают и сравнительные данные по встречаемости этих бактерий у больных. В 1982 - 1983 гг. Proteus были обнаружены в 184 пробах из 467 исследованных, что составило 39,4%. Протей был изолирован у 47,3% лечившихся больных. К 2000-2001 гг. встречаемость протея значительно снизилась – протей был обнаружен в
19% исследованных проб у 17,6% больных.
Динамика выделения протеев на этапах лечения была следующей. В 1983 г. в предоперационный период протеи составляли 18,2% от числа выделенных штаммов, через месяц после операции – 13,3%, затем наблюдалось увеличение численности протеев до 30-32% с последующим снижением показателя до 20-22% и сохранением этой частоты выделения до 5-6 месяца после операции. Через 10 лет (1993 г.) выделение протеев в дооперационный период несколько снизилось и составило 14,5%, был отмечен подъем частоты выделения в первый месяц после операции до 23% и снижение высе-ваемости в 1,8 раза к четвертому месяцу [1, 13]. По результатам исследования 2000 г., протеи были выделены в 21,5% случаев в дооперацион-ный период, в 27% случаев – в первый месяц послеоперационного периода, в последующем происходило снижение выделяемости протеев в процессе лечения.
Таким образом, контрольные срезы динамики выделения протеев в процессе лечения с десятилетним интервалом позволяют выявить некоторые особенности. В начале 1980-х годов наблюдался подъем высеваемости протеев в послеоперационный период за исключением первого месяца. Наибольшая частота выделения протеев приходилась на 2-3 месяцы после операции, затем наблюдалось постепенное снижение высеваемости Proteus .
В течение последних 10 лет наблюдается другая динамика. Так же, как и в 1980-х годах, у пациентов (14,5-21,5%), поступающих в отделение на лечение, в ранах и свищах обнаруживаются протеи. Частота выделения протеев повышается в ранний послеоперационный период, что, по мнению многих исследователей [18], является следствием внутригоспитальной инфекции. В процессе лечения больных, ко 2-3 месяцу после остеосинтеза, наблюдается значительное снижение (в 1,5-2 раза) частоты выделения протеев у обследованных больных. Приведенные данные позволяют сделать заключение о том, что общее снижение частоты выделения протея в отделении гнойной ортопедии за рассматриваемый период обусловлено в большей мере проводимыми лечебными мероприятиями, но не сокращением встречаемости протеев у больных, поступающих в отделение на лечение.
Необходимо отметить, что удельный вес протеев в общей структуре микробиоценоза к четвертому-пятому месяцу нахождения больного в стационаре может возрастать, несмотря на абсолютное снижение количества выделенных штаммов. Это связано с тем, что в процессе лечения из микробного ценоза исчезают в первую очередь грамположительные микроорганизмы (стафилококки, преобладающие в остеомиели- тическом очаге, и стрептококки) как более чувствительные к действию антибиотиков и антисептиков. Остаются резистентные к лекарственным препаратам Pseudomonas aeruginosa и Proteus spp., причем из этих двух организмов протеи более устойчивы, что было продемонстрировано работами Л.А. Блатун и сотрудников по исследованию эффективности современных бе-талактамных антибиотиков при лечении гнойных ран кожи и мягких тканей [10].
По нашим наблюдениям, из ран и свищей больных хроническим остеомиелитом в начале 1980-х годов выделялись в основном “нероя-щиеся” О-формы протеев, составлявшие 92% от общего количества выделенных штаммов этих бактерий. В последующие годы отмечается неуклонный рост выделения “роящихся” Н-форм и к настоящему времени 92-96,5% изолятов характеризуются феноменом “роения” (рис. 2). В доступной нам литературе сведений о динамике выделения О- и Н-форм протеев в стационарах других профилей найти не удалось. Общее положение о том, что из гнойных ран выделяются в основном не “роящиеся” бактерии, на наш взгляд, устарело. Известно, что “роящиеся” протеи более вирулентны по сравнению с О-формой. По всей видимости, “роящиеся” формы являются и более устойчивыми в условиях стационара, у них быстрее формируется резистентность к антибиотикам и другим лекарственным препаратам.
1983 1985 1987 1989 1991 1993 1995 1997 1999 2001
Рис. 2. Динамика выделения бактерий рода Proteus в “роящейся” Н-форме у больных хроническим остеомиелитом (в % от числа выделенных штаммов протеев)
Имеющиеся у нас данные по антибиотико-чувствительности изолированных штаммов протеев подтверждают это предположение. Чувствительность к таким широко распространенным антибиотикам, как ампициллин, карбенициллин, гентамицин, линкомицин, левомицетин, тетрациклин, за обсуждаемый период наблюдений снизилась на 34-70%. Проведенные исследования показали, что бактерии рода Proteus, выделяемые у больных хроническим остеомиелитом, сохраняют высокую чувствительность к действию цефалоспоринов III поколения (цефотаксиму, цефтазидиму), амикацину и ципрофлокса- цину. В связи с этим представляется нецелесообразным применение антибиотиков «старого» поколения из-за риска инфекции, вызванной устойчивыми протеями, до получения данных микробиологического исследования у конкретного больного.
У обследованных больных хроническим остеомиелитом в настоящее время значительно сократились случаи выделения протеев в монокультуре. Так, если в 1988 г. протеи в монокультуре выделялись в 35% случаев, то в 2000-2001 гг. протеи встречались в основном в составе ассоциаций и лишь в 5,2% случаев были обнаружены монокультуры Proteus spp. (табл. 1).
Таблица 1
Частота выделения бактерий рода Proteus в монокультуре и в ассоциациях
|
1988 г. |
2000-2001 гг. |
||||
|
абс. |
% |
абс. |
% |
||
|
1. |
Монокультура Proteus |
35 |
34,0 |
3 |
5,2 |
|
2. |
Ассоциации Proteus + Staphylococcus |
43 |
41,7 |
27 |
46,6 |
|
3. |
Proteus + Pseudomonas |
12 |
11,6 |
13 |
22,4 |
|
4. |
Proteus + Streptococcus |
- |
- |
4 |
6,9 |
|
5. |
Proteus + Staphylococcus + Pseudomonas |
3 |
2,9 |
3 |
5,2 |
|
6. |
Proteus + Staphylococcus + Streptococcus |
- |
- |
1 |
1,7 |
|
7. |
Proteus + Pseudomonas + Streptococcus |
- |
- |
2 |
3,4 |
|
8. |
Proteus + Staphylococcus + Pseudomonas + Streptococcus |
5 |
4,9 |
1 |
1,7 |
|
9. |
Proteus + Pseudomonas + прочие |
- |
- |
1 |
1,7 |
|
10. |
Proteus + прочие |
5 |
4,9 |
3 |
5,2 |
|
Итого |
103 |
100 |
58 |
100 |
|
Как видно из данных, представленных в таблице, чаще других выявляются ассоциации протея со стафилококком - 41,7% (1988г.) и 46,6% (2000-2001гг.). Причем наиболее часто, как в 1988 году, так и в 2000-2001 гг. в протейных ассоциациях встречался Staphylococcus aureus -61,8% и 53,7% соответственно. На долю остальных стафилококков ( S. epidermidis, S. saprophy-ticus ) приходилось всего 13,2% (1988 г.) и 5,3% (2000-2001 г.). Затем по частоте выделения следуют бактериальные ассоциации, включающие наряду с протеем синегнойную палочку и стрептококки.
Нельзя не отметить, что к настоящему времени сократилось количество стафилококков, встречающихся в протейных ассоциациях, одновременно к 2000-2001гг. увеличилась частота выявления синегнойной палочки и стрептокок- ков (соответственно на 7,6% и 7,4%), что свидетельствует об изменении структуры микробиоценоза. Еще одним доказательством происходящих изменений является изменение соотношения частоты выделения двух наиболее клинически значимых видов грамотрицательных бактерий: P. mirabilis и Ps. aeruginosa (табл. 2). Как видно из представленных данных, в период наблюдений с 1982 по 1989 гг., протеи преобладали в общем количестве выделенных грамот-рицательных бактерий. Однако, начиная с 1990х годов, Proteus теряют доминирующую позицию, значительно уступая по количеству изолированных штаммов Ps. aeruginosa.
Таблица 2
Количество штаммов Pseudomonas aeruginosa и Proteus spp., выделенных у больных хроническим остеомиелитом (в процентах от общего числа выделенных штаммов)
|
Период наблюдений (годы) |
Микроорганизмы |
|
|
Pseudomonas aeruginosa |
Proteus spp. |
|
|
1982 – 1984 |
20 |
24 |
|
1985 – 1989 |
17 |
16 |
|
1990 – 1994 |
16 |
11 |
|
1995 – 1999 |
20 |
9 |
|
2000 – 2001 |
15 |
8 |
Таким образом, по результатам 20-летнего периода наблюдений, к 2000-2001 гг. из остеомиелитического очага у обследованных больных протей стал высеваться значительно реже как в монокультуре, так и в ассоциации с другими микроорганизмами, в отличие от данных, представленных в литературе [14, 18]. Наиболее частым представителем Proteus , высеваемым из ран и свищей, является P. mirabilis в “роящейся” Н-форме, обладающий повышенными патогенными свойствами и способностью самостоятельно вызывать гнойную хирургическую инфекцию, характеризующийся высокой резистентностью к действию антибактериальных препаратов. Результаты бактериологических исследований показали, что у больных хроническим остеомиелитом Proteus остается проблемным возбудителем, способствующим усугублению инфекции вследствие высокой устойчивости в условиях стационара. Вместе с тем значительного увеличения количества выделенных штаммов Proteus на этапах лечения не наблюдается. Применение метода чрескостного остеосинтеза способствует повышению бактерицидной активности тканей, проводимое лечение и работы по профилактике внутрибольничной инфекции не позволяют инфекции активизироваться.


