Микробиологические основы трансформации азот- и углеродсодержащих соединений в почвах урбанизированных территорий
Автор: Медведева Мария Владимировна, Мамай Анастасия Витальевна, Бахмет Ольга Николаевна, Мошкина Елена Викторовна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 3 (172), 2018 года.
Бесплатный доступ
Сообщается о результатах долгосрочных исследований микробной трансформации основных биофильных элементов в почвах урбанизированных районов. Исследования показали, что циклы углерода углерода и азота в городских экосистемах имеют как специфические, так и общие черты, характерные для почв невозмущенных лесных сообществ. Состав и структура микробного сообщества были в пределах естественного диапазона вариаций, характерных для почв в этой климатической зоне. Благодаря высокому информативному значению пула аминокислот и базальному дыханию почв они могут использоваться в качестве экологического индикатора. Диапазон вариаций микробного метаболического фактора можно рекомендовать как показатель ранней стадии нарушения почвенной системы и изменения качества окружающей среды. Данные могут быть использованы в качестве фона для мониторинга экологического городского почв в Восточной Фенноскандии.
Короткий адрес: https://sciup.org/14751425
IDR: 14751425 | УДК: 502.521+630*521.4(470.22) | DOI: 10.15393/uchz.art.2018.122
Текст научной статьи Микробиологические основы трансформации азот- и углеродсодержащих соединений в почвах урбанизированных территорий
Как известно, лесные экосистемы играют важную роль в поддержании и сохранении биологического разнообразия, снижают негативные проявления антропогенного воздействия на природу, стабилизируют происходящие биосферные процессы. Лесам принадлежит основная роль в регуляции круговорота биофильных элементов
(углерода и азота) в наземных экосистемах [14]. Усиление урбанизации является мощным драйвером изменения структуры и функционирования лесных экосистем, нарушения выполнения ими их экосистемных услуг. Почва – это не только главный компонент лесных сообществ, но и главная составляющая часть геотехсистемы. Изменение свойств почв на фоне урбанистического пресса
приводит к нарушению их экологической и рекреационной функций, а следовательно, обеспечению устойчивого развития городов [7]. Органическое вещество почвы имеет сложный химический состав, поэтому его отдельные соединения отличаются по устойчивости к микробиологическому разложению, по участию в биохимических процессах, значимости в трофических цепях. Микробная биомасса является более чувствительной к различным воздействиям и нарушениям, чем органическое вещество почвы в целом, поэтому, проводя детальную оценку микробного сообщества, можно исследовать свойства и статус микробоценоза, а также дать прогноз его дальнейшего формирования после снятия антропогенного пресса [11], [13]. Как известно, в почве запасы органического углерода велики, однако большая его часть является недоступной для микроорганизмов, так как находится в химически или физически защищенном состоянии [9]. На фоне антропогенного воздействия происходит изменение всех звеньев трофической цепочки, круговорота биогенных элементов. В этой связи проблема исследования сопряженных процессов микробиологической трансформации соединений азота и углерода почв естественных и антропогенно трансформированных экосистем является весьма актуальной.
Сотрудниками лаборатории лесного почвоведения Института леса КарНЦ РАН на основании многолетних исследований были выявлены особенности азотного режима лесных почв Карелии. В процессе работы было установлено, что круговорот элементов-биофилов определяется гидротермическими условиями, химическим составом почвообразующих пород, типом растительности, а также физико-химическими свойствами самих почв [3], [5], [6], [9]. На основании результатов многолетних исследований установлены закономерности накопления, динамики и трансформации азотных соединений в основных типах лесных почв. При этом было отмечено, что, несмотря на изменение содержания биогенных элементов в почвах на фоне урбанистического пресса, соотношение основных фракций в азотном фонде лесных почв характеризуется высокой стабильностью в зональном, временном и экологическом аспектах. При этом относительная стабильность азотного фонда лесных почв, сформировавшихся в различных условиях фитоценотической среды, определяет устойчивость характера биологического круговорота азота в лесных биогеоценозах [9]. Вместе с тем микробиологические аспекты круговорота азот- и углеродсодержащих соединений в почвах, находящихся в условиях урбанизации, не исследованы. В этой связи цель работы – дать количественную оценку отдельных компонентов круговорота азота и углерода почв, которые являются чувствительным индикатором состояния органического вещества почв и функционирования микробного сообщества. В соответствии с поставленной целью основными задачами исследования были: 1) изучить содержание, состав и структуру аминокислотного пула почв; 2) установить эколого-физиологические показатели микробного сообщества почв исследуемых биогеоценозов; 3) выявить возможные индикаторы качества почв, находящихся в условиях урбанистического воздействия.
Полученные данные комплексных исследований микробиально-биохимических показателей необходимы для целей урбоэкологического мониторинга, а также прогнозирования возможных изменений окружающей среды в условиях меняющегося климата.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена в среднетаежной подзоне Карелии. Ключевые участки были заложены на территории Петрозаводского городского округа (61°45-48'N; 34°14-28'E), а также заповедника «Кивач» (62˚12-17`N; 34˚00-08`E). Данные пробные площадки хорошо отражали характерные для данной территории лесорастительные условия, специфику физико-химических свойств почв, почвообразующих пород. Таксационное описание древостоев приведено в табл. 1.
Таблица 1
Таксационная характеристика объектов исследования
|
cd Л О m |
m cd о и |
cd cd^ ° я |
g А S cd s |
СУ О с |
cd "з cd |
S о |
Характеристика подроста и подлеска |
|
средние |
|||||||
Тип леса: Березняк злаково-разнотравный (Бк)
|
60 |
10Б едС |
0,81 |
20,5 |
24,0 |
247 |
I |
Подрост: ель, возраст 10–30 лет, h 1–3 м, 200 шт./га; подлесок: рябина, ольха серая |
|
Тип леса: Березняк черничный (Б1) |
|||||||
|
80 |
9Б 1Ос |
0,8 0,3 |
27,5 17,8 |
20,3 17,5 |
316 40 |
III |
Подлесок: рябина, h = 6 м, d = 3 см, густота 4,0 тыс. шт./га |
|
Тип леса: Березняк травяной (Б2) |
|||||||
|
40 |
10Б |
0,87 |
17,0 |
13,0 |
90 |
III |
Подрост: ель, h = 1,0 м, густота 0,13 тыс. т/га; подлесок: рябина, h = 8 м, d = 10 см, густота 0,25 тыс. шт./га |
На каждой пробной площади были заложены полнопрофильные почвенные разрезы, проведено морфологическое описание почв. Отбор образцов почв для анализа производили по генетическим горизонтам, в отобранных образцах определяли физико-химические свойства традиционными методами [1]. Названия почв с естественным сложением даны на основе региональной классификации [8]; для городских почв – классификации, предложенной учеными МГУ имени М. В. Ломоносова [7].
Березняк злаково-разнотравный (Бк) - контроль, заповедник «Кивач». Березовый древостой (10Б, ед. С), единично встречается сосна, осина, ольха серая, возраст древостоя 60 лет, Iа.8 класс бонитета. Почва - подзолистая грунтово-глеева-тая супесчаная на суглинках, переходящих в ленточные глины.
Березняк черничный (Б1) - район Птицефабрика. Березовый древостой (9Б10С), возраст 80 лет, III класс бонитета. Почва - дерново-подзолистая грунтово-глееватая супесчаная на грубопесчаной морене с большим количеством щебня и гальки.
Березняк травяной (Б2) – район Ключевая. Березовое насаждение (10Б), возраст 40 лет, III класс бонитета. Почва - индустризем. Отдельные физико-химические свойства почв приведены в табл. 2.
Таблица 2
Физико-химические свойства исследованных почв естественных и антропогенно трансформированных экосистем
|
Тип леса |
Горизонт, мощность, см |
Сорг |
Nобщ |
рНкс1 |
Объемный вес, г/см3 |
Гранулометрический состав, частицы/ мм/ % |
||
|
песок (1–0,05) |
пыль (0,05–0,001) |
ил (<0,001) |
||||||
|
Бк |
А0 (2) |
45,67 |
2,17 |
4,20 |
0,10 |
– |
– |
– |
|
А1А2 (6) |
1,69 |
0,15 |
3,79 |
0,76 |
71,90 |
23,10 |
5,00 |
|
|
А2 (4) |
0,53 |
0,03 |
3,87 |
0,97 |
76,40 |
20,80 |
2,80 |
|
|
B1 (7) |
1,27 |
0,11 |
4,38 |
1,41 |
72,90 |
24,30 |
2,80 |
|
|
B2 (11) |
0,46 |
0,03 |
4,29 |
1,60 |
41,60 |
54,20 |
4,20 |
|
|
B3g (40) |
0,27 |
– |
4,03 |
1,69 |
23,60 |
72,70 |
3,70 |
|
|
Б1 |
А0(1) |
36,22 |
0,73 |
5,41 |
0,08 |
– |
– |
– |
|
А1А2(9) |
9,48 |
0,44 |
4,12 |
0,96 |
57,60 |
28,30 |
14,10 |
|
|
Bf(16) |
8,48 |
0,17 |
4,18 |
1,35 |
47,40 |
46,50 |
6,10 |
|
|
В2g(20) |
1,57 |
0,01 |
4,24 |
1,58 |
– |
– |
– |
|
|
ВС(40) |
1,79 |
0,04 |
4,07 |
1,76 |
61,30 |
34,40 |
4,30 |
|
|
Б2 |
U0 (1) |
44,79 |
0,86 |
5,98 |
0,08 |
– |
– |
– |
|
U1d+U2h (15) |
4,43 |
0,19 |
6,36 |
1,19 |
60,80 |
30,40 |
8,80 |
|
|
U3a3 (25) |
2,71 |
0,01 |
7,73 |
1,63 |
76,30 |
17,30 |
6,40 |
|
|
U4a3 (40) |
4,29 |
0,36 |
7,64 |
1,98 |
54,60 |
36,70 |
8,70 |
|
В отобранных образцах почв определяли общий азот методом Кьельдаля, азот белковых аминокислот – методом жидкостной хроматографии. Субстрат-индуцированное дыхание (СИД) оценивали по скорости начального максимального дыхания микроорганизмов после обогащения почвы глюкозой [10]. Углерод микробной биомассы рассчитывали по формуле: Смик (мкг С/г почвы) = = С (мкл СО2/г почвы/ч) х 40,04 + 0,37 [13]. Базальное дыхание (БД) определяли по скорости выделения СО2 почвой за 24 часа ее инкубации при 22 °С и 60 % ПВ. Скорость БД выражали в мкг С-СО2 /г почвы/ ч. Микробный метаболический коэффициент (qCO2) рассчитывали как отношение скоростей выделения СО2 из необогащенной почвы (БД) и почвы, в которую внесен избыток глюкозы (СИД). Для расчета содержания азота в микробной биомассе использовали соотношение Nмик/Смик = 0,15 [11]. Содержание микробного углерода и азота рассчитывали как процент от общего содержания С и N соответственно. Определение видового состава микробного ценоза почв проводили молекулярным методом ГХ-МС [15].
Данные химического анализа были получены с использованием оборудования ЦКП «Аналитическая лаборатория» ИЛ КарНЦ РАН, лаборатории лесного почвоведения ИЛ КарНЦ РАН, лаборатории циклов углерода, азота ИФХ и БПП РАН, Отдела хроматографии НИИ физико-химической биологии имени А. Н. Белозерского МГУ. Полученные данные обработаны при помощи программы Microsoft Office Excel.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Основные физико-химические свойства исследованных почв показаны в табл. 2. Изучаемые почвы характеризовались легким гранулометрическим составом, средним содержанием обменных оснований и обедненностью биофильными элементами, что является характерным для почв среднетаежной подзоны Карелии [5]. Свойства почв, сформировавшиеся в условиях урбанизации, по сравнению с почвами заповедной территории, претерпевали заметные изменения. Выявили подщелачивание верхних горизонтов на 0,3–0,5 ед. рН, сокращение мощности лесных подстилок в 1,4-1,9 раза и увеличение плотности верхней части профиля почв в 1,1-1,5 раза. Нарушение физико-химических свойств на фоне урбанистического пресса стало триггером изменения биологического круговорота элементов-биофилов, отдельных звеньев трофоцепи. По общему содержанию и соотношению основных групп свободных аминокислот, а также по накоплению глутаминовой кислоты можно предположить о некотором изменении биологической активности верхних горизонтов почв в условиях урбанизации [6], [9]. Результаты показали, что азот свободных аминокислот во фракции гидролизуемого азота лесных почв резко уменьшается в почвах урбанизированных территорий (табл. 3). Большее количество свободных аминокислот отмечается в тех почвах, где складываются благоприятные условия для биохимического синтеза аминокислот [6], [9], в то время как уменьшение их содержания может косвенно свидетельствовать о нарушении начальных этапов трансформации азотсодержащих соединений в почве, изменении активности протеолитических ферментов. Несмотря на то что произошло уменьшение в содержании аминокислотного пула почв, в исследованных почвах встречаются практически все известные аминокислоты. При этом по уменьшению содержания отдельных аминокислот в профиле почв их можно расположить в ряду: глутаминовая и аспарагиновая, лейцин, валин, треонин, серин, фенилаланин, изолейцин, аланин, глицин, лизин, тирозин, аргинин, гистидин. Возможно, что аминокислоты, выделяемые корнями растений, а также образуемые в результате гидролиза белка растительных и животных остатков или продуцируемые почвенной микрофлорой, быстро вовлекаются в биохимические потоки, участвуют в формировании плодородия почв. Как известно, различные группы спороносных и неспороносных бактерий, микобактерий, акти-номицетов способны синтезировать аминокислоты, поэтому в зависимости от состава микробного сообщества спектр аминокислот может быть различным. В почвах в сравнительно больших количествах, наряду с аспарагиновой кислотой, содержится дикарбоновая глутаминовая кислота, которая, являясь ключевым метаболитом, может быть стимулятором развития для многих микроорганизмов, служить косвенным индикатором биогенности почв.
Таблица 3
Содержание гидролизуемых аминокислот в почвах лиственных лесов, мг/кг
|
Состав аминокислот |
Бк |
Б1 |
Б2 |
|||||||
|
горизонты |
||||||||||
|
А0 |
А1А2 |
А2 |
Вhf |
А0 |
А1А2 |
Bf |
U0 |
U1d+U2h |
U3a3 |
|
|
Аспарагиновая |
10 581 |
287 |
120 |
476 |
1 124 |
275 |
550 |
1 067 |
172 |
169 |
|
Треонин |
5 632 |
138 |
61 |
264 |
816 |
115 |
261 |
589 |
79 |
86 |
|
Серин |
5 239 |
124 |
57 |
324 |
770 |
126 |
222 |
690 |
78 |
60 |
|
Глутаминовая |
11 455 |
289 |
128 |
483 |
2 084 |
239 |
583 |
1 243 |
156 |
168 |
|
Глицин |
4 221 |
111 |
50 |
214 |
2 280 |
297 |
473 |
1 522 |
119 |
123 |
|
Аланин |
4 258 |
108 |
43 |
197 |
912 |
124 |
309 |
571 |
90 |
94 |
|
Валин |
6 054 |
148 |
67 |
277 |
1 115 |
97 |
155 |
1 171 |
147 |
81 |
|
Изолейцин |
4 738 |
107 |
45 |
156 |
1 126 |
104 |
173 |
668 |
38 |
0 |
|
Лейцин |
7 802 |
174 |
75 |
242 |
2 282 |
160 |
229 |
1 502 |
75 |
0 |
|
Тирозин |
808 |
31 |
3 |
14 |
676 |
16 |
38 |
421 |
7 |
0 |
|
Фенилаланин |
4 411 |
107 |
58 |
192 |
1 983 |
97 |
159 |
1 309 |
54 |
0 |
|
Лизин |
2 929 |
72 |
31 |
137 |
1 427 |
94 |
175 |
989 |
33 |
88 |
|
Гистидин |
884 |
27 |
12 |
56 |
665 |
57 |
107 |
403 |
18 |
39 |
|
Аргинин |
1 244 |
28 |
11 |
47 |
1 295 |
55 |
175 |
675 |
33 |
61 |
|
Общее количество |
70 256 |
1 751 |
761 |
3 079 |
18 556 |
1 857 |
3 608 |
12 820 |
1 100 |
969 |
Характерной особенностью антропогенно измененных почв, в том числе урбаноземов, является деформация структуры микробных ценозов, изменение биологической активности как показателя одного из первых этапов нарушения экологических свойств почв. На начальных стадиях нарушения экосистемы микробное сообщество часто сохраняет способность сопротивляться отрицательному экологическому влиянию, что выражается в увеличении биохимической активности, дыхания и других микробиально-биохимических показателей [2], [4]. Вместе с тем при дальнейшем усилении антропогенного пресса на микробное сообщество оно может перейти в новую адаптивную зону, которая выражается в падении уровня биологической активности почвы ниже контрольного [4], [7]. В микробном сообществе почв изучаемых древостоев присутствуют все исследуемые эколого-трофические группы, что свидетельствует о возможности выполнять микробному сообществу свои концентрационно-минерализаци-онные функции в почве, участвовать в создании собственно органического вещества (рисунок). В составе микробоценоза доминируют микроорганизмы, чувствительные к данным эдафическим условиям, отличающиеся широкой экологической пластичностью. В почвах, испытывающих урбанистическое воздействие, формируется комплекс микроорганизмов, который представлен главным образом биотипами, осуществляющими начальные этапы превращения органического вещества. Их высокая численность и активность свидетельствуют об интенсивной деструкции мортмассы, минерализации трудногидролизуемых веществ. Содержание последних, как известно, в березоворазнотравном опаде невысокое.
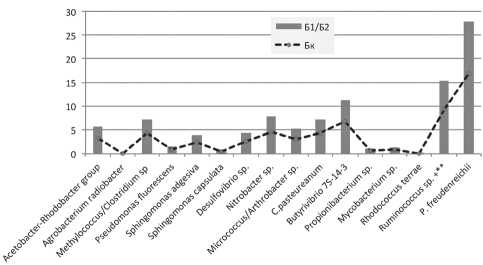
Состав микробного сообщества почв исследуемых древостоев, % от общей численности микроорганизмов
Антропогенная нагрузка модифицирует интенсивность микробиологических процессов, происходящих в почве. Это можно рассматривать как реакцию микробного комплекса на воздействие неблагоприятных условий и использовать в качестве одного из показателей оценки антропогенного воздействия на почвы.
Центральным звеном азотного цикла в почве является азот микробной биомассы [9], [11],
[12]. По количеству азота в составе микробной биомассы можно оценить долю наиболее метаболически активного пула азота почв (табл. 4). Установлено, что азот микробной биомассы сосредоточен преимущественно в верхних органогенных горизонтах почв. В минеральных горизонтах содержание азота, ассоциированного с микробной биомассой, снижается в десятки-сотни раз, что связано, возможно, с общим распределением элемента по профилю, а также с содержанием его лабильных форм.
Таблица 4
Показатели функциональной и биохимической активности биоты почв лиственных лесов
|
Тип леса |
Горизонт почв |
Nмик, мкг N/г |
qCO 2 |
Nмик/Nобщ, % |
|
Бк |
А0 |
2557,2 ± 206,30 |
0,37 |
11,78 |
|
А1A2 |
82,65 ± 17,46 |
0,14 |
5,51 |
|
|
A2 |
15,45 ± 1,25 |
0,23 |
5,15 |
|
|
B |
11,70 ± 3,83 |
0,37 |
1,06 |
|
|
А0 |
1964,70 ± 101,15 |
0,34 |
26,91 |
|
|
Б1 |
Ad |
151,50 ± 2,18 |
0,49 |
2,59 |
|
A1A2 |
37,80 ± 3,47 |
0,50 |
0,86 |
|
|
B |
11,85 ± 0,29 |
0,34 |
0,70 |
|
|
Б2 |
U10 |
1245,30 ± 167,57 |
0,54 |
14,48 |
|
U2d |
137,55 ± 7,71 |
0,14 |
7,24 |
|
|
U3h |
83,40 ± 11,67 |
0,15 |
83,40 |
|
|
U4a3 |
9,60 ± 0,53 |
0,42 |
0,27 |
Для всех исследованных лесных и антропогенно нарушенных почв под лиственными насаждениями самая высокая величина Смик наблюдалась в органогенных горизонтах (8,30–13,1 г С/кг почвы), вниз по профилю почв величина Смик существенно уменьшалась (0,06–1,01 г С/кг почвы) (табл. 5). Столь резкая дифференциация профиля почв по содержанию Смик подтверждает существование биогеохимических барьеров на пути потока ассимилянтов и биогенных элементов, а также его изменение на фоне антропогенного воздействия: нарушение физико-химических свойств почв отмечено выше.
В лесных почвах под березовыми древостоями, взятых в качестве контроля, содержание углерода в микробной биомассе составляло до 17,05 г С/кг почвы, его распределение по профилю почв было неравномерным: максимальное содержание отмечено в верхнем горизонте, вниз по профилю почв оно резко уменьшалось. В целом полученные данные сопоставимы с результатами других исследователей, что может свидетельствовать об общем плане строения лесного биогеоценоза, направленности изменения круговорота биофильных элементов в антропогенно трансформированных экосистемах [5], [7], [20].
Таблица 5 Показатели биологической активности почв изучаемых естественных и городских лесов
|
Тип леса |
Горизонт |
Cмик, мкг С/г |
БД, мкг С/г/час |
Смик/ Сорг, % |
|
Бк |
А0 |
17048 ± 1375,3 |
84,67 ± 5,04 |
3,73 |
|
А1A2 |
551 ± 116,4 |
1,02 ± 0,47 |
0,12 |
|
|
A2 |
103 ± 8,3 |
0,31 ± 0,02 |
2,93 |
|
|
B |
78 ± 25,5 |
0,37 ± 0,03 |
0,94 |
|
|
Б1 |
А0 |
13098 ± 674,3 |
59,41 ± 10,39 |
3,62 |
|
Ad |
1010 ± 14,5 |
6,61 ± 0,94 |
4,12 |
|
|
A1A2 |
252 ± 23,1 |
1,67 ± 0,12 |
0,84 |
|
|
B |
79 ± 1,9 |
0,34 ± 0,00 |
0,09 |
|
|
Б2 |
U10 |
8302 ± 1117,1 |
59,93 ± 4,16 |
1,85 |
|
U2d |
917 ± 51,4 |
1,66 ± 0,24 |
2,07 |
|
|
U3h |
556 ± 77,8 |
1,13 ± 0,14 |
2,05 |
|
|
U4a3 |
64 ± 3,5 |
0,33 ± 0,00 |
0,15 |
Необходимо отметить, что функции микробного сообщества в лиственных экосистемах связаны не только с трансформацией растительного субстрата, но и гумусовых соединений. Этим объясняется высокая заселенность микроорганизмами лесных подстилок [5], [9]. Однако общий уровень биомассы не указывает на ее активность, поскольку отражает лишь количество присутствующих в почве микроорганизмов, поэтому его изменение может свидетельствовать как о влиянии на общие микробиологические процессы, так и на специфические группы микроорганизмов. В этой связи проводили анализ дыхательной активности почв изучаемых лиственных древостоев. Результаты показали, что дыхательная активность изученных почв изменялась в органогенных горизонтах под лиственными насаждениями в пределах от 1,43–2,32 г C/кг почвы/сут. Самая высокая активность базального дыхания отмечалась в верхнем, наиболее антропогенно нарушенном, горизонте (U0) по сравнению со всеми исследованными участками. Вниз по профилю антропогенно трансформированных почв дыхательная активность снижалась в 176–235 раз по сравнению с контролем. В профиле исследованных почв величина БД изменялась в пределах 0,33–6,61 и 0,31–1,02 г C/кг почвы/сут городских и контрольных территорий соответственно. Снижение дыхательной активности микроорганизмов в минеральных горизонтах почв связано, вероятно, с изменением количества и качества поступающего органического вещества в нижележащие горизонты [3].
Тесная взаимосвязь между типом леса и биологическим потенциалом почвы показана рядом исследователей, проводивших многолетние изучения структуры и функциональной активности в основных типах леса средней тайги
Карелии [3], [9]. Микробные сообщества почв березовых лесов развиваются в условиях постоянного притока доступных пищевых ресурсов из лиственного опада. При этом чем доступнее микроорганизмам субстрат, тем активнее идет его минерализация, тем больше прирост биомассы микробов, выше их дыхание. В лиственных лесах, по сравнению с хвойными, наблюдается расширение микробного разнообразия, фиксируемое показателями обилия микробного блока, его экологической и функциональной активностью [3], [4], [6].
Универсальным индикатором нарушения экологического равновесия системы является микробный метаболический коэффициент. Он достаточно хорошо отражает способность микробного сообщества преодолевать внешние воздействия, экологическую пластичность микробоценоза [2]. Согласно классификации, предложенной Е. В. Благодатской и Н. Д. Ананьевой, изменение микробного метаболического коэффициента в диапазоне 0,2-0,3 соответствует слабой, 0,3–0,5 – средней, 0,5–1,0 – сильной степени нарушенности микробного сообщества и отражает его неустойчивость [2]. Наиболее высокий показатель свидетельствует о повышении затрат углерода на дыхание единицы микробной биомассы, что можно рассматривать как адаптивную реакцию микробного комплекса, находящегося в неблагоприятных эдафических условиях. Значения метаболического коэффициента для исследованных почв не превышали 1, что косвенно свидетельствует об устойчивости микро-боценоза к негативным проявлениям в педосфере (см. табл. 4). Вместе с тем, относительно высокие показатели qCO 2 в отдельных горизонтах указывают на более активную минерализацию органического вещества, сдвиг микробного равновесия. Данный показатель хорошо диагностирует состояние микробиоты почв, поэтому также может быть использован в мониторинговых исследованиях.
Доступность органического углерода по -чвы для микроорганизмов и закрепление его в микробной биомассе могут быть охарактеризованы величиной доли микробного углерода в органическом углероде почвы (Смик/Сорг) [8]. В исследованных почвах величина Смик/ Сорг в среднем варьировала в диапазоне от 0,1 до 4,1 %, с максимумом в верхних горизонтах. Более низкие значения данного показателя в городских почвах свидетельствуют о менее эффективном использовании органического вещества микроорганизмами. Выявленные вну-трипрофильные различия величины удельного микробного дыхания, а также существенное варьирование показателя Смик/Сорг могут диагностировать неустойчивое функционирование микробиологических процессов цикла углерода в почвах антропогенно нарушенных экосистем.
ЗАКЛЮЧЕНИЕ
Биологическая активность почв природных и трансформированных лесных экосистем имела как общие, так и специфические особенности. Общие обусловлены природно-климатическими условиями, бедностью первичными минералами почвообразующих пород, типом растительности. Специфические связаны с составом и структурой микробного сообщества, аминокислотным пулом почв, эколого-физиологическими показателями микробного сообщества. Именно последние, специфические свойства, отличают почвы города от их природных аналогов.
Проведенные исследования показали, что интенсивность микробной трансформации азот-и углеродсодержащих соединений в различных горизонтах почв естественных и антропогенно нарушенных экосистем происходит максимально в верхних органогенных горизонтах, в минеральных горизонтах процессы идут более слабо. В микробном сообществе присутствуют все наиболее важные группы микроорганизмов, осуществляющие трансформацию азот-и углеродсодержащих соединений. Значительные различия по содержанию Смик в почвах под лиственными насаждениями в черте города и контроле наблюдались в основном для верхней части профиля. Содержание углерода, иммобилизованного в микробной биомассе, в целом выше в органогенных горизонтах почв под лиственными древостоями на территории города по сравнению с лесными почвами контрольных участков. На фоне урбанистического воздействия происходит изменение показателей функционирования микробного сообщества, круговорота биофильных элементов.
Высокая индикационная информативность аминокислотного пула, базального дыхания, микробного метаболического коэффициента почв позволяет использовать их в качестве одного из показателей состояния природной среды. Диапазон изменения микробного метаболического коэффициента можно рекомендовать использовать в качестве индикатора ранних нарушений в педосфере, изменений качества урбоэкосистемы.
Рассмотренные в работе показатели могут быть использованы при анализе состояния природной среды, биологической диагностике почв, изученные характеристики позволяют расширить реестр показателей, необходимых для проведения урбоэкологического мониторинга почв.
БЛАГОДАРНОСТИ
Авторы выражают большую признательность сотрудникам Института леса КарНЦ РАН: м. н. с. Е. Э. Костиной, н. с. А. Н. Пеккоеву за помощь при проведении полевых работ.
* Работа выполнена в рамках государственного задания ИЛ КарНЦ РАН. Тема 0220-2017-0004.
THE MICROBIOLOGICAL BACKGROUND OF NITROGEN-
AND CARBON-BEARING COMPOUNDS’ TRANSFORMATIONS IN URBAN SOILS
ACKNOWLEDGMENTS
The authors are deeply grateful to the researchers from the Forest Research Institute of Karelian Research Centre of the Russian Academy of Sciences E. Kostina and A. Pekkoev for their help during fieldwork.
* The study was conducted within the framework of the state assignment of the FRI KarRC RAS. Theme 0220-2017-0004.
P. 17–21. (In Russ.)
Список литературы Микробиологические основы трансформации азот- и углеродсодержащих соединений в почвах урбанизированных территорий
- Аринушкина Е. В. Руководство по химическому анализу почвы: Уч. пособие для вузов по спец. «агрохимия и почвоведение». М.: Изд-во Московского ун-та, 1970. 487 с.
- Благодатская Е В., Ананьева Н. Д. Оценка устойчивости микробных сообществ в процессе разложения поллютантов в почве//Почвоведение. 1996. № 11. С. 1341-1346.
- Германова Н. И., Медведева М. В. Микрофлора почв заповедника «Кивач»//Природа государственного заповедника «Кивач». Труды КарНЦ РАН. 2006. № 10. C. 10-13.
- Медведева М. В., Новиков С. Г., Федорец Н. Г. Экологическая оценка состояния почв промышленной зоны города Петрозаводска//Проблемы региональной экологии. 2015. № 2. С. 6-10.
- Морозова Р. М. Лесные почвы Карелии. Л.: Наука, 1991. 184 с.
- Мошкина Е. В. Содержание свободных аминокислот в почвах хвойных лесов Карелии//Вестник Московского государственного университета леса. Лесной вестник. 2008. № 4. C. 17-21.
- Почва, город, экология/Под общ. ред. Г. В. Добровольского. М.: Фонд «За экономическую грамотность», 1997. 320 с.
- Сусьян Е. А., Ананьева Н. Д., Гавриленко Е. Г., Чернова, О. В., Бобровский М. В. Углерод микробной биомассы в профиле лесных почв южной тайги//Почвоведение. 2009. № 10. С. 1233-1240.
- Федорец Н. Г., Бахмет О. Н. Экологические особенности трансформации соединений азота и углерода в лесных почвах. Петрозаводск: КарНЦ РАН, 2003. 240 с.
- Anderson J. P. E., Domsch K. H. A physiological method for the quantitative measurement of microbial biomass in soils//Soil Biol. Biochem. 1978. Vol. 10. P. 215-221.
- Anderson J. P. E., Domsch K. H. Quantities of plant nutrients in the microbial biomass of selected soils//Soil Science. 1980. Vol. 130. No 4. Р 211-216.
- Anderson Т. Н., Gray T. R. G. Soil microbial carbon uptake characteristics in relation to soil management//FEMS Microbiol. Ecol. 1989. Vol. 74. P. 11-20.
- Harris J. A. Measurements of the soil microbial community for estimating the success of restoration//Eur. J. Soil Sti. 2003. Vol. 54. P. 801-808.
- Ollinger S. V. Forest Ecosystems//Encyclopedia of life science. Macmillan Publishers Ltd. Nature Publishing Group, 2002. P. 1-10.
- Osipov G. A., Turova E. S. Studying species composition of microbial communities with the use gas chromatography-mass spectrometry. Microbial community of kaolin//FEMS Microb. 1997. Rev. 20. P. 437-446.


