Микробиологические показатели динамики почвенного углерода
Автор: Семенов М.В.
Журнал: Бюллетень Почвенного института им. В.В. Докучаева @byulleten-esoil
Рубрика: Статьи
Статья в выпуске: 124, 2025 года.
Бесплатный доступ
Микроорганизмы играют ключевую роль в динамике содержания и запасов почвенного органического вещества (ПОВ), перераспределяя углерод (С) на рост микробной биомассы, дыхание, синтез полимерных соединений, а также внутриклеточные и внеклеточные ферментативные процессы. В данной работе представлен обзор микробиологических показателей, используемых для изучения разложения, трансформации и стабилизации почвенного органического вещества, а также в моделировании динамики почвенного С. Рассматриваются такие микробиологические параметры цикла С, как углерод микробной биомассы (Cмик), ферментативная активность почвы, углерод микробной некромассы, эффективность использования углерода (CUE), базальное дыхание и структура микробного сообщества. Обсуждаются методы определения этих показателей, их интерпретация и примеры применения в математических моделях. Учитывая, что микробная некромасса составляет значительную часть ПОВ, а CUE является ключевым параметром баланса между минерализацией и стабилизацией С, интеграция микробиологических данных в прогностические модели может существенно повысить их точность. Для изучения механизмов микробной трансформации и стабилизации ПОВ необходимо количественное определение микробиологических показателей цикла С в различных почвенно-экологических условиях.
Углерод микробной биомассы, углерод микробной некромассы, ферментативная активность, эффективность использования углерода микроорганизмами
Короткий адрес: https://sciup.org/143184848
IDR: 143184848 | УДК: 579.26:631.46 | DOI: 10.19047/0136-1694-2025-124-116-143
Текст научной статьи Микробиологические показатели динамики почвенного углерода
ФИЦ “Почвенный институт им. В.В. Докучаева”, Россия, 119017, Москва, Пыжевский пер, 7, стр. 2, , e-mail:
7 Bld. 2 Pyzhevskiy per., Moscow 119017, Russian Federation, , e-mail:
УЧАСТИЕ МИКРООРГАНИЗМОВ В ТРАНСФОРМАЦИИ И СТАБИЛИЗАЦИИ ОРГАНИЧЕСКОГО ВЕЩЕСТВА ПОЧВЫ
Почвенное органическое вещество (ПОВ) играет ключевую роль в поддержании качества почвы, придании устойчивости сельскохозяйственному производству и смягчении последствий изменения климата за счет секвестрации углерода и адаптации агроэкосистем (Семенов, Когут, 2015; Lehmann, Kleber, 2015; Rumpel et al., 2020). Почвы содержат больше органического углерода (С орг ), чем атмосфера и растительность вместе взятые (Arneth et al., 2019). Общие потери углерода почв сельскохозяйственных земель России составляют 4.7 Гт С из слоя 1 м, при этом 85% этих потерь в пахотных почвах обусловлены неудовлетворительной технологией сельскохозяйственного производства (Иванов и др., 2021). С другой стороны, сельскохозяйственные почвы России имеют высокий потенциал секвестрации С (до 0.6–0.9 млрд тонн C ежегодно) (Zomer et al., 2017). Основным источником секвестрированного С орг в почвах является атмосферный СО 2 , фиксируемый растениями в результате фотосинтеза и поступающий в почву в виде растительных остатков и прикорневых выделений (Семенов и др., 2025). При этом важно не только связать атмосферный СО 2 в новую биомассу, но и предотвратить его быстрое возвращение в атмосферу (Когут, Семенов, 2022).
Микроорганизмы придают ПОВ биогенность и биоактивность (Ковалев и др., 2021), эко-функциональность (Hoffland et al.,
2020), а также играют ключевую роль в динамике запасов С орг (Schimel, Schaeffer, 2012), перераспределяя углерод на рост микробной биомассы, дыхание, синтез полимерных соединений, внутриклеточных и внеклеточных ферментов. Баланс этих процессов определяет соотношение минерализации и накопления ПОВ и лежит в основе микробиологических механизмов его стабилизации в почве (Manzoni et al., 2012). Микроорганизмы избирательно разлагают органическое вещество: легкоразлагаемые соединения утилизируются ими быстрее, чем трудноразлагаемые компоненты (Семенов и др., 2019). Разные группы микроорганизмов предпочитают разные типы субстратов, что приводит к биологическому фракционированию ОВ на пулы, различающиеся по скорости разложения (Семенов и др., 2007). В этих условиях накопление и сохранность ПОВ определяется преимущественно за счет стабилизации компонентов растительной и микробной биомассы, обладающих устойчивостью к разложению (Lehmann, Kleber, 2015). Скорость разложения растительных остатков определяется активностью внеклеточных ферментов, продуцируемых микроорганизмами, а также эффективностью использования углерода (CUE) – долей углерода, направляемого на рост микробной биомассы по сравнению с углеродом, который теряется при микробном дыхании в виде CO 2 (Kallenbach et al., 2019; Tao et al., 2023). В последние годы установлено, что микроорганизмы играют решающую роль в формировании стабильного ПОВ за счет адсорбции внеклеточных метаболитов и микробной некромассы на минеральных поверхностях почвы – процесс, известный как “микробный углеродный насос” (Liang et al., 2017). По разным оценкам, до 55–60% С орг в почвах представлено микробной некромассой (Liang et al., 2019; Angst et al., 2021; Лебедева и др., 2024). Таким образом, микробные процессы регулируют как разложение, так и стабилизацию ПОВ, участвуя в его биологическом фракционировании.
Для точного прогнозирования динамики почвенного углерода и его отклика на изменения климата и землепользования необходимо учитывать микробиологические процессы, связанные с его циклом (Schimel, 2023). Большинство классических моделей прогнозирования запасов почвенного углерода (например, ROTH-C, Century) не используют микробную активность и преобразование
ОВ микроорганизмами в явном виде (Wieder et al., 2014; Chandel et al., 2023). Однако в последние десятилетия микробиологические параметры активно интегрируются в модели углеродного цикла, что повышает их точность и позволяет учитывать микробиологические механизмы стабилизации углерода (Chandel et al., 2023; Рыжова и др., 2025). Настоящая работа представляет обзор микробиологических показателей, их роли в процессах трансформации и стабилизации почвенного органического вещества, и применении в моделировании динамики почвенного С.
МИКРОБИОЛОГИЧЕСКИЕ ПОКАЗАТЕЛИ ДИНАМИКИ ПОЧВЕННОГО УГЛЕРОДА
Углерод микробной биомассы (C мик ) представляет собой биологически активный пул ПОВ, который обычно составляет 1– 5% от его общего содержания С орг (Joergensen, Mueller, 1996). С мик является функцией общей численности живых микроорганизмов и определяет активность биохимических процессов в почвах, в том числе трансформации и минерализации ПОВ (табл. 1). Существует широкий спектр методов определения С мик , среди которых наиболее распространены фумигация-экстракция хлороформом и субстрат-индуцированное дыхание (СИД) (Evdokimov, 2018). Фумигация-экстракция обеспечивает более устойчивые оценки С мик , но является более трудоемким методом, так как требует инкубации с хлороформом и последующего измерения углерода в фуми-гированных и нефумигированных образцах (Evdokimov, 2018; Semenov et al., 2025). СИД значительно проще и позволяет анализировать большее число образцов, однако может быть неприменимо для некоторых типов почв, таких как торфяные или сильнощелочные почвы (Semenov et al., 2025). С мик является наиболее распространенным интегральным показателем численности и активности почвенных микроорганизмов (Bünemann et al., 2018; Semenov et al., 2025) и поэтому широко используется при мониторинге (Liptzin et al., 2022) и моделировании динамики запасов почвенного углерода (Abramoff et al., 2018; Chandel et al., 2023).
Таблица 1 . Микробиологические показатели, используемые в моделях динамики почвенного С.
Тable 1. Microbiological indicators used in soil carbon dynamics models
|
Показатель |
Интерпретация показателя |
Метод определения |
Примеры моделей |
|
Углерод микробной биомассы (Смик) |
Количество С в живой микробной биомассе |
фумигация-экстракция хлороформом, субстрат-индуцированное дыхание |
Millennial, MIMICS, CORPSE |
|
Ферментативная активность |
Активность ферментов, участвующих в разложении ОВ |
Флуориметрия, колориметрия |
DEMENT, RESOM, MEND, Kaiser |
|
Углерод микробной некромассы |
Остатки мертвых микробных клеток, формирующих MAOM |
Анализ аминосахаров (ГХ-МС, ВЭЖХ), ЯМР-спектроскопия, Py-FIMS |
FOND, CORPSE, MIND MOMOS |
|
Эффективность использования C микроорганизмами |
Соотношение С, используемого на рост биомассы, к общему потребленному С |
Меченые стабильными изотопами субстраты (13C, 18O), калореспиро-метрия, стехиометрическое моделирование |
MIMICS, CORPSE, DEMENT, RESOM, MOMOS |
|
Базальное дыхание (БД) |
Выделение CO2 в результате микробного метаболизма |
Измерение выделения CO2 в инкубационных экспериментах |
CORPSE, MIMICS, MOMOS, RESOM |
|
Активные/покоящиеся микроорганизмы |
Динамика численности активных и покоящихся микроорганизмов |
ДНК/РНК-подходы, микроскопия с использованием краситетелей |
CORPSE, MIND, SOMKO, EcoSMMARTS |
|
Структура микробного сообщества |
Соотношение функциональных групп микроорганизмов |
Секвенирование 16S рРНК, метагеномика, анализ PLFA |
DEMENT, MIMICS, RESOM, EcoSMMARTS |
Ферментативная активность (ФА) почвы. Почвенные ферменты играют ключевую роль в циклах биофильных элементов (Nannipieri et al., 2012; Благодатская и др, 2016). Они катализируют разложение поступающих в почву сложных органических соединений, таких как целлюлоза, лигнин, белки и другие органические полимеры, до более простых молекул, которые составляют основную часть стабильного минерально-ассоциированного ОВ (MAOM). Микроорганизмы способны разлагать практически все ПОВ независимо от его химического состава, если оно физически доступно для микробного разложения (Kleber, 2010; Lützow et al., 2006; Woolf, Lehmann, 2019). До 40–60% ФА приходится на стабилизированные с почвенной матрицей и органическим веществом ферменты, поэтому ФА не всегда коррелирует с микробной биомассой или дыханием и отражает кумулятивный эффект долгосрочной микробиологической активности. Основными методами определения ФА являются флуориметрия (использование субстратов с флуоресцентной меткой) и колориметрия (Baldrian, 2009; Nannipieri et al., 2012; Semenov et al., 2025) (табл. 1).
Показатели ферментативной активности имеют ряд ограничений, которые могут усложнять интерпретацию полученных данных. Во-первых, существует большое количество ферментов, участвующих в разложении ПОВ, поэтому измерение активности одного или двух ферментов часто недостаточно для адекватной оценки разложения ПОВ (Nannipieri et al., 2012). Современные методы определяют потенциальную ФА, которая может отличаться от реальной активности ферментов в почве (German et al., 2011; Nannipieri et al., 2012). ФА может интерпретироваться противоположным образом: повышенная ФА может свидетельствовать как о высокой микробной активности и, следовательно, о высокой скорости разложения ОВ, так и о наличии дефицита питательных веществ (Semenov et al., 2025). Стимуляция ферментативной активности субстратом может сопровождаться ингибированием продукта по принципу обратной связи. Наконец, скорость разложения ПОВ не всегда зависит от уровня ФА. Несмотря на указанные ограничения, ферментативная активность успешно применяется в мониторинге и моделировании динамики запасов почвенного углерода (Liptzin et al., 2022; Chandel et al., 2023).
Углерод микробной некромассы представляет собой органическое вещество микробного происхождения (“мертвую биомассу”), включающее содержимое микробных клеток, их клеточные стенки, а также вторичные метаболиты, выделяемые микроорганизмами в окружающую среду (табл. 1). Согласно современным представлениям, на микробную некромассу приходится более половины всего ПОВ (Liang et al., 2019; Angst et al., 2021). Таким образом, в почве содержится значительно больше мертвой биомассы микроорганизмов, чем живой, что свидетельствует о накоплении остатков мертвых микроорганизмов в почве с течением времени. Адсорбция микробной некромассы на минеральных поверхностях почвы (так называемый “микробный углеродный насос”) является ключевым микробным механизмом формирования стабильного ПОВ (Liang et al., 2017).
Основным методом количественного определения микробной некромассы является анализ аминосахаров, таких как мурамо-вая кислота (компонент муреина, входящего в состав клеточных стенок бактерий), глюкозамин (основной компонент клеточных стенок грибов) и галактозамин (входит в состав внеклеточных полисахаридных соединений, синтезируемых микроорганизмами) (Joergensen, 2018). Эти соединения анализируются с помощью газовой хроматографии-масс-спектрометрии (ГХ-МС) или высокоэффективной жидкостной хроматографии (ВЭЖХ) после гидролиза почвенных образцов сильными кислотами (Joergensen, 2018; Liang et al., 2019). Также для определения микробной некромассы применяются ЯМР-спектроскопия и пиролизно-полевая ионизационная масс-спектрометрия (Py-FIMS) (Whalen et al., 2022).
Эффективность использования углерода (CUE) микроорганизмами – это показатель, отражающий, какая доля усвоенного микроорганизмами углерода идет на рост и биомассу, а какая теряется в виде CO2 в процессе дыхания (табл. 1, рис. 1) (Kallen-bach et al., 2019; Tao et al., 2023). CUE зависит от структуры микробного сообщества и соотношения таксонов с различными экологическими стратегиями: предполагается, что копиотрофные и быстрорастущие микроорганизмы обладают более низкой эффективностью использования углерода по сравнению с олиготрофны- ми и медленнорастущими микроорганизмами (Manzoni et al., 2012). Почвенные микробные сообщества, как правило, демонстрируют самую высокую CUE по сравнению с микроорганизмами других экосистем (Manzoni et al., 2012). Согласно последним исследованиям, CUE микроорганизмами является одним из важнейших факторов, определяющих содержание ПОВ, и положительно коррелирует с содержанием Сорг в почве (Tao et al., 2023).
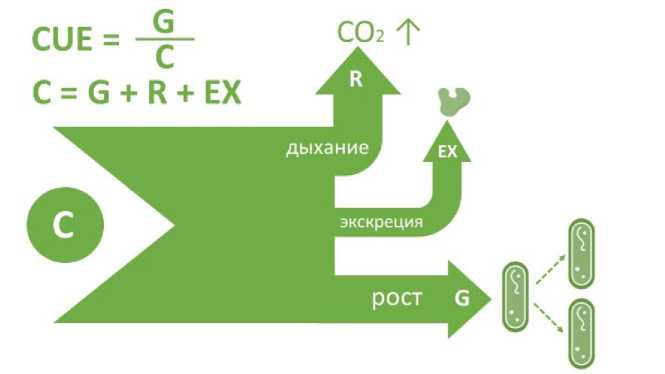
Рис. 1. Схема концепции “эффективности использования углерода (CUE – Carbon use efficiency) микроорганизмами. Потребляемый почвенными микроорганизмами углерод (C) расходуется на рост и построение биомассы (G), экскрецию ферментов и метаболитов в окружающую среду, а также на дыхание (R). Эффективность использования углерода микроорганизмами рассчитывается как отношение углерода, использованного на рост и биомассу (G), к углероду, потребленному микроорганизмами (С).
Fig. 1. Conceptual scheme of “carbon use efficiency” (CUE) by microorganisms. The carbon (C) consumed by soil microorganisms is allocated to growth and biomass formation (G), excretion of enzymes and metabolites into the environment, as well as to respiration (R). Microbial carbon use efficiency is calculated as the ratio of carbon used for growth and biomass (G) to the total carbon consumed by microorganisms (C).
В настоящее время существует несколько методов для оценки CUE почвенного микробного сообщества. Метод ¹³C позволяет определить, насколько эффективно микроорганизмы используют различные C-содержащие субстраты (Hu et al., 2025). Это дает представление о специфических метаболических путях их переработки. Метод 18 O применяется для измерения скорости роста микроорганизмов и может использоваться для анализа почвы, отобранной в полевых условиях. Стехиометрический анализ ферментов отражает энергетические затраты микроорганизмов на получение ограниченных ресурсов и выявляет несоответствие между их потребностями и доступными в почве ресурсами (Hu et al., 2025). Каждый из этих методов оценивает отдельные аспекты использования C микроорганизмами, поэтому полученные результаты могут различаться (0.59 для i3C, 0.34 для i8 O и стехиометрии) (Hu et al., 2025). Значения CUE могут значительно различаться в зависимости от типа почвы, биома, а также температуры и влажности (Manzoni et al., 2012).
Прочие микробиологические показатели. Существует ряд других микробиологических показателей, которые также могут использоваться при описании участия микроорганизмов в процессах разложения и трансформации ПОВ. Прежде всего, это микробное (базальное) дыхание – количество CO 2 , выделяемого микробной биомассой почвы за единицу времени (Задорожний и др., 2010) (табл. 1). Базальное дыхание отражает общую метаболическую активность почвенной гетеротрофной микробиоты, так как его значение зависит от доступности субстрата, физиологического состояния микроорганизмов и их метаболических потребностей (Благодатская и др, 2016). Также этот показатель можно интерпретировать как меру потенциальной минерализации С (Liptzin et al., 2022). Базальное дыхание обычно оценивается в лабораторных условиях в оживленных образцах воздушно-сухой почвы, из которых удаляются растительные остатки, с использованием газовой хроматографии, инфракрасной спектроскопии или щелочного поглощения с последующим титрованием (Semenov et al., 2025).
Еще одним важным показателем может служить скорость роста микроорганизмов. Она определяется как экологией и геном- ными характеристиками таксонов, входящих в состав микробного сообщества (Malik et al., 2019; Osburn et al., 2024), так и условиями окружающей среды (Metze et al., 2023). Более высокие скорости роста микроорганизмов чаще всего сопряжены с более интенсивным, но менее эффективным использованием углерода (Hu et al., 2025).
Когда условия окружающей среды неблагоприятны для роста, например, при дефиците субстрата, микроорганизмы могут снижать свою метаболическую активность практически до нуля, чтобы предотвратить потерю биомассы, переходя в состояние покоя (Joergensen, Wichern, 2018). Активные микроорганизмы составляют лишь около 0.1–2% от общей микробной биомассы и редко превышают 5% в почвах без поступления легкодоступных субстратов (Blagodatskaya, Kuzyakov, 2015). Живая микробная биомасса представлена преимущественно потенциально активными (10–40%) и покоящимися микроорганизмами (>50% от общей микробной биомассы) (Blagodatskaya, Kuzyakov, 2015; Благодатская и др., 2016). Затраты углерода на поддержание покоящихся микроорганизмов могут быть на два-три порядка ниже, чем у метаболически активных (Blagodatskaya, Kuzyakov, 2015). Динамика численности активных и покоящихся форм микроорганизмов зависит от количества и доступности субстрата и оказывает значительное влияние на активность микробиологических процессов трансформации ПОВ (табл. 1).
Развитие молекулярно-генетических методов, прежде всего ампликонного и метагеномного секвенирования, позволило определять таксономический состав полных (ДНК) и потенциально активных (РНК) сообществ прокариотов, грибов и протистов в почве (Prosser, 2015; Семенов, 2019). Как было показано выше, таксономическая структура почвенного микробиома во многом определяет эффективность использования углерода, скорость роста микроорганизмов и ферментативную активность почвы. Тем не менее, на текущий момент не найдена возможность интеграции показателей генетического/таксономического разнообразия почвенного микробиома в методологию оценки и прогнозирования трансформации ПОВ (Nannipieri et al., 2020; Schimel, 2023). Это связано как с методологическими проблемами (генетический ма- териал большей части почвенного микробиома принадлежит неактивным, покоящимся и мертвым микроорганизмам либо вовсе происходит от внеклеточной ДНК) (Prosser, 2015; Семенов, 2019), так и с недостаточно изученной экологией большинства таксонов (Baldrian, 2019; Schimel, 2023). Решением проблемы интерпретации и параметризации таксономического разнообразия почвенного микробиома в контексте цикла почвенного углерода может стать использование концепции экологических (“жизненных”) стратегий почвенного микробиома (Piton et al., 2023; Semenov, 2023; Malik et al., 2020). Например, отношение олиготрофных и копиотрофных таксонов микроорганизмов оказалось положительно связано с температурной чувствительностью ПОВ (Li et al., 2021). Также предлагается включать в микробиологические модели информацию не по соотношению таксонов микроорганизмов, а по количеству функциональных генов цикла С (Guo et al., 2020).
МОДЕЛИРОВАНИЕ МИКРОБНОГО УЧАСТИЯ В ПРОЦЕССАХ ТРАНСФОРМАЦИИ ПОЧВЕННОГО ОРГАНИЧЕСКОГО ВЕЩЕСТВА
Большинство классических моделей прогнозирования запасов углерода в почве (ROTH-C, Century) не учитывает микробную активность и микробное преобразование ОВ в явном виде. Эти модели базируются на взаимосвязи между запасами ПОВ и его устойчивостью, предполагая, что: 1) микробные и другие свойства экосистемы, выраженные параметрами моделей, инвариантны в широких эколого-почвенных условиях и во времени; 2) микроорганизмы быстро реагируют на изменения доступности субстрата, и их численность никогда не ограничивает скорость разложения ОВ; 3) микробные сообщества обладают функциональной избыточностью, что позволяет им одинаково эффективно перерабатывать доступный субстрат (Wieder et al., 2015; Chandel et al., 2023).
Микробиологические модели, напротив, предполагают, что скорость разложения ПОВ ограничивается либо микробной биомассой, либо ферментативной активностью, либо обоими факторами. Соответственно, используются два подхода к моделированию разложения ПОВ: ферментативно-опосредованный и опосре- дованный микробной биомассой. Основное различие между ними заключается в том, что ферментативно-опосредованные модели предполагают явное наличие пула ферментов, продукция которых регулируется как концентрацией субстрата, так и структурой микробного сообщества (Sistla et al., 2014). В таких моделях разложение ПОВ напрямую связано с ферментативной активностью, а не с микробной биомассой. В моделях, опосредованных микробной биомассой, ферментативный пул не учитывается явно, а катализ разложения ПОВ считается неявно встроенным в процесс метаболизма микробных сообществ (Chandel et al., 2023).
Включение микробиологических показателей (микробного углерода, ферментативной активности, микробного дыхания) повысило точность моделей в прогнозировании всплесков дыхания почвы в условиях высушивания – повторного увлажнения (Lawrence et al., 2009). Интеграция углерода микробной биомассы и других пулов ОВ в модель Millennial позволила получить более точные прогнозы по сравнению с моделью Century (Abramoff et al., 2022). Однако микробиологические модели динамики почвенного углерода имеют ряд ограничений. Многие микробиологические показатели трудно поддаются количественной оценке (например, микробная некромасса, соотношение активных и покоящихся микроорганизмов, эффективность использования углерода микроорганизмами – CUE). Недостаток экспериментальных данных является одним из ключевых факторов, затрудняющих описание микробных процессов и параметризацию моделей. Кроме того, включение микробных процессов увеличивает сложность моделей и число параметров, что может повышать неопределенность прогнозов. В некоторых случаях переход от простых линейных к более сложным нелинейным микробиологическим моделям не приводит к значительному повышению точности предсказаний, как показано в исследованиях по моделированию гетеротрофного дыхания почвы (Sulman et al., 2018).
На микробные процессы в почве влияет множество факторов окружающей среды, включая температуру, влажность, pH, окислительно-восстановительный потенциал и доступность кислорода. Среди существующих микробиологических моделей разложения ПОВ только половина учитывает влияние температуры, треть – влажности, и лишь 10% учитывают влияние pH почвы (Chandel et al., 2023). Температурная зависимость микробных процессов в моделях описывается с использованием четырех математических функций: 1) функции Q10, 2) уравнения Аррениуса, 3) обобщенной функции Пуассона и 4) арктангенс-функции. Моделирование реакции микробных сообществ на пульсовые изменения влажности представляет сложность, так как влага регулирует как физические, так и биологические процессы в почве, существенно влияя на скорость разложения ОВ (Lawrence et al., 2009). Влажность почвы является критическим фактором контроля разложения ПОВ: при переувлажнении кислород становится лимитирующим фактором, а при низкой влажности ограничивается диффузия из-за утончения или разрыва водных пленок (Abramoff et al., 2017). Почвенный pH также оказывает значительное влияние на минеральные поверхности и доступность ПОВ для микроорганизмов. При высоком pH сорбционная способность минеральных поверхностей снижается, что увеличивает доступность ПОВ для разложения (Abramoff et al., 2022). Наиболее комплексные модели (например, Millennial) одновременно учитывают микробиологические параметры для описания разложения, трансформации и минерализации ПОВ, а также процессы сорбции-десорбции на минеральных частицах для моделирования стабилизации ПОВ.
ЗАКЛЮЧЕНИЕ
За последние три десятилетия модели динамики почвенного углерода все чаще включают микробиологические показатели и процессы, которые они описывают. Большинство микробиологических моделей были разработаны после 2000-го года, что совпадает с развитием молекулярных методов изучения почвенных микроорганизмов и развитием представлений об их роли в процессах трансформации и биологического фракционирования ПОВ. Основными эмпирическими микробиологическими показателями, используемыми в моделях динамики почвенного С, являются углерод микробной биомассы, ферментативная активность и микробное дыхание, характеризующие интенсивность разложения ПОВ. Более сложные модели включают дополнительные показатели, такие как углерод микробной некромассы, эффективность использования углерода микроорганизмами (CUE) и соотношение активных и покоящихся форм микроорганизмов, а также бактерий и грибов или копиотрофов и олиготрофов. Несмотря на активное развитие молекулярно-генетических методов изучения микробиома, их применение в микробиологических моделях почвенного цикла С остается ограниченным из-за сложности в интерпретации данных в контексте разложения и трансформации ПОВ.
Недостаток экспериментальных данных и высокая трудоемкость оценки некоторых микробиологических показателей ограничивают совершенствование микробиологических моделей. Тем не менее, поскольку микробная некромасса составляет значительную часть ПОВ, а CUE является ключевым параметром баланса между минерализацией и стабилизацией ОВ, интеграция микробиологических показателей в прогностические модели динамики почвенного углерода может существенно повысить их точность. Параллельно с развитием микробиологических моделей трансформации почвенного С необходимы дальнейшие исследования по выявлению и уточнению механизмов микробиологической трансформации и стабилизации ПОВ в различных почвенноэкологических условиях.


