Микробиологический анализ торфяной лечебной грязи месторождения Таборли-3
Автор: Гафарова Л.Ф., Курди У., Яковлева Г.Ю., Колпаков А.И., Ильинская О.Н.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 1, 2025 года.
Бесплатный доступ
Торфяные грязи (пелоиды) представляют собой природные органоминеральные комплексы, образованные при разложении органических остатков в болотистой местности в условиях недостатка кислорода. Они обладают высокой теплоемкостью и содержат биологически активные вещества (соли, газы, биостимуляторы, метаболиты организмов и пр.), а также живые микроорганизмы. Однако микробный состав пелоидов практически не изучен. Цель работы заключалась в анализе микробного состава торфяных пелоидов месторождения Таборли-3 (Республика Татарстан) согласно санитарно- бактериологическим характеристикам, спектру культивируемых микроорганизмов, молекулярно- генетическому определению прокариотического метагенома и его функционального потенциала. В течение 2021-2023 гг. изучены 7 образцов таборлинских пелоидов. Санитарно-бактериологический анализ осуществляли согласно программе производственного контроля санаториев, применяющих данную грязь. Таксономическую идентификацию выделенных культур микроорганизмов проводили методом времяпролетной масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией MALDI-TOF MS. Молекулярно-генетический анализ сообщества микроорганизмов выполняли секвенированием 16S рРНК с помощью Illumina MiSeq, дальнейщий анализ последовательностей проводили с использованием пакета программного обеспечения Mothur на платформе Galaxy. Охарактеризованы бактериальные сообщества пелоидов, в которых преобладали представители филумов Firmicutes (22%) и Proteobacteria (36%). На уровне семейств доминировали Streptococcaceae, Ruminicoccaceace, Lactobacillaceae, Comamondaceae и Sphingomonadaceae. Функциональный потенциал сообществ подтверждает, что бактерии пелоидов содержат основные гены метаболизма углеводов, липидов, витаминов, аминокислот и нуклеотидов, а также способны утилизировать ксенобиотики. Впервые охарактеризован микробиом лечебных грязей месторождения Таборли-3. Мониторинг состава микробных сообществ лечебных грязей является важной составляющей для оценки вклада микроорганизмов и их метаболитов в оздоровительный эффект пелоидотерапии.
Пелоиды, торфяные грязи, санитарно-бактериологический анализ, микробиом, метагеном, функциональный профиль
Короткий адрес: https://sciup.org/147251161
IDR: 147251161 | УДК: 581.522 | DOI: 10.17072/1994-9952-2025-1-21-31
Текст научной статьи Микробиологический анализ торфяной лечебной грязи месторождения Таборли-3
Под лечебными грязями (пелоидами) понимаются природные коллоидальные органоминеральные образования (иловые, торфяные, сопочные), обладающие высокой пластичностью, теплоемкостью и медленной теплоотдачей, содержащие биологические активные вещества (соли, газы, витамины, ферменты, гормоны и др.) и живые микроорганизмы1.
Торфяные грязи образуются вследствие разложения высших растений в местностях, подвергающихся заболачиванию, чаще вблизи пресных водоемов2. Они представляют собой болотные отложения торфов высокой степени разложения (более 40%), преимущественно органического состава (более 50% от сухого вещества)3. Провинция торфяных грязей на севере граничит с тундрой, на юге ‒ с лесостепной и степной зонами, охватывает более 80% территории России. Практически в любой области этой территории можно выявить месторождения торфяных грязей. Это, как правило, пресноводный бессульфидный торф, лечебная значимость которого обуславливается высокими тепловыми свойствами и большим количеством органических веществ, в том числе признающихся терапевтически активными ‒ гуминовых кислот, липидов, битумов [Ялтанец и др., 2004]. Данные о торфяных лечебных грязях, приведенные в литературе, подтверждают ее терапевтическую эффективность в отношении хронических неспецифических заболевания легких, астмы и заболевания верхних отделов ЖКТ [Антипова и др., 2012]; также применяются при реабилитации пациентов после операций на позвоночнике [Гайдукова и др., 2023].
Таборли-3 ‒ действующее месторождение торфяных шламов (грязей), находится на пойменной террасе р. Чаж в Агрызском р-не Республики Татарстан (рис. 1) [Таборли: Российский федеральный геологический фонд, 2023]. Грязи используются в Татарстане – в санатории «Шифалы-Су Ижминводы» [Tatarica: Татарская энциклопедия, 2023], спортивно-оздоровительном комплексе санатория-профилактория «Ян» (Альметьевский р-н), и также в санаториях Удмуртии «Варзи-Ятчи» и «Металлург» [Перспективы развития…, 2020]. Запасы таборлинского месторождения лечебной грязи значительны, что обусловливает возможность развития сети грязелечебниц в прилегающих и удаленных регионах. В Республике Татарстан известно 8 месторождений лечебной грязи с запасами около 900 тыс. м3 [Tatarica: Татарская энциклопедия, 2023]. Наиболее крупные – это месторождение торфяных грязей Таборли-3 (Агрызский р-н) и Верхняя Мочажина (Лениногорский р-н). Разрабатываются месторождения сапропе- левых грязей (Бугульминский р-н) и иловых лечебных грязей (Азнакаевский р-н). На сегодня наиболее изученными являются грязи Сакского месторождения (Крым), которые характеризуются наличием гипса, галита, кальцита, арагонита и бассанита [Максимов и др., 2021], а жидкая фаза представлена поровым раствором, содержащим хлориды и магниево-натриевые растворимые соли вместе с комплексом органических веществ [Антипова и др., 2012]. К сожалению, о составе пелоидов Татарстана практически ничего не известно; также отсутствуют данные о химических, физических, радиологических и микробиологических характеристиках торфяной грязи месторождения Таборли-3, не опубликованы и результаты, подтверждающие ее терапевтические эффекты. Однако, в соответствии с информацией на официальном сайте санатория «Шифалы-Су Ижминводы», лечебные грязи месторождения Таборли-3 с успехом применяются для лечения и профилактики широкого круга заболеваний опорно-двигательного аппарата, нервной системы, органов малого таза, а также кожных и ряда других заболеваний [Санаторий Шифалы Су Ижминводы, 2023]. В результате жизнедеятельности микроорганизмов в грязь попадают биологически активные вещества: сероводород, липиды, каротиноиды, ферменты оксидоредуктазы и гидролазы, витамины, гормоноподобные вещества.
Рис. 1 . Местоположение месторождения торфяной грязи Таборли-3 [Паспорт месторождения …, 2023] [Location of the Taborli-3 peat mud deposit [Taborli-3 field passport, 2023]
В связи с вышеизложенным, целью настоящей работы стал анализ микробного состава торфяных пе-лоидов месторождения Таборли-3 в соответствии с рекомендуемыми нормами санитарнобактериологического исследования параллельно с характеристикой таксономического спектра культивируемых микроорганизмов, молекулярно-генетическому определению прокариотического метагенома и его функционального потенциала.
Материалы и методы
Подготовка образцов пелоидов и микробиологическое исследования
В 2021 г. проведен анализ проб лечебной грязи (п = 7) месторождения Таборли-3, расположенного в Агрызском р-не Республики Татарстан (рис. 1), Санитарно-бактериологический анализ пелоидов проводили в соответствии с Методическими указаниями4.
Отобранные образцы пелоидов гомогенизировали и отбирали 1 г влажной массы, готовили серию последовательных разведений в стерильной дистиллированной воде и высевали на рекомендованные среды для подсчета колониеобразующих единиц (КОЕ). Общее количество микроорганизмов определяли на неселективной среде – мясопептонном агаре (компания BioMedia, РФ). Для выявления энтеробактерий использовали лактозопептонную среду Эйкмана (ООО Биотехновация); для выделения и грамотрица-тельных микроорганизмов кишечной группы производили высев на среду Эндо (Микролаб, представи- тель Laboratorios Conda в РФ). Для обнаружения грибов медицинского значения применяли среду Сабуро (BioMedia) для солеустойчивых микроорганизмов, в том числе коагулазоположительных стафилококков ‒ желточно-солевой агар производства ВНИИМС (ФГБНУ «ФНЦ пищевых систем им. В.М. Горбатова» РАН), для синегнойной палочки ‒ цетримидный агар (BioMedia). Результаты представляли как среднеарифметическое число со стандартным отклонением по исследованным 7 образцам. Таксономическую идентификацию чистых культур всех выделенных микроорганизмов проводили методом времяпролетной масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией MALDI-TOF-MS на масс-спектрометре Vitek MS (производства БиоМерье (bioMerieux), Франция).
Метагеномный анализ сообщества бактерий
Из поступивших образцов пелоидов выделяли общую ДНК с использованием набора Miniprep Kit (Axygen, США) согласно протоколу производителя. Полученную ДНК нормализовали до концентрации 10 нг/мкл. Для подтверждения качественного выделения ДНК проводили амплификацию гена 16S рРНК, по области V3—V4 гена 16s рРНК бактерий с помощью полимеразной цепной реакции и гель-электрофореза. С помощью Illumina MiSeq была проведена подготовка библиотеки и секвенирование. Выбор оперативной таксономической единицы (OTU) осуществляли при пороге идентичности 97% и классифицировали по справочной базе данных Greengenes 13-8-99 [DeSantis et al., 2006]. Оценку функциональных профилей сообществ осуществляли на платформе iVikodak с использованием инструмента Global Mapper [Nagpal et al., 2019].
Результаты
Стандартный санитарно-бактериологический анализ образцов пелоидов месторождения Таборли-3 выявил присутствие 12 основных видов культивируемых бактерий (табл. 1). Только одна из 7 проб не соответствовала гигиеническим нормативам по показателю Pseudomonas aeruginosa , обнаружение которой недопустимо в грязях, готовых к применению. Данный факт свидетельствует о важности и необходимости соблюдения регламента термообработки при пробоподготовке грязи перед ее использованием.
Таблица 1
Таксономическая идентификация и количественный состав культивируемых бактерий торфяной лечебной грязи месторождения Таборли-3, поступающей в санатории Республики Татарстан.
Представлены средние значения 7 образцов
[Taxonomic identification and quantitative composition of cultivated bacteria of peat medicinal mud from the Taborli-3 deposit, supplied to sanatoriums of the Republic of Tatarstan. The average values of 7 samples are presented]
|
№ |
Идентифицированные микроорганизмы |
Σ колоний микроорганизмов, выросших из 7 образцов пелоидов (×104/г пелоида) |
% |
|
1 |
Bacillus firmus |
245±15 |
87.7 |
|
2 |
Lysinibacillus fusiformis |
10±2 |
3.6 |
|
3 |
Micrococcus luteus |
3±1 |
1.1 |
|
4 |
Rhizobium radiobacter |
3±1 |
1.1 |
|
5 |
Brevibacillus spp |
3±1 |
1.1 |
|
6 |
Staphylococcus hominis |
3±1 |
1.1 |
|
7 |
Paracoccus yeei |
3±1 |
1.1 |
|
8 |
Bacillus megarerium |
2±1 |
0.7 |
|
9 |
Staphylococcus warneri |
2±1 |
0.7 |
|
10 |
Staphylococcus pasteuri |
2±1 |
0.7 |
|
11 |
Brevundimonaa diminuta |
2±1 |
0.7 |
|
12 |
Pseudomonas aeruginosa* |
1 |
0.4 |
|
Итого |
279 |
Примечание: * обнаружен только в одном образце.
Как видно из данных табл. 1, среди выделенных микроорганизмов доминировал вид Bacillus firmus , часто встречающийся в различных почвах. Этот вид включает штаммы, умеренно устойчивые к щелочам (pH от 6.5 до 8.5), и алкалофильные (pH до 10.5) [Guffanti et al., 1980]. B. firmus может участвовать в ассоциативной азотфиксации [Злотников и др., 2007], которая способствует более гибкому реагированию на экологические факторы, позволяет полнее использовать потоки энергии и глубже утилизировать субстраты по сравнению с чистыми культурами [Вавилин, 1986].
Также относительно часто встречались изоляты Lysinibacillus fusiformis . По данным литературы, различные штаммы L. fusiformis выделяются из сельскохозяйственных почв и производственных сточных вод. Некоторые штаммы проявляют высокую протеолитическую активность в отношении казеина, обладают высокой липолитической активностью [Нагызбеккызы и др., 2022] Штаммы L. fusiformis проявляют антагонистическую активность в отношении других бактерий [Марданова и др., 2015] и могут использоваться в биоремидиации [Mehta et al., 2015].
Перечисленные выше свойства B. firmus и L. fusiformis иллюстрируют их участие в процессах биоремедиации и повышении лечебных свойств грязей.
Метагеномный анализ позволил установить, что в пелоидах доминируют бактерии филумов Proteobacteria (36%) и Firmicutes (22%) (рис. 2 А). Стоит отметить, что в пелоидах присутствуют и цианобактерии (11%), являющиеся наиболее сложно организованными и морфологически дифференцированными прокариотами, способными к оксигенному фотосинтезу.
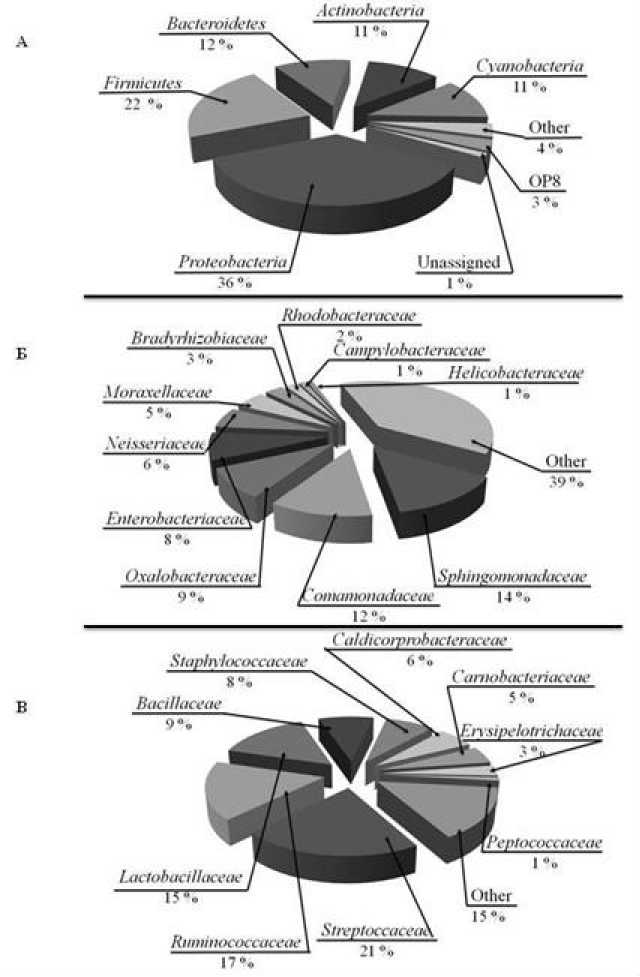
Рис. 2 . Таксономическая идентификация бактерий пелоидов месторождения Таборли-3: А – согласно филумам, Б – внутри филума Firmicutes , В – внутри филума Proteobacteria
[Taxonomic identification of bacteria from peloids of the Taborli-3 deposit:
A – according to phyla, Б – within the Firmicutes phylum, В – within the Proteobacteria phylum]
Внутри филума Firmicutes преобладали представители семейства Sphingomonadaceae (14%) (рис. 2Б), – грамотрицательные бактерии, содержащие гликозилцерамиды в своей внешней мембране [Kawahara et al., 2002]. Они являются многочисленными в окружающей среде, но не в кишечнике человека, и не являются патогенными [Nandy et al., 2013]. Второе место по численности занимает семейство Comamonadaceae (12%), аэробные грамотрицательные оксидазоположительные палочки, которые обычно встречаются в почве, воде и на растениях, но редко вызывают инфекции у человека.
Среди филума Proteobacteria выявлено высокое содержание стрептококков, руминикокков и лактобацилл (рис. 2В). Семейство Streptococcaceae включает шаровидные аспорогенные грамположительные хемоорганотрофные факультативно-анаэробные бактерии, присутствующие у человека в составе нормальной микрофлоры верхних дыхательных путей; также стрептококки, родственные Streptococcus sanguis , представляют собой основной сегмент бактериальной флоры некоторых почв. Стрептококки имеют сложные питательные потребности и погибают при пастеризации, что косвенно подтверждается отсутствием культивируемых форм этих бактерий в пелоидах. Руминококки – семейство грамположи-тельных неподвижных анаэробных аспорогенных бактерий, которые расщепляют целлюлозу, заселяют рубец жвачных и толстую кишку травоядных животных, а также входят в состав резидентной микрофлоры толстой кишки человека. Присутствие лактобацилл в пелоидах имеет особое значение, поскольку они участвуют в сбраживании травянистой биомассы с образованием спектра органических кислот, включая молочную, тем самым препятствуют развитию в пелоидах плесневых грибов.
Оценка функционального потенциала микробиома пелоидов подтверждает многообразие процессов, которые осуществляют бактерии. Очевидно, что большинство генетических детерминант относится к основным метаболическим процессам, таким как обмен углеводов, витаминов, аминокислот, нуклеотидов, терпеноидов, поликетидов (табл. 2). В то же время не исключена возможность продукции факторов устойчивости к антибиотикам, например, ферментов бета-лактамаз, разрушающих пенициллиновое кольцо, или генов, участвующих в развитии бактериальных инфекций. Метагеномный и функциональный анализы существенно расширяют наши познания о спектре микроорганизмов пелоидов, однако классический санитарно-бактериологический анализ по-прежнему имеет решающее значение для определения безопасности применения лечебных грязей.
Таблица 2 Функциональная активность бактериальных сообществ лечебной грязи месторождения Таборли-3
[Functional activity of bacterial communities in therapeutic mud of the Taborli-3 deposit]
|
Число генов |
Функции |
|
32113,89 |
Углеводный обмен |
|
9254,55 |
Метаболизм терпеноидов и поликетидов |
|
7289,53 |
Биодеградация и метаболизм ксенобиотиков |
|
5300,23 |
Устойчивость к антибиотикам |
|
6398,43 |
Инфекционные заболевания бактериальные |
|
6109,62 |
Липидный обмен |
|
10077,31 |
Метаболизм кофакторов и витаминов |
|
8651,81 |
Энергетический обмен |
|
14671,70 |
Аминокислотный обмен |
|
10007,93 |
Нуклеотидный метаболизм |
|
8285,88 |
Биосинтез вторичных метаболитов |
|
611,28 |
Экологическая адаптация |
|
12296,82 |
Репликация |
|
2434,72 |
Мембранный транспорт |
Обсуждение
Проведенные исследования выявили преобладание в пелоиде грамотрицательных бактерий филумов Proteobacteria (36%) и грамположительных бактерий филума Firmicutes (22%). За ними с примерно равными долями следовали бактероиды, актиномицеты и цианобактерии (рис. 2А). Мы сочли возможными приводить принятые ранее номенклатурные названия филумов, поскольку использование новой номенклатуры 2021 г. (соответственно, Bacillota, Pseudomonadota, Bacteroidota, Actinomycetota и Cyanobacteriota) оспаривается многими авторами [Oren et al., 2022]. Естественно, что выделение и определение метаболического потенциала разнообразных микроорганизмов из пелоидов не входит в протоколы санитарно-бактериологического анализа и представляет собой отдельную масштабную задачу, требующую использования широкого спектра разнообразных сред и подбора условий культивирования. На основе анализа метагенома пелоидов можно сделать определенный вывод о вкладе доминирующих филумов в физиологическую активность лечебных грязей. В частности, обнаружение стрептококков косвенно свидетельствует о наличии в пелоиде их внеклеточных метаболитов, таких как стрептолизин, стрептокиназа, лейкоцидин, бактериоцины (рис. 2В). Наличие руминококков вследствие их метаболической активности вносит вклад в расщепление остатков целлюлозы в пелоиде с образованием метана. Лактобациллы – известные продуценты не только молочной, но и других органических кислот, считаются наиболее значимой группой пробиотических бактерий.
В то же время анализ культивируемых бактерий, определенных нами в составе пелоида месторождения Таборли-3, показывает практически абсолютное доминирование двух видов – Bacillus firmus и Lysinibacillus fusiformis (см. табл. 1).
-
B. firmus не обладает риском для здоровья человека и используется в некоторых биологических процессах, в частности, для энзиматического гидролиза целлюлозосодержащих субстратов [Teeravivattanakit et al., 2022]. Этот вид также обладает высокой ксиланолитической активностю, улучшая доступ целлюлолитических ферментов к целлюлозе [Teeravivattanakit et al., 2022], что важно для разложения растительных остатков при созревании пелоида.
Более того, B. firmus эффективен в процессе биодеградации ксенобиотиков, в частности, ди-2-этилгексилфталата (ДЭГФ), который используется в качестве пластификатора при производстве пластмасс и выбрасывается на свалки. Так, штамм B. firmus MP04 использует ДЭГФ в качестве единственного источника углерода при pH 7, концентрации соли 5%, температуре от 20 до 37°C [Rashmi et al., 2023]. Описан гипертолерантный к мышьяку штамм B. firmus L-148, который может переносить концентрацию мышьяка более 3М и окислять 75 мМ арсенита [As(III)], в том числе в присутствии тяжелых металлов [Bagade et al., 2020]. B. firmus способен разлагать краситель Reactive Blue 160 (RB160), используемый в текстильной красильной промышленности и попадающий в воду и почвы (в бассейне р. Нойял, штат Тамил Наду, Индия), с образованием нетоксичных продуктов разложения [Barathi et al., 2019]; способен метаболизировать фипронил, который широко используется против различных насекомых-вредителей и создает серьезные проблемы для окружающей среды [Mandal et al., 2014].
-
B. firmus оказался сильным поликлональным активатором В-лимфоцитов мыши, влияющим на все изотипы Ig и повышающим синтез IFN-гамма и IL-10. Учитывая стимулирующий эффект на образование IgA и стимуляцию макрофагов, B. firmus представляется перспективным адъювантом слизистой оболочки и/или пробиотиком [Prokesová et al., 2002].
Данные литературы об различных биологических активностях Lysinibacillus fusiformis свидетельствуют, что этот вид способен к деградации ксенобиотиков [Adefiranye et al., 2023]; например, гербицида диурона, что делает его перспективным участником процессов биоремедиации участков, загрязненных диуроном [Reyes-Cervantes et al., 2021]. Штамм L. fusiformis B30 эффективно удаляет азотистые загрязнения посредством гетеротрофной нитрификации и аэробной денитрификации без накопления нитритов, переводя аммонийный азот в газообразный [Wu et al., 2023]. Штамм L. fusiformis MK559526 продуцирует биосурфактант с высоким потенциалом эмульгирования и значительным снижением поверхностного натяжения, что определяет значение штамма в процессе биоремедиации почв [John et al., 2021].
Эндофитные бактерии L. fusiformis B27, выделенные из Rhizophora mucronata , являются перспективным продуцентом L-аспарагиназы, которая применяется как противоопухолевое цитостатическое средство в терапии некоторых лейкозов [Prihanto et al., 2019]. Штамм L. fusiformis S4C11, выделенный из корней яблони в северной Италии, обладает противогрибковой активностью в отношении различных возбудителей и способен препятствовать прорастанию конидий Botrytis cinerea , а также ингибировать ее рост за счет продукции летучих органических молекул [Passera et al., 2021].
Таким образом, доминантные культивируемые бактерии пелоидов месторождения Таборли-3 имеют высокий потенциал полезных свойств, подтверждающих их вклад в детоксифицикацию возможных промышленных загрязнений пелоидов, а также в их оздоравливающий эффект.
Заключение
Впервые охарактеризован микробиом торфяных грязей (пелоидов) месторождения Таборли-3 (Республика Татарстан), применяющихся в санаториях Татарстана для лечения и профилактики широкого круга заболеваний опорно-двигательного аппарата, нервной системы, органов малого таза, а также кожных и ряда других заболеваний. Органоминеральные комплексы пелоидов содержат продукты разложения органических веществ, соли, газы, биостимуляторы, метаболиты организмов, а также живые микроорганизмы, вносящие вклад в оздоравливающий эффект пелоидов.
Согласно полученным санитарно-бактериологическим характеристикам, исследованные пелоиды в основном удовлетворяют требованиям безопасности: только в одной пробе из 7-и была обнаружена единственная колония Pseudomonas aeruginosa . Молекулярно-генетический анализ сообщества микроорганизмов на основе секвенирования 16S рРНК показал, что в сообществе преобладают бактерии филумов
Firmicutes (22%) и Proteobacteria (36%). Среди семейств доминировали представители Streptococcaceae , Ruminicoccaceace, Lactobacillaceae, Comamondaceae и Sphingomonadaceae . Анализ функционального потенциала прокариотического метагенома выявил, что бактерии пелоидов содержат основные гены метаболизма углеводов, липидов, витаминов, аминокислот и нуклеотидов, а также способны утилизировать ксенобиотики.
Важно отметить, что доминирующими культивируемыми микроорганизмами были безопасные для человека бактерии двух видов – Bacillus firmus и Lysinibacillus fusiformis , для которых подтверждена способность к деструкции ксенобиотических загрязнений и антифунгицидный потенциал. Выявление структуры и функций микробных сообществ пелоидов представляет собой современное перспективное направление, которое позволит во многом объяснить полезные свойства лечебных грязей.


