Микробиологический синтез никотинамидадениндинуклеотида и его ингибирование
Автор: Цыренов В.Ж., Санданов А.А., Козин В.А.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Биологические науки
Статья в выпуске: 5 (50), 2014 года.
Бесплатный доступ
Осуществлен микробиологический синтез никотинамидадениндинуклеотида (НАД) различными коринеподобными бактериями. Исследовано ингибирующее действие НАД и НАДФ. Установлено, что их действие направлено на аденилаткиназу.
Над, salvage биосинтез, ингибирование, аденилаткиназа
Короткий адрес: https://sciup.org/142142931
IDR: 142142931 | УДК: 615.9+577,472
Текст научной статьи Микробиологический синтез никотинамидадениндинуклеотида и его ингибирование
Никотинамидадениндинуклеотид (НАД) это ценное биологически активное вещество, которое находит применение в медицине в качестве лекарства-иммуномодулятора, а также как реактив и компонент диагностикумов. В настоящее время производство НАД в России отсутствует.
Перспективным методом получения НАД является сэлвидж-синтез, осуществляемый штаммами-продуцентами из группы коринеподобных бактерий.
В статье приведены сравнительные исследования различных штаммов коринеподобных бактерий на предмет возможности их использования в качестве биологических объектов для постановки микробиологического синтеза НАД. Исследованы особенности процессов регуляции фосфорилирования в аденилатной ветви сэлвидж-синтеза НАД, в частности, ингибирование синтеза.
Материалы и методы
Микроорганизмы, культивирование
Объектом исследования явились штаммы коринебактерий: Corynebacterium ammoniagenes ВСТИ 403, Corynebacterium flavum ВСТИ 301, Corynebacterium species ВСТИ 4, коллекция кафедры биотехнологии ВСГУТУ, коллекция ФГУП «ГосНИИгенети-ка». Corynebacterium ammoniagenes АТСС 6872 коллекция Института биохимии им А.Н. Баха, а также типичные представители родов коринеподобных бактерий Arthrobacter citreus 278, Corynebacterium insidiosum 246, Corynebacterium stationis 336, Corynebacterium linens 242 Rhodococcus globerulus 226.
Подготовка питательной среды
Посевная среда [1] содержала: 20 г D-глюкозы моногидрат, 10 г казеинового пептона, 10 г дрожжевого экстракта и 2,5 г NaCL на 1 л воды. Перед стерилизацией pH доводили до 7,23 Н NaOH. Инокулят (10%) готовили на посевной среде. Культуру микроорганизмов объемом по 50 мл выращивали в колбах Эрленмейера объемом 750 мл.
Ферментационная среда в 1 л содержала: 100 г глюкозы моногидрата, дрожжевого экстракта, 10 г KH2PO4, 10 г K2HPO4, 10 г MgSO4∙7H2O; 6 г мочевины, стерилизованной отдель- но, и биотин (30 мкг/л) добавляли после фильтрации, начальный рН 7,4. Для удовлетворения потребности C. ammoniagenes в марганце в эту среду добавляли 2 мкМ MnCL2.
Среду по 50 мл разливали в качалочные колбы на 750 мл, доводили рН 5 н, NaOH до 7,6 и стерилизовали в течение 15 мин при 1 атм. Мочевину стерилизовали отдельно при 0,5 атм в течение 15 мин и добавляли в колбы (0,6%) после стерилизации. Биотин стерилизовали пропусканием через 0,22 мкм фильтр и добавляли в колбы в количестве 30 мкг/л. Фосфаты (К 2 НРО 4 + КН 2 РО 4 ) готовили отдельно и добавляли в колбы к основной части ферментационной среды.
Условия ферментации
Культуру с 2-суточного косяка петлей переносили в 50 мл посевной среды и помещали на качалку (220 об/мин). После суток роста при 30±1°С посевной культурой в количестве 10 об.% инокулировали среду для биосинтеза. Для осуществления сэлвидж-синтеза в среду для биосинтеза добавляли предшественники: аденин никотинамид по 2 мг/мл соответственно на 2-е сут ферментации. Продолжительность ферментации составляла 2-4 сут.
Определение роста
Наблюдения за ростом клеток проводили измерением оптической плотности при 578 нм. Отбирали 1 мл аликвоту культуральной жидкости, разбавляли ее 3 мл дистиллированной воды и добавляли 100 мкл 2 Н HCL с целью растворения осажденных кристаллов. Для предотвращения слипания клеток бактерий добавляли 5 мкл Твин 80 (20% вес/объем). Осадок после низкоскоростного центрифугирования ресуспендировали в 1 мл дистиллированной воды и измеряли мутность. Для вычисления сухого веса пользовались калибровочной кривой.
Идентификация и количественное определение НАД и нуклеотидов
Идентификацию и количественное определение НАД и нуклеотидов осуществляли после отделения клеток на низкоскоростной центрифуге. Высокопроизводительная жидкостная хроматография (ВЭЖХ) НАД с градиентной элюцией выполнялась по методу [4] с использованием хроматографа Agilent 1100 (производство США), оснащенного ультрафиолетовым детектором переменной частоты, установленным на 254 нм. Сольвент А содержал 20 мл концентрированной фосфорной кислоты в 800 мл деионизованной воды доведенным до 4,0 рН с помощью 25% NaOH, и объемом, доведенным до 1 л. Сольвент В содержал равные объемы ацетонитрила и метанола. Все реактивы пропускали через фильтр (5 мкм). Нуклеотиды элюировали при 37 ºС на колонке С 18 5 µ. Для использования в качестве стандартов в сольвенте А растворяли рибонуклеотиды 5'-АМФ и АТФ (0,1 М стандартный раствор). Скорость элюции во всех опытах устанавливали 0,7 мл/мин.
Результаты и обсуждение
Исследование способности коринеподобных бактерий к сэлвидж-синтезу НАД
В качестве объектов исследования по отбору активного штамма-продуцента НАД использовано 11 культур коринеподобных бактерий. Изучение роста бактерий показало, что все отобранные штаммы-продуценты накапливали биомассу в заданных условиях. Характеры кривых роста выбранных штаммов-продуцентов идентичны. Наибольший рост был показан у С. Аmmoniagenes ВСТИ 404 , а наименьший – у Arthrobcter citreus 278.
Исследование биосинтеза показало, что накопление НАД лучше всего происходит в присутствии детергентов. Наиболее эффективным оказался цетилпиридиний хлорид в концентрациях 1-2 мг/мл (табл.). Результаты ВЭЖХ показали, что в условиях ферментации, когда в культуру микроорганизмов вносятся предшественники – аденин и никотинамид, наблюдается биосинтез НАД (рис. 3).
При использовании в синтезе С. аmmoniagenes (Brevibacterium) АТСС 6872, многократно описанного штамма-продуцента нуклеотидов и НАД, а также продуцента нуклеотидов, С. аmmoniagenes ВСТИ 404 наблюдается значительное накопление НАД. Другие микроорганизмы синтезировали небольшие количества НАД (до 0,5 мг/мл), АТФ, а также следовые количества УФ-поглощающих веществ (рис. 1).
Таблица
Динамика накопления НАД в процессе микробиологического синтеза
|
Микроорганизмы |
Выход НАД, мг/мл |
|||||
|
12 ч |
24 ч |
48 ч |
||||
|
О |
К |
О |
К |
О |
К |
|
|
C. ammoniagenes АТСС 6872 |
1,38 |
0,21 |
2,04 |
0,16 |
2,59 |
0,71 |
|
C.ammoniagenes ВСТИ 404 |
1,9 |
0,2 |
3,16 |
0,64 |
2,68 |
0,67 |
|
C. flavum ВСТИ 301 |
0,35 |
0,31 |
0,52 |
0,26 |
0,43 |
0,37 |
|
C. ammoniagenes ВСТИ 403 |
1,56 |
0,18 |
3,27 |
0,76 |
3,04 |
0,60 |
|
A. citreus 278 |
0,05 |
0,25 |
0,11 |
0,05 |
0,20 |
0,01 |
|
C. insidiosum 246 |
0,09 |
0,25 |
0,19 |
0,05 |
0,09 |
0,07 |
|
C. stationis 336 |
0,35 |
0,17 |
0,38 |
0,37 |
0,31 |
0,4 |
|
C. linens 242 |
0,4 |
0,11 |
0,31 |
0,24 |
0,19 |
0,22 |
|
R. globerulus 226 |
0,17 |
0,15 |
0,29 |
0,34 |
0,26 |
0,31 |
|
Arthrobcter species ВСТИ 5 |
0,1 |
0,12 |
0,25 |
0,2 |
0,11 |
0,21 |
Примечание. О опыт, ферментация в присутствии детергента; К контроль, ферментация в отсутствие детергента. Аденин, никотинамид ЦПХ добавляли по 2 мг/мл
В ходе исследования динамики рН было показано, что в процессе ферментации НАД в первые 12 ч происходит увеличение рН 6,7 до 8,4 у C. ammoniagenes АТСС 6872 и с 7 до 8,5 у C. ammoniagenes ВСТИ 403 . После 12 ч культивирования наблюдали стабилизацию рН до 7 в обоих случаях ферментации: при использовании штаммов-продуцентов C. ammoniagenes АТСС 6872 и C. ammoniagenes ВСТИ 404 .
Установлено, что наибольшей способностью к синтезу НАД обладают штаммы C. ammoniagenes ВСТИ 404 и C. ammoniagenes ВСТИ 403 . Их положительным свойством является то, что их способность синтезировать нуклеотиды не лимитируется содержанием Mn++ в среде культивирования.
Накопление НАД в условиях сверхсинтеза не достигало 100% выхода от количества внесенных предшественников. Это позволило предположить, что при сверхсинтезе НАД действуют регуляторные механизмы, одним из которых, возможно, является ретроингибирование.
Внесение в культуральную среду экзогенных НАД, НАДФ и НАДН показало, что эти соединения ингибировали сверхсинтез НАД. Ингибирующий эффект НАД проявляется при концентрации его 4 мг/мл. НАДФ оказывал более сильный эффект (рис. 1).
Известно, что ферменты сэлвидж-синтеза НАД находятся под контролем АТР, потому представлялось интересным выяснить, направлено ли обнаруженное нами ретроингибирующее действие НАД и НАДФ на образование АТР, являющегося промежуточным метаболитом синтеза НАД.
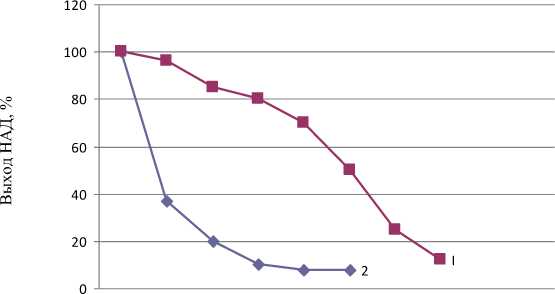
Рис. 1. Влияние НАД (I) и НАДФ (2) на сверхсинтез НАД (время синтеза 45 ч)
В отсутствие пиридинового предшественника и в присутствии АМФ наблюдался сверхсинтез АТР. При изучении влияния НАД и НАДФ на образование АТР из АМР было обнаружено, что уровень накопления АТР из АМР снижался при внесении в среду НАД (3 мкмоль/мл) и НАДФ (2 мкмоль/мл). НАД ингибировал синтез АТР на 56%, НАДФ на 17%. Поскольку в качестве предшественника использовался АМР, заключили, что одной из точек приложения ингибирующего действия НАД и НАДФ на сверхсинтез НАД является синтез АТР и АМР.
Для подтверждения этих результатов исследована активность фосфорилирования АМР бесклеточными экстрактами в качестве источника фосфорилирующих ферментов с использованием радиоактивного [С14] – АМР.
Максимальное угнетение реакции фосфорилирования АМР наблюдалось при одной и той же концентрации обоих эффектов – 5 мМ (рис. 2).
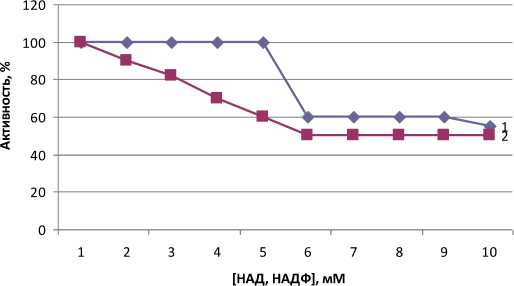
Рис. 2. Влияние НАД (I) и НАДФ (2) на синтез АТФ бесклеточными C. ammoniagenes
Для того чтобы отделить аденилаткиназу от нуклеозиддифосфосиназы, при очистке использовали кислотную обработку бесклеточного экстракта С. ammoniagenes АТСС 6872 I NHCL до рН 3 с последующим дробным высаливанием сернокислым аммонием от 35 до 55 % насыщения.
Активность аденилаткиназы ингибировалась на 50% под действием НАД и НАДФ при концентрации эффекторов 3 и 3,5 мМ соответственно (рис. 3).
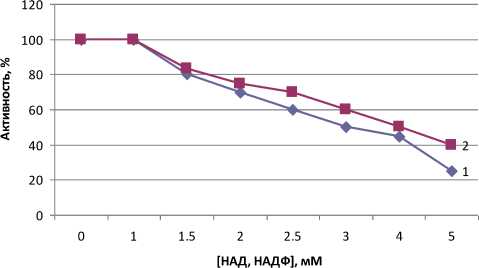
Рис. 3. Ингибирование NАD (I) и NADР (2) частично очищенной аденилаткиназы
Выводы
-
1. Для осуществления микробиологического синтеза никотинамидадениндинуклеотида (НАД) методом ферментации отобраны штаммы-продуценты Corynebacterium ammoniagenes ВСТИ 404 и Corynebacterium ammoniagenes ВСТИ 310.
-
2. Установлено, что ингибирующее влияние микробиологического синтеза НАД осуществляется конечными продуктами синтеза.


