Микробиологический скрининг соединений с потенциальной противолепрозной активностью среди вновь синтезированных соединений ряда пиримидина
Автор: Луценко А. В., Юшин М. Ю., Генатуллина Г. Н., Тырков А. Г., Аюпова А. К., Сароянц Л. В., Старикова А. А., Самотруева М. А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 2 т.38, 2023 года.
Бесплатный доступ
Цель: изучить влияние вновь синтезированных производных пиримидина на рост Mycobacterium lufu (M. lufu) и Mycobacterium tuberculosis H37Rv (M. tuberculosis H37Rv) при культивировании на среде Школьниковой.Материал и методы. Объектами исследований являлись 6 образцов -5-(арилметилиден)-2,4,6-пиримидин-2, 4,6(1Н,3Н,5Н)-трионов под лабораторными шифрами ТАГ1, ТАГ2, ТАГ3, ТАГ4, ТАГ5, ТАГ6 и 7 образцов 5-(гетарилметилиден)-2,4,6-пиримидин-2,4,6(1Н,3Н,5Н)-трионов под лабораторными шифрами ТАГ7, ТАГ8, ТАГ9, ТАГ10, ТАГ11, ТАГ12, ТАГ13. В качестве тест-культур использовали штаммы M. lufu и M. tuberculosis H37Rv. Антимикобактериальную активность изучаемых соединений исследовали методом серийных разведений.Результаты. Установлено, что все изучаемые соединения проявляют антимикобактериальную активность. Наибольший подавляющий эффект в отношении M. lufu отмечен у соединений ТАГ1, ТАГ4, ТАГ7, ТАГ12 и ТАГ13, который был сопоставим с таковым препарата сравнения - дапсона. По характеру ингибирующего воздействия на рост M.tuberculosis соединения под лабораторными шифрами ТАГ1, ТАГ4, ТАГ7 и ТАГ13 были сравнимы с изониазидом, а действие соединения ТАГ3 даже несколько превосходило препарат сравнения.Заключение. Среди изучаемых вновь синтезированных производных пиримидина наиболее выраженной антимикробной активностью как в отношении M. lufu, так и M. tuberculosis H37Rv обладают соединения под лабораторными шифрами ТАГ1, ТАГ4, ТАГ7 и ТАГ13, что позволяет рассматривать их в качестве наиболее перспективных веществ для дальнейших исследований по поиску антимикобактериальных, в том числе и противолепрозных препаратов.
Mycobacterium lufu, mycobacterium tuberculosis h37rv, 5-(арилметилиден)-2, 4, 6-пиримидин-2, 4, 6(1н, 3н, 5н)-трионы, 5-(гетарилметилиден)-2, 4, 6-пиримидин-2, 4, 6(1н, 3н, 5н)-трионы, антимикобактериальная активность, противолепрозная активность, метод серийных разведений
Короткий адрес: https://sciup.org/149142836
IDR: 149142836 | УДК: 57.083.134:579.873.21:547.853.3:615.28 | DOI: 10.29001//2073-8552-2023-38-2-218-226
Текст научной статьи Микробиологический скрининг соединений с потенциальной противолепрозной активностью среди вновь синтезированных соединений ряда пиримидина
ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ / EXPERIMENTAL INVESTIGATIONS
Conflict of interest:
Financial disclosure:
Mycobactеrium lufu, Mycobactеrium tuberculоsis ,5-(arylmethylidene)-2,4,6-pyrimi-dine-2,4,6(1Н,3Н,5Н)-triones, 5-(hetarylmethylidene)-2,4,6-pyrimidine-2,4,6(1Н ,3Н,5Н)-trions, antileprosy activity, serial dilution method.
the authors do not declare a conflict of interest.
the scientific article was carried out within the framework of the state task of the Ministry of Health of the Russian Federation No. 056-00113-21-00 in terms of conducting research on the topic “Development of methods for diagnosing and treating leprosy infection based on the principles of personalized medicine.”
Lutsenko A.V., Yushin М.Yu., Genatullina G.N., Tyrkov A.G., Ayupova A.K., Saroyants L.V., Starikova A.A., Samotrueva M.A. Microbiological screening of compounds with potential anti-lep activity among new synthesis compounds of the pyrimidine series. The Siberian Journal of Clinical and Experimental Medicine. 2023;38(2):218–226.
Глобальная стратегия Всемирной организации здравоохранения (ВОЗ) по борьбе с лепрой на 2021–2030 гг. направлена на достижение нулевых показателей автохтонных случаев заболевания, что ориентирует страны с высокой распространенностью лепры активизировать свою деятельность, а страны со спорадической заболеваемостью – полностью искоренить эту тяжелую болезнь.
Одним из направлений научных исследований, которые считаются ключевыми для этого стратегического периода, является поиск и разработка эффективных противо-лепрозных препаратов и их комбинаций [1].
Открытие в начале 40-х гг. XX в. противолепрозного действия сульфонов явилось эпохальным событием в мировой лепрологии, разделившим всю историю борьбы с лепрой на «досульфоновый» и «сульфоновый» периоды [2]. Внедрение сульфоновых препаратов многим исследователям представлялось окончательным решением проблемы лечения лепры, которое приведет к полной победе над этим тяжелым заболеванием. Однако уже в начале 50-х гг. прошлого столетия наряду с положительными результатами терапии больных лепрой с использованием препаратов сульфонового ряда появились сведения о том, что в некоторых случаях наблюдаемый клинический, гистологический и бактериоскопический регресс приостанавливался, и даже отмечались рецидивы заболевания [3].
Следующим наиболее значимым достижением в борьбе с лепрой стало внедрение метода комбинированной терапии заболевания, применяемого и в настоящее время, который включает использование трех основных препаратов: дапсона, рифампицина и лампрена, что привело к значительному снижению заболеваемости лепрой и уменьшению числа рецидивов [4–6].
Однако, несмотря на достигнутые успехи, лечение лепры остается все еще длительным, возникают сложности, связанные с побочными эффектами, непереносимостью тех или иных противолепрозных препаратов, входящих в схемы ВОЗ, развитием лекарственной резистентности. Кроме того, следует подчеркнуть, что на территории Российской Федерации зарегистрированы только дапсон и рифампицин. Отсутствие в схемах терапии лампрена снижает эффективность проводимого противолепрозного лечения, повышает шансы развития осложнений и устойчивости My с obacterium leprae ( M. leprae ) к применяемым препаратам. Для проведения полноценного этиотропного лечения больных лепрой и обеспечения эпидемиологической безопасности страны необходимо создавать эффективные схемы лечения данной патологии с использованием отечественных препаратов [5].
В настоящее время растет интерес к производным пиримидина как потенциально перспективным веществам для разработки и создания эффективных лекарственных препаратов, что во многом обусловлено широким спектром их фармакологического действия, в том числе противоопухолевого, противовирусного, противопрото-зойного, фунгицидного, а также антимикобактериального [7–10].
Цель: изучить влияние вновь синтезированных производных пиримидина на рост Mycobacterium lufu ( M. lufu ) и Mycobacterium tuberculosis ( M. tuberculosis ) при культивировании на среде Школьниковой.
Материал и методы
Объектом исследования являлись 6 образцов производных пиримидина – 5-(арилметилиден)-2,4,6-пирими-дин-2,4,6(1Н,3Н,5Н)-трионов под лабораторными шифрами ТАГ1, ТАГ2, ТАГ3, ТАГ4, ТАГ5, ТАГ6 и 7 образцов 5-(ге-тарилметилиден)-2,4,6-пиримидин-2,4,6(1Н,3Н,5Н)-три-онов под лабораторными шифрами ТАГ7, ТАГ8, ТАГ9, ТАГ10, ТАГ11, ТАГ12, ТАГ13, синтезированных на кафедре органической, неорганической и фармацевтической химии Астраханского государственного университета имени В.Н. Татищева по методикам, опубликованным ранее [11, 12]. Химические формулы изучаемых соединений приведены на рисунке 1.
Возбудитель лепры не культивируется на искусственных питательных средах, поэтому в настоящей работе в качестве тест-культур использовали штамм M. lufu, полу- ченный при содействии ВОЗ НИИ по изучению лепры, и штамм M. tuberculosis H37Rv, предоставленный бактериологической лабораторией Областной инфекционной клинической больницы имени А.М. Ничоги.
ТАГ 13
TAG 13
Рис. 1. Химические формулы вновь синтезированных производных пиримидина
Fig. 1. Chemical formulas of newly synthesized pyrimidine derivatives
M. lufu и M. tuberculosis традиционно используются для первичного отбора соединений с потенциальной противолепрозной активностью в экспериментах in vitro . Антимикобактериальную активность изучаемых соединений исследовали методом серийных разведений на среде Школьниковой [13]. Готовили по 13 пробирок для каждого соединения и препарата сравнения – дапсона для M. lufu и изониазида для M. tuberculosis . 10 пробирок для ряда серийных разведений и три пробирки с контролем: положительный контроль – посевы без добавления в среду веществ, контроль на стерильность среды Школьниковой – без посевов тест-культуры и соединений, контроль растворителя – посевы с димексидом в эквиобъемах.
Рабочий раствор изучаемых соединений получали путем растворения 4 мг изучаемого соединения в 0,5 мл димексида и 4,5 мл физиологического раствора. В каждую пробирку в ряду серийных разведений вносили по 5 мл среды Школьниковой. В первую пробирку в стерильных условиях добавляли 800 мкл рабочего раствора изучаемого соединения, содержание препарата в ней составляло 128 мкг/мл. Затем концентрация соединений в ряду серийных разведений убывала в 2 раза: 128 мкг/мл, 64 мкг/мл, 32 мкг/мл, 16 мкг/мл, 8 мкг/мл, 4 мкг/мл, 2 мкг/мл, 1 мкг/мл, 0,5 мкг/мл и 0,25 мкг/мл, после чего во все пробирки вносили по 0,2 мл рабочей взвеси микобактерий.
Для приготовления взвеси микобактерий использовали двухнедельную культуру M. lufu и четырехнедельную культуру M. tuberculosis , которые были синхронизированы холодом (+4 °С) в течение 72 ч. Количество микобактерий в суспензии определяли по стандарту мутности McFarland 0,5. Рабочая взвесь M. lufu содержала 106, M. tuberculosis – 108 микобактериальных клеток в 1 мл. Содержание M. lufu в каждой пробирке ряда последовательных разведений изучаемых веществ составляло 2 × 105, M. tuberculosis – 2 × 107 микробных тел. Эту процедуру проводили для каждого исследуемого вещества в 4
сериях повторных экспериментов. Посевы инкубировали в течение 10–12 дней: M. lufu – при температуре 31 °С, M. tuberculosis – при температуре 37 °С. По истечении этого срока визуально оценивали наличие роста в каждой из пробирок в соответствии с общепринятыми методиками [14].
Статистический анализ результатов определения концентраций соединений выполняли в пакете STATISTICA 10.0. Нормально распределенные количественные показатели описывали средними значениями и стандартными отклонениями ( M ± SD ). Для выявления статистически значимых различий средних значений показателей в независимых группах использовали t-критерий Стьюдента. Статистически значимыми различия считали при p ≤ 0,05.
Результаты и обсуждение
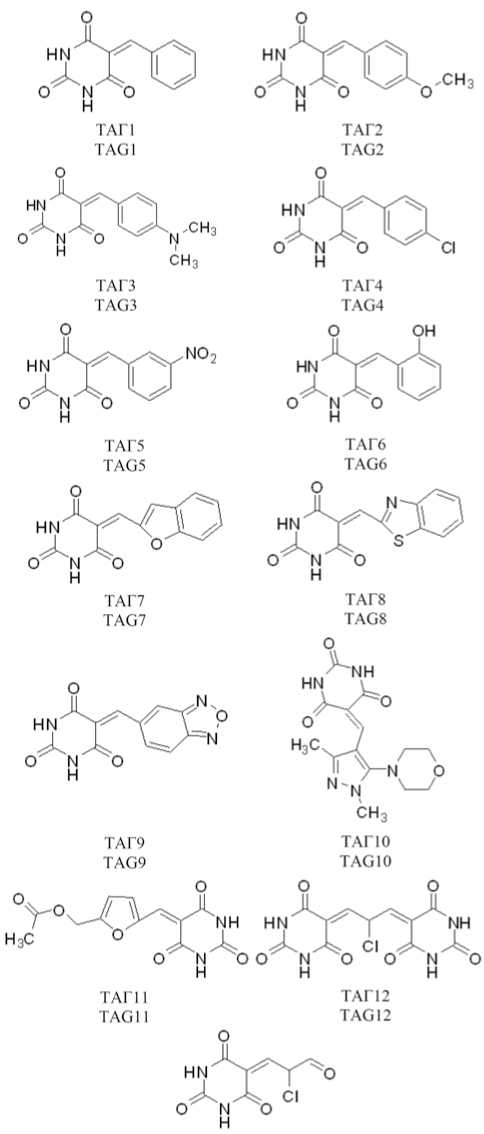
Интенсивность развития (помутнение, придонный рост, наличие пленки и взвеси) культур микобактерий в жидкой питательной среде Школьниковой в присутствии тестируемых соединений оценивали по 3-балльной системе: «–» (0) – отсутствие роста; «+» (1) – слабый рост; «++» (2) – умеренный рост; «+++» (3) – интенсивный рост. Результаты визуальной оценки антимикобактериальной активности вновь синтезированных производных пиримидина в отношении M. lufu приведены на рисунках 2, 3 и в таблице 1; а M. tuberculosis – на рисунках 4, 5 и в таблице 2.
Согласно полученным данным, во всех сериях эксперимента в положительном контроле наблюдали значительное помутнение среды, что характеризует интенсивный рост тестируемых микобактерий. В контроле на стерильность среда оставалась прозрачной. Под действием противолепрозного препарата дапсона в диапазоне концентраций 128–4 мкг/мл рост M. lufu не отмечался. В присутствии противотуберкулезного препарата изониазида в концентрациях 128–32 мкг/мл рост M. tuberculosis не наблюдался.
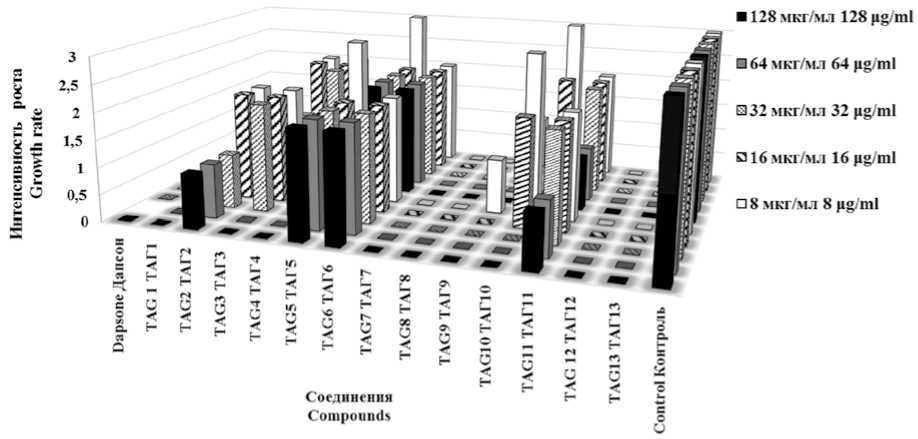
Рис. 2. Показатели визуальной оценки активности производных пиримидина в отношении роста M. lufu в диапазоне концентраций 128-8 мкг/мл Примечание: «–» (0) – отсутствие роста, «+» (1) – слабый рост, «++» (2) – умеренный рост, «+++» (3) – интенсивный рост.
Fig. 2. Indicators of visual assessment of the activity of pyrimidine derivatives in relation to the growth of M. lufu in the concentration range of 128-8 μg/ml Note: “-” (0) - no growth, “+” (1) - weak growth, “++” (2) - moderate growth “+++” (3) - intensive growth.
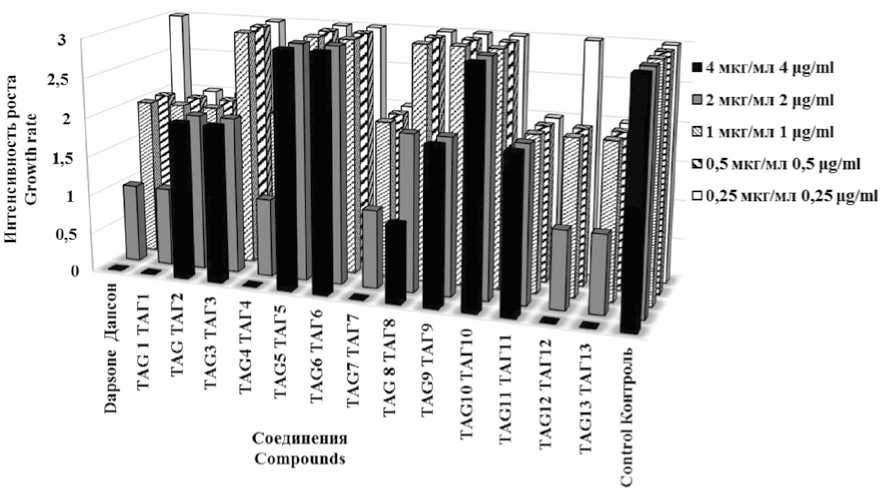
Рис. 3. Показатели визуальной оценки активности производных пиримидина в отношении роста M. lufu в диапазоне концентраций 4–0,25 мкг/мл Примечание: «–» (0) – отсутствие роста, «+» (1) – слабый рост, «++» (2) – умеренный рост, «+++» (3) – интенсивный рост.
Fig. 3. Indicators of visual assessment of the activity of pyrimidine derivatives in relation to the growth of M. lufu in the concentration range of 4-0.25 µg/ml Note: “-” (0) - no growth, “+” (1) - weak growth, “++” (2) - moderate growth, “+++” (3) - intensive growth.
Таблица 1. Антимикобактериальная активность изучаемых соединений в отношении M. lufu
Table 1. Antimycobacterial activity of the studied compounds against M.lufu
|
Соединения Compounds |
n |
Антимикобактериальная активность (мкг/мл) Antimycobacterial activity (µg/ml) |
|
Дапсон Dapsone |
4 |
3,5 ± 0,5 |
|
ТАГ1 TAG1 |
4 |
3,0 ± 0,58 |
|
ТАГ3 TAG3 |
4 |
64,0 ± 0,0 *** |
|
ТАГ4 TAG4 |
4 |
3,5 ± 0,5 |
|
ТАГ7 TAG7 |
4 |
3,0 ± 0,58 |
|
ТАГ8 TAG8 |
4 |
6,0 ± 1,15 |
|
ТАГ9 TAG9 |
4 |
14,0 ± 0 *** |
|
ТАГ10 TAG10 |
4 |
28,0 ± 4,0 *** |
|
ТАГ12 TAG12 |
4 |
3,5 ± 0,5 |
|
ТАГ13 TAG13 |
4 |
4,0 ± 0 |
Примечание: *** – p < 0,001, р – уровень значимости различий по сравнению с применением дапсона.
Note: *** - p < 0.001, p – significance level in relation to dapsone.
Соединения под лабораторными шифрами ТАГ1, ТАГ4, ТАГ7, ТАГ8, ТАГ12 и ТАГ13 действовали на культуру М. lufu практически идентично дапсону, являющемуся в данном исследовании препаратом сравнения. Несколько менее выраженным подавляющим эффектом в отношении М. lufu обладает соединение ТАГ9: полная прозрачность среды наблюдалась при концентрациях 128–16 мкг/мл. Соединения ТАГ3 и ТАГ10 подавляли рост М. lufu при концентрациях 128-64 и 128-32 мкг/мл соответственно. Вещества под лабораторными шифрами ТАГ2, ТАГ5, ТАГ6, ТАГ11 в исследуемых концентрациях полного подавляющего воздействия на рост данной культуры не оказывали. При этом наименее выраженный ингибирующий эффект продемонстрировали соединения ТАГ5 и ТАГ6.
Таблица 2. Антимикобактериальная активность изучаемых соединений в отношении M. tuberculosis H37Rv
Table 2. Antimycobacterial activity of the studied compounds against M. tuberculosis H37Rv
|
Соединения Compounds |
n |
Антимикобактериальная активность (мкг/мл) Antimycobacterial activity (µg/ml) |
|
Изониазид Isoniazid |
4 |
24,0 ± 4,62 |
|
ТАГ1 TAG1 |
4 |
28,0 ± 4,0 |
|
ТАГ3 TAG3 |
4 |
12,0 ± 2,3 * |
|
ТАГ4 TAG4 |
4 |
28,0 ± 4,0 |
|
ТАГ7 TAG7 |
4 |
28,0 ± 4,0 |
|
ТАГ13 TAG13 |
4 |
28,0 ± 4,0 |
Примечание: p – уровень значимости различий по сравнению с применением изониазида: * – < 0,05.
Note: p - significance level in relation to isoniazid: * – < 0.05.
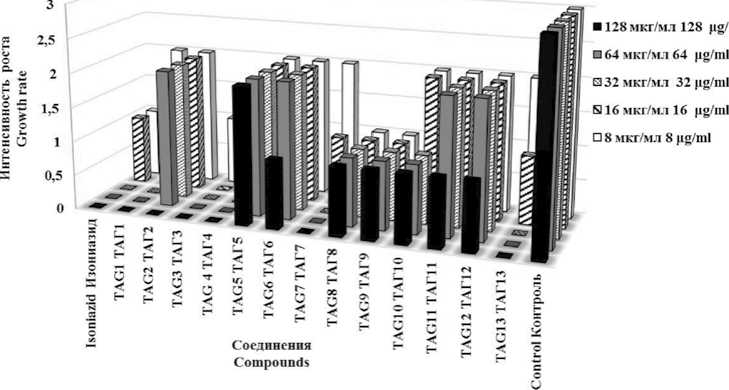
Рис. 4. Показатели визуальной оценки активности производных пиримидина в отношении роста M. tuberculosis H37Rv в диапазоне концентраций 128–8 мкг/мл
Примечание: «–» (0) – отсутствие роста, «+» (1) – слабый рост, «++» (2) – умеренный рост, «+++» (3) – интенсивный рост.
Fig. 4. Indicators of visual assessment of the activity of pyrimidine derivatives in relation to the growth of M. tuberculosis H37Rv in the concentration range of 128-8 μg/ml
Note: “-” (0) - no growth, “+” (1) - weak growth, “++” (2) - moderate growth, “+++” (3) - intensive growth.
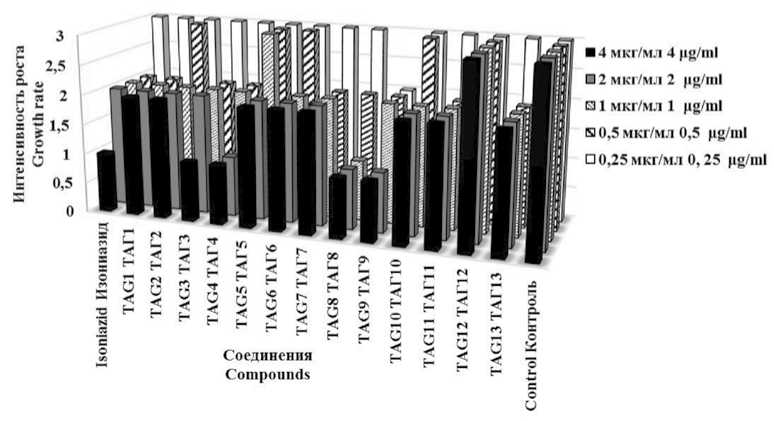
Рис. 5. Показатели визуальной оценки активности производных пиримидина в отношении роста M. tuberculosis H37Rv в диапазоне концентраций 4-0,25 мкг/мл
Примечание: «–» (0) – отсутствие роста, «+» (1) – слабый рост, «++» (2) – умеренный рост, «+++» (3) – интенсивный рост.
Fig. 5. Indicators of visual assessment of the activity of pyrimidine derivatives in relation to the growth of M. tuberculosis H37Rv in the concentration range of 4-0,25 μg/ml
Note: “-” (0) - no growth, “+” (1) - weak growth, “++” (2) - moderate growth, “+++” (3) - intensive growth.
Проведенная оценка посевов M. tuberculosis показала, что наибольший подавляющий эффект на рост культуры был обнаружен у соединения ТАГ3, который был даже несколько выше, чем у изониазида (p ≤ 0,05). Антими-кобактериальное действие соединений под лабораторными шифрами ТАГ1, ТАГ4, ТАГ7 и ТАГ13 в отношении M. tuberculosis было сопоставимо с таковым препарата сравнения. Менее выраженный эффект наблюдался у соединений ТАГ2, ТАГ5, ТАГ6, ТАГ8, ТАГ9, ТАГ10, ТАГ11 и ТАГ12, которые при самых высоких используемых концентрациях были не способны полностью подавить рост тест-культуры. Минимальное ингибирующее воздействие на M. tuberculosis отмечено у соединений ТАГ5 и ТАГ12.
Анализ полученных результатов позволяет предположить, что присутствие атомов кислорода в пиримидиновом цикле 5-арил(гетарил)метилиден-2,4,6-пири-мидин-2,4,6(1Н,3Н,5Н)-трионов, а также атомов азота в основе пиримидинового цикла, которые способны предоставлять неподеленные электронные пары для образования межмолекулярных водородных связей с активным сайтом фермента с образованием промежуточного комплекса, присутствие фенильного радикала, определяющего липофильность ТАГ1, обусловливает проявление этим соединением выраженной активности в отношении M. lufu. Замещение бензойного кольца ковалентно-связанным атомом хлора в ТАГ4 также может опосредовать противомикробное действие вещества за счет изменения способности ароматической системы к реакциям электрофильного замещения, протекающим в ходе биосинтетических превращений, катализируемым различными ферментативными системами. Однако присутствие галогена в молекуле лекарственного вещества может определять его токсичность. Наличие непредельного фрагмента, связывающего гетероцикл и бензойное кольцо в молекулах обоих веществ, может обусловливать участие производных в окислительно-восстановительных реакциях, сопровождающихся переносом жирных кислот, образованием активных форм кислорода, окислительным фосфорилированием при участии корд-фактора, вследствие чего может влиять на нарушение биосинтеза липидного компонента клеточной мембраны микобактерий, подавлять их вирулентность, ингибировать отдельные звенья дыхательной цепи и, как следствие, вызывать гибель микробной клетки.
Бензофурановый цикл в структуре ТАГ7, вероятно, повышает гидрофобность соединения, облегчая его проникновение в клетку через липофильный гликолипидный слой. Частичное участие неподеленной пары в ароматической делокализации у кислородного атома фуранового цикла определяет ее подвижность и способность участвовать в межмолекулярном связывании по донорно-акцепторному механизму, делая кислород дополнительным центром, участвующим в образовании промежуточного комплекса с бактериальными ферментами. Введение в молекулу ТАГ10 пиразольного и оксазинового циклов увеличивает количество центров в виде атомов азота и кислорода, способных предоставить не-поделенную пару электронов для образования водородных связей, и, как следствие, повышает вероятность дезактивации жизненно важных ферментов микобактерий. Замещение бензойного кольца в ТАГ3 диметиламинным радикалом повышает степень связывания с активным сайтом ферментов по атому азота, при этом компактная структура, в отличие от ТАГ7, ТАГ10, содержащих объемные гетероциклические заместители, не создает стерических препятствий при взаимодействии с белковыми молекулами. Вероятно, по этой причине степень антимикробного эффекта ТАГ3 более высокая, чем у перечисленных соединений.
Способность оказывать менее выраженное проти-вомикробное действие ТАГ11 и ТАГ12, с одной стороны, имеющих в структуре достаточный набор функциональных групп, способных участвовать в формировании промежуточных адсорбционных комплексов с ферментативными мишенями, может быть объяснена симметричностью ТАГ12, конформационной изменчивостью, при которой фармакофор оказывается недоступным для взаимодействия, конкурентностью реакционных центров за связывание с аминокислотным остатком белковой молекулы фермента и прочими стерическими препятствиями. Вовлечение неподеленной пары гидроксильного заместителя бензойного кольца в ТАГ6 в ароматическое сопряжение делает ее неподвижной и несклонной к участию в донорно-акцепторном взаимодействии. Перераспределение электронов между атомами азота и кислорода в нитрогруппе в ТАГ5 блокирует электронные пары, обусловливая невозможность их участия в межмолекулярном связывании с мишенью. Являясь электро-ноакцептором, нитрогруппа ограничивает способность ароматической системы к реакциям электрофильного замещения, а также, способствует смещению электронной плотности от непредельного фрагмента, связанного с бензойным кольцом, понижает степень участия соединения в качестве восстановителя в значимых биологических окислительно-восстановительных процессах.
Заключение
В результате проведенного исследования установлено, что все изучаемые соединения проявляют антимико-бактериальную активность. Наибольший подавляющий эффект в отношении M. lufu отмечен у соединений ТАГ1, ТАГ4, ТАГ7, ТАГ12 и ТАГ13, который был сопоставим с таковым препарата сравнения – дапсона. По характеру ингибирующего воздействия на рост M. tuberculosis соединения под лабораторными шифрами ТАГ1, ТАГ4, ТАГ7 и ТАГ13 были сравнимы с изониазидом, а действие соединения ТАГ3 даже несколько превосходило препарат сравнения. Таким образом, среди изучаемых вновь синтезированных производных пиримидина наиболее выраженной антимикробной активностью как в отношении M. lufu , так и M. tuberculosis H37Rv обладают соединения под лабораторными шифрами ТАГ1, ТАГ4, ТАГ7 и ТАГ13, что позволяет рассматривать их в качестве наиболее перспективных веществ для дальнейших исследований по поиску антимикобактериальных, в том числе и проти-волепрозных препаратов.
Список литературы Микробиологический скрининг соединений с потенциальной противолепрозной активностью среди вновь синтезированных соединений ряда пиримидина
- World Health Organization. Regional Office for South-East Asia. На пути к нулевым показателям лепры. Глобальная стратегия по борьбе с лепрой ( болезнь Хансена) на 2021-2030 гг.. World Health Organization, Regional Office for South-East Asia; 2021:30. URL: https://apps.who.int/iris/handle/10665/342171 (19.12.2022).
- Faget G.H., Pogge R.C., Johansen F.A., Dinan J.F., Prejean B.M., Eccles C.G. The promin treatment of leprosy: a progress report. Public Health Reports. 1943;58(48):1729-1741. https://doi.org/10.2307/4584691.
- Хрыков Г.А. Дальнейшее наблюдение за действием сульфоновых препаратов на лепрозный процесс. Сборник трудов по лепре. Нукус; 1957(1):83-89.
- Noordeen S.K. History of chemotherapy of leprosy Clinics in Dermatology. 2016;34(1):32-36. https://doi.org/10.1016/j.clindermatol.2015.10.016.
- Кубанов А.А., Карамова А.Э., Воронцова А.А., Калинина П.А. Фармакотерапия лепры. Вестник дерматологии и венерологии. 2016;92(4):12-19. https://doi.org/10.25208/0042-4609-2016-92-4-12-19.
- Kar H.K., Gupta R. Treatment of leprosy. Clinics in Dermatology. 2015;33(1):55-65. https://doi.org/10.1016/j.clindermatol.2014.07.007.
- Самотруева М.А., Цибизова А.А., Ясенявская A.Л., Озеров А.А., Тюренков И.Н. Фармакологическая активность производных пиримидинов. Астраханский медицинский журнал. 2015;10(1):12-29. URL: https://cyberleninka.ru/article/n/farmakologicheskaya-aktivnost-proizvodnyh-pirimidinov (19.12.2022).
- Khrapova A.V., Saroyants L.V., Yushin M.Y., Zukhairaeva A.S., Velikorodov A.V. Prospects of using pharmacologically active compounds for the creation of antimycobacterial drugs. Pharmaceutical Chemistry Journal. 2022;55(10):1108-1114. https://doi.org/10.1007/s11094-021-02544-4.
- Shmalenyuk E.R., Chernousova L.N., Karpenko I.L., Kochetkov S.N., Smirnova T.G., Andreevskaya S.N. et al. Inhibition of Mycobacterium Tuberculosis strains H37Rv and MDR MS-115 by a new set of C-5 modified pyrimidine nucleosides. Bioorg. Med. Chem. 2013;21(17):4874-4884. https://doi.org/10.1016/j.bmc.2013.07.003.
- Khandazhinskaya A.L., Alexandrova L.A., Matyugina E.S., Solyev P.N., Efremenkova O.V., Buckheit K.W. et al. Novel 5'-norcarbocyclic pyrimidine derivatives as antibacterial agents. Molecules. 2018;23(12):3069. https://doi.org/10.3390/molecules23123069.
- Yushin M.Yu., Ayupova A.K., Tyrkov A.G., Ilyasov F.K. Effect of 5-(Arylmethylidene)-2,4,6-pyrimidine-2,4,6(1H,3H,5H)-tiones on the course of experimental leprosy infection. Pharmaceutical Chemistry Journal. 2022;55(10):1019-1022. https://doi.org/10.1007/s11094-021-02531-9.
- Yushin M.Yu., Tyrkov A.G., Saroyants L.V., Gabitova N.M., Khrapova A.V., Genatullina G.N. et al. Synthesis and antimicobacterial activity of 5-(hetarylmethylidene)-2,4,6-pyrimidine-2,4,6(1H,3H,5H)-triones and 5-(2 chloropropylidene)-2,4,6-pyrimidine-2,4,6(1H,3H,5H)-triones. Pharmaceutical Chemistry Journal. 2020;54(2):134-137. https://doi.org/10.1007/s11094-020-02169-z.
- Меньшиков В.В., Анкирская А.С., Бехало В.А., Бойцов А.Г., Бондаренко В.М., Дехнич А.В. и др. Методики клинических лабораторных исследований. Том III. Клиническая микробиология. М.: Лабора; 2009:880.
- Теппер Е.З., Шильникова В.К., Переверзева Г.И. Практикум по микробиологии. М.: Дрофа; 2004:256.


