Микробиом кишечника и остеопороз: патогенетическая связь и перспективы терапевтических вмешательств
Автор: Булгакова Светлана Викторовна, Романчук Наталья Петровна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 4 т.7, 2021 года.
Бесплатный доступ
Остеопороз - хроническое метаболическое заболевание костной ткани, характеризующееся снижением костной плотности и нарушением микроархитектоники под влиянием генетических и эпигенетических факторов, что делает кость хрупкой и увеличивает риск переломов. Однако точный механизм развития остеопороза до конца не ясен. В кишечнике человека живут сотни триллионов микроорганизмов, поддерживающих тесные симбиотические отношения с организмом хозяина и его здоровье. С развитием современных платформ секвенирования появляется все больше доказательств того, что кишечный микробиом может играть важную роль в метаболизме костной ткани. Данный обзор литературы посвящен анализу патогенетических механизмов участия микробиоты кишечника в развитии остеопороза и возможных терапевтических стратегий с участием пробиотиков, пребиотиков, антибактериальных препаратов, диеты, направленных на увеличение костной плотности.
Остеопороз, кишечная микробиота, пробиотики, пребиотики, питание
Короткий адрес: https://sciup.org/14120935
IDR: 14120935 | УДК: 616.71-007.234 | DOI: 10.33619/2414-2948/65/16
Текст обзорной статьи Микробиом кишечника и остеопороз: патогенетическая связь и перспективы терапевтических вмешательств
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.71-007.234
Остеопороз (ОП) — системное метаболическое заболевание костной ткани, которое характеризуется снижением костной массы на единицу объема и нарушением микроструктуры костной ткани, что увеличивает хрупкость костей и риск переломов. С общим старением населения ОП стал серьезной медико-социальной проблемой для семьи и общества в целом. ОП поражает представителей обоих полов в любом возрасте, но чаще всего встречается у женщин в постменопаузе [1]. Наследственность, уровень гормонов, питание и образ жизни тесно связаны с патогенезом ОП. Эстрогены, паратиреоидный гормон, витамин D, и факторы воспаления являются важными регуляторами костного метаболизма [2–4]. Тем не менее, патогенез ОП все еще изучается.
В кишечнике человека живут сотни триллионов симбиотических бактерий. Их разнообразие и количество более чем в десять раз превышает общее количество клеток человека. На сегодняшний день более 80% микроорганизмов неизвестны [5]. Кишечная микробиота имеет взаимовыгодное симбиотическое отношение с человеческим организмом и играет важную роль в поддержании его здоровья. Когда баланс микробиоты кишечника из-за определенных факторов нарушается, организм становится подвержен таким заболеваниям, как ожирение, сахарный диабет или даже рак (например, колоректальный рак) [6–7]. Есть предположения, что микробиота кишечника тесно связана с регуляцией метаболизма костной ткани, хотя механизм полностью не известен. Быстрое развитие современной микробиологии способствует постоянному открытию новых компонентов кишечного микробиома человека, что дает информацию о новых звеньях патогенеза ОП [8]. Данный обзор литературы посвящен анализу взаимосвязи между микробиотой кишечника и ОП, возможностях профилактики и терапии низкой костной плотности.
Роль микробиома кишечника в патогенезе остеопорозе
Микробиом кишечника, часто называемый «вторым по величине геномом человека», представляет собой разнообразное микробное сообщество, состоящее из бактерий, грибов, вирусов и простейших [9]. У здоровых людей микрофлора, организм и окружающая среда всегда находятся в стабильном динамическом равновесии. Большинство микроорганизмов находятся в желудочно-кишечном тракте, но они, тем не менее, влияют на развитии заболеваний не только пищеварительного тракта. Имеется большое количество данных, говорящих о тесной связи кишечного микробиома с костным метаболизмом и минеральным обменом в норме и при патологии [10–16].
Ремоделирование костной ткани — это динамический процесс, связывающий два процесса: костеобразование (остеобласты) и резорбцию (остеокласты) [17]. Известно, что на развитие ОП влияет микробиом кишечника [10, 11–14, 18–20].
Остеобласты происходят из мезенхимальных клеток стромы костного мозга, отвечают за костеобразование, синтез, минерализацию костного матрикса [1, 18]. Остеокальцин известен, как маркер созревания остеобластов [19]. Проводится большое количество исследований с участием мышей, лишенных кишечной микробиоты (GF) или мышей, получавших антибиотики, для создания моделей отсутствия или нарушения функции микробиома кишечника и контрольной группы с нормальным микробиомом, для лучшего понимания влияния микробиома кишечника на развитие остеопороза. Uchida Y. et al. (2018) обнаружили, что по сравнению с первичными остеобластами, выделенными из альвеолярных костей и свода черепа мышей GF, остеобласты мышей, не содержащих специфических патогенов (SPF), экспрессировали значительно больше остеокальцина, щелочной фосфатазы (ALP) и инсулиноподобного фактора роста-I./-II (IGF-I/IGF-II), в то время как соотношение остеопротегерин (OPG)/активатор рецептора лиганда NF-κB (RANKL) было снижено [11]. В итоге плотность костной ткни у мышей SPF была ниже, чем у мышей GF, что указывает на то, микробиом кишечника оказывает более сильное регулирующее воздействие на остеокласты. Изучая мышей с серповидно-клеточной анемией (SCD), Tavakoli S. и Xiao L.
(2019) показали, что для мышей SCD характерна большая бактериальная нагрузка кишечника и кишечная проницаемость, что привело к изменению микробиома кишечника и связанному с ним снижению костной массы и нарушению функции остеобластов [12].
Однако после лечения антибиотиками функция остеобластов у мышей SCD была восстановлена, а экспрессия связанного с остеобластами транскриптора Runt-related транскрипционного фактора 2 (Runx2) и IGF-I была увеличена, что привело к увеличению костной плотности. К сожалению, в этих исследованиях не была изучена роль конкретных микроорганизмов. Механизм, с помощью которого микробиом кишечника влияет на структуру костной ткани путем прямого воздействия на остеобласты, еще не выяснен, и необходимы дальнейшие исследования.
Остеокласты, происходящие из системы мононуклеарных фагоцитов, представляют собой особые терминально дифференцированные клетки, которые осуществляют резорбцию костной ткани [20]. Ряд исследований показали, что микробиом кишечника с большей вероятностью регулирует метаболизм костей, влияя на активность остеокластов [13–14]. Sjögren К et al. (2012) обнаружили, что недостаток микробиома кишечника может привести к увеличению костной массы [13]. По сравнению с мышами, выращенными традиционным способом (Conv.R), минеральная плотность губчатой и кортикальной костной ткани мышей GF увеличивалась, а количество остеокластов уменьшалось. Между тем, количество CD4 + Т-клеток и CD11b+/Gr1-клетки-предшественники остеокластов, полученных из костного мозга мышей GF, уменьшилось. Однако на костеобразование это не повлияло [13]. Таким образом, увеличение костной массы у мышей GF в основном достигается за счет ингибирования остеокластогенеза.
Li J. Y. et al. (2016) также доказали, что в условиях GF продукция факторов, способствующих развитию остеокластов, таких как фактор некроза опухоли-α (TNF-α), RANKL и интерлейкин-17 (IL-17), не увеличивается у мышей с дефицитом половых стероидов, вызванных лейпролидом [14]. Напротив, после реколонизации различными микроорганизмами кишечника проницаемость кишечника и продукция остеокластогенных цитокинов у мышей с дефицитом половых стероидов увеличивались, что приводило к потере трабекулярной костной ткани. Кроме того, для проверки эффективности пробиотиков авторы использовали Lactobacillus rhamnosus GG (LGG) и комплексный пробиотический препарат VSL№3, который содержит восемь штаммов живых бактерий ( Bifidobacterium breve, Bifidobacterium longum, Bifidobacterium infantis, Lactobacillus acidophilus, Lactobacillus plantarum, Lactobacillus paracasei, Lactobacillus bulgaricus и Streptococcus thermophilus ).
Результаты показали, что пробиотические препараты также предотвращают повышенную кишечную проницаемость, вызванную дефицитом половых стероидов, тем самым ограничивая продукцию цитокинов остеокластами. Это служит доказательством того, что микробиом кишечника и пробиотические препараты участвуют в резорбции трабекулярной костной ткани, вызванной дефицитом половых стероидов. Однако ряд данных указывают на то, что микробиом кишечника влияет только на функцию остеобластов или остеокластов. Тем не менее, стимуляция остеобластов и остеокластов часто осуществляется одновременно, хотя механизм воздействия микробиома кишечника на метаболизм костной ткани до сих пор неизвестен.
Кальций является основным минералом костей человека, и в физиологических условиях пища является единственным источником кальция для человеческого организма [21]. Кальций с пищей транспортируется в верхнюю часть тонкого кишечника и всасывается [22]. В общем, влияние микробиома кишечника на всасывание кальций, в основном, регулируется короткоцепочечными жирными кислотами (SCFA) [15]. SCFAs являются основными продуктами кишечной бактериальной ферментации помимо уксусной, пропионовой, изомасляной, масляной, изовалериановой, валериановой кислот. Ободочная кишка является основным местом производства SCFA, а масляная кислота — основным источником энергии для эпителиальных клеток толстой кишки. Ряд исследований указывают на то, что пробиотики могут расщеплять пищевые волокна на SCFAs, что может способствовать секреции большего количества SCFA в кишечнике за счет увеличения количества пробиотиков и / или пребиотиков [23–24]. С другой стороны, SCFAs могут увеличивать абсорбцию кальция кишечной стенкой за счет снижения pH в кишечнике, тем самым увеличивая костную массу [23]. Последующие исследования подтвердили, что масляная кислота может также регулировать презентацию антигена путем ингибирования дендритных клеток, которые не только стимулируют дифференцировку остеобластов, но также ингибируют образование остеокластов в клетках костного мозга [16, 25].
Хорошо известно, что витамин D также оказывает огромное влияние на повышение абсорбции кальция, фосфора в кишечнике и кальцификацию костей. Дефицит витамина D может привести к уменьшению доли Firmicutes и Deferribacteres и с большей вероятностью вызвать колит у мышей с блокадой Cyp, тогда как воспаление уменьшалось после приема добавок витамина D или лечения антибиотиками. Примечательно, что пропорция Firmicutes и Deferribacteres могла быть восстановлена на фоне приема витамина D. Исследование подтверждает, что витамин D может регулировать развитие ОП, напрямую контролируя микробиом кишечника [26]. Таким образом, большое количество исследований свидетельствует о том, что микробиом кишечника участвует в патогенезе ОП, тем не менее, точный механизм нуждается в уточнении.
И иммунная, и костно-мышечная системы находятся под регуляторным влиянием секреции цитокинов костным мозгом и имеют между собой общие факторы транскрипции и сигнальные пути [27]. Как отмечают Zhao W. et al. (2009), CD4+Т-лимфоциты являются ключевыми клетками, участвующими в регуляции иммунного ответа при OП [28]. Эти клетки не только активируют остеобласты, но и ингибируют остеокласты. Активированные CD4 + Т-клетки могут продуцировать цитокины, такие как RANKL, OPG и TNF-α [29]. RANKL способствует активации остеокластов и резорбции костной ткани через систему NF-κB (RANK) –RANKL [30]. TNF-α может напрямую стимулировать образование остеокластов или повышать экспрессию RANKL и OPG для косвенной активации остеокластов [31].
Ряд исследований [13 –14, 32] обнаружили тесную связь между микробиомом кишечника и ОП [13–14, 32]. Так, Li J. Y. et al. (2016) показали, что дефицит половых стероидов у мышей GF не приводил к росту Т-клеток и вместо этого увеличивал продукцию TNF-α, IL-17 и RANKL в костном мозге и кишечнике [14]. Экспрессия этих воспалительных цитокинов увеличивалась у мышей GF с восстановленной микробиотой, после лечения LGG или VSL # 3, и их экспрессия была аналогична таковой у мышей Conv.R. Точно такие же результаты были получены при овариэктомии (OVX). Ряд исследований обнаружили, что серотонин (5-гидрокситриптамин (5-HT)), как наиболее широко изученный нейромедиатор, регулирует метаболизм костной ткани через микробиом кишечника [13, 32]. И остеоциты, и остеобласты могут синтезировать и регулировать захват 5-HT [33]. Мыши с нокаутом 5-HT показали снижение костной массы и прочности. Интересно, что 5-HT, полученный из кишечника, оказывает отрицательное влияние на формирование костной ткани, тогда как 5-HT, выделенный из мозга, имеет противоположный эффект [32]. Более того, Sjögren К. et al. (2012) не только подтвердили, что микробиом кишечника управляет CD4+Т-клетками и
CD11b+/Gr1 -клетки-предшественники остеокластов регулируют метаболизм костной ткани, но также определяют индексы инактивации и деградации кишечного производного 5-HT у мышей GF [13]. Впоследствии они обнаружили, что экспрессия фермента 5-HT триптофангидроксилазы-1 (TPH-1) снижалась, тогда как экспрессия переносчика серотонина (SERT) увеличивалась. Хотя у мышей GF после нормализации костной массы вследствие восстановления микробиоты наблюдалось лишь небольшое изменение 5-HT. В связи с чем нельзя исключить, что микробиом кишечника имеет потенциальный механизм регулирования костной массы [13]. Таким образом, полученные данные свидетельствуют о том, что микробиом кишечника может влиять на прогрессирование ОП с участием иммунной системы или нейротрансмиттеров.
Микробиом кишечника как мишень для терапии остеопороза
Современные препараты для лечения ОП делятся на три основные категории: препараты, минерализующие кости (кальций и др.), стимуляторы костеобразования (паратироидный гормон) и ингибиторы костной резорбции (эстрогены, бисфосфонаты и т. д.) [34]. Все эти препараты дали хорошие результаты в терапии ОП, но также отмечены и некоторые побочные эффекты. Так, прием чрезмерного количества препаратов кальция может привести к гиперкальциемия, образованию камней в почках, инфаркту миокарда [35]. Лечение паратиреоидным гормоном может увеличить риск гиперкальциемии, повлечь за собой высокие расходы системы здравоохранения в связи с дороговизной препарата [36].
Систематический обзор показал, что ралоксифен запрещен у больных с венозной эмболией или тромбозами в анамнезе, у пациентов, длительное время прикованных к постели или ведущих сидячий образ жизни [37].
Поскольку нарушение микробиома кишечника является одним из важных патогенетических механизмов развития ОП, разработка стратегий лечения низкой костной плотности, нацеленных на микробиом кишечника, может быть многообещающей особенно в качестве альтернативной, безопасной и эффективной терапии. Среди методов лечения, нацеленных на микрофлору, следует рассмотреть диету, антибактериальные препараты и пробиотики.
Питание
Питание оказывает большое влияние на здоровье костной ткани на протяжении всего жизненного цикла, на что часто не обращают внимания. С другой стороны, диета является основным фактором, определяющим тип и долю микроорганизмов в организме-хозяине [38]. Кроме того, микробиом кишечника вносит свой вклад в секрецию белков и ферментов, связанных с пищеварением и энергетическим обменом, поскольку он ферментирует непереваренные питательные вещества в SCFA, что приводит к снижению рН кишечника и увеличению кишечной проницаемости, а также к повышению всасывания минералов, таких как кальций [23]. Учитывая эту связь, питание может рассматриваться как важный фактор при оценке влияния изменений микробиома кишечника на здоровье костной ткани.
Существует мнение, что все поступающие с пищей вещества ферментируются микробиомом кишечника. Так, волокна расщепляются на SCFA, что снижает pH в кишечнике, который затем влияет на абсорбцию минералов. Однако, подобное объяснение может быть слишком упрощенным, а лежащие в его основе механизмы, тем не менее. разнообразны. Существуют специальные продукты, называемые пребиотиками, которые не могут быть гидролизованы и усвоены пищеварительной системой [24]. Пребиотики можно разделить на две категории: олигосахариды и полисахариды. Олигосахариды, в основном, включают в себя фруктоолигосахариды (FOS), галактоолигосахариды (GOS) и ксилоолигосахариды, тогда как полисахариды представлены инулином и микроводорослями [39]. Пребиотики, особенно неперевариваемые олигосахариды (NDO), могут избирательно стимулировать, и активировать к размножению в желудочно-кишечном тракте полезных бактерий, подавлять развитие вредных бактерий, увеличивать концентрацию SCFAs, представленных масляной кислотой, что способствует всасыванию кальция [40–41]. Kleessen В. et al. (2003) обнаружили, что влияние FOS на толщину и состав слизистой оболочки кишечника опосредованы микробиомом кишечника, а не изменениями в самой структуре слизистой оболочки [42]. По сравнению с мышами GF, мыши, получавшие смесь олигофруктозы и инулина, имеют более высокие ворсинки и более глубокие крипты, что является показателем стабильности кишечного барьера слизистой оболочки. Между тем, количество микроорганизмов, включая бифидобактерии и Bacteroides – Prevotella выросло.
Это исследование также демонстрирует, тот факт, что здоровое питание с достаточным содержанием пробиотиков сохраняет стабильный микробиом кишечника, поддерживает здоровье и абсорбционную функцию кишечника [42]. Кроме того, FOS, поступающие с пищей, могут увеличивать биодоступность изофлавонов, которые имеют структуру, аналогичную эстрогену, и повышать минеральную плотность костей, сниженную из-за OVX [43]. Кроме того, было подтверждено, что правильное питание с включением пребиотиков имеет благотворное влияние на микробиоту и гомеостаз кишечника, может увеличить всасывание кальция и костную массу.
Антибактериальные препараты
В настоящее время антибактериальные препараты широко используются для лечения различных заболеваний. Долгосрочное использование антибиотиков может значительно снизить биоразнообразие микробиома кишечника, увеличить количество кишечных метаболитов и серотонина, а затем изменить скорость всасывания минералов, связанных с костным метаболизмом [44]. Обнаружено, что антибиотики могут не только изменять структуру микробного сообщества, но и влиять на их биологический метаболизм [45–46]. Cox L. M. et al. (2014) проанализировали микробиом кишечника и гистоморфометрию костей мышей, получавших низкие дозы пенициллина (LDP). Как и ожидалось, по сравнению с мышами без LDP, уровни Lactobacillus и сегментированных нитчатых бактерий (SFB) у самок мышей с LDP были намного ниже. Кроме того, у самок мышей с LDP значительно увеличилась костная плотность, в отличие от самцов. Cho I. et al. (2012) разработали модель ожирения, в которой молодым мышам вводили четыре различных антибиотиков в низких дозах (пенициллин, ванкомицин, пенициллин плюс ванкомицин и хлортетрациклин) [46].
Все антибиотики, принимаемые в низких дозах в течение трех недель, увеличивали минеральную плотность костной ткани (МПКТ) в разной степени, однако значительных различий в МПКТ через семь недель не наблюдалось. Результаты секвенирования 16S показали, что доля Firmicutes и Lachnospiraceae у мышей, получавших низкие дозы антибиотиков, была значительно увеличена. Благодаря анализу кишечной, печеночной и жировой тканей стало ясно, что антибактериальные препараты в основном влияли на микрофлору кишечника через метаболизм SCFAs, липидов и, как следствие, на костный метаболизм [46].
В настоящее время протестировано лишь небольшое количество антибиотиков, таких как пенициллин, ванкомицин и хлортетрациклин, но есть целесообразность проанализировать и другие группы для формирования схем терапевтического воздействия на низкую костную плотность в будущем.
Пробиотики
Пробиотики — полезные и безвредные бактерии микробиома кишечника [47]. Поскольку это второй по величине геном человека, экспрессия множества генов в микробиоме кишечника в основном осуществляется пробиотиками. Эти гены кодируют регуляцию почти всей деятельности кишечника и некоторых других органов. Среди них наиболее важной функцией, связанной с желудочно-кишечным трактом, является регулирование метаболизма SCFAs, жирных кислот с разветвленной цепью и витаминов. Таким образом, пробиотики являются ключевыми компонентами микробиома кишечника, регулирующими метаболизм костной ткани [48].
О влиянии пробиотиков на костную массу у животных достаточно широко известно [49–50]. В рандомизированном плацебо-контролируемом двойном слепом исследовании 90 пациентов с низкой МПК были случайным образом разделены на две группы. Одна группа перорально ежедневно получала Lactobacillus reuteri ( L. reuteri 6475), а другая группа — плацебо. В конце исследования объем общей МПКТ и отдельно трабекулярной были значительно снижены у пациентов, принимавших L. reuteri 6475, по сравнению с группой плацебо [51]. Также, Lambert M. N. T. et al. (2017) впервые выделили экстракт красного клевера (RCE) богатый изофлавоновыми агликонами и пробиотическими молочнокислыми бактериями [52]. Они обнаружили, что это вещество улучшает метаболизм костной ткани и способствует выработке метаболитов эстрогенов у 78 пациентов с постменопаузальным ОП. Окончательный результат показал, что потеря костной массы в группе RCE была в два раза ниже, чем в контрольной группе. Эти клинические данные продемонстрировали эффективность пробиотических добавок для предотвращения потери костной массы и развития ОП [51–52].
Таким образом, на микробиом кишечника положительно влияют пробиотики, такие как Bacteroidetes , Firmicutes , Lactobacillus и SFB, и этот метод может стать адъювантной терапией OП в будущем.
Современная генетика и эпигенетика остеопороза, 5П Медицина и 5G технологии
Положительное влияние физических упражнений на костную массу уже давно подтверждено многочисленными исследованиями [1, 53–54]. Как правило, мы подчеркиваем влияние лекарств на микробиом кишечника, но игнорируем роль физической активности. Работа Allen J. M. et al. (2018) наглядно показала, что упражнения также могут повлиять на здоровье микробиома кишечника [55]. В исследование вошли 32 волонтера, они получали тренировку на выносливость в течение шести недель. В результате чего обнаружено увеличение концентрации SCFAs в кале. После прекращения тренировок микробиом кишечника вскоре полностью изменился [55]. Таким образом, физические упражнения могут увеличить разнообразие микробиома кишечника, что положительно коррелировало со здоровьем хозяина и костной плотностью. Неизвестно, действительно ли упражнения влияют на костную массу через микробиом кишечника, но, безусловно то, что они имеют положительное влияние.
Трансплантация фекальной микробиоты (FMT) также имеет большой потенциал в лечении OП [56]. Впервые Lawson P. A. et al. обнаружили, что FMT эффективна при лечении инфекции Clostridioides difficile (CDI) [57]. В последние годы FMT широко используется для лечения различных заболеваний, таких как болезнь Крона, метаболический синдром, cc) ® I сахарный диабет и заболевания нервной системы [58]. В отличие от отдельных бактерий или их комбинации, FMT может восстанавливать и стабилизировать микробиом кишечника быстрее и эффективнее. Из-за обилия видов и количества бактерий трансплантированный микробиом может быть сохранен в максимальной степени, а микробиом кишечника реципиента может быть существенно улучшен.
Было предложено несколько механизмов для объяснения роли микробиома кишечника в патогенезе ОП (Рисунок). Однако ни один из них не может полностью объяснить механизм развития ОП [59].
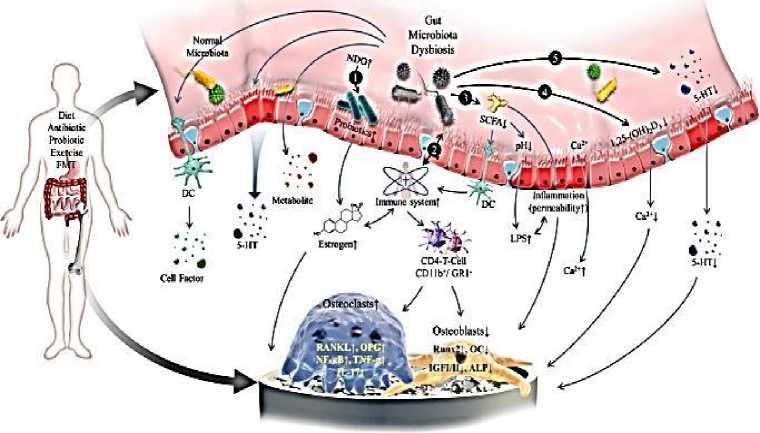
Рисунок. Схематическая диаграмма влияния микробиома кишечника на развитие остеопороза [59]: 5-HT — 5-гидрокситриптамин; ALP — щелочная фосфатаза; DC - дендритная клетка; FMT — трансплантация фекальной микробиоты; GR1— гранулоциты 1; IGF-I / II — инсулиноподобный фактор роста I/II; ИЛ-17 — интерлейкин-17; ЛПС — липополисахарид; NDO — неперевариваемый олигосахарид; NF-κB — ядерный фактор каппа-B; ОК — остеокальцин; ОПГ — остеопротегерин; RANKL — активатор рецептора лиганда NF-κB; Runx2 — фактор транскрипции 2, связанный с runt; SCFA — короткоцепочечная жирная кислота; TNF-α - фактор некроза опухоли-α
Таким образом, ОП — хроническое метаболическое заболевание костей, характеризующееся уменьшением объема костной ткани на единицу объема при совместном действии генетических и экологических факторов, что приводит к снижению прочности кости, делает ее хрупкой и повышает вероятность перелома кости. Однако точный механизм, определяющий прогрессирование ОП, еще предстоит подчеркнуть. В кишечнике человека живут сотни триллионов симбиотических бактерий, которые имеют взаимовыгодные симбиотические отношения с человеческим организмом, что помогает поддерживать здоровье человека. С развитием современных высокопроизводительных платформ секвенирования (ВТС) появляется все больше свидетельств того, что кишечный микробиом может играть важную роль в программировании костного метаболизма. В настоящем обзоре мы обсуждаем потенциальные механизмы кишечного микробиома в развитии ОП, такие как изменения костного метаболизма, поглощения костных минералов и иммунной регуляции. Также была проведена оценка потенциала стратегий, ориентированных на кишечный микробиом, в профилактике и лечении ОП [59].
На микробиом кишечника в основном воздействуют диета, антибиотики и пробиотики. Микробиом кишечника оказывает заметное влияние на регулирование костной массы с помощью множества механизмов включая: 1. воздействие на полезные бактерии, увеличение биодоступности эстрогена и затем регулирование костной массы с помощью пребиотиков; 2. увеличение экспрессии воспалительных цитокиновых ответов иммунной системой; 3. продуцирование метаболитов микробиомом кишечника, таких как жирные кислоты с короткой цепью; 4. изменение кишечной проницаемости и усиление стимулирующего действия витамина D на абсорбцию минералов в костях; 5. воздействие на ось кишечник-мозг и уровень эндокринов. В исследовании Романчук Н. П. [60], установлено следующее:
–микробиологическая память будет оставаться стабильной, когда рацион функционального (здорового) диетического питания и здоровая биомикробиота остаются почти неизменными;
–новая управляемая здоровая биомикробиота и персонализированное функциональное и сбалансированное питание «мозга и микробиоты» — это долговременные медицинские программы пациента, которые позволяет проведению профилактики полипрагмазии;
–персонализированные функциональные диеты на основе алгоритмов искусственного интеллекта улучшают гликемические реакции на диетические продукты. Другие персонализированные терапевтические применения диетической-иммуно-метаболической оси включают функциональные пробиотические добавки и/или функциональное диетическое планирование, основанное на профилях микробиома;
–иммунная система человека и микробиота совместно эволюционируют, и их сбалансированное системное взаимодействие происходит в течение всей жизни. Эта тесная ассоциация и общий состав, и богатство микробиоты играют важную роль в модуляции иммунитета хозяина и могут влиять на иммунный ответ при вакцинации;
–наличие инновационных технологий, таких как секвенирование следующего нового поколения и коррелированные инструменты биоинформатики, позволяют глубже исследовать перекрестные нейросетевые взаимосвязи между микробиотой и иммунными реакциями человека;
–микробиота представляет собой ключевой элемент, потенциально способный влиять на функции антигена вызывать защитный иммунный ответ и на способность иммунной системы адекватно реагировать на антигенную стимуляцию (эффективность вакцины), действуя в качестве иммунологического модулятора, а также природного адъюванта вакцины;
–функциональные продукты питания, здоровая биомикробиота, здоровый образ жизни и управляемое защитное воздействия окружающей среды, искусственный интеллект и электромагнитная информационная нагрузка/перегрузка – ответственны за работу иммунной системы и ее способности своевременного иммунного ответа на пандемические атаки;
–совершенствование стратегий иммунизации и географического успеха вакцинации, взаимосвязаны с искусственным интеллектом и инновационными инструментами, моделированием и управлением иммунной защитой и индивидуальным иммунным ответом;
–мультимодальные инструменты, биочипирование, нейронные и мозговые чипы, технологии секвенирования следующего (нового) поколения создают биомаркеры для управления структурой здоровой биомикробиоты и функционального питания, в зависимости от целевых показателей;
–функциональный продукт питания с помощью биомаркеров и технологий искусственного интеллекта является целевой питательной средой как для организма в целом, так и для биомикробиоты в частности [60].
Ранняя возрастная (40–45 лет) диагностика, лечение и профилактика остеопороза с использованием инструментов (технологий) 5П Медицины и 5G медицинских сервисов, позволит управлять медико-социально-экономической проблемой современности [61].
Ранняя возрастная диагностика, лечение и профилактика остеопороза с использованием инструментов (технологий) 5П медицины и 5G медицинских сервисов, позволяет управлять «безмолвной эпидемией» («скрытой эпидемией») 21 века с помощью немедикаментозных методов лечения — трех мультипарадигмальных платформ: ЗОЖ, физическая активность, функционального питания (сбалансированного, здорового, натурального) [61].
Ключ к успеху лечения остеопороза находится в новой 5П-медицине основанной, на глубоком индивидуализированном подходе и мотивации профилактировать заболевание [61].
Заключение
Современное развитие OП является результатом сочетания генетических факторов, факторов окружающей среды, питания, низкой физической активности и др. Многие исследования доказали, что существуют весьма вероятные связи между микробиомом кишечника и ОП, в связи с чем микробиота кишечника человека может быть важным этиологическим фактором снижения костной плотности. Благодаря быстрому развитию современных технологий секвенирования мы можем более полно и точно определять состав микробных сообществ и его связь с факторами окружающей среды (заболеваниями и т. д.).
Основная задача в настоящее время - подтвердить роль микробиоты кишечника в развитии ОП и изучить механизм ее участия в метаболизме костной ткани. Между тем, влияние диеты, антибиотиков, пробиотиков и FMT на развитие ОП следует изучить более полно для разработки новых схем терапии низкой костной плотности. Эти методы лечения могут помочь избежать побочных эффектов существующих лекарственных препаратов и дать идеи для новых схем терапии низкой костной плотности в будущем.
Современная новая генетика и эпигенетика остеопороза, активное внедрение 5П Медицины и широкомасштабное использование 5G технологий, позволить с помощью комбинированного и гибридного кластера в диагностике, лечении и профилактике остеопороза — увеличить среднюю продолжительность жизни в регионе.
Список литературы Микробиом кишечника и остеопороз: патогенетическая связь и перспективы терапевтических вмешательств
- Булгакова С. В., Тренева Е. В., Захарова Н. О., Романчук П. И. Профилактика остеопоротических переломов у лиц пожилого и старческого возраста // Врач. 2020. Т. 31 №9. С. 22-27. https://doi.org/10.29296/25877305-2020-09-04
- Tang C. H. Osteoporosis: from molecular mechanisms to therapies. 2020. https://doi.org/10.3390/ijms21030714
- Булгакова С. В, Меликова А. В. Роль окислительного стресса в патогенезе постменопаузального остеопороза (обзор литературы) // Терапевт. 2020. №10. С. 15-18.
- Zheng W., Liu C., Lei M., Han Y., Zhou X., Li C., ... Ma X. Evaluation of common variants in the CNR2 gene and its interaction with abdominal obesity for osteoporosis susceptibility in Chinese post-menopausal females // Bone & joint research. 2019. V. 8. №11. P. 544-549. https://doi.org/10.1302/2046-3758.811.BJR-2018-0284.R1
- Qin J., Li R., Raes J., Arumugam M., Burgdorf K. S., Manichanh C., ... Wang J. A human gut microbial gene catalogue established by metagenomic sequencing // Nature. 2010. V. 464. №7285. P. 59-65. https://doi.org/10.1038/nature08821
- Salga9o M. K., Oliveira L. G. S., Costa G. N., Bianchi F., Sivieri K. Relationship between gut microbiota, probiotics, and type 2 diabetes mellitus // Applied microbiology and biotechnology. 2019. V. 103. №23. P. 9229-9238. https://doi.org/10.1007/s00253-019-10156-y
- Xu H., Wang X., Feng W., Liu Q., Zhou S., Liu Q., Cai L. The gut microbiota and its interactions with cardiovascular disease // Microbial biotechnology. 2020. V. 13. №3. P. 637-656. https://doi.org/10.1111/1751-7915.13524
- Chen M. F., Chang C. H., Chiang-Ni C., Hsieh P. H., Shih H. N., Ueng S. W., Chang Y. Rapid analysis of bacterial composition in prosthetic joint infection by 16S rRNA metagenomic sequencing // Bone & joint research. 2019. V. 8. №8. P. 367-377. https://doi.org/10.1302/2046-3758.88.BJR-2019-0003.R2
- Zhu B., Wang X., Li L. Human gut microbiome: the second genome of human body // Protein & cell. 2010. V. 1. №8. P. 718-725. https://doi.org/10.1007/s13238-010-0093-z
- Булгакова С. В., Романчук Н. П. Иммунный гомеостаз: новая роль микро- и макроэлементов, здоровой микробиоты // Бюллетень науки и практики. 2020. Т. 10. №6. C. 206-233. https://doi.org/10.33619/2414-2948/59/22
- Uchida Y., Irie K., Fukuhara D., Kataoka K., Hattori T., Ono M., ... Morita M. Commensal microbiota enhance both osteoclast and osteoblast activities // Molecules. 2018. V. 23. №7. P. 1517. https://doi.org/10.3390/molecules23071517
- Tavakoli S., Xiao L. Depletion of intestinal microbiome partially rescues bone loss in sickle cell disease male mice // Scientific reports. 2019. V. 9. №1. P. 1-10. https://doi.org/10.1038/s41598-019-45270-4
- Sjögren K., Engdahl C., Henning P., Lerner U. H., Tremaroli V., Lagerquist M. K., ... Ohlsson C. The gut microbiota regulates bone mass in mice // Journal of bone and mineral research. 2012. V. 27. №6. P. 1357-1367. https://doi.org/10.1002/jbmr.1588
- Li J. Y., Chassaing B., Tyagi A. M., Vaccaro C., Luo T., Adams J., ... Pacifici R. Sex steroid deficiency-associated bone loss is microbiota dependent and prevented by probiotics // The Journal of clinical investigation. 2016. V. 126. №6. P. 2049-2063. https://doi.org/10.1172/JCI86062
- Scholz-Ahrens K. E. et al. Prebiotics, probiotics, and synbiotics affect mineral absorption, bone mineral content, and bone structure // The Journal of nutrition. 2007. V. 137. №3. P. 838S-846S. https://doi.org/10.1093/jn/137.3.838S
- D'Amelio P., Sassi F. Gut microbiota, immune system, and bone // Calcified tissue international. 2018. V. 102. №4. P. 415-425. https://doi.org/10.1007/s00223-017-0331-y
- Hadjidakis D. J., Androulakis I. I. Bone remodeling // Annals of the New York Academy of Sciences. 2006. V. 1092. №1. P. 385-396. https://doi.org/10.1196/annals.1365.035
- Sanghani-Kerai A., Osagie-Clouard L., Blunn G., Coathup M. The influence of age and osteoporosis on bone marrow stem cells from rats // Bone & joint research. 2018. V. 7. №4. P. 289297. https://doi.org/10.1302/2046-3758.74.BJR-2017-0302.R1
- Al-Suhaimi E. A., Al-Jafary M. A. Endocrine roles of vitamin K-dependent-osteocalcin in the relation between bone metabolism and metabolic disorders // Reviews in Endocrine and Metabolic Disorders. 2020. V. 21. №1. P. 117-125. https://doi.org/10.1007/s11154-019-09517-9
- Indo Y., Takeshita S., Ishii K. A., Hoshii T., Aburatani H., Hirao A., Ikeda K. Metabolic regulation of osteoclast differentiation and function // Journal of Bone and Mineral Research. 2013. V. 28. №11. P. 2392-2399. https://doi.org/10.1002/jbmr.1976
- Булгакова С. В., Тренева Е. В., Захарова Н. О., Николаева А. В. Кальций и витамин К: влияние на костную ткань и сосудистое ремоделирование (обзор литературы) // Успехи геронтологии. 2020. Т. 6. №33. С. 1200-1208. https://doi.org/10.34922/AE.2020.33.6.025
- Christakos S., Dhawan P., Porta A., Mady L. J., Seth T. Vitamin D and intestinal calcium absorption // Molecular and cellular endocrinology. 2011. V. 347. №1-2. P. 25-29. https://doi.org/10.1016/j.mce.2011.05.038
- Abrams S. A., Griffin I. J., Hawthorne K. M., Liang L., Gunn S. K., Darlington G., Ellis K. J. A combination of prebiotic short-and long-chain inulin-type fructans enhances calcium absorption and bone mineralization in young adolescents- // The American journal of clinical nutrition. 2005. V. 82. №2. P. 471-476. https://doi.org/10.1093/ajcn/82.2.471
- Blaut M. Relationship of prebiotics and food to intestinal microflora // European journal of nutrition. 2002. V. 41. №1. P. i11-i16. https://doi.org/10.1007/s00394-002-1102-7
- Morozumi A. High concentration of sodium butyrate suppresses osteoblastic differentiation and mineralized nodule formation in ROS17/2.8 cells // Journal of oral science. 2011. V. 53. №4. P. 509-516. https://doi.org/10.2334/josnusd.53.509
- Ooi J. H., Li Y., Rogers C. J., Cantorna M. T. Vitamin D regulates the gut microbiome and protects mice from dextran sodium sulfate-induced colitis // The Journal of nutrition. 2013. V. 143. №10. P. 1679-1686. https://doi.org/10.3945/jn.113.180794
- Nance D. M., Sanders V. M. Autonomic innervation and regulation of the immune system (1987-2007) // Brain, behavior, and immunity. 2007. V. 21. №6. P. 736-745. https://doi.org/10.1016Zj.bbi.2007.03.008
- Zhao W., Liu Y., Cahill C. M., Yang W., Rogers J. T., Huang X. The role of T cells in osteoporosis, an update // International journal of clinical and experimental pathology. 2009. V. 2. №6. P. 544. https://www.ncbi.nlm.nih.gov/pubmed/19636401
- Saidenberg-Kermanac'h N., Cohen-Solal M., Bessis N., De Vernejoul M. C., Boissier M. C. Role for osteoprotegerin in rheumatoid inflammation // Joint Bone Spine. 2004. V. 71. №1. P. 913. https://doi .org/10.1016/S1297-319X(03)00131-3
- Wittrant Y., Theoleyre S., Chipoy C., Padrines M., Blanchard F., Heymann D., Redini F. RANKL/RANK/OPG: new therapeutic targets in bone tumours and associated osteolysis // Biochimica et Biophysica Acta (BBA)-Reviews on Cancer. 2004. V. 1704. №2. P. 49-57. https://doi.org/10.1016/j.bbcan.2004.05.002
- Azuma Y., Kaji K., Katogi R., Takeshita S., Kudo A. Tumor necrosis factor-a induces differentiation of and bone resorption by osteoclasts // Journal of Biological Chemistry. 2000. V. 275. №7. P. 4858-4864. https://doi.org/10.1074/jbc.275.7.4858
- Pawlak D., Domaniewski T., Znorko B., Oksztulska-Kolanek E., Lipowicz P., Doroszko M., ... Pawlak K. The impact of peripheral serotonin on leptin-brain serotonin axis, bone metabolism and strength in growing rats with experimental chronic kidney disease // Bone. 2017. V. 105. P. 1-10. https://doi.org/10.1016/j.bone.2017.08.004
- Bliziotes M., Eshleman A., Burt-Pichat B., Zhang X. W., Hashimoto J., Wiren K., Chenu C. Serotonin transporter and receptor expression in osteocytic MLO-Y4 cells // Bone. 2006. V. 39. №6. P. 1313-1321. https://doi.org/10.1016/j.bone.2006.06.009
- Rachner T. D., Khosla S., Hofbauer L. C. Osteoporosis: now and the future // The Lancet. 2011. V. 377. №9773. P. 1276-1287. https://doi.org/10.1016/S0140-6736(10)62349-5
- Cano A., Chedraui P., Goulis D. G., Lopes P., Mishra G., Mueck A., ... Lambrinoudaki I. Calcium in the prevention of postmenopausal osteoporosis: EMAS clinical guide // Maturitas. 2018. V. 107. P. 7-12. https://doi.org/10.1016/j.maturitas.2017.10.004
- Curry S. J., Krist A. H., Owens D. K., Barry M. J., Caughey A. B., Davidson K. W., Screening for osteoporosis to prevent fractures: US Preventive Services Task Force recommendation statement // Jama. 2018. V. 319. №24. P. 2521-2531. https://doi.org/10.1001/jama.2018.7498
- Adomaityte J., Farooq M., Qayyum R. Effect of raloxifene therapy on venous thromboembolism in postmenopausal women: a meta-analysis // Database of Abstracts of Reviews of Effects (DARE): Quality-assessed Reviews. Centre for Reviews and Dissemination (UK), 2008.
- Weaver C. M. Diet, gut microbiome, and bone health // Current osteoporosis reports. 2015. V. 13. №2. P. 125-130. https://doi.org/10.1007/s11914-015-0257-0
- Valcheva R., Dieleman L. A. Prebiotics: Definition and protective mechanisms // Best Practice & Research Clinical Gastroenterology. 2016. V. 30. №1. P. 27-37. https://doi.org/10.1016Zj.bpg.2016.02.008
- Delcour J. A., Aman P., Courtin C. M., Hamaker B. R., Verbeke K. Prebiotics, fermentable dietary fiber, and health claims // Advances in Nutrition. 2016. V. 7. №1. P. 1-4. https://doi.org/10.3945/an.115.010546
- Swennen K., Courtin C. M., Delcour J. A. Non-digestible oligosaccharides with prebiotic properties // Critical reviews in food science and nutrition. 2006. V. 46. №6. P. 459-471. https://doi.org/10.1080/10408390500215746
- Kleessen B., Hartmann L., Blaut M. Fructans in the diet cause alterations of intestinal mucosal architecture, released mucins and mucosa-associated bifidobacteria in gnotobiotic rats // British Journal of Nutrition. 2003. V. 89. №5. P. 597-606. https://doi.org/10.1079/BJN2002827
- Ohta A., Uehara M., Sakai K., Takasaki M., Adlercreutz H., Morohashi T., Ishimi Y. A combination of dietary fructooligosaccharides and isoflavone conjugates increases femoral bone mineral density and equol production in ovariectomized mice // The Journal of nutrition. 2002. V. 132. №7. P. 2048-2054. https://doi.org/10.1093/jn/132.7.2048
- Yan J., Charles J. F. Gut microbiome and bone: to build, destroy, or both? // Current osteoporosis reports. 2017. V. 15. №4. P. 376-384. https://doi.org/10.1007/s11914-017-0382-z
- Cox L. M., Yamanishi S., Sohn J., Alekseyenko A. V., Leung J. M., Cho I., ... Blaser M. J. Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences // Cell. 2014. V. 158. №4. P. 705-721. https://doi.org/10.10167j.cell.2014.05.052
- Cho I., Yamanishi S., Cox L., Methé B. A., Zavadil J., Li K., ... Blaser M. J. Antibiotics in early life alter the murine colonic microbiome and adiposity // Nature. 2012. V. 488. №7413. P. 621626. https://doi .org/10.1038/nature 11400
- Sánchez B., Delgado S., Blanco-Míguez A., Louren9o A., Gueimonde M., Margolles A. Probiotics, gut microbiota, and their influence on host health and disease // Molecular nutrition & food research. 2017. V. 61. №1. P. 1600240. https://doi.org/10.1002/mnfr.201600240
- Louis P., Flint H. J., Michel C. How to manipulate the microbiota: prebiotics // Microbiota of the human body. 2016. P. 119-142. https://doi.org/10.1007/978-3-319-31248-4_9
- Chen Y. C., Greenbaum J., Shen H., Deng H. W. Association between gut microbiota and bone health: potential mechanisms and prospective // The Journal of Clinical Endocrinology & Metabolism. 2017. V. 102. №10. P. 3635-3646. https://doi.org/10.1210/jc.2017-00513
- McCabe L. R., Parameswaran N. Advances in probiotic regulation of bone and mineral metabolism // Calcified tissue international. 2018. V. 102. №4. P. 480-488. https://doi .org/10.1007/s00223 -018-0403 -7
- Nilsson A. G., Sundh D., Backhed F., Lorentzon M. Lactobacillus reuteri reduces bone loss in older women with low bone mineral density: a randomized, placebo-controlled, doubleblind, clinical trial // Journal of internal medicine. 2018. V. 284. № 3. P. 307-317. https://doi.org/10.1111/joim.12805
- Lambert M. N. T., Thybo C. B., Lykkeboe S., Rasmussen L. M., Frette X., Christensen L. P., Jeppesen P. B. Combined bioavailable isoflavones and probiotics improve bone status and estrogen metabolism in postmenopausal osteopenic women: a randomized controlled trial // The American journal of clinical nutrition. 2017. V. 106. №3. P. 909-920. https://doi.org/10.3945/ajcn.117.153353
- Nordstrom A., Karlsson C., Nyquist F., Olsson T., Nordstrom P., Karlsson M. Bone loss and fracture risk after reduced physical activity // Journal of bone and mineral research. 2005. V. 20. №2. P. 202-207. https://doi.org/10.1359/JBMR.041012
- Xu J., Lombardi G., Jiao W., Banfi G. Effects of exercise on bone status in female subjects, from young girls to postmenopausal women: an overview of systematic reviews and metaanalyses // Sports Medicine. 2016. V. 46. №8. P. 1165-1182. https://doi.org/10.1007/s40279-016-0494-0
- Allen J. M., Mailing L. J., Niemiro G. M., Moore R., Cook M. D., White B. A., ... Woods J. A. Exercise alters gut microbiota composition and function in lean and obese humans // Med Sci Sports Exerc. 2018. V. 50. №4. P. 747-57. https://doi.org/10.1249/MSS.0000000000001495
- Borody T. J., Khoruts A. Fecal microbiota transplantation and emerging applications // Nature reviews Gastroenterology & hepatology. 2012. V. 9. №2. P. 88-96. https://doi.org/10.1038/nrgastro.2011.244
- Lawson P. A., Citron D. M., Tyrrell K. L., Finegold S. M. Reclassification of clostridium difficile as clostridioides difficile (Hall and O'Toole 1935) Prevot 1938 // Anaerobe. 2016. V. 40. P. 95-99. https://doi.org/10.1016/j.anaerobe.2016.06.008
- Borody T. J., Eslick G. D., Clancy R. L. Fecal microbiota transplantation as a new therapy: from Clostridioides difficile infection to inflammatory bowel disease, irritable bowel syndrome, and colon cancer // Current opinion in pharmacology. 2019. V. 49. P. 43-51. https://doi.org/10.1016/j.coph.2019.04.017
- Li S., Mao Y., Zhou F., Yang H., Shi Q., Meng B. Gut microbiome and osteoporosis: a review // Bone & Joint Research. 2020. V. 9. №8. P. 524-530. https://doi.org/10.1302/2046-3758.98.BJR-2020-0089.R1
- Романчук Н. П. Здоровая микробиота и натуральное функциональное питание: гуморальный и клеточный иммунитет // Бюллетень науки и практики. 2020. Т. 6. №9. С. 127166. https://doi.org/10.33619/2414-2948/58/14
- Булгакова С. В., Сиротко И. И., Романчук П. И. Остеопороз: 5G технологии и 5П медицина, экономические и медико-социальные парадигмы // Бюллетень науки и практики. 2021. Т. 7. №2. С. 163-178. https://doi.org/10.33619/2414-2948/63/14


