Микробиота желудочно-кишечного тракта домашних плотоядных
Автор: Лобанова А.А.
Журнал: Вестник Омского государственного аграрного университета @vestnik-omgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 1 (49), 2023 года.
Бесплатный доступ
Целью аналитического обзора является обобщение и систематизация данных современной научной литературы о микробиоте как сложной экосистеме желудочно-кишечного тракта, которая оказывает большое влияние на здоровье хозяина. Установлено, что количество бактерий и разнообразие их видового состава увеличивается в зависимости от локализации в желудочно-кишечном тракте (просвет кишечника или слизистая оболочка), варьируется - от кормления и голодания. Преобладающими бактериальными группами кишечника собак и кошек являются Bacteroides, Clostridium, Lactobacillus, Bifidobacterium spp. и Enterobacteriaceae. Чаще всего возбудители инфекционных болезней желудочно-кишечного тракта домашних плотоядных - Campylobacter spp., Clostridium spp., E. coli, Salmonella spp. При исследовании замороженных образцов из 60 упаковок корма (диеты на основе сырого мяса) от десяти различных производителей во всех обнаружены энтеробактерии , а в 31-м образце превышен уровень 5000 бактерий/г; это порог удовлетворительной микробной гигиены в соответствии с нормами ЕС. В двух образцах количество Cl. perfringens превысило 5000 бактерий/г, а это максимально разрешенный уровень анаэробных бактерий. Виды Salmonella обнаружены в четырех (7%) образцах, Campylobacter - в трех (5%). Изменения в составе кишечного микробиома являются результатом многих факторов, таких как диета, антибиотики, стресс, болезни. В настоящее время существуют разные способы модуляции кишечного микробиома - модулирование диеты, использование противомикробных препаратов, пре-, пробиотиков, постбиотиков и синбиотиков. Трансплантация фекальной микробиоты (ТФМ) представляет один из новых методов модуляции кишечной микробиоты.
Микробиота, возбудитель, дисбиоз, домашние плотоядные, желудочно-кишечный тракт, пробиотики, трансплантация фекальной микробиоты
Короткий адрес: https://sciup.org/142237260
IDR: 142237260 | УДК: 619:616.34:576:636.9 | DOI: 10.48136/2222-0364_2023_1_106
Текст обзорной статьи Микробиота желудочно-кишечного тракта домашних плотоядных
Сложная экосистема кишечных бактерий оказывает огромное влияние на здоровье хозяина. Взаимодействия между бактериями и хозяином опосредованы прямым контактом микробов с иммунной системой и различными метаболитами микробиоты. Физиологический микробиом модулирует иммунную систему, защищает от энтеропатогенов и обеспечивает питательные преимущества для хозяина.
Изменения в сложных отношениях между кишечными бактериями и клетками-хозяевами влияют на иммунные реакции хозяина и метаболический статус и могут привести к заболеванию. В недавних исследованиях описан дисбактериоз кишечника (т.е. изменения состава и/или разнообразия кишечной микробиоты) при различных острых и хронических желудочно-кишечных (ЖКТ) заболеваниях [1]. Кроме того, первоначальные данные на моделях человека и животных связывают хронический дисбактериоз, например, вызванный воздействием антибиотиков, с внекишечными расстройствами, такими как диабет и ожирение [2; 3]. Результаты подчеркивают важность кишечной микробиоты и дисбиоза в регуляции метаболизма хозяина, последствия которых отражаются на общем состоянии организма.
Сегодня ведется разработка молекулярных анализов для определенных групп бактерий, расчетов индексов микробного дисбиоза и анализов микробных функциональных метаболитов, чтобы помочь оценить дисбиоз; понять патофизиологию желудочнокишечных заболеваний; также это может способствовать новым диагностическим и терапевтическим подходам к дисбактериозу.
Цель обзора – обобщение и систематизация данных современной научной литературы о микробиоте желудочно-кишечного тракта домашних плотоядных.
Материалы и методы
Проведен поиск и систематизация научных публикаций отечественных и зарубежных авторов, в которых отражены данные о количественном и качественном составе микробиоты желудочно-кишечного тракта домашних плотоядных. Поиск литературных источников осуществляли в электронных базах: платформа онлайн-обучения «Уралбиовет Консалтинг» , база данных научной периодики «PubMed» , электронное ветеринарное руководство MSD Veterinary Manual , электронный ветеринарный журнал «TVP» . Временной диапазон поиска – 2005–2022 гг.
Применены следующие фильтры: систематический обзор (systematic review), клиническое исследование (clinical trial), ветеринарные науки (veterinary science). Язык публикаций: русский и английский.
Результаты исследований
В результате исследований установлено, что у животных одного вида микробиота похожа, но отличается на уровне видов и штаммов. У каждой собаки и кошки свой микробный профиль. Кроме того, выявлено, что количество бактерий и разнообразие их видового состава увеличивается в зависимости от локализации в желудочнокишечном тракте (просвет кишечника или слизистая оболочка), варьирует в зависимости от кормления и голодания.
Vestnik of Omsk SAU, 2023, no. 1(49) VETERINARY AND ZOOTECHNY
Ротовая полость – важная часть кишечной экосистемы. Бактерии постоянно проглатываются и могут колонизировать части кишечника. Из слюны собак были выделены актиномицеты – 26%, стрептококки – 18%, Granulicatella – 17%, Bacteroides melani-nogenicus, Corynebacterium. Бактерии из налета и зубного камня представлены Porphy-romonas – 20%, актиномицеты – 12%, Neisseria – 10%.
Кишечная микробиота включает вирусы, бактерии, грибы и простейшие.
Большинство исследований на сегодняшний день сосредоточены на бактериальной микробиоте, которая, по оценкам, составляет подавляющее большинство кишечной микробиоты.
В кишечнике, по оценкам, присутствуют 100 триллионов микробных клеток, это в 10 раз превышает количество клеток млекопитающих во всем организме. В совокупности микробные гены превосходят количество генов хозяина примерно в 10 раз.
Количество бактерий в двенадцатиперстной и тощей кишках собак и кошек составляет 102–109 КОЭ/г: значительно выше, чем в двенадцатиперстной кишке человека (<105 КОЭ/г). У кошек больше анаэробных бактерий в тонком кишечнике по сравнению с собаками. В подвздошной кишке микробов больше (107 КОЭ/мл содержимого) и их видовой состав разнообразней, чем в проксимальном отделе тонкого кишечника. Количество бактерий в толстой кишке колеблется – 109–1011 КОЭ/г. Преобладающими бактериальными группами кишечника собак и кошек являются Bacteroides, Clostridium, Lactobacillus, Bifidobacterium spp. и Enterobacteriaceae.
Чаще всего возбудители инфекционных болезней желудочно-кишечного тракта домашних плотоядных – Campylobacter spp., Clostridium spp., E. coli, Salmonella spp.
Campylobacter jejuni, C. coli, C. upsaliensis и C. helveticus – комменсальные микроорганизмы кишечника собак и кошек. Распространенность кампилобактерий у здоровых собак регистрируют в пропорциях: C. jejuni – 49%, C. coli – 5%, C. upsaliensis – 19%, а у кошек – C. jejuni – 46%, C. coli – 1%, C. upsaliensis – 5% и C. helveticus – 22%. При определенных условиях Campylobacter может вызывать патологию желудочнокишечного тракта. К факторам риска относят молодой возраст животного, иммунокомпетентность, предшествующую терапию, например, антибиотиками, неудовлетворительные условия содержания и т.д. [4].
Палочковидная бактерия Clostridium perfringens является облигатным анаэробом. Он способствует нормальной микробной экологии и питанию толстого кишечника здоровых собак и кошек. При определенных условиях пролиферация и споруляция Cl. per-fringens способствуют образованию энтеротоксина А (или CPE – Clostridium perfringens Enterotoxin), который может вызывать повреждение слизистой оболочки, секрецию жидкости в просвет кишечника и диарею по толстокишечному типу.
Cl. perfringens подозревается в качестве энтеропатогена собак. Однако его точная роль в расстройствах желудочно-кишечного их тракта остается неизвестной.
Недавние исследования свидетельствуют о важности измененной кишечной микробиоты в активации факторов вирулентности энтеропатогенов. Цель исследования состояла в том, чтобы оценить взаимосвязь между диареей, дисбактериозом и наличием Cl. perfringens и его энтеротоксина (CPE).
Образцы кала были собраны проспективно у 95 здоровых контрольных собак и 104 собак с заболеваниями ЖКТ и оценены на обилие бактерий и наличие CPE с ис-
Vestnik of Omsk SAU, 2023, no. 1(49) VETERINARY AND ZOOTECHNY пользованием количественной ПЦР и ELISA соответственно. Cl. perfringens обнаружен у всех собак. Потенциально энтеротоксигенные Cl. perfringens обнаружены у 33,7% здоровых контрольных собак и 48,1% больных собак соответственно. CPE был обнаружен с помощью ИФА у 1,0% контрольных собак и 16,3% больных.
Численность Fusobacteria, Ruminococcaceae, Blautia и Faecalibacterium значительно снижена у больных собак, в то время как численность Bifidobacterium, Lactobacillus и Escherichia coli значительно увеличена по сравнению с контрольными собаками. Микробный дисбактериоз не зависел от присутствия энтеротоксигенных Cl. perfringens или CPE [5].
Большинство штаммов кишечной палочки являются комменсалами, которые не вызывают болезнь. Штаммы кишечной палочки, обусловливающие диарею, разделяют на четыре вида – энтероинвазивный, энтеропатогенный, энтерогеморрагический и эн-тероадгезивный. Все перечисленные штаммы выделены от собак и кошек с диареей. E. coli может быть выращена из фекалий здоровых собак и кошек, поэтому положительный посев не обязательно указывает на заболевание. Идентификация патогенных штаммов требует современных молекулярных технологий, таких как биоанализ, гибридизация ДНК и ПЦР-амплификация.
Факультативные анаэробные палочковидные бактерии Salmonella spp . можно обнаружить в кале здоровых собак. В результате исследования установлено, что от 1% до 30% образцов кала или ректальных мазков, взятых у здоровых домашних собак, 16,7% – от собак в питомниках и 21,5% – у госпитализированных оказались положительными в посеве на сальмонеллез. У здоровых кошек (от 1% до 18%) также выделяли сальмонеллу. У собак с диареей чаще всего выделяют Salmonella typhimurium .
Риску заражения сальмонеллой наиболее подвержены молодые и иммунокомпетентные животные с сопутствующими болезнями желудочно-кишечного тракта, например, парвовирусной инфекцией или паразитарной инвазией, и животные, получающие терапию глюкокортикоидами [4] .
До недавнего времени идентификацию кишечных бактерий осуществляли почти исключительно с использованием традиционной бактериальной культуры. Культура фекалий все еще может быть полезна для обнаружения специфических энтеропатогенов, таких как Salmonella или Campylobacter jejuni, поскольку этот подход позволяет проводить тестирование чувствительности клинических образцов к антибиотикам, но подавляющее большинство кишечных бактерий являются строгими анаэробами и не обнаруживаются при использовании стандартных методов культивирования. Поэтому обычная бактериальная культура не позволяет подробно охарактеризовать сложные кишечные бактериальные сообщества. В настоящее время для описания микробиоты кишечника используют ряд молекулярных методов [6].
Традиционные бактериальные культуры, а также молекулярные подходы выявили различия в типе и количестве бактерий в желудочно-кишечном тракте. Бактериальная численность в двенадцатиперстной кишке здоровых собак колеблется от 102 до 109 колониеобразующих единиц (КОЕ)/г [8]. В толстой кишке содержится гораздо больше, до 1011 КОЕ/г [7].
Молекулярные инструменты позволяют идентифицировать ранее некультивируе-мые и, следовательно, неизвестные бактерии.
Установлено, что двенадцатиперстная кишка содержит смесь аэробных и факультативно-анаэробных бактерий, в то время как толстая кишка колонизирована почти исключительно строгими анаэробами. В толстой кишке преобладают группы бактерий
Vestnik of Omsk SAU, 2023, no. 1(49)
VETERINARY AND ZOOTECHNY
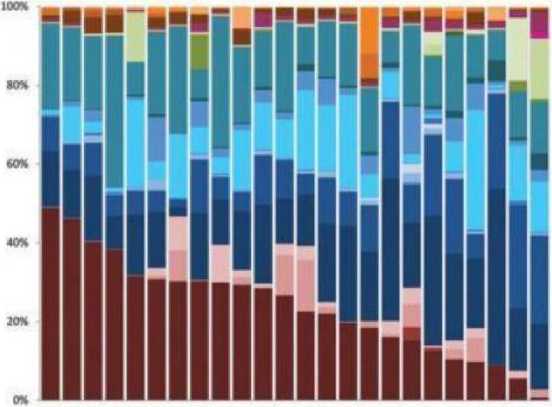
Clostridiaceae, Bacteroidaceae, Prevotellaceae и Fusobacteriaceae (рис. 1). Каждый столбец на рисунке представляет состав микробиоты одной здоровой собаки.
t nteroboctenoceae
-
■ Su«inivib,ionoceor
-
■ Hehtobotttfoceoe
-
• Campvtobocteroceac
-
■ Akoligenoceoc
-
■ Corwbocttrxxeoe
-
■ Bifidotxxtenocro#
TufKibocterottoe
Strcptococcoceaf
-
■ tnterococcaceoe
s BotiHocroe
-
■ fusoboctenoteoe
-
■ tryiipetotnchocew
-
■ Ruminotoccoceoe
-
■ Veillontllocroe
-
■ Pept«treptx
Peptotoccoceoe
-
■ Clostridiolei;l_
-
■ CtoMhdwIei.tthef
-
■ OoMhdioctee
-
■ Lochnospiroctoe
IPoraprevotrllaceof)
ч Prevoielloceo*
-
■ Porphyfomonadoceot
-
■ Bacteroidoceoe
Рис. 1. Разнообразие кишечной микробиоты у здоровых собак [8]
Следует отметить, что у каждой собаки есть уникальное микробное сообщество с отчетливыми различиями в пропорциях этих бактериальных групп. Исходя из этого, индивидуальные различия в видах микробов могут вызывать индивидуальную реакцию на различные диеты, источники клетчатки и пробиотики.
Желудочно-кишечный тракт также является домом для разнообразной популяции вирусов и грибков. В одном исследовании описано до 40 видов грибков в образцах фекалий собак; большинство из них были различными Candida spp.
Основные группы бактерий в кишечнике – строгие или факультативные анаэробы [9].
В последние годы для кормления собак все более популярны диеты на основе сырого мяса (raw meat-based diets – RMBD). Сторонники утверждают, что RMBD более естественен для собак, потому что это то, что едят их предки (волки). Противники утверждают, что RMBD представляет опасность для здоровья как людей, так и животных из-за риска распространения зоонозных бактерий и устойчивых штаммов бактерий [10].
Такие диеты основаны на субпродуктах, которые не подвергались какой-либо обработке для снижения микробного обсеменения, поэтому существует риск присутствия потенциально патогенных микроорганизмов. Замороженные образцы из 60 упаковок RMBD от десяти различных производителей были проанализированы на содержание в них бактерий, принадлежащих к семейству Enterobacteriaceae, Clostridium perfringens, а также на присутствие Salmonella и Campylobacter .
Энтеробактерии обнаружены во всех 60 образцах и в 31-м образце превышали уровень 5000 бактерий/г, это порог удовлетворительной микробной гигиены в соответствии с нормами ЕС. В двух образцах количество Cl. perfringens превысило 5000 бакте-рий/г, а это максимальный уровень анаэробных бактерий, разрешенный национальными стандартами Швеции. Виды Salmonella обнаружены в четырех (7%) и виды Campylobacter – в трех (5%) образцах. Результаты показывают, что очень важно соблюдать правила гигиены при хранении, обращении и кормлении RMBD, ограничив потенциальные риски для здоровья животных и людей, особенно молодых людей и людей с ослабленным иммунитетом [11].
Vestnik of Omsk SAU, 2023, no. 1(49)
VETERINARY AND ZOOTECHNY
В другом перекрестном исследовании изучали различия в выделении бактерий с фекалиями между собаками, получавшими RMBD, сухой корм. Образцы фекалий от 50 собак проанализированы на наличие продуцирующей бета-лактамазы расширенного спектра (БЛРС) Escherichia coli, Campylobacter и Salmonella.
В результате у 25 собак, получавших RMBD, БЛРС (ESBL), выделена E coli в 13 образцах фекалий, Campylobacter – 12-ти и Salmonella – одном. У 25 собак, получавших сухой корм, БЛРС-продуцирующая кишечная палочка выделена из одного образца фекалий, а Campylobacter – из четырех, при этом сальмонеллы не обнаружены (рис. 2).
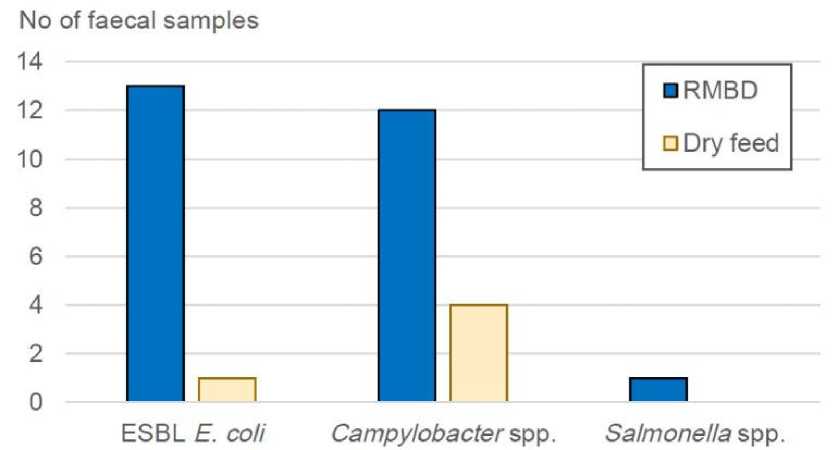
Рис. 2. Исследование образцов фекалий от собак, получавших диету на основе сырого мяса (RMBD), и собак, получавших сухие корма (Dry feed)
Таким образом, отмечена значительная разница в выделении зоонозных и резистентных бактерий с фекалиями между собаками, получавшими RMBD и сухой корм. Эти результаты подтверждают, что RMBD может представлять микробиологический риск не только для собак, но и для людей, контактирующих с RMBD и фекалиями собак [10].
Изменения в составе кишечного микробиома, также известные как дисбиоз, являются результатом многих факторов, таких как диета, антибиотики, стресс, болезни и т.д. Существует несколько способов модуляции кишечного микробиома: модулирование диеты, использование противомикробных препаратов, пре-, про-, постбиотиков и синбиотиков. Трансплантация фекальной микробиоты (ТФМ) представляет один из новых методов модуляции кишечной микробиоты у людей с целью реконструкции кишечного микробиома реципиента. В медицине эта форма бактериотерапии успешно применяется при рецидивирующей инфекции Clostridium difficile. Метод ТФМ известен в медицине крупных животных уже несколько лет, в то время как в медицине мелких животных его использование не является частью обычной практики [12].
Заключение
В результате анализа публикаций отечественных и зарубежных авторов установлено, что в желудочно-кишечном тракте собак и кошек обитает очень сложная микробиота, состоящая из бактерий, грибков, вирусов и простейших. До недавнего времени традиционная бактериальная культура обычно использовалась для идентификации бак-
Vestnik of Omsk SAU, 2023, no. 1(49) VETERINARY AND ZOOTECHNY терий, присутствующих в желудочно-кишечном тракте, но теперь общепризнано, что у стандартных методов посева нет достаточного разрешения для идентификации преимущественно анаэробных бактерий, обитающих в кишечнике.
В настоящее время разработаны молекулярные методы для оценки дисбиоза кишечника у собак и кошек с желудочно-кишечными заболеваниями, но эти подходы еще не так доступны для рутинной диагностики. Одним из новых методов модуляции микробиоты кишечника является трансплантация фекальной микробиоты.
Список литературы Микробиота желудочно-кишечного тракта домашних плотоядных
- Honneffer J.B., Minamoto Y., Suchodolski J.S. Microbiota alterations in acute and chronic gastrointestinal inflammation of cats and dogs. World J Gastroenterol. 2014;20:16489-16497.
- Saari A., Virta L.J., Sankilampi U. et al. Antibiotic exposure in infancy and risk of being overweight in the first 24 months of life. Pediatrics. 2015;135:617-626.
- Vrieze A., Out C., Fuentes S. et al. Impact of oral vancomycin on gut microbiota, bile acid metabolism, and insulin sensitivity. J Hepatol. 2014;60:824-831.
- Федотова Д. Бактериальные инфекции ЖКТ // Уралбиовет Консалтинг: [сайт]. [2022]. URL: https://ubvk.ru/bakterialnye-infekcii-zhkt-fedotova-darya/ (дата обращения: 27.02.2023).
- Minamoto Y., Dhanani N., Markel M.E., Steiner J.M., Suchodolski J.S. Prevalence of Clostridium perfringens, Clostridium perfringens enterotoxin and dysbiosis in fecal samples of dogs with diarrhea. National Library of Medicine. National Center for Biotechnology Information. 2014;174(3-4):463-473. DOI 10.1136/vr.105199.
- Suchodolski J. Diagnosis and interpretation of intestinal dysbiosis in dogs and cats. National Library of Medicine. National Center for Biotechnology Information. 2016;215:30-7. DOI 10.1016/j.tvjl.2016.04.011.
- Mentula S., Harmoinen J., Heikkilä M. et al. Comparison between cultured small-intestinal and fecal microbiotas in beagle dogs. Appl Environ Microbiol. 2005;71:4169-4175.
- Simpson K.W., Dogan B., Rishniw M. et al. Adherent and invasive Escherichia coli is associated with granulomatous colitis in boxer dogs. Infect Immun. 2006;74:4778-4792.
- Suchodolski J. Intestinal Microbes and Digestive System Disease in Dogs. Today's Veterinary Practice. 2017;7:59–64.
- Runesvärd E., Wikström C., Fernström L., Hansson I. Presence of pathogenic bacteria in faeces from dogs fed raw meat-based diets or dry kibble. National Library of Medicine. National Center for Biotechnology Information. 2020;187(9):e71. DOI 10.1136/vr.105644.
- Hellgren J., Hästö L.S., Wikström C., Fernström L., Hansson I. Occurrence of Salmonella, Campylobacter, Clostridium and Enterobacteriaceae in raw meat-based diets for dogs. National Library of Medicine. National Center for Biotechnologytion. 2019;184(14):442. DOI 10.1136/vr.105199.
- Takáčová M., Bomba A., Tóthová C., Micháľová A., Turňa H. Any Future for Faecal Microbiota Transplantation as a Novel Strategy for Gut Microbiota Modulation in Human and Veterinary Medicine? National Library of Medicine. National Center for Biotechnology Information. 2022;12(5):723. DOI 10.3390/life12050723.


