Микробная транслокация и системный воспалительный ответ при ВИЧ-инфекции
Автор: Хасанова Г.Р., Биккинина О.И., Анохин В.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Стоматология
Статья в выпуске: 3 т.9, 2013 года.
Бесплатный доступ
Цель: комплексная оценка маркеров системного воспалительного ответа во взаимосвязи с показателями эндотоксинемии у больных ВИЧ-инфекцией для оценки роли эндотоксина в процессе гиперактивации иммунной системы и прогрессирования заболевания. Материал и методы. Определены концентрации эндотоксина, растворимого белка CD14, провоспалительных цитокинов (интерлейкина-ip, фактор некроза опухоли-а), и С-реактивного белка у 232 больных ВИЧ-инфекцией. Использовались ЛАЛ-тест, иммуноферментные и биохимические методы исследования. Результаты. Установлено статистически значимое повышение всех исследованных нами маркеров системного воспалительного ответа в группе ВИЧ-инфицированных пациентов в сравнении с группой условно здоровых людей. Выявлена прямая корреляция уровня sCD14 с большинством маркеров системного воспалительного ответа. Повышение уровня sCD14 ассоциировалось с нарастанием клинических и лабораторных маркеров иммуносупрессии. Заключение. Полученные результаты подтверждают роль эндотоксина — маркера микробной транслокации из кишечника и высокоактивного биологического вещества — в патогенезе гиперактивации иммунной системы и прогрессирования ВИЧ-инфекции.
Вич-инфекция, гиперактивация иммунной системы, микробная транслокация, цитокины, эндотоксин
Короткий адрес: https://sciup.org/14917780
IDR: 14917780
Текст научной статьи Микробная транслокация и системный воспалительный ответ при ВИЧ-инфекции
-
1В ведение. В последние годы активно обсуждается роль хронической иммунной активации и воспаления в патогенезе необратимого поражения иммунной системы и прогрессирования ВИЧ-инфекции. По мнению J. M. Brenchley и соавт., решающую роль в этом процессе играет поступление в системный кровоток микробов и их компонентов в результате по-
- Ответственный автор — Хасанова Гульшат Рашатовна
Адрес: 420140, Казань, проспект Победы, 83.
Тел.: (843) 2678006.
вышения проницаемости стенки кишки на фоне ВИЧ-инфекции [1]. Повышение проницаемости стенки кишки может быть обусловлено массивной гибелью кишечного пула CD4-лимфоцитов, в особенности на острой стадии заболевания, cущественным снижением экспрессии белков, обеспечивающих межэпителиальные связи, продолжающейся репликацией вируса и постоянным воспалением стенки кишки, а также нарушениями микробиоценоза кишечника [2]. Признанным маркером микробной транслокации является липополисахарид клеточной стенки грамотрица- тельных бактерий, или эндотоксин (ЛПС). Известно, что эндотоксин является мощнейшим биологически активным веществом, взаимодействие которого с комплексом СD14/TLR4/MD2, расположенным на поверхности макрофагов и других клеток миелоидного ряда, вызывает секрецию растворимого белка CD14 (sCD14) и провоспалительных цитокинов, таких, как фактор некроза опухоли (TNF-α), интерлейкин-6, интерлейкин-1β (IL-1 β) [3, 4].
Цель: комплексная оценка маркеров системного воспалительного ответа (СВО) во взаимосвязи с показателями эндотоксинемии у больных ВИЧ-инфекцией для оценки роли эндотоксина в процессе гиперактивации иммунной системы и прогрессирования заболевания.
Материал и методы. Все исследования проведены на базе Республиканского центра по профилактике и борьбе со СПИД и ИЗ МЗ РТ (г. Казань). Исследуемую группу составили 232 человека с установленным диагнозом «ВИЧ-инфекция» (см. табл. 1). Забор крови осуществлялся в амбулаторных условиях во время плановой диспансеризации пациентов.
Контрольную группу составили 26 здоровых добровольцев в возрасте от 23 до 55 лет (M±SD=30,6±11,3 г.).
Концентрация ЛПС в сыворотке крови определялась с помощью ЛАЛ-теста (E-toxate, Sigma) в адаптированной к клиническим условиям модификации [4].
Для оценки концентрации ИЛ-1β и TNF-α использовали тест-системы для иммуноферментного анализа производства «Вектор-бест», sCD14 — производства «HyСult biotech». Концентрация С- реактивного белка ( С -РБ) определена биохимическими способами.
Статистическая обработка полученных данных проводилась с использованием программы Portable Statistica 8. Для оценки связи между количественными признаками применялся коэффициент ранговой корреляции Спирмена , между количественными и качественными признаками — метод Кендал — Тау. Нормальность распределения количественного признака в вариационном ряду оценивалась с помощью критерия Шапиро — Уилка. При сравнении двух непрерывных рядов данных использовали t-критерий Стьюдента. Критический уровень статистической значимости р считали равным 0,05.
Результаты. Основные результаты исследования суммированы в табл. 2 и на рисунке.
Из представленных данных видно, что у большинства пациентов с ВИЧ-инфекцией как концентрация ЛПС, так и концентрация sCD14 превышали наибольшие показатели, зарегистрированные нами в группе здоровых. При разделении больных на группы по клиническим стадиям ВИЧ-инфекции (в соответствии с классификацией В. И. Покровского, 2001) и по стадиям иммуносупрессии (по классификации CDC) вы-
Таблица 1
Характеристика исследуемой группы
|
Демографические и клинико-лабораторные характеристики пациентов |
Показатели |
|
Пол: мужчины |
112 (48,3%) |
|
Возраст, г., M± SD * |
34±7,4 |
|
Среднее содержание CD4-лимфоцитов, кл/мкл, M±SD Вирусная нагрузка, средний log копий/мл, M±SD Оппортунистические заболевания: |
286±215,1 3,3±2,2 |
|
волосистая лейкоплакия языка |
17 (7,3%) |
|
кандидоз |
61 (26,3%) |
|
туберкулез |
36 (15,5%) |
|
Получение антиретровирусной терапии |
55 (23,7%) |
|
Средняя продолжительность приема антиретровирусных препаратов, мес., M±SD |
9,35±10,4 |
|
Хронические вирусные гепатиты ( В, С или В+С ) Употребление психоактивных веществ в период проведения исследования: |
109 (49,9%) |
|
алкоголь |
26 (11,2%) |
|
героин |
11 (4,7%) |
П р и м еч а н и е : * — здесь и далее: М — выборочное среднее арифметическое; SD — стандартное отклонение.
Таблица 2
Показатели эндотоксинемии (ЛПС, sCD14), провоспалительных цитокинов (TNF-α, IL-1 β) и С-РБ у пациентов с ВИЧ-инфекцией и здоровых людей
|
Исследуемый показатель |
Количество обследованных пациентов |
Количество пациентов с показателями, превышающими наибольшие показатели группы здоровых, абс (%) |
Среднее значение в исследуемой группе,M±SD |
Среднее значение в контрольной группе M±SD |
р |
|
ЛПС, EU/мл |
232 |
121 чел. (52,2%) |
2,2±2,03 |
0,67±0,28 |
0,000006 |
|
sCD-14, пг/мл |
89 |
81 (91%) |
3,37±1,57 |
1,95±0,39 |
0,00001 |
|
IL-1β, пг/мл |
155 |
98 (63,2%) |
44,0±120,4 |
0,21±0,42 |
0,00008 |
|
TNF-α, пг/мл |
67 |
23 (34,3%) |
9,0±17,56 |
0,21±0,42 |
0,0001 |
|
С-РБ, мг/л |
176 |
45 (25,6%) |
15,11±43,6 |
0,75±1,36 мг/л |
0,0067 |
П р м еч а н и е : p — cтатистическая значимость различий между исследуемой и контрольной группами.
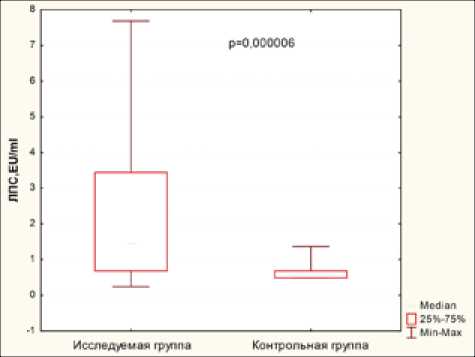
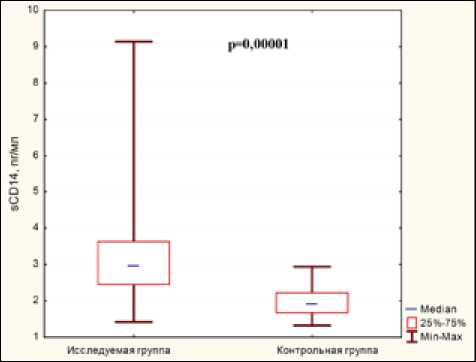
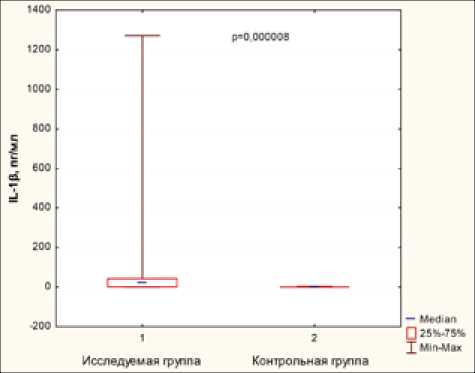
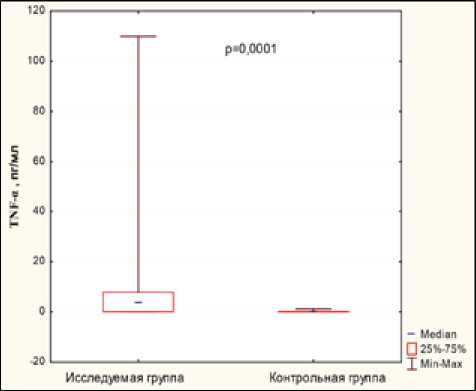
Показатели ЛПС, sCD14, IL-1β и TNF-α в исследуемой и контрольной группах явленная статистически подтвержденная закономерность прослеживалась во всех группах пациентов.
У значительной доли обследованных пациентов выявлены также относительно высокие показатели TNF-α, IL-1β и С-РБ (табл. 1). Средние значения всех вышеназванных показателей также статистически значимо превышали показатели контрольной группы (табл. 2, рисунок).
У всех 232 пациентов проводился общий анализ крови. Ускорение СОЭ выше общепринятой нормы (2-10 мм/ч) отмечено у 174 чел. (75%). У 8 пациентов (3,4%) выявлено количество лейкоцитов периферической крови ниже 4,0х10 9 /л и у 73 (31,5%) — выше 12,0х109/л, что соответствует международным критериям диагностики синдрома СВО.
Из общей группы были выделены больные с нарушениями стула в течение длительного времени (неустойчивый стул, жидкий стул до 4 раз в день, запоры). Выявлена достоверная взаимосвязь нарушений стула и концентрации ЛПС в сыворотке крови ( r =0,12, p =0,009); при этом средняя концентрация ЛПС в группе больных с нарушениями стула статистически значимо превышала таковую в группе без нарушений стула (M±SD=2,93±2,42 и 2,07±1,91 соответственно, p =0,04).
Для sCD14 подобная взаимосвязь не установлена ( r =0,1, p =0,15; M±SD=4,28±2,34 и 3,27±1,45 в группах с нарушениями стула и без таковых соответственно р =0,24).
Не выявлено зависимости концентрации эндотоксина сыворотки от стадии заболевания, выраженности иммуноcупрессии и наличия оппортунистических инфекций, что подтверждает, на наш взгляд, универсальность феномена гиперэндотоксинемии при ВИЧ-инфекции.
Установлена связь показателя sCD14 (маркера взаимодействия ЛПС с эффекторными клетками) с клиническими и лабораторными маркерами иммуносупрессии. Выявлена обратная корреляция показателей CD4-клеток и концентрации sCD14 у обследованных больных ( r =–0,21, p =0,046). Для более точной оценки проведено поперечное срезовое исследование со сравнением превалентностей случаев снижения уровня СD4-лимфоцитов≤200 кле-ток/мкл в двух группах: с уровнем sCD14>2,44 пг/ мл (максимальный показатель контрольной группы) и с уровнем sCD14≤2,44 пг/мл. Выявленное отношение превалентностей (PR) составило 2,709; 95% ДИ 1,087–6,791. При этом в группе пациентов с показателями sCD14≤2,44 уровень CD4-клеток был статистически значимо выше, чем у пациентов с более высокими показателями sCD14 (379,3±212,5 и 258±179,8 соответственно; p =0,016).
При разделении больных на группы в зависимости от наличия или отсутствия клинических признаков иммунодефицита (оппортунистических инфекций) также выявлена разница средних показателей sCD14: в группе пациентов с оппортунистическими заболеваниями уровень sCD14 значимо превышал данный показатель в группе пациентов без оппортунистических инфекций (M±SD) 3,83±1,82 и 2,89±1,1 соответственно (р=0,0049).
При проведении корреляционного анализа выявлены статистически значимые положительные связи уровня эндотоксина с IL-1β ( r =0,27, p =0,0007), sCD14 с TNF-α ( r =0,35, p =0,007), с количеством лейкоцитов крови ( r =0,21, p =0,04), а также с IL-1β с TNF - α ( r= 0,45, p =0,00012). Концентрация sCD14 была также прямо пропорциональна уровню С- РБ, СОЭ, температуре тела, однако корреляционные связи не являлись статистически достоверными ( r =0,16, p =0,15; r =0,19, p =0,08; r =0,08, p =0,49 соответственно).
Обсуждение. Таким образом, проведенное исследование позволило выявить у ВИЧ-инфицированных пациентов повышенный уровень как сывороточного ЛПС, так и sCD14, количество которого отражает результат взаимодействия эндотоксина с клетками миелоидного ряда и может рассматриваться как маркер активации моноцитов эндотоксином. Известно, что связывание ЛПС с MD2-белком невозможно без участия CD14-рецепторов [5]. Данный процесс сопровождается высвобождением в кровь растворимого белка sCD14, при этом наиболее высокие уровни sCD14 ассоциируются с генерализованными формами инфекции, обусловленными грамотрицательными микроорганизмами и септическим шоком [6]. Кишечник, вне всякого сомнения, самый ёмкий резервуар грамотрицательной бактериальной флоры в организме, что, наряду с доказанным ранее фактом ВИЧ-индуцированного повреждения кишечного барьера [1, 2] позволяет говорить о том, что регистрируемая в данном случае эндотоксинемия — «кишечного» происхождения. Проведенными нами ранее исследованиями установлена чрезвычайно высокая частота регистрации дисбиотических изменений в кишечнике у пациентов с ВИЧ-инфекцией, что может также способствовать снижению колонизационной резистентности кишечника и микробной транслокации [7]. Это подтверждается и выявленной нами связью между частотой нарушений стула и гиперэндотоксинемией. Параллельно у большинства обследованных пациентов, независимо от стадии их заболевания, регистрируются высокие показатели провоспалительных цитокинов, а также таких классических маркеров воспаления, как С -РБ и СОЭ, что подтверждает наличие системного воспалительного ответа, реализуемого, как известно, компонентами врожденного иммунитета. В отличие от данных, приводимых отдельными исследователями, мы не выявили статистически значимых взаимосвязей между концентрацией ЛПС и sCD14. Этот факт может быть объяснен возможным связыванием ЛПС опсонинами, такими, как антитела к ЛПС, липопротеиды высокой плотности и др., что может снижать биологическую активность эндотоксина. Иначе говоря, результативность действия ЛПС на клетки миелоидного ряда, на наш взгляд, зависит не только от концентрации плазменного эндотоксина, но и от генетически детерминированной восприимчивости toll-like- рецептора-4 к эндотоксину, а также возможностей антиэндотоксиновых систем организма, которые могут кардинально различаться у отдельных больных. В то же время концентрация sCD14 отражает «результативную» эндотоксинемию. Интересно, что для большинства исследованных нами показателей воспаления (TNF-α, С-РБ, уровень лейкоцитов, СОЭ) зарегистрированы положительные корреляции именно с sCD14, а не с ЛПС.
Феномен гиперактивации иммунной системы с последующим ее истощением рассматривается сегодня многими исследователями как один из ключевых в патогенезе иммунодефицита при ВИЧ-инфекции [8, 9]. Классической иллюстрацией, подтверждающей эту точку зрения, можно считать, в частности, многочисленные наблюдения о сравнительно благополучном течении инфекции вируса иммунодефицита у низших приматов — дымчатых мангобеев, у которых очень высокая «вирусная нагрузка» при отсутствии признаков повышенной активности иммунной системы, и не приводит к значимому прогрессированию иммунодефицита в течение многих лет наблюдения [10]. В то же время хроническая стимуляция иммунной системы в эксперименте на мышах способствует развитию оппортунистических заболеваний даже в отсутствие вирусной инфекции [11]. Установленная в нашем исследовании обратная корреляция между sCD14 и клиническими, равно как и лабораторными, признаками иммуносупрессии позволяет предположить роль эндотоксина как одного из факторов, способствующих гиперактивации и «истощению» иммунной системы при ВИЧ-инфекции.
Заключение. Полученные результаты подтверждают роль эндотоксина — маркера микробной транслокации из кишечника и высокоактивного биологического вещества — в патогенезе гиперактивации иммунной системы и прогрессирования ВИЧ-инфекции. Все это в конечном итоге позволяет рассматривать перспективы использования препаратов патогенетического лечения ВИЧ-инфекции, направленных на сдерживание избыточного поступления в кровоток эндотоксина гра-мотрицательных бактерий и купирование системных воспалительных реакций.
Список литературы Микробная транслокация и системный воспалительный ответ при ВИЧ-инфекции
- Microbial translocation is a cause of systmeic immune activation in chronic HIV infection/J.M. Brenchley, D.A. Price, T. W. Schacker [et al.]//Nat. Med. 2006. № 12. P. 1365-1371
- Early impairment of gut function and gut flora suporting a role for alteration of gastrointestinal mucosa in human immunodeficiency virus pathogenesis/A. Gori, С Tincati, G. Rizzardini [etal.]//J. Clin. Microbiol. 2008. № 46. P. 757-758
- LPS-induced cytokine production in human monocytes and macrophages/M. Rossol, H. Heine, U. Meusch [et al.]//Crit.Rev. Immunol. 2011. №31 (5). P. 379-446
- Яковлев М.Ю. Системная эндотоксинемия в физиологии и патологии человека: автореф.... д-ра мед. наук. М., 1993.57 с.
- CD14 controls the LPS-induced endocytosis of Toll-like receptor 4/1. Zanoni, R. Ostuni, L. R. Marek [et al.]//Cell. 2011. №147(4). P. 868-880
- Circulating soluble CD14 is associated with high mortality in gram-negative septic shock/R. Landmann, W. Zimmerli, S. Sansano[etal.]//J. Infect. Dis. 1995. №171 (3). P. 639-644
- Нарушения микробиоценоза кишечника у больных ВИЧ-инфекцией/Г. Р. Хасанова, В. А. Анохин, О. И. Биккинина [и др.]//Казанский медицинский журнал. 2013. № 1. С. 34-39
- Immune activation see point during early HIV infection predicts subsequent CD4+ T-cell changes independent of viral load/S. G. Deeks, CM. Kithen, L. Liu [et al.]//Blood. 2004. №104. P. 942-947
- Microbil translocation is associated with sustained failure in CD4+T-cell reconstitution in HIV-infected patients on long-term highly active antiretroviral therapy/G. Marchetti, G. M. Bellistri [et al.]//AIDS. 2008. № 22. P. 2035-2038
- Nonpathogenic SIV infection of sooty mangabeys is characterised by limited bystander immunopathology despite chronic high-level viremia/G. Silvestri, D. L. Sodora, R.A. Koup [et al.]//Immunity. 2003. № 18. P. 441-452
- Lethal T-cell immunodeficiency induced by chronic costimulation via CD27-CD70 interactions/K. Tesselaar, R. Arens, G. M. van Schijndel [et al.]//Nat. Immunol. 2003. № 4. P. 49-54.


