Микробное разнообразие в глинисто-солевых шламах калийного предприятия (г. Березники, Пермский край)
Автор: Корсакова Е.С., Шестакова Е.А., Одинцова Т.А., Бачурин Б.А., Плотникова Е.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 1, 2017 года.
Бесплатный доступ
Из глинисто-солевых шламов предприятия БКПРУ-2 ПАО «Уралкалий» (г. Березники, Пермский край) выделено 138 штаммов бактерий, которые на основании морфологических и генетических особенностей были объединены в 28 морфогеномогрупп. Представители каждой группы были идентифицированы на основе анализа нуклеотидных последовательностей гена 16S рРНК, сравни-тельное исследование которых показало принадлежность штаммов к классам Alphaproteobacteria, Gammaproteobacteria и Actinobacteria. Все обнаруженные бактерии являются галотолерантными, т.к. способны к росту на средах без добавления NaCl и с повышенной концентрацией соли (до 150 г/л). Большинство штаммов росли в щелочных условиях (рН 9.0) и использовали в качестве един-ственного источника углерода ряд моно- и полиароматических соединений, в том числе полицик-лические ароматические углеводороды, фталаты.
Глинисто-солевые шламы, филогенетическое разнообразие, бактерии-деструкторы, аромати-ческие соединения, фталаты
Короткий адрес: https://sciup.org/147204813
IDR: 147204813 | УДК: 579.695:579.262:579.222.2
Текст научной статьи Микробное разнообразие в глинисто-солевых шламах калийного предприятия (г. Березники, Пермский край)
Верхнекамское месторождение калийно-маг-ниевых и натриевых солей (ВМКМС) Пермского края является одним из крупнейших среди разрабатываемых в мире. В результате деятельности калийных комбинатов предприятий ПАО «Уралкалий» (г. Соликамск и Березники, Пермский край) образуются значительные объемы глинисто-солевых шламов и избыточных рассолов, которые хранятся в специальных гидротехнических сооружениях - шламохранилищах. Формирование состава шламов определяется, в первую очередь, составом добываемого сырья, а также технологическими факторами последующей рудоподготовки и обогащения, что обусловливает присутствие в них, наряду7 с легкорастворимыми хлоридными минералами, широкого спектра тяжелых металлов и органических соединений [Бачурин, Одинцова, 2009]. Основным источником последних являются используемые технологические химические реагенты и продукты их трансформации, главными вещест ве Корсакова Е. С. Шестакова Е. А., Одинцова Т. А., Бачурин Б. А., Плотникова Е. Г., 2017
вами преобразования которых являются полиэток-сильные соединения (полигликоли, полиоксиалканолы и ИХ эфиры, диоксоланы, диоксаны И Др.)к гетероциклы углеводородные структуры. включая полициклическую ароматику7 и фталаты [Бачурин. 2008: Бачурин, Одинцова, Первова. 2014].
По результатам эколого-геохимических исследований было обнаружено, что аккумулированные в глинисто-солевых шламах органические поллютанты служат мощными источниками 'загрязнения природных экосистем благодаря их высокой геохимической подвижности и могут рассматриваться как потенциальные вторичные источники контаминации гидросферы - высвобождение их из связанного состояния может происходить при выщелачивании отходов атмосферными осадками [Бачурин, Одинцова, 2006; Бачурин, 2012; Бачурин, Сметанников, Хохрякова, 2014]. В связи с этим при такой комплексной нагрузке абиотических факторов на территории шламохра-нилищ возникают условия для формирования уникальных сообществ галофильных и галотолерангных микроорганизмов, в том числе способных разлагать экотоксиканты.
Ранее из шламов района солеразработок ВМКМС были выделены и охарактеризованы бак- терии-дестру кторы полицикли ческих ароматических углеводородов и фталатов родов Rhodococ-cus^ Pseudomonas, Arthrobacter, Bacillus [Плотникова и др.. 200 L 2 011; Ястребова и др., 2009: Пастухова и др., 2010: Корсакова, Пьянкова. Плотникова. 2013; Кандаурова, Ястребова, Плотникова. 2016]. Описаны новые таксоны архей и прокариот, выделенные из продуктов флотационного обогащения калийных минералов и техногенных вод шла мохра нилища П АО « Ура лка лий» [ Реутских, Сара лов. 2012: Саралов и др.. 2012а. 20126; Saratov et al., 2013].
Цель настоящей работы - изучение бактериального сообщества глинисто-солевых шламов калийного предприятия БКПРУ-2 ПАО «Уралкалий» в г. Березники (Пермский край).
Материалы и методы исследования
Образцы шламов. В качестве материала для исследования были выбраны пять образцов, отобранных из шла мохра нилища калийного предприятия БКПРУ-2 ПАО «Уралкалий» (г. Березники) (табл. 1).
Таблица 1
Характеристика образцов глинисто-солевых шламов
|
№ образца шлама |
Регистрационный № |
Точка отбора, глубина отбора |
Минерализация, мг/кг |
ХБА\ мг/кг |
Н1Г\ мг/кг |
|
1 |
219/1 |
И [дам из шурфа № 1, о.3 м |
2641MJ |
902.5 |
312.5 |
|
2 |
220/2 |
Шлам из шурфа № 1, 0.5 м |
26400 |
817.5 |
265.0 |
|
3 |
221/3 |
Шлам из шурфа № 2, 0,2 м |
22650 |
932.5 |
340.0 |
|
4 |
222/4 |
Шлам из шурфа № 3. 0.2 м |
35800 |
1111.0 |
349.0 |
|
5 |
222/5 |
11 [лам из шурфа Яо 3, 0.4 м |
43000 |
но/** |
но. |
Примечание. ХБА - хлороформенный битумоид (компонент органического вещества, извлекаемый из горной породы органическим растворителем - хлороформом, без предварительной обработки соляной кисло гой). НП -нефтепродукты; и,о, - не определяли [Бачурин, Одинцова, 2009],
Для выделения и роста микроорганизмов была использована минеральная среда Раймонда (МСР) (Raymond, 1961) с добавлением NaCl (50 г/л). Агаризованные среды получали при добавлении агара («Sigma». США) в концентрации 15 г/л. Для приготовления богатой среды Раймонда (Б СР) в МСР добавляли 5 г/л триптона («Fluka», США) и 2.5 г/л дрожжевого экстракта («Difco», США) в качестве ростовых субстратов
Микробиологический анализ образцов шламов проводили общепринятыми методами посева почвенной суспензии на агаризованную БСР с последующим подсчетом колоний микроорганизмов (колониеобразующих единиц, КОЕ) и выделением бактерий из единичных колоний для идентификации [Методы ..., 1991]. Биоразнообразие и плотность видов бактерий -деструкторов оценивали с помощью индексов Шеннона-Уивера. Симпсона и Менхиника. используя дифференцированный подсчет колоний, принадле жащих к разным морфо(геномо)типам [Широких и др.. 2013; Орлова, 2013].
Способность бактерий разлагать ароматические углеводороды оценивали путем культивирования на агаризованной МСР (30 г/л NaCl) при 28°С с добавлением моно( полихроматических углеводородов («Fluka», США) в качестве единственного источника углерода и энергии. Нафталин, бифенил, бензол, толуол, фенол и дибутилфталат помещали на крышку перевернутой чашки Петри; орто- фталевую кислоту (у-ФК), бензойную (БК), цйрт-гидроксибензойную кислоты (ПГБК) вносили в среду до конечной концентрации 1 г/л, салициловую кислоту7 - до 0.5 г/л. Рост колоний бактерий на агаризованных средах с углеводородами оценивали по сравнению с ростом на агаризованных средах того же состава без субстратов (контрольный вариант). Колонии диаметром менее 1 мм оценивали как «+». 1-2 мм - «++», более 3 мм - «+++».
Рост микроорганизмов при изменении осмолярности среды. Изучение устойчивости микроорганизмов к NaCl (0-200 г/л) проводили на ага-ризованной среде БСР. оценивая размер выросших колоний.
Рост при разных значениях pH определяли при концентрации Na' 0.8-0.85 М в буферных системах, приготовленных на основе БСР. Штаммы культивировались на чашках Петри на агаризо-ванной среде при pH 5.0, 6.0, 7.0. 8.0, 9.0. Рост учитывали на седьмой день культивирования [Герхардт и др.. 1983].
Рост при разных температурах. Штаммы культивировали на агаризованной БСР (30 г/л NaCl) при 10, 20. 28. 37 и 45°С. Рост учитывали на седьмой день культивирования.
ДНК-тонирование полученных бактериальных изолятов проводили методом ВОХ-ПЦР (полимеразная цепная реакция повторяющихся ВОХ-элементов) с использованием праймера BOXA1R (5 -CTACGGCAAGGCGACGCTGACG-3’) в соответствии с методикой [Versalovic et al, 1994]. Продукты реакции разделяли электрофорезом в 1.5%-ном агарозном геле на 1 х ТВЕ буфере (89 мМ Трис-НО, 89 мМ борная кислота. 2,5 мМ ЭДТА, pH 8.2) в течение 2 ч. при напряжённости электрического поля 5.7 V/см и анализировали полученные фрагменты.
Филогенетический анализ полученных изо-лятов был основан на определении нуклеотидных последовательностей гена 16S рРНК с применением набора реактивов Big Dye Terminator Cycle Se quencing Kit на автоматическом секвенаторе Genetic Analyser 3500XL («Applied Biosystems», США) в Пермском государственном национальном исследовательском университете (кафедра ботаники и генетики растений). Полученные нуклеотидные последовательности были проанализированы с использованием программ CLUSTAL W, Sequence Scanner v. 2.0. Mega v. 7.0. Поиск гомологичных последовательностей проводили по базам данных GenBank и EzTaxon (http://www. .
Результаты и их обсуждение
Методом прямого высева на агаризованную БСР с содержанием 50 г/л NaCl из образцов шламов было выделено 138 штаммов бактерий. Отбор осуществлялся на основе различий в морфологии колоний микроорганизмов, растущих на агаризованной среде. В результате были сформированы 34 морфологические группы, представители которых были взяты для проведения дальнейших исследований.
Проведена сравнительная характеристика представителей наиболее сходных морфогрупп с применением метода ВОХ-ПЦР. Анализ полученных ВОХ-ПЦР профилей фрагментов геномной ДНК исследуемых бактерий показал, что 22 штамма, близких по морфологическим признакам, принадлежат к 16 геномогруппам (рис. 1). Согласно полученным результатам, выделенные штаммы бактерий были объединены в 28 морфогеномогрупп, далее обозначенных как репрезентативные операционные таксономические единицы (ОТЕ).
М12345678 9 10 11 М 12 13 14 15 16 17 18 19 20 М 21 22
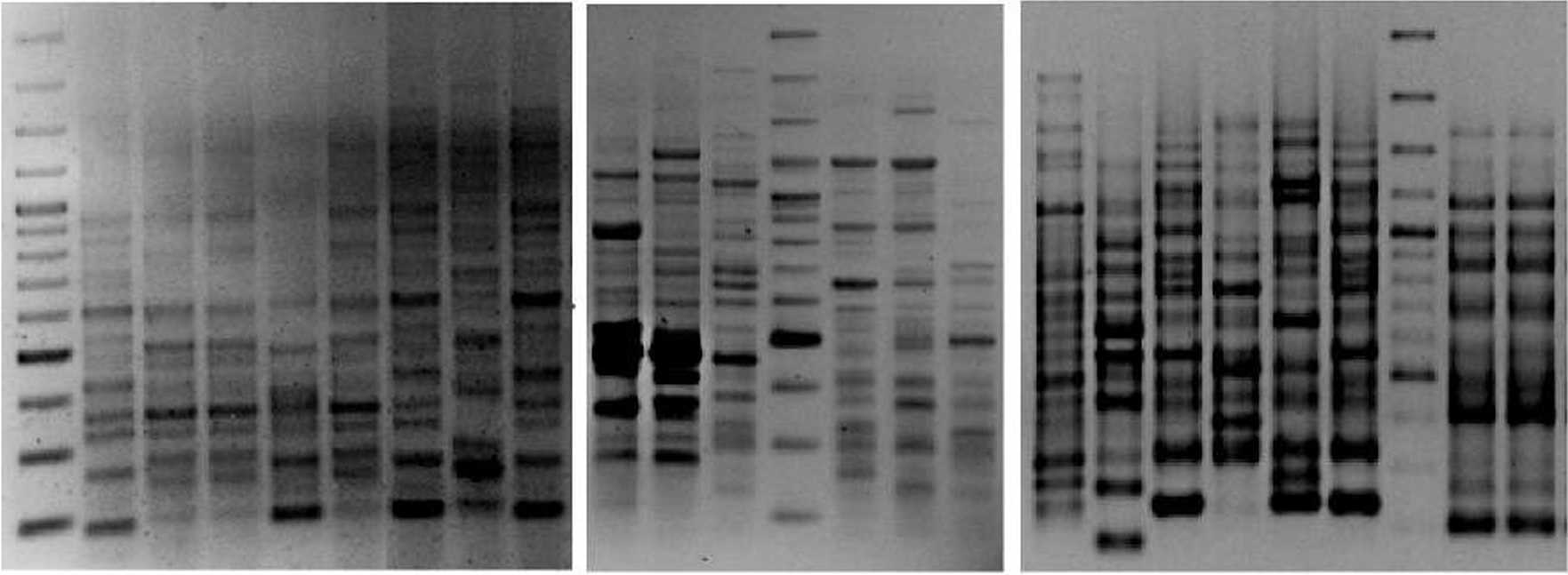
'—у—' 4—у—'
1 11 111 II 1 IV 1 V VI Vil VIII IX X XI XII XIII XIV XV XIII XVI
Рис. 1. Электрофореграмма продуктов ВОХ-ПЦР штаммов бактерий, изолированных из образцов шламов:
М
- маркер O’GeneRuler™ 100 bp Plus DNA Ladder («Fermentas», Литва), 7 - ВОЮ;
2
- ВОН;
3
- ВО 14:
4 -
ВО22;
5
- ВО26:
6 -
ВО36; 7 - ВО23; 5 - ВО8;
9
- ВОЮ;
10
- ВО34-1; 7 7 - ВО25; 7 2 - ВО9:
13 -
ВО20;
14 -
ВО35; 75 - ВО13;
16
- ВО27;
17 -
ВО28; 719 - ВОЗО; 20 - ВОЗ 1; 21 - ВО 1; 22 - Rhodococcus sp. КТ723 (штамм-деструктор нафталина из рабочей коллекции Лаборатории молекулярной микробиологии и биотехнологии ИЭГМ УрО РАН)
Была проведена статистическая оценка альфа-разнообразия представленных микробных сообществ с использованием индесов Шеннона-Уивера (придает большее значение уникальным ОТЕ) и Симпсона (общим ОТЕ), показавшая примерно равные показатели биоразнообразия и выравнен-ности сообществ в исследуемых пробах. Однако, согласно проведенному анализу, образец шлама № 5 характеризуется гораздо большим биоразнообразием уникальных ОТЕ по индексу Шеннона-Уивера (Н'=1.316) и меньшим значением общих ОТЕ (D=0.319) при сравнении с пробами № W. Большое количество морфогеномогрупп, низкая численность изолированных бактерий и высокий уровнь минерализации (43000 мг/кг) данной пробы могут быть непосредственно связаны с присутст вием галотолерантных и галофильных форм микроорганизмов (табл. 1). Расчет плотности видов (видового богатства) в сообществе по индексу Менхиника (DMn) показал, что наибольшее значение данного параметра выявлено в образце шлама № 2, в котором, в свою очередь, была обнаружена высокая численность бактерий (7.84 хЮ1) и малое количество представленных морфотипов (табл. 2). Вероятно, что такие особенности связаны с параметрами данной пробы, а именно с отбором с глубины 0.5 м. на котором воздействие неблагоприятных биотических факторов снижается (в том числе вымывание бактерий из образца шлама атмосферными осадками), что обусловливает высокую численность обнаруженных бактерий
Таблица 2
Анализ разнообразия микробных сообществ образцов шламов
|
Номер образца |
Количество ОТЕ |
Общая численность бактерий, КОЕ/1 г шлама |
Индекс Менхиника (Dwn) |
Индекс 111енно-на-Уивсра (1Г) |
Индекс Симпсона (D) |
|
1 |
13 |
6.35*10° |
0.005 |
0.839 |
0.463 |
|
2 |
10 |
7.84*10" |
0.011 |
1.077 |
0.469 |
|
3 |
15 |
7.35*10° |
0.006 |
1.047 |
0.475 |
|
4 |
13 |
2.72*10° |
0.008 |
0.996 |
0.482 |
|
5 |
14 |
2.27*10° |
0 009 |
1.316 |
0.319 |
В результате сравнения последовательностей гена 16S рРНК (у 28 изолятов. представителей каждой морфогеномогруппы) с типовыми видами из базы данных EzTaxon (http://www.ezbiocloud. net) установлено, что 7 культур являются представителями класса Bacilli, 8 штаммов относятся к классу
Crnnmuproteobcctenck 11 штаммов - к классу А cli-nobacteria и 2 штамма - к классу' Alphaproteobac-lena. Уровень сходства 16S рДНК изолятов с типовыми штаммами узаконенных видов находился в пределах 98.1-100% (табл. 3).
Таблица 3
Анализ нуклеотидных последовательностей генов 16S рРНК изолированных бактерий
|
№ штамма |
Типовой штамм |
№ GenBank |
Сходство, % |
Количество нуклеотдов |
|
ВО1 |
Rhodococcus wradslaviensisMCMB 13082т |
Z37138 |
99.9 |
800 |
|
ВО2 |
Rhodococcus fascians DSM 20669т |
X79186 |
100 |
819 |
|
ВОЗ |
Bacillus pumilus ATCC 7061T |
ABRX01000007 |
99.9 |
1426 |
|
ВО4 |
Bacillusfmrms NCIMB 9366T |
X60616 |
99.3 |
908 |
|
ВОЗ |
Bacillus thiiringiensis AICC 107921 |
ACNF01000156 |
100 |
915 |
|
ВО6 |
Bacillus safens is РО-ОЗбЬ1 |
AF234854 |
99.9 |
935 |
|
BOS |
Pseudomonas xanthomarina KMM 14471 |
.ABI 76954 |
987 |
1401 |
|
ВО9 |
Dietzia mans DSM 436721 |
X79290 |
99 8 |
904 |
|
BOI 1 |
Pseudomonas xanthomarina KMM I4471 |
AB 176954 |
990 |
1434 |
|
BOIS |
Stenotrophomonas maltophiho ATCC 136371 |
AB008509 |
100 |
930 |
|
BOIS |
Bacillus safensis FO-ОЗбЬ1 |
AF234854 |
100 |
923 |
|
BO19 |
ArthrobacTer oxydans DSM 201191 |
X83408 |
100 |
1233 |
|
BO20 |
DiOzia mans DSM 436721 |
X79290 |
99.9 |
887 |
|
BO21 |
Anhrobacter oxydans DSM 201191 |
X83408 |
99.2 |
1388 |
|
BO22 |
Pseudomonas xanthomanna KMM 14471 |
AB 176954 |
99.0 |
1438 |
|
BO23 |
Pseudomonas xanthomarbta KMM 14471 |
AB 176954 |
99.2 |
1404 |
|
BO24 |
Pseudomonas xauthomanna KMM 14471 |
AB 176954 |
99.2 |
1421 |
|
BO25 |
Arthrobacter nicotianae DSM 20123T |
X80739 |
99.1 |
1387 |
|
BO27 |
Stenotrophomonas maiiophdia ATCC 136371 |
AB008509 |
99.2 |
769 |
|
BO28 |
Paracoccus beibnensrs ЛЛ’1284Т |
EU65OI96 |
98.1 |
1330 |
|
возо |
Paracoccus beibnensis JI Л 1284T |
EU650196 |
98.2 |
1330 |
|
BO32 |
Pseudomonas mon lei Id CIP 104883T |
AF064458 |
99.5 |
927 |
|
возз |
Bacillus vietnamensis 15-lT |
AB099708 |
99.0 |
604 |
Окончание табл. 3
|
№ штамма |
Типовой штамм |
№ GenBank |
Сходство, % |
Количество нуклеотидов |
|
ВО34-1 |
Arthrobacter oxydems DSM 20119 1 |
X83408 |
100 |
1401 |
|
ВО35 |
Kocuria rosea DSM 204471 |
X87756 |
99 7 |
972 |
|
ВО37 |
Micrococcus luteus NCTC 26651 |
CP001628 |
100 |
414 |
|
ВО38 |
StrepTomyces somaiiensis NBRC 129161 |
AB 184243 |
100 |
1392 |
|
ВО141 |
Bacillus plexus IFO 157151 |
AB021185 |
100 |
722 |
Согласно полученным результатам, преимущественным значением среди выделенных бактериальных штаммов обладали представители классов Aciinobacieria и Gammaproieobacteria, а именно -бактерии родов Dietzia (31.77%) и Stenotrophomo-nas (46Л%), соответственно (рис. 2). Что характерно. наибольшим многообразием таксономических групп характеризовались микроорганизмы класса Actinobacteria. среди которых доминирующее положение занимали изоляты, филогенетически близкородственные к бактериям рода Dietzia. Менее многочисленными были бактерии родов Аг-throbactey Кос uh а, Micrococcus, Rhodococcus и Streptomyces (в порядке уменьшения количества КОЕ/1 г шлама).
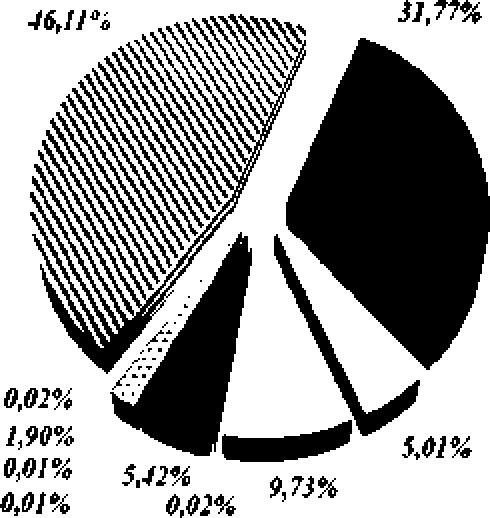
7, RhodOCOCCHS sp.
«BociHus sp.
’frSfenotrophomcmfis sp.
■ №№ sp.
Arthrobader sp.
Pseudomonas sp.
■ Porncoccus sp.
• Micrococcus sp.
•Streptomyces sp.
* Kocuria sp.
Рис. 2, Относительное содержание различных филогенетических групп (родов) бактерий классов A ct / по ba с ten а ,А Iphaproteob ас teri а.
Bacilli и Gammaproteobacteha
В результате изучения биодеградационных свойств 28 штаммов (представителей сформированных ОТЕ) было выявлено семь наиболее активных штаммов-деструкторов VArthrobacter spp. BOI 9, BO25t Bacillus spp. BO4, BO33, Kocuria sp. BO35, Paracoccus sp. BO28 и Rhodococcus sp. BOI), обладающих широкой субстратной специфичностью и способных использовать в качестве единственного источника углерода и энергии такие соединения, как нафталин, бифенил, орто- фталевую. бензойную, и^^-гидроксибензойную. салициловую кислоты, а также фенол, толуол и бензол. Стоит отметить, что большинство штаммов росли на моно- и полиароматических соединениях, но были также обнаружены бактерии (штаммы Rhodococcus sp. BOL Dietzia sp. BO9, Arthro-bacter spp. БО25, BO34-1, Bacillus sp. ВОЗЗ). использующие в качестве субстрата широко используемое в химической промышленности, труднораз-лагаемое и токсичное соединение - дибутилфталат (табл. 4).
Кроме того, было установлено, что все изолированные бактериальные культуры способны к росту на агаризованной среде как без добавления NaCl, так и с повышенной концентра дней соли (30-150 г/л), т.с. являются галотолсрантными организмами [Кашнер, 1981]. Среди них присутст-в>ют штаммы, обладающие способностью к росту при особенно высоких концентрациях хлорида натрия -до 150 г/л, а именно спорообразующис бактерии рода Bacillus (табл. 5).
Таблица 4
Рост бактерий на ароматических углеводородах на агаризованной МСР
|
Штамм |
Субстрат |
|||||||||
|
Фен. |
Бен, |
Тол. |
Наф, |
Биф, |
О-ФК |
БК |
СК |
ПГБК |
ДБФ |
|
|
Rhodococcus sp. BOI |
+++ |
++ |
+ |
+++ |
++ |
+44 |
+ |
++ |
++4 |
++ |
|
Rhodococcus sp. BO2 |
- |
+++ |
++ |
++ |
++ |
44 |
+ |
++ |
++4 |
4 |
|
Bacillus sp. BO3 |
+ |
+ |
+ |
+ |
4 |
44 |
+ |
+ |
4 |
+ |
|
Bacillus sp. BO4 |
+++ |
++ |
+4 |
+++ |
444 |
+44 |
++ |
+++ |
++ |
— |
|
Bacillus sp. BO5 |
+ |
+ |
— |
+ |
4 |
4 |
— |
— |
— |
— |
|
Bacillus sp. BO6 |
44 |
+ |
+ |
4 |
4 |
44 |
4 |
4 |
— |
|
|
Pseudomonas sp. BOS |
+ |
++ |
4 |
4 |
4 |
4 |
4 |
4 |
||
|
Dictzia sp. BO9 |
+ |
-И- |
4 |
4 |
+44 |
4+4 |
4 |
++ |
||
|
Pseudomonas sp. BO11 |
44 |
++ |
+ |
++ |
++ |
+44 |
4+4 |
++ |
||
|
Stenotrophomouas sp. BO 13 |
44 |
+ |
— |
++ |
++ |
44 |
4 |
++ |
||
|
Bacillus sp. BOIS |
4 |
+ |
+ |
++ |
++ |
44 |
4 |
4 |
||
|
Arthrobacter sp. BOW |
44 |
+ |
+ |
++ |
4 |
+44 |
++ |
++ |
++ |
|
|
Dietzia sp, BO20 |
44 |
++ |
+ |
4 |
4 |
4+4 |
++ |
4 |
||
|
Arthrobacter sp. BO21 |
44 |
++ |
+ |
4 |
44 |
4 |
4+4 |
4+ |
4+ |
— |
Окончание табл. 4
|
Штамм |
Субстрат |
|||||||||
|
Фен. |
Бен, |
Тол. |
Наф. |
Биф. |
о-ФК |
БК |
СК |
ПГБК |
ДБФ |
|
|
Pseudomonas sp. БО22 |
++ |
— |
+ |
++ |
+4- |
+ |
++ |
+ |
— |
|
|
Рдегк/утунил’ sp. BO23 |
+ |
++ |
— |
++ |
++ |
— |
+++ |
+ |
+ |
— |
|
Pseudomonas sp. BO24 |
+ |
++ |
— |
4-4- |
4- |
— |
+4-4- |
4+ |
+ |
— |
|
Arthrobacter sp. BO25 |
+++ |
+++ |
+++ |
+++ |
++4- |
+4- |
+++ |
++ |
+++ |
+++ |
|
Sfenotraphomonas sp. BO27 |
-н- |
++ |
+ |
4- |
4- |
4- |
+ |
+ |
+ |
— |
|
Paracoccus sp. B02S |
+++ |
+++ |
+ |
-Н- |
-Н- |
+4- |
4-Н- |
4-Н- |
+ |
+ |
|
Paracoccus sp. BO 30 |
+ |
+ |
+ |
4- |
+ |
4- |
+ |
+ |
— |
|
|
Pseudomonas sp. BO32 |
-н- |
++ |
-Н- |
-Н- |
4- |
+ |
+ |
4-Н- |
— |
|
|
Bad Hus sp. BO33 |
-н- |
+++ |
+ |
4- |
4- |
-Н- |
+ |
+ |
+ |
+++ |
|
Arthrobacter sp. BO34-1 |
— |
+ |
4- |
-Н- |
+4- |
+ |
+ |
4-Н- |
+++ |
|
|
Коси ria sp, BO35 |
+++ |
++ |
++ |
-Н- |
-Н- |
+4- |
+ |
+ |
+ |
— |
|
Micrococcus sp, BO37 |
+++ |
+ |
-Н- |
-Н- |
+4- |
+ |
+ |
+ |
— |
|
|
Streptomvces sp, B03S |
+++ |
+ |
-Н- |
-Н- |
+4- |
4-Н- |
++ |
-н- |
— |
|
|
Bacillus sp. BO141 |
++ |
— |
— |
4-4- |
-НН- |
4-Н- |
++ |
++ |
-н- |
— |
Примечание. Фен. - фенол; Бен. - бензол; Тол. - толуол; Наф. - нафталин; Биф. - бифенил; о-ФК - орто- фталевая кислота; БК - бензойная кислота; СК - салициловая кислота; ПГБК - нстрл-гидрокеибензойная кислота; ДБФ - дибутил фталат.
Таблица 5
Рост бактерий в присутствии различных концентраций NaCl
|
Штамм |
Концентрация NaCl (г/л)} среда БСР |
|||||||||
|
Без NaCl |
30 |
50 |
60 |
70 |
S0 |
90 |
100 |
120 |
150 |
|
|
Rhodococcus sp. BOI |
+++ |
+++ |
+++ |
+++ |
+++ |
++ |
++ |
+ |
||
|
Rhodococcus sp. BO2 |
++ |
+++ |
+ |
+ |
— |
- |
— |
— |
- |
- |
|
Bacillus sp. BO3 |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+ |
|
Bacillus sp. BO4 |
+++ |
+++ |
+++ |
+++ |
++ |
++ |
+ |
++ |
+ |
- |
|
Bacillus sp. BO 5 |
+++ |
+++ |
+++ |
+++ |
+ |
- |
— |
— |
- |
- |
|
Bacillus sp. BOO |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
++ |
+ |
|
Pseudomonas sp. BOS |
+++ |
+++ |
++ |
+ |
+ |
+ |
+ |
— |
- |
- |
|
Dietzia sp. BO9 |
+ |
4-Н- |
++ |
++ |
4-Н- |
+ |
+ |
— |
||
|
Pseudomonas sp. BO 11 |
-НН- |
4-Н- |
-НН- |
-НН- |
+4 |
4-4 |
+ |
+ |
||
|
Stenotrophomonas sp. BO13 |
-НН- |
4-Н- |
-нн- |
+ |
+ |
+ |
+ |
— |
||
|
Bacillus sp. BOIS |
-НН- |
4-Н- |
-нн- |
-нн- |
4-Н- |
4-Н- |
4-Н- |
4-Н- |
-НН- |
+ |
|
Arthrobacter sp. BO 19 |
-НН- |
4-Н- |
++ |
+ |
+ |
+ |
+ |
— |
||
|
Dietzia sp BO20 |
4- |
4-Н- |
-н- |
-н- |
+ |
+ |
+ |
— |
||
|
Arthrobacter sp. BO2 1 |
-нн- |
4-Н- |
++ |
+ |
— |
|||||
|
Pseudomonas sp, BO22 |
-н- |
4-Н- |
++ |
++ |
+ |
+ |
+ |
— |
||
|
Pseudomonas sp, BO23 |
-н- |
4-Н- |
++ |
++ |
+4 |
4-4 |
+ |
+ |
||
|
Pseudomonas sp, BO24 |
-н- |
4-Н- |
++ |
++ |
+4 |
4-4 |
+ |
+ |
||
|
Arthrobacter sp, BO25 |
-нн- |
4-Н- |
-нн- |
-нн- |
4-Н- |
4-Н- |
4-Н- |
4-Н- |
4-+ |
— |
|
Stenotrophomonas sp. BO27 |
+++ |
+++ |
+ |
— |
— |
— |
— |
— |
— |
— |
|
Patacoccus sp. BO28 |
+++ |
+++ |
++ |
++ |
++ |
+ |
+ |
— |
— |
— |
|
Paracoccus sp. BO30 |
+++ |
+++ |
+ |
+ |
— |
- |
— |
— |
- |
|
|
Pseudomonas sp, BO32 |
+++ |
+++ |
++ |
+ |
— |
- |
— |
— |
- |
|
|
Bacillus sp, BO33 |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+ |
|
Arthrobacter sp. BO34-1 |
+++ |
+++ |
++ |
+ |
— |
- |
— |
— |
- |
- |
|
Kocuria sp. BO35 |
+++ |
+++ |
+++ |
+++ |
+++ |
++ |
+ |
+ |
- |
- |
|
Micrococcus sp. BO37 |
+++ |
+++ |
+++ |
+++ |
+++ |
++ |
+ |
+ |
+ |
- |
|
Streptomvces sp. BO38 |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
++ |
- |
|
Bacillus sp. BO141 |
+++ |
+++ |
+++ |
+++ |
+++ |
++ |
++ |
++ |
++ |
- |
Примечание. «+» - слабый роет, «++» - средний рост; «+++» - хороший рост; «-» - отсутствие роста бактерий,
Также был исследован диапозон роста бактерий при различных значениях pH в среде культивирования и при различной температуре. Установлено, что значительная часть изолятов (Bacillus spp.
ВОЗ? ВО4, ВОЗ, ВО IX, Rhodococcus Sp, ВО2, Arthrobacter sp, BO25, Pseudomonas sp. BO32) способна к эффективному росту при pH среды от 6,0 до 9,0. Штамм Rhodococcus sp. ВО1 характерно- вался ростом в более широком диапазоне значений pH среды (от 5,0 до 9,0).
У ряда исследуемых штаммов (Bacillus spp. ВОЗ. ВО18, ВО141, Pseudomonas spp. BOIL BO14, BO26, Paracoccus sp. ВОЗО и Kocuria sp. BO35) была отмечена способность к росту в диапазоне температур от +10°С до 45°С (с оптимумом роста 28°С). относящая их к термотолерантным микроорганизмам. При температуре ниже 10°С рост культуры не наблюдался или был незначительным.
Интересен тот факт, что среди изолированных бактерий встречаются штаммы, сходные по филогенетическому положению с одним и тем же типовым штаммом бактерий, но отличающиеся по ВОХ-ПЦР профилям фрагментов геномной ДНК. субстратной специфичности, а также способности к росту на средах с различными значениями pH и концентрации NaCL Так, например, выявлено 5 штаммов (ВО8. BOIL ВО22. ВО23. ВО24). которые имеют наибольший процент сходства по нуклеотидной последовательности гена 16S рРНК с типовым видом Pseudomonas xanthomarina КММ 1447Т. но при этом существенно различаются по утилизации ароматических соединений (табл. 4), а штамм Pseudomonas sp. ВОН может эффективно использовать в качестве единственного источника углерода орто-фталевую кислоту.
Заключение
В результате исследования микробного сообщества образцов глинисто-солевых шламов из шла-мохранилища БКПРУ-2 ПАО «Уралкалий» (г. Березники, Пермский край) получены новые данные по филогенетическому разнообразию культивируемых бактерий района Верхнекамского месторождения солей. Выделено 138 штаммов бактерий-деструкторов различных ароматических углеводородов, в том числе фталатов филогенетический анализ показал принадлежность изо лированных штаммов к трем классам: Alphaproteobacteria. Gammaproteobacteria и Actinobacteria: десяти родам: Arthrobacter. Bacillus. Dietzia, Kocuria. M i crococcus, Pa racoccus, Pseudomona s. Rhodococcus, Stenotrophomonas и Streptomyces. При изучении их биодеградационных свойств выявлено семь наиболее активных штаммов-деструкторов, способных использовать в качестве ростового субстрата различные углеводороды: нафталин, бифенил. фенол, толуол и бензол, бензойную . пара -гидроксибензойную, салициловую кислоты, а также ([палаты (орто-фталат, дибутил-фталат), Кроме того, показано, что все изоляты являются галотолерантами (растут в присутствии 100-150 г/л NaCl), а ряд из них - алкалафилами (растут в диапазоне значений pH до 9.0).
Таким образом. установлено, что в районах шламохранилищ сформированы уникальные мик робные сообщества, в состав которых входят солеустойчивые бактерии-деструкторы ароматических соединений, являющихся одними из характерных экотоксикантов отходов калийного производства. Выявленные активные галотолерантные бактерии-деструкторы фталатов, моно(поли)ароматических углеводородов перспективны для дальнейшего изучения и использования при создании новых биотехнологий ремедиации территорий с высокой минерализацией и контаминацией стойкими органическими загрязнителями.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 16-44-590968 р_а и Программами УрО РАН «Молекулярная и клеточная биология» (проект №15-4-4-13) и «Фундаментальный базис инновационных технологий оценки, добычи и глубокой комплексной переработки стратегического минерального сырья» (проект №15-11-5-24).
Список литературы Микробное разнообразие в глинисто-солевых шламах калийного предприятия (г. Березники, Пермский край)
- Бачурин Б.А. Эколого-геохимическая характеристика отходов калийного производства//Горный журнал. 2008. Т. 10. С. 88-91
- Бачурин Б.А. Эколого-геохимические аспекты выщелачивания техногенно-минеральных образований горного производства//Материалы Всероссийской конференции с участием иностранных ученых «Геологическая эволюция взаимодействия воды с горными породами». 2012. С. 199-202
- Бачурин Б.А., Одинцова Т.А. Органическая геохимия техногенеза горнопромышленного профиля//Минералогия техногенеза. 2006. Т. 7. С. 265-284
- Бачурин Б.А., Одинцова Т.А. Отходы горнообогатительного производства как источники эмиссии органических поллютантов//Горный информационно-аналитический бюллетень. 2009. Вып. 7. С. 374-380
- Бачурин Б.А., Одинцова Т.А., Первова Е.С. Эколого-геохимическая характеристика флотореагентов//Материалы II-й Всероссийской научной виртуальной онлайн-конференции «Химическая наука: современные достижения и историческая перспектива». 2014. С. 17-22
- Бачурин Б.А., Сметанников А.Ф., Хохрякова Е.С. Эколого-геохимическая оценка продуктов переработки глинисто-солевых шламов калийного производства//Современные проблемы науки и образования. 2014. № 6. С. 1-8
- Герхардт Ф. и др. Методы общей бактериологии. М.: Мир. 1983. Т. 1-3
- Кандаурова Ю.М., Ястребова О.В., Плотникова Е.Г. Бактерии-деструкторы орто-фталевой кислоты, выделенные из района добычи и переработки калийных солей (г. Березники, Пермский край)//Материалы ХIV Всероссийской научнопрактической конференции с международным участием «Биодиагностика состояния природных и природно-техногенных систем». Киров, 2016. С. 329-332.
- Кашнер Д. Жизнь микробов в экстремальных условиях. М.: Мир. 1981. 365 с
- Корсакова Е.С., Пьянкова А.А., Плотникова Е.Г. Бактерии-деструкторы стойких органических загрязнителей -эфиров фталевой кислоты, как основа для создания новых экобиотехнологий//Известия Самарского научного центра РАН. 2013. Т. 15, № 3 (5). С. 1633-1636
- Методы почвенной микробиологии и биохимии: учеб. пособие/под ред. Д.Г. Звягинцева. М.: Изд-во МГУ, 1991. 304 с
- Орлова Ю.С. Использование индексов биологического разнообразия для анализа альгофлоры бассейна р. Алатырь//Вестник Мордовского университета. 2013. Т. 3/4. С. 53-57
- Пастухова Е.С. и др. Бактерии-деструкторы ортофталевой кислоты, выделенные из отходов калийного производства//Вестник Пермского университета. Сер. Биология. 2010. Вып. 3. С. 24-29
- Плотникова Е.Г. и др. Бактерии-деструкторы полициклических ароматических углеводородов, выделенные из почв и донных отложений района солеразработок//Микробиология. 2001. Т. 70, № 1. С. 61-69
- Плотникова Е.Г. и др. Галотолерантные бактерии рода Arthrobacter -деструкторы полициклических ароматических углеводородов//Экология. 2011. № 6. С. 459-466
- Реутских Е.М. Саралов А.И. Exiguobacterium sp. RS34 -галоалкалотолерантная факультативно анаэробная неспорообразующая бактерия порядка Bacillales из шламохранилища калийного рудника//Вестник Пермского университета. Сер. Биология. 2012. Вып. 3. С. 49-53
- Саралов А.И. и др. Arhodomonas recens sp. nov. -умеренно галофильная гаммапротеобактерия из рассолов флотационного обогащения калийных минералов//Микробиология. 2012а. Т. 81, № 5. C. 630-637
- Саралов А.И. и др. Halarchaeum solikamskense sp. nov. -термо-толерантный нейтрофильный галоархаеон из пенных продуктов флотационного обогащения калийных минералов//Микробиология. 2012б. Т.81, № 5. C. 638-644
- Широких И.Гидр. Численность и структура комплексов почвенных актиномицетов в районе возможного влияния химически опасного объекта//Почвоведение. 2013. Т. 7. С. 860-866
- Ястребова О.В. и др. Разнообразие бактерий, выделенных из района разработок месторождения калийных солей Верхнекамья//Bестник Пермского университета. 2009. Вып. 10 (36). Биология. С. 124-129
- Raymond R.L. Microbial oxidation of nparaffinichydrocarbons.//Developments in Industrial Microbiology. 1961. Vol. 2, № 1. P. 23-32
- Saralov A.I. et al. Haloferax chudinovii sp. nov., a halophilic archaeon from Permian potassium salt deposits//Extremophiles. 2013. Vol. 17(3). P. 499-504
- Versalovic J. et al. Genomic fingerprinting of bacteria using repetitive sequence-based polymerase chain reaction//Methods in Molecular and Cellular Biology. 1994. Vol. 5(1). P. 25-40


