Микробное сообщество техногенно загрязненного грунта района солеразработок (г. Березники)
Автор: Ястребова О.В., Воронина А.О., Ананьина Л.Н., Корсакова Е.С., Плотникова Е.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2018 года.
Бесплатный доступ
С использованием молекулярно-генетических методов проведено исследование структуры микробного сообщества грунта, расположенного вблизи солеотвала БКПРУ-3 предприятия ПАО «Уралкалий» (г. Березники, Пермский край). Методом ПЦР-РВ фрагментов гена 16S рРНК в тотальной ДНК исследуемого образца грунта выявлено наличие бактериальных генов 16S рРНК в количестве 6.6 х 1011 (±8.87 х 107) копий гена на 1 г грунта, а также доминирование грамотрицательных бактерий. ДГГЭ-анализ генов 16S рРНК, амплифицированных с тотальной ДНК, выявил, что бактериальные сообщества накопительных культур, полученных на бифениле и ортио-фталате, существенно различаются между собой, а также отличаются от исходного сообщества образца грунта как по составу, так и наличием доминирующих видов. Установлено, что в полученных НК доминировали грамотрицательные бактерии классов Gammaproteobacteria и Acidobacteria. Методом ДГГЭ-анализа в исследуемом микробном сообществе выявлены «некультивируемые» бактерии рода Halomonas, ранее не обнаруженные культуральны-ми методами.
Денатурирующий градиентный гель-электрофорез, ген 16s ррнк, некультивируемые бактерии, ортио-фталат, бифенил
Короткий адрес: https://sciup.org/147227017
IDR: 147227017 | УДК: 579.695:579.262:579.222.2
Текст научной статьи Микробное сообщество техногенно загрязненного грунта района солеразработок (г. Березники)
Верхнекамское месторождение калийно-магни-евых и натриевых солей (ВМКМС) Пермского края представляет собой многопластовую толщу соленосных отложений и является одним из крупнейших среди разрабатываемых в мире. Обогащение и переработка калийных руд на комбинатах предприятия ПАО «Уралкалий» (г. Соликамск и Березники, Пермский край) сопровождается образованием значитель- ных объемов глинисто-солевых шламов и избыточных рассолов, сбрасываемых в шламохранилища и содержащих более 90% хлорида натрия. Растворение и вынос солей отвалов и шламохранилищ приводит к появлению зон засоления, а также водоемов с соленой водой (рассолосборники), в которых происходит осаждение солей.
В образующихся галитовых отвалах и рассолос-
борниках зафиксирован широкий спектр поллютантов, включая тяжелые металлы и органические соединения, что обусловлено технологическими факторами рудоподготовки и обогащения добываемого сырья [Бачурин, 2008; Бачурин, Одинцова, 2009]. Продуктами трансформации химических реагентов, используемых в данных технологических процессах, являются полиэтоксильные соединения (полигликоли, полиоксиалканолы и их эфиры, диоксоланы, диоксаны и др.), гетероциклы, углеводородные структуры, включая полициклическую ароматику и фталаты [Бачурин, Одинцова, 2009; Бачурин, Одинцова, Пер-вова, 2014].
Сложившиеся условия являются основой для формирования в экосистемах данного района сообществ микроорганизмов, устойчивых к высокому содержанию соли в среде и способных при этом проявлять биодеградационные свойства. Из исследований микробных сообществ различных экосистем известно, что доля микроорганизмов, культивируемых в лабораторных условиях, составляет не более 0.1–1%, большую же часть природных микробных консорциумов представляют некультиви-руемые микроорганизмы [Puspita et. al., 2012; Dickinson et. al., 2016]. В связи с этим необходимы новые методические подходы для выявления и описания некультивируемых бактерий, изучения генетического разнообразия и структуры микробных консорциумов, понимания их экологической роли. Одним из методических подходов при изучении микробного разнообразия является использование метода денатурирующего градиентного гель-электрофореаза (ДГГЭ), который позволяет с высокой точностью проследить изменения состава микробных сообществ разных экосистем под действием различных факторов, определить филогенетическую принадлежность всех представителей сообщества, в том числе некультивируемых микроорганизмов [Назаров и др., 2010; Feris et. al., 2004].
Материалы и методы исследования
Образцы исследования. В районе промышленных разработок Верхнекамского месторождения солей (Пермский край) в весенне-летний период 2016 г. были отобраны образцы почв, шламов, донных отложений рассолосборника, а также грунта на расстоянии 5 м от солеотвала предприятия БКПРУ-3 ПАО «Уралкалий» (г. Березники).
Химический анализ отобранных проб показал высокую степень их засоленности, а также содержание таких органических загрязнителей, как алканы, фталаты, моно- и полиароматические углеводороды [Корсакова и др., 2015].
Оценка количества бактерий грунта была проведена методом полимеразной цепной реакции в реальном времени (ПЦР-РВ). При амплификации бактериальных генов 16S рРНК были использованы праймеры Eub338 (5'-ACTCCTACGGGAGGCAGCAG-3') и Eub518 (5'-ATTACCGCGGCTGCTGG-3') [Fierer et. al., 2005].
ПЦР-РВ проводили в присутствии красителя Sybr Green I в наборе реактивов 2X Maxima SYBR Green/ROX qPCR Master Mix («Thermo Scientific», США) на приборе «CFX96 Touch™ Real-Time PCR Detection Systems» («Bio-Rad Laboratories», США). Для стандартной калибровочной кривой, а также для анализа кривых плавления ДНК (температуры плавления (Tm) дуплекса ДНК) был использован образец очищенной геномной ДНК штамма Pseudomonas sp. SN11. Эффективность ПЦР определяли методом серийных разведений с построением калибровочной кривой.
Накопительное культивирование. Образец грунта был использован для получения двух накопительных культур (НК). В 250 мл колбы с минеральной средой (100 мл) и ароматическим субстратом помещали 1 г образца. НК1 получена с использованием минеральной среды К1 [Zaitsev et. al., 1991] с бифенилом в качестве субстрата. НК2 получена на минеральной среде Раймонда [Розанова, Назина, 1982] с добавлением NaCl (30 г/л) и 1 г/л орто- фталевой кислоты ( орто- ФК) в качестве субстрата.
Выделение тотальной ДНК из образца грунта и накопительных культур проводили с использованием коммерческого набора реактивов «MP Biomedicals» (США). Выделение ДНК из НК1 и НК2 проводили через 1 и 7 месяцев соответственно, с начала культивирования. Концентрацию ДНК определяли на приборе QubitTM Fluorometer («Invi-trogen», США) с использованием реактивов производителя.
Денатурирующий градиентный гель электрофорез (ДГГЭ ). Структуру микробных сообществ исследовали методом ДГГЭ фрагментов гена 16S рРНК, составляющих приблизительно 500 п.н., амплифицированных с использованием эу-бактериальных праймеров 27F (5`-AGAGTTTGATC(A/C)TGGCTCAG-3`) и 518R 518R (5`-ATTACCGCGGCTGCTGG-3`) [Tiirola et al., 2002]. Праймер 27F включал на 5`-конце 40 п.н. GC-хвост (5`-CGCCCGCCGCGC CCCGCGCCCGTCCCGCCGCCCCCGCCCG-3`).
Амплификацию l мкл очищенной геномной ДНК проводили в 50 мкл смеси, содержащей 0,25 мM дНТФ, 0,3 мкM праймера (каждого), 1,5 мМ MgCl 2 , 1х буфер для Taq -полимеразы («Син-тол», Россия), 2 ед. акт. Taq -полимеразы («Син-тол», Россия). Процедура ПЦР включала начальный денатурирующий шаг при 95°С в течение 5 мин. и 30 циклов: 94°С в течение 30 сек., 55°С в течение 1 мин. и 72°С в течение 3 мин.; затем 72°С в течение 10 мин.
Электрофорез был выполнен в 6% полиакриламидном геле, содержащем линейный денатури- рующий химический градиент от 30 до 60%, где 100% составляет 7М мочевина и 40% – формамид, согласно протоколу [Muyzer, de Waal E.C., Uitter-linden, 1993]. Разгонку проводили в течение 16 ч. при 45 V и 60°С на DcodeTM Universal Mutation System («Bio-Rad Laboratories», США). ДНК была визуализирована после окрашивания бромистым этидием (0,5 мкг/мл) UV-трансиллюминацией и документирована системой Gel Doc XR («Bio-Rad Laboratories», США).
Элюирование ДНК осуществляли в стерильной деионизированной воде в течение 24 ч. при температуре 4°С. Элюированную ДНК использовали в качестве матрицы для ПЦР-реам-плификации гена 16S рРНК. Амплификацию гена 16S рРНК проводили с использованием бактериальных праймеров 27F (5`-AGAGTTTGATC(A/C)TGGCTCAG-3`) и 1492R (5`-АСGG(C/T)TACCTTGTTACGACTT-3`) на ам-плификаторе «My Cycler» («Bio-Rad Laboratories», США).
Определение нуклеотидных последовательностей гена 16S рРНК осуществляли с применением набора реактивов Big Dye Terminator Cycle Sequencing Kit на автоматическом секвенаторе Genetic Analyser 3500XL («Applied Biosystems», США) в молекулярно-генетической (ПЦР) лаборатории кафедры ботаники и генетики растений Пермского государственного национального исследовательского университета.
Филогенетический анализ полученных нуклеотидных последовательностей 16S рДНК проводили с использованием программ MEGA 7.0, Sequence Scanner v. 2.0. Поиск гомологичных последовательностей осуществляли при использовании баз данных GenBank и EzTaxon .
Результаты и их обсуждение
С использованием метода ПЦР-РВ в тотальной ДНК, выделенной из образца грунта, отобранного у солеотвала БКПРУ-3, было выявлено наличие бактериальных генов 16S рРНК в количестве 6,6 х 10 11 (±8.87 х 107) копий гена на 1 г грунта. Методом анализа кривых плавления ДНК была установлена Tm исследуемой ДНК, равная 82.5°С, что всего на один градус превышает Tm геномной ДНК штамма Pseudomonas sp. SN11. Основываясь на полученных данных, можно предположить, что нуклеотидный состав анализируемой ДНК незначительно отличается составом GC-пар, что указывает на предполагаемое доминирование грамотри-цательных бактерий в микробном сообществе образца исследуемого грунта.
Проведен ДГГЭ-анализ генов 16S рРНК, ам-плифицированных с тотальной ДНК образца грун-
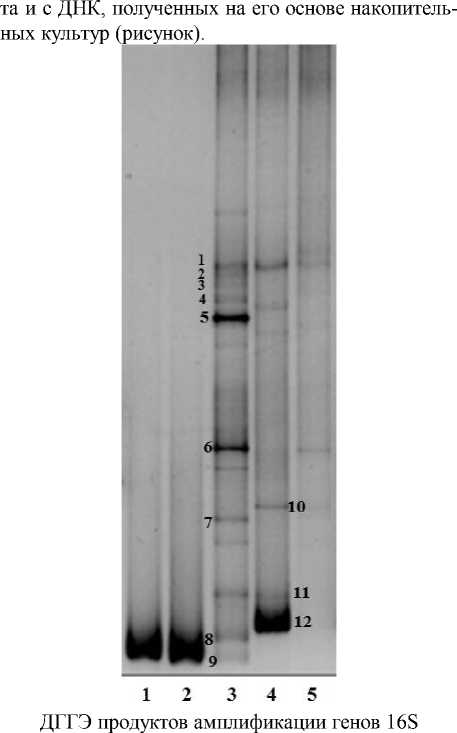
рРНК с препаратов суммарной ДНК техно-геннозагрязненного грунта, отобранного около солеотвала, накопительных культур (НК) и штаммов бактерий.
1 – Rhodococcus sp. PP22-1; 2 – Rhodococcus sp. KBB16; 3 – НК1 с бифенилом в качестве субстрата; 4 – НК2 с орто -ФК в качестве субстрата и присутствием 30 г/л NaCl; 5 – образец грунта
Как показал ДГГЭ-анализ генов 16S рРНК тотальной ДНК образца грунта, исследуемое бактериальное сообщество характеризовалось таксономическим разнообразием. Бактериальные сообщества накопительных культур, полученных на бифениле и орто -фталате, существенно различались между собой, а также отличались от сообщества исходного образца как по составу, так и наличием мажорных (доминантных) полос на ДГГЭ-профиле (рисунок). В ряде работ показано, что при загрязнении почвенных экосистем ароматическими углеводородами менялась видовая структура микробных сообществ, при этом не снижалось бактериальное разнообразие [Feris et. al., 2004; Vin˜as et. al., 2005]. Из других исследований известно, что загрязнение почвы нефтепродуктами приводит к снижению видового разнообразия микробных сообществ при увеличении общей численности бактерий [Панов и др., 2013; Castle, Montgomery, Kirchman, 2006].
|
Фрагменты гена 16S рДНК, отличающиеся цированы. У 12 фрагментов 16S рДНК были опре-электрофоретической подвижностью при разгонке делены нуклеотидные последовательности (рису-(ДГГЭ), были элюированы из геля и реамплифи- нок, таблица). Результаты филогенетического анализа элюированных из геля фрагментов гена16S рРНК |
||||
|
Накопительные культуры (НК) |
№ полосы ДГГЭ |
Штамм ближайшего родственного вида и номер в базе данных GenBank |
Сходство фрагмента гена 16S рРНК, % |
Кол-во анализированных нуклеотидов |
|
НК1 (субстрат бифенил) |
1-4 |
Некультивиру емый бактериальный клон Acidobac-terium sp. mrtpkts1 (JQ065958.1) |
99 |
408 |
|
*Acidobacteria bacterium A24_SHP_5_238T (KX443571.1) |
97 |
|||
|
5 |
Некультивируе мый бактериальный клон Acidobac-terium sp. mrtpkts1 (JQ065958.1) |
99 |
400 |
|
|
*Tellurimicrobium multivorans strain Ac_18_E7T (NR 146026.1 ) |
97 |
|||
|
6 |
Некультивируемый бактериальн ый клон класс а Verrucomicrobia AUVE 05A08 (EF651189.1) |
99 |
349 |
|
|
*Chthoniobacter flavus Ellin428T (NR_115225.1) |
86 |
|||
|
7 |
Некультивируемый бакте риальный кло н Sphingo-bacterium sp. RLBp5164 (KC453719.1) |
97 |
429 |
|
|
*Flavitalea sp. AQ6-291 T (KX146487.1) |
95 |
|||
|
8 |
Burkholderia fu ngorum LMG 16225T (NR 025058.1) |
85 |
481 |
|
|
9 |
Rhodococcus wratislaviensis DSM 44107T (NR 118605.1) |
100 |
470 |
|
|
НК2 (субстрат орто -ФК, 30 г/л NaCl) |
10 |
Halomonas sp. GQ58 (JN998400.1) |
68 |
480 |
|
Halomonas salina ATCC 49509 T (NR_119189.1) |
67 |
|||
|
11 |
Halomonas sediminicola CPS11T (NR_152067) |
96 |
487 |
|
|
12 |
Halomonas ventosae strain Al12T (NR042812) |
99 |
478 |
|
|
Примечание. *Наиболее филогенетически близкий культивируемый бактериальный штамм. |
||||
Секвенирование фрагментов гена 16S рРНК доминантных полос показало, что в сообществе НК2 (с орто- ФК в качестве субстрата и содержанием 30 г/л NaCl) преобладали галофильные бактерии рода Halomonas , близкородственные штамму Halomonas ventosae Al12T (уровень сходства по гену 16S рРНК составлял 99%). Кроме того, в данной НК выявлены другие бактерии, филогенетически близкие бактериям рода Halomonas , но имеющие невысокий уровень сходства с бактериями, представленными в базах данных: штаммом Halomonas sediminicola CPS11T и штаммом Halomonas salina ATCC 49509T (уровень сходства по гену 16S рРНК – 96 и 67% соответственно) (таблица).
Бактериальное сообщество НК1, полученное с использованием бифенила в качестве субстрата, характеризовалось более высоким таксономическим разнообразием, чем сообщество исследуемого образца грунта, а также НК2.
Как показало секвенирование фрагментов 16S рДНК, в НК1 доминировали некультивируе-мые грамотрицательные бактерии рода Acidobacterium и бактерии класса Verrucomicrobia
(уровень сходства по гену 16S рРНК в обоих случаях составлял 99%). В данном бактериальном сообществе обнаружены также бактерии рода Sphingobacterium (уровень сходства по гену 16S рРНК 97%), Burkholderia (уровень сходства 87%) и бактерии, наиболее филогенетически близкие штамму Rhodococcus wratislaviensis DSM 44107T (уровень сходства 100%) (таблица). Ранее из НК1 был выделен штамм-деструктор бифенила Rhodococcus sp. KBB16, наиболее филогенетически близкий штамму Rhodococcus wratislaviensis DSM 44107T [Воронина и др., 2017]. Наличие данного штамма в НК1 было показано методом ДГГЭ (таблица).
Накопительное культивирование с последующим высевом на селективные среды также показало доминирование грамотрицательных бактерий в исследуемом микробном сообществе. Из НК2 ( орто -ФК в качестве субстрата и 30 г/л NaCl) ранее было изолировано семь галотолерантных штаммов-деструкторов орто -ФК. Анализ генов 16S рРНК штаммов показал их принадлежность к родам Idiomarina , Alcanivorax , Oceanisphaera , Mari-nobacter (класс Gammaproteobacteria ), Breoghania
(класс Alphaproteobacteria ) и Rhodococcus (класс Actinobacteria ). В том числе был выделен штамм Rhodococcus sp. PP22-1 (рисунок), наиболее филогенетически близкий штамму Rhodococcus jialingae djl-6-2T (уровень сходства 99.73%), способный к деструкции орто -ФК и бифенила [Кандаурова, Ястребова, Плотникова, 2016]. В то же время не были выделены в чистую культуру бактерии рода Halomonas , выявленные методом ДГГЭ (рисунок). Можно предположить, что в НК2 при длительном культивировании в условиях засоления среды преимущественное размножение получили галотолерантные протеобактерии рода Halomonas , которые способны использовать орто ФК в качестве субстрата. Известна способность бактерий рода Halomonas к деструкции ароматических соединений при повышенном засолении среды, однако лишь в единичных сообщениях показана способность данных бактерий к деструкции орто -ФК [Корсакова, Пьянкова, Плотникова, 2013; Gutierrez et al., 2013].
Таким образом, с использованием молекулярногенетических методов проведено более полное исследование структуры микробного сообщества грунта, отобранного вблизи солеотвала калийного предприятия БКПРУ-3. Методом ДГГЭ-анализа в исследуемом микробном сообществе выявлены «некультиви-руемые» бактерии, ранее не обнаруженные культуральными методами, а также показаны изменения в структуре микробного сообщества под воздействием различных ароматических субстратов ( орто -ФК, бифенил) и засоления среды.
Исследование выполнено при финансовой поддержке РФФИ и Министерства науки и образования Пермского края в рамках научного проекта № 16-44-590968 р_а.
Список литературы Микробное сообщество техногенно загрязненного грунта района солеразработок (г. Березники)
- Бачурин Б.А. Эколого-геохимическая характеристика отходов калийного производства // Горный журнал. 2008. Т. 10. С. 88-91
- Бачурин Б.А., Одинцова Т.А. Отходы горно-обогатительного производства как источники эмиссии органических поллютантов // Горный информационно-аналитический бюллетень. 2009. Вып. 7. С. 374-380
- Бачурин Б.А., Одинцова Т.А., Первова Е.С. Эколо-го-геохимическая характеристика флотореаген-тов // Материалы II Всерос. науч. виртуал. он-лайн-конф. «Химическая наука: современные достижения и историческая перспектива). Казань, 2014. С. 17-22
- Воронина А.О. и др. Гены деструкции ароматических соединений в микробном сообществе почвы, загрязнённой отходами калийного производства (г. Березники, Пермский край) // Материалы X Всерос. конгресса молодых учёныхбиологов «Симбиоз-Россия-2017). Казань, 2017. С. 73-74
- Кандаурова Ю.М., Ястребова О.В., Плотникова Е.Г. Бактерии-деструкторы орто-фталевой кислоты, выделенные из района добычи и переработки калийных солей (г. Березники, Пермский край) // Материалы XIV Всерос. науч.-практ. конф. с междунар. участием «Биодиагностика состояния природных и природно-техногенных систем). Киров, 2016. С. 329-332
- Корсакова Е.С., Пьянкова А.А., Плотникова Е.Г. Бактерии-деструкторы стойких органических загрязнителей - эфиров фталевой кислоты, как основа для создания новых экобиотехнологий // Известия Самарского научного центра РАН, 2013. Т. 15, № 3(5). С. 1633-1636
- Корсакова Е.С. и др. Разнообразие бактерий-деструкторов органических загрязнителей шла-мохранилища калийного производства (г. Березники, Пермский край) // Российский иммунологический журнал. 2015. Т. 9, № 2. С. 591-593
- Назаров А.В. и др. Влияние нефтяного загрязнения на бактерии дерново-подзолистой почвы // Почвоведение. 2010. Т. 12. С. 1489-1493
- Панов А.В. и др. Влияние загрязнения почвы на состав микробного сообщества // Микробиология. 2013. Т. 82, № 2. С. 239-246
- Розанова Е.П., Назина Т.Н. Углеводородокисляющие бактерии и их активность в нефтяных пластах // Микробиология. 1982. Т. 51. С. 324-348
- Castle D.M., Montgomery M.T., Kirchman D.L. Effects of naphthalene on microbial community composition in the Delaware estuary // FEMS Microbiol. Ecol. 2006. Vol. 56. P. 55-63
- Dickinson I. et al. Extremophiles in an Antarctic marine ecosystem // Microorganisms. 2016. Vol. 4(1). Р. 8.
- DOI: 10.3390/microorganisms4010008
- Feris K.P. et al. A shallow BTEX and MTBE contaminated aquifer supports a diverse microbial community // FEMS Microb. Ecol. 2004. Vol. 48. P. 589-600
- Fierer N. et al. Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays // Applied And Environmental Microbiology. 2005. Vol. 71, № 7. P. 4117-4120
- Gutierrez T. et al. Role of bacterial exopolysaccha-rides (EPS) in the fate of the oil released during the deepwater horizon oil spill // PLOS ONE. June 2013. Vol. 8, № 6. e67717
- Muyzer G., de Waal E.C., Uitterlinden A.G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of poly-merase chain reaction-amplified genes coding for 16S rRNA // Applied and Environmental Microbiology. 1993. Vol. 59. P. 695-700
- Puspita I.D. et al. Are uncultivated bacteria really un-cultivable? // Microbes and Environments. 2012. Vol. 27, № 4. Р. 356-366
- Tiirola M.A. et al. Isolation and characterization of No-vosphingobium sp. strain MT1, a dominant poly-chlorophenol-dagrading strain in a groundwater bioremediation system // Applied and Environmental Microbiology. 2002. Vol. 68. P. 173-180.
- Vin~asM. et al. Bacterial community dynamics and poly-cyclic aromatic hydrocarbon degradation during bio-remediation of heavily creosote-contaminated soil // Applied and Environmental Microbiology. 2005. Vol. 71, № 11. P. 7008-7018
- Zaitsev G.M. et al. Genetic control of degradation of chlorinated benzoic acids in Arthrobacter globi-formis, Corynebacterium sepedonicum and Pseu-domonas cepacia strains // FEMS Microbiol. Lett. 1991. Vol. 81. P. 171-176


