Микрочиповые технологии в биологических исследованиях. Экспресс-анализ ДНК: сепарационные матрицы для разделения ДНК
Автор: Евстрапов А.А., Рудницкая Г.Е., Петухова Н.А.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Материалы научного семинара "Микрочиповые технологии в аналитической химии"
Статья в выпуске: 2 т.15, 2005 года.
Бесплатный доступ
Изучение литературных данных показывает, что одним из перспективных методов анализа ДНК является метод капиллярного электрофореза на микрочипе. Многие компании и фирмы уделяют внимание разработке микрочиповых технологий и приборов для экспресс-анализа биологических веществ. При создании микрочиповых устройств и систем прослеживаются тенденции получения многоканальных приборов, интеграции в микрочипы вспомогательных элементов, встраивания микрочиповых устройств в аналитические приборы (микроскопы высокого разрешения, масс-спектрометры и т. д.). Одной из проблем при разработке методик анализа ДНК на микрочипе является выбор и синтез сепарационной матрицы, позволяющей получить эффективное разделение фрагментов. Приведены результаты исследований по синтезу полидиметилакриламида с заданными свойствами. Обсуждены данные, полученные при электрофоретическом разделении смеси маркеров молекулярного веса ДНК на стеклянном микрочипе с разными характеристиками сепарационной среды
Короткий адрес: https://sciup.org/14264380
IDR: 14264380 | УДК: 543.545:
Текст статьи Микрочиповые технологии в биологических исследованиях. Экспресс-анализ ДНК: сепарационные матрицы для разделения ДНК
Важными направлениями в биологических исследованиях являются изучение генетических мутаций и полиморфизмов, которые могут видоизменять функции гена и, по-видимому, являться причиной унаследованных болезней и других заболеваний. Для экспресс-анализа ДНК в настоящее время применяются методы: капиллярного электрофореза и электрофореза на микрочипе (ЭМЧ) [1–4], масс-спектрометрии (МС) [5]; гибридизационного анализа на микрочипе ("биочип") [6]. Использование ЭМЧ позволяет проводить анализ малых объемов пробы с высокой производительностью и быстродействием на компактных устройствах, которые могут быть встроены в другие системы [7–12].
Первые работы по использованию электрофореза на микрочипах появились в 1990-х годах [13– 15]. В этих устройствах каналы изготавливались в плоских стеклянных и кремниевых пластинах методами микромеханической обработки. Разделение компонентов смесей (пробы) проводилось электрофоретическими методами. Упомянутые работы вызвали бурный прогресс в развитии новых технологий ЭМЧ. В 1994 г. Woolley и Mathies продемонстрировали быстрое (120 с) разделение фрагментов ДНК на многоканальном микрочипе с длиной канала 35 мм [16]. По сравнению с традиционным КЭ в ЭМЧ короткие сепарационные длины в сочетании с высокой напряженностью электрического поля дают возможность осуществить быстрое разделение компонентов пробы — вплоть до нескольких секунд. При этом реализуется полный контроль всех стадий процесса и параметров анализа. Кроме того, существует возможность интеграции отдельных функциональных элементов, датчиков и устройств, обеспечивающих необходимые режимы фракционирования и их контроль.
В настоящее время ЭМЧ успешно используются: для анализа неорганических и органических веществ; иммунного анализа; для анализа биомолекул, в том числе ДНК, РНК, белков; анализа продуктов ПЦР; результатов секвенса ДНК; обнаружения мутаций и т. п. [1, 2, 9, 10, 17–20].
Среди фирм, занимающихся разработкой мик-рочиповых технологий и устройств необходимо отметить: Shimadzu Cor. (Япония), Agilent Technologies Inc. и Caliper Technologies Inc. (США), Nanogen Inc. (США), Aclara BioSciences Inc. (США), BioMicro Systems (США), Fluidigm Corporation (США), Mezzo Systems (США), Mildendo GmbH (Германия). В деятельность этих компаний втянуты виднейшие ученые и специалисты университетов (University of Tokyo — T. Kitamori; Technical University of Denmark — J. Kutter; Oak Ridge National laboratory — S. Jacobson и M. Ramsey; Stanford University — J. Santiago и др.).
Значительное количество статей по микрофлю-идным системам в журналах Electrophoresis, Analytical Chemistry, Analyst, Biosensors and Bioelectronics, Sensors and Actuators, Journal of Micromechanics and Microengineering, Clinical Chemistry, Luminescence, Lab on a Chip: Miniaturisation for Chemistry and Biology и других свидетельствует об огромном интересе исследователей к этой проблеме.
Технология электрофоретического разделения на микрочипе реализована в коммерческих приборах, например Agilent 2100 Bioanalyzer (Agilent Technologies Inc.), построенном по микрочиповой технологии The Caliper LabChip(R) Technology, Caliper AMS 90 SE (Caliper Technologies Inc.), Shimadzu MCE 2010 (Shimadzu), Hitachi SV 1100 и SV 1210 (Hitachi) [21–24]. Это подтверждает то, что технология ЭМЧ является полноценной альтернативой методам гель-электрофореза и капиллярного электрофореза и, возможно, в недалеком будущем заменит эти методы.
В России в рамках научно-исследовательских программ ведутся работы по созданию современных аналитических систем на основе микрораз-мерных устройств и микрофлюидных технологий. Необходимо отметить, что на текущий момент времени такие работы проводятся в Центре микротехнологии и диагностики СПб. государственного электротехнического университета, Институте аналитического приборостроения РАН (ИАнП РАН), на кафедре аналитической химии МГУ, на фирме "Люмэкс" (СПб.).
В ИАнП РАН проводятся работы по созданию систем экспресс-анализа биологических веществ на основе микро- и наноразмерных технологий (см., например, [25–27]). К настоящему времени имеются прототипы микрофлюидной аналитической системы на основе ЭМЧ (пМФАС), состоящие из аналитического блока, прецизионного программируемого высоковольтного источника и персонального компьютера, обеспечивающего функционирование системы (рис. 1). В пМФАС реализована концепция построения прибора с модулями, снабженными собственными микропроцессорами. Это дает возможность обеспечить независимое функционирование каждого модуля и гибкую диагностику (настройку, ремонт и восстановление) работоспособности как прибора в целом, так и каждого модуля в отдельности. Программное обеспечение верхнего уровня имеет дружественный интерфейс для пользователя и обеспечивает: управление прибором; получение и отображение данных о состоянии прибора и его основных модулей; получение данных при измерениях и их отображение в реальном масштабе времени; обработку результатов измерений в соответствии с заданным оператором алгоритмом; файловую запись полученных результатов измерений и распечатку результатов измерений в виде графиков и таблиц. В аналитическом блоке расположены: детектор лазер-индуцируемой флуоресценции, устройство оптического сканирования, микропроцессорные платы и вспомогательные модули. Совместно с ЗАО "Светлана-полупроводники" (С.-Петербург)

Рис. 1. Прототип микрофлюидной аналитической системы (пМФАС, ИАнП РАН)

Рис. 2. Комплект стеклянных микрочипов с одноканальной топологией (ИАнП РАН—ЗАО "Свет-лана-полупроводники")
освоена технология изготовления стеклянных микрочипов с различной топологией (рис. 2). Совместно с ООО "Лазерный центр" (С.-Петербург) отработаны технологии воспроизводимого получения микроразмерных структур в полиметилметакрилате и получены экспериментальные образцы полимерных микрочипов. На пМФАС и микрочипах осуществляются исследования биологических проб и отработка методик экспресс-анализа фрагментов ДНК и иммунного анализа.
АНАЛИЗ И РАЗДЕЛЕНИЕ ДНК
В 1994 г. Effenhauser и др. [28] демонстрировали успешное использование ЭМЧ для разделения смеси олигомеров разных размеров с длиной от 10 до 15 оснований, используя полиакриламид как разделительную матрицу. Первое разделение фрагментов двуцепочечных ДНК было описано Woolley и Mathies [16]. Были разделены меченые фрагменты ДНК с разрешением фрагментов 271 и 281 bp за 120 с в 35 мм сепарационном канале. McCormick и другие [29] использовали микрофлюидные устройства, изготовленные из полиметилметакрилата (ПММА) для демонстрации разделения фрагментов двуцепочечных ДНК с высоким разрешением за время меньше чем 3 мин. В качестве стандартов для калибровки приборов и детекторов используются смеси меченых олигонуклеотидов, т. к. технология маркирования олигонуклеотидов разной длины достаточно хорошо отработана.
Проект "Геном Человека" (HGP) стимулировал быстрое развитие технологий электрофоретического секвенирования. Хотя секвенс генома человека считается выполненным, но технология секвенирования непрестанно развивается, создаются коммерческие приборы и аналитические системы в формате микроустройств.
Woolley и Mathies [30] в 1995 г., используя четырехцветный формат обнаружения, провели секвенирование ДНК за 540 секунд в микроканале длиной 3 cм. Позже Liu и другие [31] оптимизировали матрицу для разделения, длину канала, условия введения пробы и температуру разделения для быстрого ДНК-секвенса. Увеличив сепарационную длину канала до 7 cм и используя фрагменты, меченные красителями с передачей энергии, удалось провести анализ последовательности ДНК с длиной считывания 500 оснований за 20 мин. В работе [32] параллельный секвенс ДНК был выполнен на ЭМЧ с 16 каналами, где за 15 мин проанализирована последовательность ДНК с длиной считывания 450 оснований.
Все эти работы позволили перейти к многоканальным микрочипам. Были изготовлены 96канальные микрочипы для высокопроизводительных генетических исследований. Длина канала разделения была увеличена до 16 см для чтения до 500 оснований за время 25 мин [33].
Теоретическая модель разделения ДНК и подтверждающие ее эксперименты демонстрировались при одноцветном секвенсе ДНК в одноканальном микрочипе в работе [34]. Там же рассмотрены аспекты матрицы разделения и топологии микроканала (длина прочтения до 400 оснований была достигнута за 14 мин при 200 В/см и 350 оснований — за 7 мин при 400 В/см). Позже изучалось влияние буферного состава, температуры и электрического поля на разрешение при раз- делении ДНК [35].
Существует другая идеология разделения ДНК. В [36] использовались ультракороткие каналы (менее 1.5 cм), очень низкие напряжения (–30 V) и полиакриламидный гель для разделения ДНК (ssDNA) на стеклянно-кремниевых гибридных микроустройствах. ДНК-фрагменты размером от 120 до 400 баз были разделены за 85 мин. Та же группа исследователей демонстрировала универсальную микроэлектрофоретическую платформу, состоящую из множества электродов, нагревателей, температурных датчиков, которые позволяют использовать различные гелевые структуры для разделения и одно- и двухцепочечных ДНК в канале длиной 1 см [37].
Предпринимаются попытки математического моделирования процесса электрофоретического разделения биологических проб в полимерах [38]. Однако множество факторов, влияющих на процессы движения, взаимодействия и разделения компонентов пробы, не позволили до настоящего времени создать цельную адекватную модель.
МАТЕРИАЛЫ. ИЗГОТОВЛЕНИЕ МИКРОЧИПОВ
Хотя технологии микромеханической обработки кремния хорошо развиты, кремний не применялся для ЭМЧ, т. к. для электрофореза требуется высокая диэлектрическая прочность материала. Кварц, идеально подходивший для ЭМЧ и оптических методов регистрации, отличался высокой стоимостью, что нежелательно для серийного производства. В настоящее время большинство микрочипов для электрофоретического разделения ДНК изготавливается из стеклянных или полимерных материалов [39–41]. Иногда используются гибридные конструкции.
Стекло — наиболее популярный и доступный материал для микрочипов. Технология изготовления каналов, микрососудов и реакторов в стеклянном материале, заимствованная из электронной промышленности, сочетает стадии литографии (обычно ультрафиолетовой) и кислотного травления. После создания сети каналов, сосудов и реакторов на стеклянной пластине ее подвергают процессу сверления, чтобы получить интерфейсы доступа к сформированным каналам [42, 43]. Затем полученную пластину соединяют с защитной, применяя процесс термического связывания (спекания) при температуре вблизи 600 °С (4 часа). Существуют и другие процессы герметизации полученных каналов, например с использованием фотоотверждаемого клея [44].
В микрочипах, предназначенных для анализа биологических проб, необходимо использовать наиболее инертные и изученные материалы, чтобы изначально устранить появление посторонних эффектов. Поэтому большинство исследователей предпочитает использовать стеклянные микрочипы, полученные методом термического связывания.
Другими, перспективными материалами для микрочипов являются полимеры. Полимеры обладают разнообразными полезными свойствами, которые можно регулировать меняя состав полимерного материала. Кроме того, полимеры — относительно дешевый материал по сравнению со стеклом, что позволяет создавать одноразовые микроустройства [45–46]. К тому же использование полимеров в некоторой степени устраняет проблемы утилизации микрочипов после анализа биологического материала. К наиболее используемым полимерам следует отнести полиметилметакрилат (ПММА) [30, 47], поликарбонат (ПК) [48, 49], по-лидиметилсилоксан (ПДМС) [50, 51], применяются и другие [41, 46, 52, 53]. Изготовление микроструктур в полимерах может быть реализовано прямыми методами и с использованием мастер-форм. В случае прямых методов используется механическая микрообработка или лазерное воздействие на полимер [53, 54].
Достаточно полно и подробно методы получения микроструктур изложены в [41, 56–59].
ДЕТЕКТИРОВАНИЕ
Детектирование результатов разделения биологических проб на микрочипах осуществляется теми же методами, что и в КЭ: лазер-инду-цированной флeоресценции [60–63], электрохимическими [64–66], хемилюминесцентными [67], масс-спектрометрическими [68], рамановской спектроскопии [69], по изменению показателя преломления [70] и др.
Лазер-индуцированная флуоресценция (ЛИФ) — наиболее популярный метод детектирования для анализа ДНК из-за его чрезвычайно высокой чувствительности. Лазерный луч может быть сфокусирован на микроканале с внутренним объемом на уровне нано- и пиколитров, что делает детектирование ЛИФ подходящим для ЭМЧ. Используется одноцветная, двухцветная и четырехцветная лазерная детекция продуктов разделения, время-разрешенное детектирование и т. п. (см., например, [71]).
Новый подход для управления сканированием лазерного излучения — с помощью акусто-оптического дефлектора (AOД) — был развит для многоканального детектора ЛИФ и ЭМЧ [64]. При этом достигалось высокое быстродействие при сканировании каналов. Авторами [72] была показана возможность конфокального флуоресцентного детектирования на уровне единичных молекул.
Электрохимическое детектирование также часто используется в ЭМЧ, в связи с тем что доста- точно просто встроить электроды в каналы микрочипа. Woolley c соавторами [63] продемонстрировали высокочувствительный электрохимический датчик для обнаружения фрагментов ДНК и продуктов ПЦР. При множестве преимуществ электрохимического детектирования существует ряд проблем, которые сдерживают развитие этого метода, например проблемы изменения чувствительности при анализе, загрязнение электродов и т. д.
ИНТЕГРАЦИЯ ФУНКЦИОНАЛЬНЫХ КОМПОНЕНТОВ
При создании "лаборатории на чипе" предпринимаются успешные попытки объединения и автоматизации всех аналитических процедур в одном микроустройстве. Разделение — это только один из этапов анализа ДНК. Поэтому часто целью интеграции является встраивание элементов и устройств пробоподготовки в микрочип. Как правило, количество анализируемой пробы очень мало, и требуется каким-либо способом увеличить ее концентрацию. Одним из таких способов являются реакции амплификации. Поэтому во многих микрочипах встроенными элементами являются реакционные камеры с нагревательно-охладительными устройствами для обеспечения тепловых режимов амплификации [73].
Наиболее распространенной реакцией амплификации является полимеразно-цепная реакция (ПЦР), которая требует относительно чистых ДНК, в то время как реальный образец может содержать различные примеси. Поэтому в микроканалы чипа иногда встраиваются разнообразные фильтры и элементы, увеличивающие поверхность контакта для извлечения и концентрирования ДНК [74–77].
Интеграция в чип касается и систем детектирования. Вариант интеграции фотоприемного устройства в микрочип, при котором лавинный фотодиод был встроен в микрофлюидное устройство из ПДМС, приведен в [78]. Поскольку размер фотоприемной площадки соизмерим с размером канала, то отпадает необходимость в собирающей оптике.
Сейчас уже возможно встраивание не только фотоприемных устройств, но и различного рода излучателей и источников света. Для управления и контроля процессами в микроканалы чипа встраиваются всевозможные датчики, функциональные элементы, микроступеньки, изолирующие посты, клапаны, микронасосы и т. д.
Кроме вышеперечисленного существует тенденция интеграции микрочиповых устройств в высокочувствительные системы регистрации и анализа, например конфокальные микроскопы, атомносиловые микроскопы, масс-спектрометры [79] и др.
МЕТОДЫ РАЗДЕЛЕНИЯ НА МИКРОЧИПЕ
Наиболее часто на микрочипе реализуются электрофоретические и хроматографические методы разделения. Группа Soper исследовала возможность электрохроматографического разделения фрагментов ДНК на микрочипе [66] и показала, что эта технология является многообещающим инструментом для анализа ДНК.
Электрофоретическое разделение широко используется для разделения фрагментов ДНК. При электрофоретическом разделении чрезвычайно важной задачей становится правильный выбор матрицы (среды) разделения, т. к. необходимо разделить фрагменты ДНК, обладающие почти идентичной электрофоретической подвижностью в свободном состоянии [80–82].
Большинство реактивов для модификации поверхности и "ситовых" матриц, используемых для разделения ДНК в ЭМЧ, были унаследованы от КЭ. Для качественного разделения на стеклянных чипах поверхность каналов модифицируется различными способами в зависимости от целей и задач разделения биопроб [83, 84].
Пластмассовые микрочипы обычно имеют более низкую величину скорости электроосмотического потока (ЭОП), чем стеклянный или кварцевый чип при одинаковых pH [85]. Например, учитывая гидрофильную природу отрицательно заряженных молекул ДНК и гидрофобную поверхность ПДМС-микрочипа, не требуется модифицировать поверхность для подавления ЭОП и получения разделения фрагментов ДНК [30].
При разделении ДНК методом КЭ различные факторы являются критическими для получения качественного высокоскоростного разделения помимо влияния электрического поля, а именно: среда разделения, концентрация, состав и pH буфера [86].
Сепарационные матрицы для разделения фрагментов ДНК
Качество электрофоретических методик анализа олигонуклеотидов, фрагментов рестрикции ДНК, продуктов полимеразной цепной реакции (ПЦР), фрагментов секвенса ДНК на МФЧ в существенной степени зависит от выбора сепарационной среды — полимерной матрицы. Для эффективного разделения образцов ДНК композиция полимерной матрицы должна быть оптимизирована с учетом химической природы полимера, физических характеристик полимера (молекулярномассовое распределение) и концентрации полимера в буферном растворе.
Однако, как отмечено в работе [87], только небольшое количество исследований нацелено на изучение влияния физических свойств полимеров
(средней молекулярной массы М w , остаточной длины в водном растворе, полидисперсности) на качество электрофоретического разделения. Этот недостаток авторы объясняют отсутствием средств и/или желания у большинства исследователей синтезировать и точно характеризовать полимерные материалы, которые подходят для капиллярного электрофореза. Часто используемые полимеры являются модифицированными природными продуктами и доступны только в определенных молекулярно-массовых пределах, которые значительно меняются от партии к партии. Поэтому, считают авторы, эти природные полимеры непригодны для точных и надежных исследований влияния М w на качество электрофоретического разделения.
Чтобы добиться эффективного разделения фрагментов ДНК, в методических работах уделяется особое внимание получению полимера с заданной молекулярной массой.
Растворы полимеров как сепарационные матрицы в КЭ
Подвижности молекул ДНК различных размеров в свободных растворах почти не различаются из-за одинаковых соотношений заряд/поверхность (размер). В таких условиях трудно достигнуть разделения по молекулярным весам. Поэтому для анализа таких биополимеров, как РНК, ДНК или ДДСН-белковые комплексы, методом капиллярного электрофореза применяют среды с ситовыми свойствами, как в традиционном гель-электро-форезе.
Исторически электрофоретическое разделение по размерам молекул ДНК из формата традиционного электрофореза в блоке геля было адаптировано на капиллярный формат при использовании тех же матриц (поперечносшитый акриламид или агароза). Гели для КЭ готовили, как и жесткие гели, т. е. добавлением катализаторов к раствору мономера непосредственно перед закачкой в капилляр, где и происходила полимеризация. Но проблемы приготовления, стабильности, хранения привели к поиску негелевых жидких полимерных ситовых сред. Малые размеры капилляра при низкой конвекции и больших капиллярных силах позволили использовать растворы полимеров вместо поперечносшитых гелей. Для разделения ДНК в КЭ используют большое число полимеров: гид-роксиэтилцеллюлозу (ГЭЦ), гидроксипропилцел-люлозу (ГПЦ), гидроксипропилметилцеллюлозу (ГПМЦ), полиэтиленгликоли (ПЭГ), полиэтилен-оксиды (ПЭО), поливинилпиролидон (ПВП), линейный полиакриламид (ПАА) и его алкилзаме-щенные (полидиметилакриламид ПДМАА).
Разбавленные растворы полимеров имеют физические свойства, близкие к свойствам растворов малых молекул. Теория Grossman и Soane [88, 89] утверждает, что когда концентрация полимера в растворе возрастает и достигает порогового значения, молекулы полимера начинают переплетаться. Спутанные полимерные цепи образуют нестойкую сетку, размер пор которой не зависит от молекулярной массы полимера. Образовавшаяся сетка обладает ситовыми свойствами. Такие растворы спутанных полимеров используют в капиллярном электрофорезе для достижения разделения по молекулярным размерам.
Переход к раствору с ситовыми свойствами сопровождается резким увеличением вязкости. Растворы полимеров оценивают так называемой характеристической вязкостью [η], которая является мерой способности полимеров увеличивать вязкость растворителя. Для многих полимеров характеристическую вязкость можно определить по эмпирическому выражению Марка—Хувинка [90]
[η] ≅ kMwa, где a и k — характеристические константы для данной системы полимер—растворитель, Mw — средняя молекулярная масса полимера.
Для гибких молекул показатель степени варьирует от 0.5 (полимер в "идеальном" растворителе) до 0.8 — для случая "набухших" цепей.
Концентрация полимера с , при которой происходит переход от раствора к раствору с ситовыми* свойствами, называется порогом спутывания с * и определяется как [90]
с * ≅ 1.5[η]–1 ≅ (1.5/ k )M w – а .
Чтобы оценить "размер пор" такой полимерной сетки, следует рассмотреть сегмент полимерной цепочки между двумя точками спутанностей. Он может быть рассчитан как
ζ ≈ 1.43 R g ( c / c * (1+ a ) / 3 a )), ( c > c *), (1)
где R g — радиус инерции полимера.
Выражение (1) означает, что "размер пор" сетки в растворе спутанного полимера не зависит от длины его цепи, а зависит только от концентрации и природы полимера. Это означает, что растворы полимеров одинаковой природы и одной и той же концентрации, но имеющие различную молекулярную массу будут иметь одинаковый "размер пор" образовавшейся сетки. Однако, вязкость этих растворов будет зависеть от их молекулярной массы. С другой стороны, растворы двух полимеров разной природы также могут образовывать сетку с одинаковым "размером пор", но будут иметь разную вязкость из-за различных значений характеристической вязкости. Это позволяет сформулировать правило для выбора подходящего полимера для проведения электрофоретического разделения.
Так, следует сравнивать вязкости различных полимерных матриц, сетки которых имеют близкие "размеры пор", и выбрать матрицу с наименьшей вязкостью для заданного "размера пор".
Фактором, усложняющим проведение КЭ, служит явление электроосмоса (ЭО) — потока жидкости в капилляре, вызванного электрическим полем. В КЭ явление усиливается, т. к. внутренняя стенка капилляра имеет иммобилизованные заряды, что вызывает образование подвижного слоя противоионов, которые движутся в присутствии электрического поля, создавая объемный поток жидкости. Для подавления электроосмотического потока (ЭОП) и уменьшения взаимодействий ана-лит—стенка капилляра большинство сепарационных матриц требует химической модификации внутренней поверхности капилляра. Только малое количество полимеров обладает собственной способностью модификации поверхности капилляра (self-coating ability). Подобные полимеры обеспечивают так называемое "динамическое покрытие". Они обратимо адсорбируются на стенке капилляра, создавая зону с высокой вязкостью, которая мешает движению двойного электрического слоя под действием электрического поля и отстраняет аналит от стенки.
Способы миграции молекул ДНК при электрофоретическом разделении в растворах спутанных полимеров по существу те же, что и в попереч-носшитых гелях: модель Огстона, рептация без ориентирования и рептация с ориентированием. Сила взаимодействия с полимерной матрицей больше для больших молекул ДНК. На этом и основано разделение по молекулярным размерам. В зависимости от конформации и размеров молекул анализируемого вещества, а также от характеристик пористой структуры полимерного раствора можно придти к различным механизмам разделения. Как правило, для подвижности анализируемых веществ в разделяющем полимере находят зависимость от их размеров. Такие логарифмические зависимости, обычно имеющие сигмоидную форму, показаны на рис. 3 (из [90]). На графиках можно выделить 4 области.
Область I. — В этой начальной области подвижность изменяется слабо с ростом длины молекул ДНК, т. е. для маленьких фрагментов селективность невысока. В этой области, называемой областью Огстона, "размеры пор" полимерной сетки больше, чем размеры самих молекул, которые без заметного сопротивления мигрируют сквозь нее. При этом молекулы могут сохранять свою глобулярную структуру. Это является причиной низкой селективности в данной области размеров молекул.
Область II. — Для двухцепочечных молекул ДНК, как считает Heller C. [91], характерна промежуточная зона (II), где нет сепарации. Это соот- ветствует ситуации, когда радиус инерции Rg молекулы ДНК больше, чем размер пор полимерной сетки, поэтому механизм просеивания не работает. С другой стороны, молекула ДНК слишком короткая и слишком жесткая, чтобы эффективно репти-ровать через сепарационную матрицу. По этим же причинам разделение кольцевых молекул ДНК в растворах спутанных полимеров неэффективно, т. к. структура кольцевой молекулы ДНК даже более жесткая, чем у линейной молекулы.
Область III. — В этой области хорошей сепарации с достаточно высокой селективностью, так называемой области рептации без ориентирования, имеет место большое изменение подвижности молекул ДНК с ростом длины их цепей. В этой области размеры молекул ДНК больше, чем поры полимерной матрицы, так что молекула может проникнуть в поры только в вытянутом состоянии,
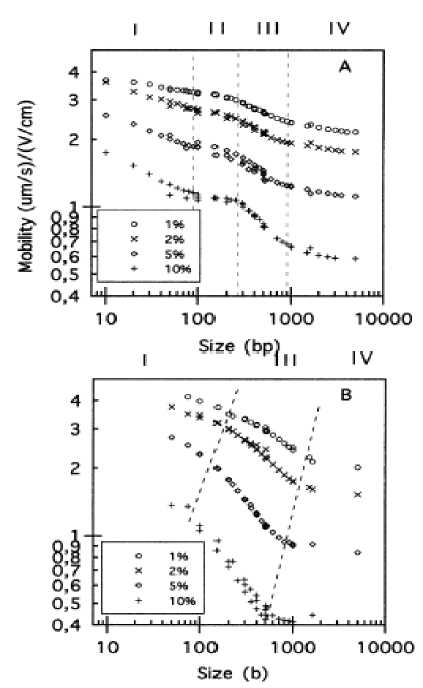
Рис. 3. Зависимость подвижности молекул ДНК от их размеров для двухцепочечных молекул ДНК (А) и для одноцепочечных молекул ДНК (В). Условия: сепарация при 210 В/см в ПДМАА (490 кДа) при различных концентрациях в 0.5×Трис-борат-ЭДТА и при (А) — 25°С, (В) — 50°С в присутствии мочевины [90]
огибая в "змеевидном" движении волокна матрицы (рептация). Таким образом могут возникнуть сильные взаимодействия молекул ДНК с полимерной сеткой, что приводит к повышению селективности анализа.
Область IV. — В этой области молекулы ДНК имеют минимальную подвижность. Это — зона рептации с ориентированием. В данном случае оба конца длинной молекулы ДНК движутся в одном направлении (в направлении приложенного электрического поля) и сильно переплетаются с волокнами сепарационной полимерной матрицы (ловушка), что и является причиной аномальной миграции молекул ДНК. Для малых молекул это переплетение не играет существенной роли, т. к. они могут быстро освободиться от такой конформации. Но для больших молекул вероятность выхода из такого состояния очень мала.
Таким образом, область рептации (III) является самой привлекательной для достижения эффективного разделения. С увеличением концентрации полимера в этой области сепарация улучшается (увеличивается крутизна наклона зависимости на рис. 3), но ценой потери подвижности и поэтому при увеличении времени анализа. Следовательно, более низкие концентрации полимера полезны для быстрого скрининга с низким разрешением, а более высокие концентрации позволяют проводить сепарацию при высоком разрешении. Таким образом, концентрация полимера играет важную роль для сепарации по механизму рептации.
Влияние длины цепи полимера на сепарацию молекул ДНК отражено на рис. 4 из [92]. При высокой концентрации и длинные, и короткие полимерные цепи обеспечивают хорошее разрешение для небольших фрагментов одноцепочечных молекул ДНК. Для сепарирования фрагментов больших размеров лучше использовать растворы полимеров с более длинными полимерными цепями и с более низкими концентрациями. Для двухцепочечных молекул ДНК влияние длины полимерной цепи на разделение не столь значительно.
Автор работы [90] рекомендует в качестве сепарационной матрицы для разделения молекул ДНК использовать растворы спутанных полимеров. Лучшее разрешение достигается при работе в режиме рептации без ориентирования. В режиме рептации разрешение возрастает при повышении концентрации полимера. Когда используют низкие концентрации полимера, длина цепи полимера должна быть увеличена, чтобы гарантировать работу в требующемся режиме (режиме рептации без ориентирования). Также желательно использовать такие сепарационные матрицы, которые способны подавлять электроосмотический поток и уменьшать взаимодействия аналит—стенка капилляра. Следовательно, для получения "идеальной"
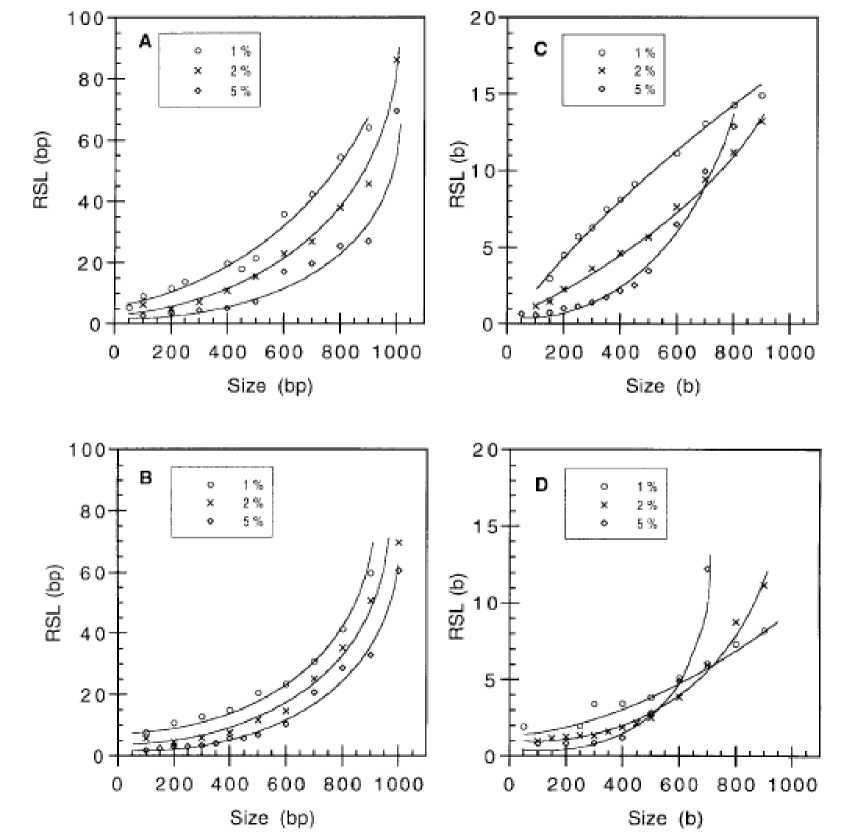
Рис. 4. Зависимость разрешения по длине (т.е. наименьшей разницы в размерах молекул ДНК в основаниях или в парах оснований) от размера самой молекулы ДНК при сепарировании в среде ПДМАА с различной молекулярной массой и с различной концентрацией [92]. А — двухцепочечные молекулы ДНК в среде ПДМАА с короткой цепью; В — двухцепочечные молекулы ДНК в среде ПДМАА с длинной цепью; С — одноцепочечные молекулы ДНК в среде ПДМАА с короткой цепью; D — одноцепочечные молекулы ДНК в среде ПДМАА с длинной цепью
сепарационной матрицы полимер должен удовлетворять трем требованиям:
-
1) легко вводиться в капилляр и удаляться из него;
-
2) обладать хорошими сепарационными свойствами;
-
3) позволять проводить сепарацию без модификации внутренней поверхности капилляра.
Наиболее перспективным полимером является полидиметилакриламид (ПДМАА) [90]. Среди линейных полимеров ПДМАА показывает хорошее разделение при низкой вязкости. У него превосходные свойства агента, обеспечивающего динамическое покрытие стенки капилляра. Кроме того, его синтез из мономера достаточно прост.
Получение полидиметилакриламида
Нами было исследовано влияние условий гомополимеризации N,N-диметилакриламида (ДМАА) на молекулярно-массовые характеристики получающегося полимера.
Так как ДМАА легко полимеризуется под дей- ствием инициаторов радикального типа, ПДМАА получали радикальной полимеризацией в присутствии динитрила азоизомасляной кислоты (ДАК) в различных растворителях (вода, диоксан-1,4), варьируя содержание инициатора и исходную концентрацию мономера.
Использовали ДМАА фирмы Fluca, который перегоняли в вакууме для удаления ингибитора. В ампулы помещали раствор мономера (в диоксане-1,4 или воде) и рассчитанное количество инициатора ДАК. Затем откачивали ампулы на водоструйном насосе в течение 15 мин для удаления из раствора воздуха, после чего 5 мин продували аргоном и запаивали. Подготовленные ампулы помещали в термостат. Полимеризацию проводили при температуре 75 °С в течение 24 часов. ПДМАА, синтезированный в диоксане, осаждали в диэтиловый эфир. Выделенный полимер промывали эфиром и высушивали в вакуум-сушилке до постоянного веса. Полимер, полученный в водном растворе, выделяли диализом против воды и лиофильной сушкой. Выход ПДМАА определяли гравиметрически. Характеристическую вязкость измеряли в вискозиметре Уббелоде в воде при 25°С по известной методике [93]. Молекулярную массу (ММ) полученного ПДМАА рассчитывали по формуле [94]
Ы25о C = 23.2 • 10-3 • M0-81.
H2O
Условия полимеризации и характеристики полученных полимеров представлены в таблице. Результаты из таблицы показывают, что в диоксане получается ПДМАА с относительно небольшой молекулярной массой. Содержание инициатора слабо влияет на изменение молекулярной массы получаемого полимера. Увеличением концентрации ДМАА в исходном растворе удалось повысить молекулярную массу продукта до 50 000. Дальнейшее повышение концентрации мономера нецелесообразно. При переходе к водным растворам молекулярная масса получаемого ПДМАА резко возрастает. Повышением содержания инициатора и понижением концентрации мономера удается понизить ее до 200 000. Дальнейшее понижение молекулярной массы достигается добавлением к полимеризуемой массе перекиси водорода.
Влияние условий полимеризации N,N-диметилакриламида на молекулярно-массовые характеристики ПДМАА
|
№ образца |
Растворитель |
[ДМАА], масс. % |
[ДАК], масс. %(*) |
Выход, % |
[n] , мл/г |
ММ |
|
4 |
Диоксан-1,4 |
15 |
3.5 |
80 |
98 |
30000 |
|
5 |
То же |
15 |
2.5 |
78 |
103 |
32000 |
|
6 |
» |
15 |
1 |
79 |
115 |
36000 |
|
7 |
» |
20 |
1 |
91 |
140 |
47000 |
|
8 |
» |
50 |
1 |
89 |
147 |
50000 |
|
13 |
Н 2 О |
10 |
1 |
79 |
645 |
300000 |
|
14 |
То же |
10 |
2 |
76 |
600 |
280000 |
|
15 |
» |
10 |
2+1%Н 2 О 2 |
87 |
180 |
63 000 |
|
16 |
» |
5 |
2 |
75 |
480 |
213000 |
— содержание инициатора выражено в масс. % от веса мономера.
13906 rfu 1 ch1
50005000503003500050500550600 с
50 100 150 200 250 300 350 400 450 500 550 600 С
11140 rfu
1 ch1
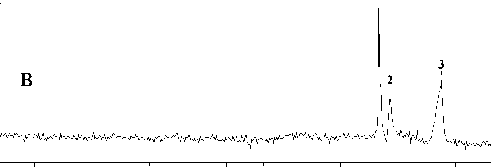
50 100 150 200 250 300 350 400 450 500 550 600 С
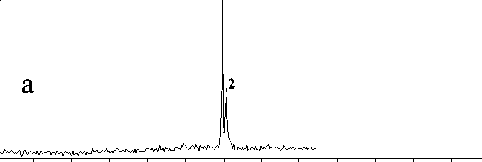
Рис. 5. Разделение фрагментов ДНК (маркеров молекулярного веса размером 200, 400 и 800 пар оснований) методом капиллярного электрофореза на микрочипе в зависимости от концентрации полимера ПДМАА сепарационной матрицы: а — 10 % ПДМАА (М w ~30 000), б — 15 % ПДМАА (М w ~ ~30 000), в — 20 % ПДМАА (М w ~ 30 000)
матрице — растворе ПДМАА с различной молекулярной массой и различной концентрацией полимера на стеклянном микрофлюидном чипе. Использовался чип с одноканальной топологией. Ширина сепарационного канала — 50 мкм, глубина — 12 мкм, длина канала до точки детектирования — 35 мм. Ввод пробы осуществлялся по "Z-образной" схеме при напряжении 450–490 В в течение 300 с. Электрофорез проводили при напряжении 600 В.
Сепарационный канал чипа заполняли раствором полимера с помощью специального шприцевого устройства. В резервуары МФЧ по 6 мкл микродозатором вводились необходимые реагенты. Качество заполнения (например, отсутствие пузырей) сепарационного канала контролировали визуально с помощью оптического микроскопа.
Анализ начинали со стадии префореза (т. е. "холостого" опыта — электрофореза без ввода пробы) для стабилизации системы. Префорез проводили в течение 5 мин при 1000 В.
После проведения анализа раствор полимера удаляли из сепарационного канала вытеснением его дистиллированной водой с помощью шприцевого устройства. Канал чипа промывали дистиллированной водой, а затем осушали воздушным потоком.
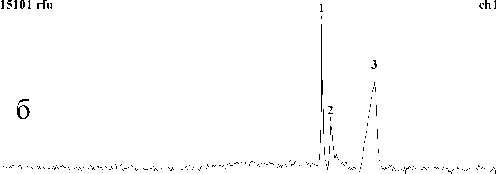
Результаты разделения фрагментов ДНК приведены на рис. 5 и 6. Полученные данные показывают, что 10 %-й раствор ПДМАА с М w ~30 000 (рис. 5, а) не обеспечивает разделения фрагментов ДНК. Видимо, этот раствор не имеет ситовых свойств, т. к. концентрация полимера не достигла порогового значения, при котором молекулы полимера начинают переплетаться и образовывать ситовую структуру. Но если увеличить концентрацию полимера до 15–20 %, можно достигнуть желаемого результата (рис. 5, б и в). Разделение также можно получить при использовании полимера с большей молекулярной массой: ~66 000 (рис. 6).
В результате исследований был синтезирован с количественным выходом ПДМАА с характеристическими вязкостями [п] от 98 до 645 мл/г и молекулярной массой в интервале от 30-103 до 300-103. Проведенные исследования позволяют получать ПДМАА с заранее заданными молекулярно-массовыми характеристиками.
Разделение фрагментов ДНК методом капиллярного электрофореза на стеклянном микрочипе
Были проведены работы по электрофоретическому разделению смеси маркеров молекулярного веса (ЗАО "Синтол", Москва) в сепарационной
ЗАКЛЮЧЕНИЕ
Изучение литературных данных показывает, что одним из перспективных методов экспресс-анализа ДНК является метод капиллярного электрофореза на микрочипе. Этот метод интенсивно развивается и некоторые компании и фирмы предлагают варианты коммерческих приборов на основе микрочиповых технологий.
При создании микрочиповых устройств важными критериями являются скорость и стоимость единичного анализа. Поэтому прослеживаются тенденции создания многоканальных устройств и интеграции в микрочипы вспомогательных элементов (амплификаторов, фильтров, датчиков и др.).
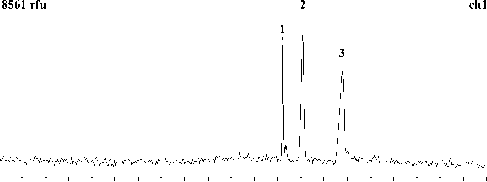
20 60 100 140 180 220 260 300 340 380 с
Рис. 6. Разделение фрагментов ДНК (маркеров молекулярного веса размером 200, 400 и 800 пар оснований) методом капиллярного электрофореза на микрочипе. Сепарационная матрица: 10 % ПДМАА, М w ~66 000 (ср. рис. 5, а)
В качестве основных материалов, используемых в микрочипах для электрофоретических методов, применяются стеклянные материалы и полимеры. Полимерные материалы позволяют значительно снизить стоимость микрочипов.
Важной проблемой при разработке методик анализа ДНК на микрочипе является правильный выбор и создание сепарационной матрицы. Во многих случаях в качестве матрицы используются растворы полимеров, которые дают возможность получить эффективное разделение фрагментов ДНК. Одним из перспективных полимеров является полидиметилакриламид. Поэтому особое влияние уделяется получению (синтезу) ПДМАА с заданными свойствами.
Проведенные исследования электрофоретического разделения смеси маркеров молекулярного веса на стеклянном микрочипе показали, что эффективное разделение достигается при концентрации полимера 15–20 % (М w ~30 000) и 10 % (М w ~ 66 000).


