Микроциркуляторный кровоток миокарда и субэпикарда у пациентов с аортальным пороком до и после хирургической коррекции порока
Автор: Окунева Галина Николаевна, Клинкова Ася Станиславовна, Булатецкая Людмила Михайловна, Железнев Сергей Иванович, Волков Александр Михайлович, Шматов Дмитрий Викторович, Астапов Дмитрий Александрович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая болезнь сердца
Статья в выпуске: 3 т.13, 2009 года.
Бесплатный доступ
Интраоперационно изучен микроциркуляторный кровоток (МКК) у 15 больных с аортальным стенозом (АС) и аортальной недостаточностью (АН) III-IV ст., локализованными преимущественно в миокарде и субэпикарде различных камер сердца, до и после хирургической пластики порока аорты. (ОБЪЯВЛЕНИЕ). Использовались лазерно-доплеровский расходомер BLF-21 "Transonic System Inc" и персональный компьютер. Регистрировали данные ЭКГ: градиент давления между аортой и левым желудочком (ЛЖ), а также размеры камер сердца. Оценивали мио-/эпикардиальное соотношение МК в левом и правом желудочках (ПЖ) до и после пластики. У больных БА МК миокарда в ЛЖ и ПЖ значительно превышает субэпикардиальный МК в 1,5 раза как до, так и после пластики. Послеоперационный субэпикардиальный МК имел тенденцию к снижению во всех отделах сердца, кроме ЛЖ, где МК имел тенденцию к увеличению.
Микроциркуляторный кровоток, миокардиальный кровоток, субэпикардиальный кровоток
Короткий адрес: https://sciup.org/142233453
IDR: 142233453 | УДК: 616.126.52-089.168.1:612.135-07
Текст научной статьи Микроциркуляторный кровоток миокарда и субэпикарда у пациентов с аортальным пороком до и после хирургической коррекции порока
Многими авторами изучалось трансмуральное распределение кровотока в сердце на препаратах животных. Впервые об измерении коронарного кровотока в различных слоях миокарда было сообщено в 1957 году Love и Burch, которые использовали ддя этой цели внутривенозное введение радиоактивного рубидия [7]. Это было продолжено многочисленными исследованиями, используя ин-травенозные и интракардиальные инъекции ионизированного рубидия и калия. Измерение регионарного миокардиального кровотока с диффузионными индикаторами имеют теоретические и практические ограничения из-за дорогостоящего оборудования и наличия артефактов, поэтому наибольшее распространение получил метод меченных радиоактивных микросфер. Микросферная техника является экстракционным методом, где микросферы, введенные в поток крови животного (собаки) идентично распределяются в кровотоке (или в эритроцитах), задерживаясь в тканях во время первого прохождения. Заключением этих исследований является то, что субэндокард в норме кровоснабжается приблизительно на 10% больше, по сравнению с субэпикардом, где эндо-эпикардиальный коэффициент составляет 1,1-1,2 [10].
D. Alyono, R.W. Anderson (1986) проводили исследования на собаках, когда гипертрофия ЁЖ (ГЛЖ) развивалась в результате искусственно вызванного АС. В данном эксперименте миокардиальный кровоток измерялся с помощью микросфер, где он был выше у собак с АС в отличие от животных без ГЛЖ. Однако во время максимальной коронарной вазодилатации при введении аденозина средний миокардиальный кровоток по ЛЖ с гипертрофией был значительно ниже, чем у здоровых собак. На основании полученных данных авторы пришли к заключению, что на фоне АП, где присутствует повышенная нагрузка на ЛЖ и развивается его гипертрофия, возникают нарушения микроциркуляции и снижение коронарного вазо-дилататорного резерва [5].
K. Rajappan, E. Ornella (2003) и др. было установлено, что в результате коррекции АП устра няется препятствие оттоку крови из ЛЖ и таким образом, происходит снижение повышенной постнагрузки на миокард ЛЖ, что влечет за собой снижение потребности сердечной мышцы в кислороде и соответственно перестройку микроциркуля-торного русла. В дальнейшем, в результате регрессии массы ЛЖ происходит нормализация отношения размера коронарных артерий к массе ЛЖ [8].
Однако возникает вопрос, изменяется ли миокардиальный МЦК в ЛЖ и ПЖ, а также субэпикардиальный кровоток других отделов сердца после хирургической коррекции АП? Как изменяется мио-эпикардиальный коэффициент на желудочках после выполненной коррекции АП.
В наших ранее опубликованных работах получены и проанализированы результаты интраоперационного исследования субэпикардиального МЦК в разных отделах сердца и на стенках магистральных сосудов у пациентов с АП до и после хирургической коррекции порока [4]. В известной нам литературе не приводятся данные по интраоперационному изучению миокардиального и субэпикардиального МЦК до и после замены аортального клапана у пациентов с АП.
Целью настоящего исследования явилась оценка миокардиального и субэпикардиального микро-циркуляторного кровотока различных камер сердца до и после коррекции аортального порока.
МАТЕРИАЛ И МЕТОДЫ
Обследовано 15 пациентов до и после хирургической коррекции АП, средний возраст которых составил 49,4±3,5 г. Из них с АС III-IV ст., ХСН 2А-Б ст., - 12 человек, с преобладанием АН IIIIV ст., ХСН 2А-Б ст. - 3 человека. Большинство пациентов составляли мужчины - 12 человек (80%), женщины - 20%. У 13 пациентов (86%) выявлен концентрический тип ГЛЖ, у 3 соответственно эксцентрический. Исследуемым пациентам в аортальную позицию в 87% были имплантированы механические протезы (Микс, Мед-Инж, Sorin-
Bicarbon), и в 13% случаев - биологические протезы.
Микроциркуляторный кровоток определялся с помощью метода лазер-допплеровской флоуметрии (ЛДФ) на BLF-21 «Transonic System Inc» (США) в комплексе с персональным компьютером. Записи МЦК производились во время операции поверхностным датчиком типа «R» (rite angle) диаметром 15 мм в течение 20 с на каждом исследуемом участке с последующим расчетом средней величины МЦК (мл/(100 г х мин), а также игольчатым датчиком типа «N» (Gauge Needle) длиной 10 мм на левом и правом желудочках.
На фоне стабильной гемодинамики и стандартного анестезиологического обеспечения, фиксировались исходные показатели МЦК перед хирургической коррекцией АП на переднебоковой поверхности миокарда левого и правого желудочков (МЛЖ, МПЖ) и субэпикарда каждой камеры сердца: центральная часть левого и правого предсердий (ЭЛП, ЭПП), переднебоковая поверхность левого желудочка (ЭЛЖпп), область верхушки левого желудочка (ЭЛЖв), переднебоковая поверхность правого желудочка (ЭПЖ). Также измерялись показатели МЦК после устранения АП и восстановления гемодинамики: МЛЖ 1 , МПЖ 1, ЭЛП 1 , ЭПП 1 , ЭЛЖпп 1 , ЭЛЖв 1 , ЭПЖ 1 . Одновременно с измерением МЦК регистрировались основные показатели центральной гемодинамики до коррекции порока: АДС, АДД, АДср. и ЧСС, рассчитывалось двойное произведение - ДП=ЧСС х АДср и после коррекции АП.
Для оценки степени ГЛЖ у всех пациентов по данным ЭхоКГ анализировались размеры и объемы ЛЖ: конечно-диастолический размер - КДР (см), конечно-систолический размер КСР (см), конечно-диастолический объем - КДО (мл), конечно-систолический объем КСО (мл), ударный объем УО (мл), а также толщина межжелудочковой перегородки ТМЖП (см) и задней стенки ЛЖ (ТЗСЛЖ) до коррекции порока, и в ближайшие сроки после его коррекции (через 7-10 дней). Вычислялся конечно-диастолический индекс (КДИ) - отнесенный к площади поверхности тела КДО, индекс нагрузки объемом - КДО отнесенный к массе миокарда левого желудочка (ММЛЖ), а также ударный индекс (УИ) - отнесенный к площади поверхности тела УО.
Анализировались систолический градиент давления на аортальном клапане при наличии порока и после его коррекции, когда снималась повышенная нагрузка на ЛЖ, размеры правого и левого предсердий до и после операции, а также фракция выброса (ФВ) ЛЖ. Для определения величины ГЛЖ рассчитывалась ММЛЖ (г) по формуле Reicheck и R. Devereux и затем ее отнесенная к площади поверхности тела величина индекса массы миокарда левого желудочка (ИММЛЖ) [9]. При наличии ГЛЖ, по данным приведенных авторов, величины ИММЛЖ превышают 118 г/м2 у мужчин и 104 г/м2 у женщин. Относительная толщина миокарда определялась по формуле:
ОТМ=2 ТЗСЛЖ/КДР [2].
РЕЗУЛЬТАТЫ
До операции средний МЦК по субэпикарду всех камер сердца составлял 61,4±2,4 мл/(100 г • мин). Наиболее низкий МЦК был отмечен по ЭЛП, где были выявлены статистичкески значимые различия с МЦК по ЭПП, ЭПЖ, ЭЛЖв (р<0,05) (рис. 1).
Наиболее высокий миокардиальный МЦК до коррекции порока наблюдался по МПЖ, а наименьший по МЛЖ, хотя статистически значимых различий по миокардиальному МЦК между левым и правым желудочками не было отмечено (р>0,05) (рис. 2). Таким образом, было выявлено, что средний МЦК в миокарде желудочков сердца до коррекции АП выше, чем в субэпикарде в 1,5 раза: МЛЖ и ЭЛЖпп 91,0±5,0 и 60,6±3,9 мл/(100 г мин), МПЖ и ЭПЖ 99,2±3,4 и 69,9±5,4 мл/(100 г-мин) соответственно (р<0,05) (табл. 1).
После коррекции порока МЦК по субэпикарду снижался по правым камерам сердца и по вер-
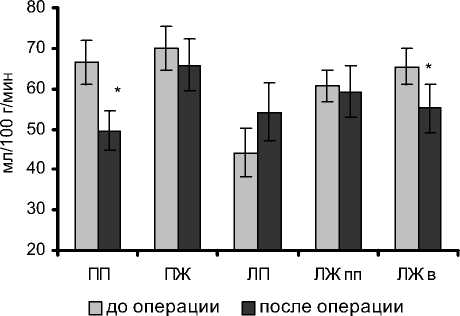
Рис. 1. Субэпикардиальный МЦК различных камер сердца у пациентов до и после коррекции аортального порока.
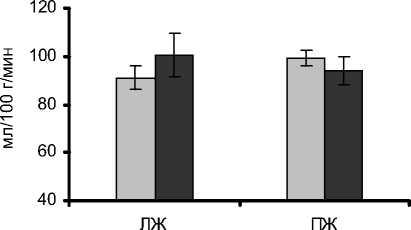
□ до операции □ после операции
Рис. 2. Миокардиальный МЦК по ЛЖ и ПЖ у пациентов до и после коррекции аортального порока.
хушке ЛЖ 1 , средние значения МЦК всех камер сердца составляли 57,4±2,8 мл/(100 г •мин) (рис. 1). Следует отметить, что изначально наиболее низкий МЦК по ЭЛП после коррекции порока имел тенденцию к повышению и в среднем увеличивался на 10 мл/(100 г •мин) (р>0,05). Статистически значимое снижение МЦК после операции происходило только по ЭПП 1 и по ЭЛЖв 1 (р<0,05) (табл. 1). Микроциркуляторный кровоток по ЭЛЖпп практически не изменялся (р>0,05) (табл. 1).
Микроциркуляторный кровоток по МЛЖ 1 имел тенденцию к повышению после коррекции АП, а по МПЖ 1 незначительно снижался, при этом статистически значимых различий не было выявлено (р>0,05) (рис. 2). Мио-эпикардиальный коэффициент по ЛЖ после коррекции порока практически не изменялся: 1,55 и 1,58 соответственно (р>0,05) (табл. 1). По ПЖ до и после операции данный коэффициент не отличался: 1,51 и 1,50 соответственно. В результате проведенных исследований было выявлено, что МЦК в миокарде желудочков сердца до и после коррекции аортального порока выше, чем в субэпикарде в 1,5 раза (р<0,05) (табл. 1).
Таким образом, увеличение миокардиального МЦК по МЛЖ происходит не только за счет коррекции порока, но и за счет перераспределения МЦК между желудочками сердца, а также возможно и за счет перераспределения МЦК из эпикардиального кровотока.
В табл. 2 представлены данные ЭхоКГ размеров и объемов ЛЖ, а также размеры левого и правого предсердий, систолический градиент на аортальном клапане до и в ближайшие сроки после коррекции АП. Как видно из таблицы, в ближайшие сроки после коррекции АП было отмечено ста тистически значимое резкое снижение систолического градиента на аортальном клапане, а также снижение ФВ ЛЖ (р<0,05). Другие показатели систолической функции ЛЖ такие как УО, УИ, также достоверно снижались. Размеры и объемы ЛЖ в ближайшие сроки после операции имели тенденцию к снижению, в то время как ТЗСЛЖ оставалась неизменной. Также следует отметить тенденцию к снижению размера ЛП (р>0,05). Таким образом, после операции происходит снижение показателей ЭхоКГ в связи с уменьшением повышенной функциональной нагрузки на ЛЖ (табл. 2).
Для установления связей между миокардиальным и субэпикардиальным МЦК желудочков сердца до и после операции, а также между МЦК по всем камерам сердца был проведен корреляционный анализ. Были выявлены прямые корреляционные связи до операции МЦК по МЛЖ с МЦК по МПЖ (r=0,61, р<0,05), а также с субэпикардиальным МЦК по ЭЛП (r=0,61, р<0,05).
После коррекции порока корреляционная связь МЦК по МЛЖ 1 с МЦК по МПЖ 1 усиливается (r=0,80, р>0,05), также как и с МЦК по ЭЛП 1 (r=0,90, р<0,05). Таким образом, до и после коррекции АП желудочки сердца были функционально связаны между собой миокардиальным МЦК.
Анализ показателей субэпикардиального МЦК по камерам сердца выявил следующие корреляционные связи: прямые корреляционные связи до операции МЦК по ЭЛЖпп с ЭЛЖв (r=0,72, р<0,05), ЭПЖ (r=0,75, р<0,05), ЭПП (r=0,66, р<0,05). После коррекции порока сохранялись корреляционные связи МЦК по ЭЛЖпп 1 с МЦК по ЭЛЖв 1 ЭПЖ 1 и ЭПП 1 , в то же время появилась корреляционная связь с МЦК по ЭЛП 1 (r=0,85, р<0,05). Таким об-
Таблица 1
Показатели субэпикардиального и миокардиального МЦК отделов сердца у пациентов с аортальным пороком до и после хирургической коррекции
|
Показатели, ед. измерения |
До операции |
После операции |
Д МЦК (МЦК после операции - МЦК до операции) |
||
|
М±т |
О |
М±т |
О |
||
|
ЭПП, мл/(мин х 100 г) |
66,5±5,3 |
19,8 |
49,6±5,0 |
16,0 |
р>0,05 |
|
ЭПЖ, мл/(мин х 100 г) |
69,9±5,4 |
19,7 |
65,8±6,5 |
20,6 |
р>0,05 |
|
ЭЛП, мл/(мин х 100 г) |
44,1±6,0 |
21,7 |
54,2±7,1 |
21,4 |
р>0,05 |
|
ЭЛЖ передняя пов. мл/(мин х 100 г) |
60,6±3,9 |
14,6 |
59,2±6,3 |
19,9 |
р>0,05 |
|
ЭЛЖ обл. верхушки, мл/(мин х 100 г) |
65,4±4,5 |
16,8 |
55,2±6,0 |
17,0 |
р<0,05 |
|
МЛЖ, мл/(мин х 100 г) |
91,0±5,0 |
17,3 |
100,4±9,1 |
20,4 |
р>0,05 |
|
МПЖ, мл/(мин х 100 г) |
99,2±3,4 |
13,0 |
94,1±6,0 |
19,2 |
р>0,05 |
|
м/э коэффициент ЛЖ |
1,55±0,1 |
0,3 |
1,58±0,1 |
0,3 |
р>0,05 |
|
м/э коэффициент ПЖ |
1,51±0,1 |
0,4 |
0,50±0,1 |
0,3 |
р>0,05 |
Таблица 2
Характеристика показателей левого желудочка, правого и левого предсердий у пациентов с аортальным пороком (M±m) до и после операции
ОБСУЖДЕНИЕ
По литературным данным известно, что у больных с аортальным пороком происходит нарушение коронарного кровотока на уровне микроциркуляции. Причины этих нарушений сводятся к следующему: 1) из-за повышенной нагрузки на ЛЖ в миокарде происходит изменение метаболизма и ультраструктуры кардиомиоцитов, приводящее к компенсаторной гипертрофии миокарда ЛЖ: увеличение потребности кардиомиоцитов в кислороде, что в свою очередь приводит к увеличению нагрузки на митохондриальный и сократительный аппарат клетки [1] 2) при аортальном пороке отмечено сужение просвета сосудов коронарного русла, уменьшение количества капилляров на единицу площади миокарда, что свидетельствует о неблагоприятном состоянии МЦК [6].
Н. Илларионов, А.М. Волков (1990) изучали прижизненную морфоструктурную характеристику миокардиального звена компенсации при приобретенных пороках аортального клапана Имеющиеся сведения по этому вопросу получены, в основном, при моделировании аортальной патологии в эксперименте, либо при исследовании секционного материала. Особую практическую значимость приобретает прижизненное изучение характера и динамики морфоструктурных измене ний в сердечной мышце в зависимости от стадии порока. Изучению были подвергнуты некоторые аспекты гипертрофии и кардиосклероза миокарда, структурно-гиперпластической перестройки микроциркуляторного русла коронарных артерий. Было выявлено, что в случаях АС были больше развиты структурно-гиперпластические изменения в стенке коронарных артерий: гипертрофия мышечного слоя, гиперплазия и огрубение эластики во внутреннем слое. Наблюдающееся при этом утолщение стенки артерий и сужение их просвета были несколько больше при этом варианте порока в сравнении с АН. Прижизненная оценка изменений миокарда при АС (по материалу био-птатов) показала также выраженную гипертрофию кардиомиоцитов в ЛЖ (125,9%) и обычное развитие этого процесса с переходом в атрофию - в ЛП, в этом же отделе был в 1,5 раза больше развит склероз [3].
По данным нашего исследования миокардиальные слои ЛЖ и ПЖ выполняющие наибольшую функциональную нагрузку имеют более высокий МЦК, чем субэпикард (в 1,5 раза) как до, так и после операции. Таким образом, увеличение миокардиального МЦК по МЛЖ и МПЖ как до, так и после коррекции АП происходит за счет перераспределения МЦК из эпикардиального кровотока.
Левый и правый желудочки сердца функционально связаны между собой, что подтверждается наличием связей миокардиального МЦК МЛЖ и МПЖ, а также субэпикардиального МЦК этих же отделов сердца. Следует отметить, что по субэпикардиальному МЦК выявлены достоверные корреляционные связи ЭЛЖ со всеми отделами сердца.
После коррекции АП субэпикардиальный МЦК имел тенденцию к снижению по всем камерам сердца, кроме ЛП 1 . В свою очередь, изначально низкий МЦК по ЭЛП вероятно обусловленный дистрофическими изменениями в этом отделе имел тенденцию к повышению после коррекции АП. Это согласовалось с данными ЭхоКГ: в ближайшие сроки после коррекции АП было отмечено статистически значимое снижение систолического градиента на аортальном клапане, ФВ ЛЖ, размеры и объемы ЛЖ в ближайшие сроки после операции имели тенденцию к снижению, в то время как ТЗСЛЖ оставалась неизменной, так как для регрессии гипертрофии необходим временной интервал. Также следует отметить тенденцию к снижению размера ЛП (р>0,05). Таким образом, после операции происходит снижение показателей ЭхоКГ левых камер сердца в связи с уменьшением повышенной функциональной нагрузки на ЛЖ (табл. 2) (р<0,05).
ВЫВОДЫ
-
1) По результатам интраоперационного исследования МЦК было установлено, что у пациентов с АП миокардиальный МЦК по ЛЖ и ПЖ достоверно превышает субэпикардиальный кровоток в 1,5 раза как до, так и после коррекции аортального порока.
-
2) После коррекции АП субэпикардиальный МЦК по всем отделам сердца снижается, что соответствует снижению показателей ЭхоКГ в связи с уменьшением повышенной функциональной нагрузки на ЛЖ.
Список литературы Микроциркуляторный кровоток миокарда и субэпикарда у пациентов с аортальным пороком до и после хирургической коррекции порока
- Архипова Г.Ф., Часовских Г.Г., Кириченко В.М. и др. // Метаболическая и морфологическая характеристика компенсаторных изменений миокарда при приобретенных аортальных пороках. Новосибирск. 1985. С. 98-104.
- Баллюзек М.Ф., Шпилькина Н.А. // Регионарное кровообращение и микроциркуляция. 2003. Т. 2, № 10. С. 50-53.
- EDN: LACWLX
- Бравве И.Ю., Илларионов Н., Волков А.М. и др. // Сборник научных трудов, НИИПК МЗ РСФСР 1990. С. 96-101.
- Окунева Г.Н., Булатецкая Л.М., Клинкова А.С. и др. // Ангиология и сосудистая хирургия (приложение). II Всероссийская конференция с международным участием. 2006. С. 22-23.
- Alyono D., Anderson R.W., Parrish D.G. et al. // Circulation Research. 1986. V. 58. P. 47-57.
- Fallen E.L. // Circulation. 1967. № 36. P. 480-489.
- Love W.D., Butch G.E. // J. C&A Invest. 1957. V. 36. P. 468-478.
- Rajappan K., Ornella E., Paolo G. et. al. // Circulation. 2003. V. 107, № 3. P. 3170-3175.
- Reichek N., Devereux R.B. // Circulation. 1981. V. 63. P. 1391-1398.
- Rudolph A.M., Heumann M.A. // Circulation Research. 1967. V. 21. P. 163-184.


